Способ подготовки периферической крови для иммуноферментного определения спонтанной продукции цитокинов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к клинической лабораторной диагностике. Сущность способа: осуществляют забор крови в пробирку, содержащую антикоагулянт, перемешивают и оставляют на 20 мин для свободного осаждения эритроцитов при комнатной температуре, после седиментации эритроцитов берут 0,5 мл лейкоцитарной взвеси и определяют в ней количество лейкоцитов любым способом (рутинным или автоматизированным), доводят ее концентрацию до величины 5*109 лейкоцитов/л дистиллированной водой, биологическую жидкость помещают в морозильную камеру при температуре -20°С до полного замораживания и используют ее после процесса размораживания для иммуноферментного определения спонтанной продукции цитокинов. Применение изобретения обеспечивает точность определения концентрации цитокинов методом ИФА, снижается индивидуальная вариабельность показателей. 1 табл.
Реферат
Изобретение относится к области медицины, а именно к клинической лабораторной диагностике, и касается способа подготовки биологической жидкости, а именно периферической крови, к определению концентрации медиаторов межклеточных взаимодействий (цитокинов) методом иммуноферментного анализа (ИФА).
Известно, что уровень цитокинов при разных патологических состояниях позволяет оценить состояние больного [1], прогнозировать исход заболевания [2], а также предвидеть риск возникновения различных осложнений [3]. При этом многие исследователи на практике сталкиваются с проблемой значительной вариабельности уровня цитокинов в сыворотке крови у обследуемых когорт больных [4, 5]. Это обусловлено высокой скоростью деградации пептидов после клеточной экскреции [6], способностью активно связываться в комплексы с различными сывороточными белками [7], а также различием функционального состояния отдельных клеток-продуцентов. Решение данной проблемы может быть связано с определением не только внеклеточной концентрации цитокинов, но, одновременно, и внутриклеточной.
Известен способ подготовки биологической жидкости (цервикального смыва) для определения цитокинового профиля методом ИФА, заключающийся в отборе образцов, замораживании при -70°С, тестировании их на содержание гемоглобина, разбавлении 1:2 фосфатно-солевым буфером с 1% сыворотки эмбрионов коров с последующим определением искомой концентрации [8]. Недостатком данного метода является необходимость тестирования образца на гемоглобин, отсутствие информации о точном количестве изучаемых клеток в образце.
Известен способ определения стимулированной продукции цитокинов [9], заключающийся в предварительном выделении мононуклеарных клеток на градиенте плотности (фикол-урографин) методом центрифугирования в течение 40 мин, последующем трехразовом отмывании их средой RPMI-1640, стандартизации их количества, культивировании их с полной культуральной средой 24 или 48 ч во влажной камере с использованием СО2 инкубатора, последующем центрифугировании, сборе кондиционной среды и дальнейшем определении в ней концентрации цитокинов методом ИФА. Недостатком данного метода является длительность подготовки, необходимость специального оборудования (СО2-инкубатор, планшеточная центрифуга) и реагентов (эмбриональная телячья сыворотка, гентамицин, ампициллин, глутамин, меркаптоэтанол), невозможность получения информации о спонтанном уровне продукции цитокинов, отсутствии в исследовании нейтрофилов (не являются мононуклеарными клетками) продуцирующих, тем не менее, ряд цитокинов.
Известна модификация вышеописанного способа определения стимулированной продукции цитокинов [10] с дополнительным предварительным фильтрованием размороженного для исследования супернатанта через одноразовые нитроцеллюлозные фильтры с порами 0,4 мкм в диаметре. Недостатком способа является его трудоемкость, длительность, необходимость дополнительных расходных материалов.
Известен способ подготовки биологической жидкости [11], заключающийся в использовании цельной периферической гепаринизированной крови, разведенной средой RPMI 1640 с глутамином в соотношении 1:5. Кровь и грибной антиген в соотношении 1:1 помещаются в иммунологический планшет. В качестве контроля (оценка спонтанной индукции) используется кровь с добавлением культуральной среды без грибного антигена. Планшеты инкубируются 72 ч (для IFN-γ) и 24 ч (для остальных цитокинов) в условиях эксикатора (37°С, 0,5% СО2) с последующим снятием супернатанта, делении его на малые порции, замораживании при -70°C с последующим определением количества цитокинов в них методом ИФА. Недостатком данного метода является его трудоемкость, необходимость наличия специального оборудования и реагентов.
Известен способ определения цитокинов и иммуноглобулина Е в конденсате выдыхаемой влаги (RU 2222015 С1, 2004) согласно которому конденсат концентрируют путем лиофильной сушки при комнатной температуре в течении 6 ч с последующим разведением забуференным физиологическим раствором в объеме, в 4-5 раз меньшем начального объема конденсата выдыхаемой влаги, стабилизируют бычьим сывороточным альбумином до конечной концентрации 1% с последующим определением концентрации цитокинов и IgE методом иммуноферментного анализа. Недостатком данного метода является длительная инкубация при комнатной температуре, приводящая к изменению концентрации цитокинов, риск контаминации бактериальными антигенами, необходимость использования специальных реагентов (бычий альбумин), влияющих на плотность белковой массы исследуемого раствора.
Известен способ получения биологической жидкости (смыва из полости носа) путем введения в носовой ход сухого марлевого тампона, который после извлечения переносят в пробирку, содержащую физиологический раствор и после 30 минутной инкубации отжимают [12]. Полученный раствор центрифугируют при 3000 об/мин в течение 10 мин, определяют оптическую плотность методом спектрофотометрии против физиологического раствора, стандартизируют путем разбавления/концентрирования до 0,4 единиц оптической плотности и используют для определения уровня содержания цитокинов. Недостатком данного метода является стандартизация по количеству всех растворенных метаболитов, среди которых присутствуют белки с различной молекулярной массой, не выполняющие функцию цитокинов (например, альбумины, глобулины, лизины и др.), не показана возможность использования способа для определения концентрации цитокинов крови.
Известен способ определения концентрации цитокинов в сыворотке крови, заключающийся в получении ее стандартным методом - коагуляции сгустка эритроцитов и фибрина при комнатной температуре в течение 30 мин, отделении его методом центрифугирования с последующим изучением концентрации цитокинов методом ИФА [13]. Недостатком способа является значительная вариабельность концентрации цитокинов в индивидуальных образцах, не позволяющая в целом оценить спонтанную продукцию цитокинов.
Известен способ подготовки пробы периферической крови для ИФА, взятый в качестве прототипа (Меньшиков В.В. Руководство по клинической лабораторной диагностике. - М.: Медицина, 1982. - 420 с.). Производят забор 5 мл периферической крови из локтевой вены. В пробирку с кровью добавляют антикоагулянт (гепарин) из расчета на 1 мл крови - 5 Ед. гепарина. Тщательно перемешивают. Пробу центрифугируют в течение 5 мин со скоростью 3000 об/мин. После этого забирают 0,1 мл надосадочной жидкости и помещают в лунку планшета для определения содержания цитокинов с помощью ИФА по стандартной методике в соответствии с протоколом фирмы-производителя.
Недостатком способа является невозможность определения в периферической крови общей концентрации внутри- и внеклеточных цитокинов, а также значительная вариабельность концентрации цитокинов в индивидуальных образцах, что влияет на точность измерения цитокинов методом ИФА.
Технический результат - повышение точности определения спонтанной продукции цитокинов, снижение индивидуальной вариабельности показателей за счет полного высвобождения вне- и внутриклеточных цитокинов из лимфоцитов периферической крови.
Технический результат достигается тем, что в способе подготовки периферической крови для иммуноферментного определения спонтанной продукции цитокинов, включающем забор крови и смешивание его с антикоагулянтом, согласно технического решения после перемешивания антигаулянта с кровью смесь оставляют при комнатной температуре на 20 мин для свободного осаждения эритроцитов, затем забирают 0,5 мл надосадочной лейкоцитарной взвеси и разводят ее дистиллированной водой до концентрации 5*109 лейкоцитов/л, замораживают при температуре -20°С, после размораживания полученную биологическую жидкость используют для определения цитокинов.
Осаждение эритроцитов из смеси антикоагулянта с кровью в течение 20 мин при комнатной температуре позволяет получить стандартизованную лейкоцитарную взвесь, необходимую для дальнейшего приготовления биологической жидкости. Разбавление лейкоцитарной взвеси до 5*109 лейкоцитов/л дистиллированной водой и полное замораживание ее при температуре -20°С позволяет разрушить клеточные мембраны, приводящие к выходу внутриклеточных цитокинов во внеклеточную среду, что при размораживании полученной биологической жидкости дает повышение точности измерения общей концентрации цитокинов, при этом снижается индивидуальная вариабельность показателей.
Как известно, животные клетки по-разному реагируют на замораживание [14], это обусловлено, в том числе, присутствием в их структуре белков, дифференцируемых на гидрофильные, к которым относится большинство белков цитоплазмы, ядра и межклеточные вещества, и гидрофобные - включающие белки, входящие в состав биологических мембран. Также известно, что лейкоциты имеют необходимость индивидуального подбора режима замораживания и оттаивания, связанную с особенностями кристаллизации воды [15], кроме того, воздействие низких температур в результате кристаллообразования при фазовом переходе вода-лед приводит к разрушению клеточных мембран [16, 17]. При этом отрицательные температуры ниже 15 градусов приводят к разрушению плазматической мембраны [18].
Проведенные исследования и статистическая обработка результатов позволили авторам подобрать оптимальный режим подготовки периферической крови для иммуноферментного анализа, что позволяет достоверно оценить концентрацию спонтанной продукции цитокинов.
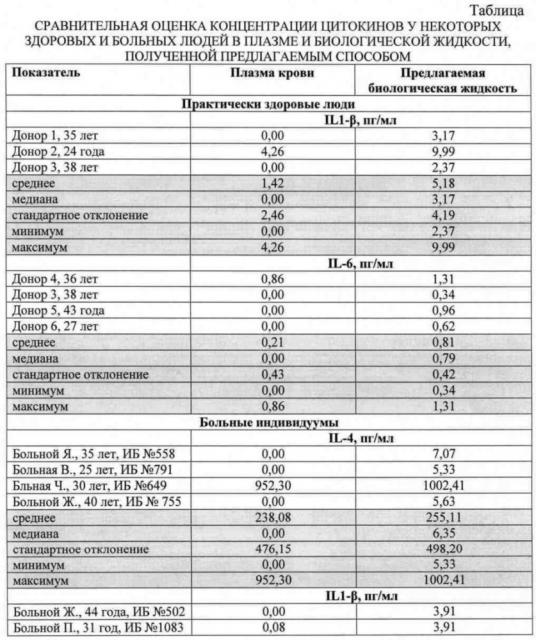
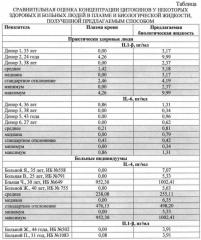
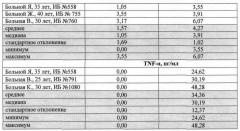
Для сравнения методом иммуноферментного анализа была определена концентрация цитокинов в плазме крови и периферической крови, подготовленной предлагаемым способом, были обследованы 150 человек, из которых: 50 - здоровые добровольцы, 100 - имели воспалительные заболевания. Больные находились на лечении в Уральский НИИ травматологии и ортопедии. Больные были поделены на 3 когорты в зависимости от тяжести течения заболевания: Первая когорта - 40 человек (20 мужчин и 20 женщин, средний возраст - 33,4±1,7 года, сопутствующая патология встречалась у 20 больных (50%)). Вторая когорта - 30 человек (15 мужчин, 15 женщин, средний возраст - 36,2±4,5 года, сопутствующая патология встречалась у 15 больных (50%)). Третья когорта - 30 человек (15 мужчин и 15 женщин, средний возраст - 32,8±1,9 года; сопутствующая патология встречалась у 15 больных (50%)). Группа здоровых добровольцев 50 человек (27 мужчин, 23 женщины, средний возраст 35,8 лет). Исследование показало, что содержание различных цитокинов (IL-1β, IL-2, IL-4, IL-6, IL-10, INFγ, TNF-α) в биологической жидкости, подготовленной предлагаемым способом выше концентрации в плазме крови на величину от 7,4 до 43,3%. Это доказывает, что при определении концентрации цитокинов иммуноферментным методом использование периферической крови, подготовленной предлагаемым способом, является предпочтительным.
Таким образом, предлагаемый способ подготовки периферической крови для иммуноферментного определения спонтанной продукции цитокинов методом стандартизации количества лейкоцитов с последующим криогидролизом их мембран является новым и соответствует критерию «изобретательский уровень».
Предлагаемый способ осуществляют следующим образом. У пациента в условиях соблюдения правил асептики и антисептики стандартным образом забирается периферическая кровь в пробирку, содержащую антикоагулянт (гепарин лития) в объеме 5-7 мл. После аккуратного перемешивания пробирку оставляют на 20 мин при комнатной температуре для свободного осаждения эритроцитов. После их седиментации на дно пробирки производят взятие 0,5 мл располагающейся над эритроцитами фракции лейкоцитарной взвеси, в которой производят точное определение концентрации лейкоцитов - источника цитокинов - любым удобным способом (на гематологическом анализаторе, в камере Горяева) и доводят ее до концентрации 5*109 лейкоцитов/л дистиллированной водой, что позволяет стандартизировать исследование и дает возможность сравнительного анализа образцов с разным количеством клеток между собой. Подготовленную лейкоцитарную взвесь помещают в морозильную камеру с температурой -20°С до полного замораживания, приводящего к деструкции клеточных мембран, и высвобождения цитокинов из клеток. После размораживания полученную биологическую жидкость используют для определения спонтанной продукции цитокинов, содержащихся в клетке и внеклеточном пространстве методом иммуноферментного анализа с использованием стандартных коммерческих наборов реагентов в зависимости от варианта исследуемого цитокина, используя ручной метод или любой автоматический или полуавтоматический анализатор. Предлагаемый способ легко воспроизводим в условиях любого лечебного учреждения.
Предлагаемый способ иллюстрируется следующими примерами: в таблице представлена сравнительная оценка определения концентрации цитокинов в плазме крови стандартным методом и биологической жидкости, полученной предложенным методом.
Литература
1. Е.Ф. Чернушенко, Л.П. Кадан. О.Р. Панасюкова, В.Н. Петишкина, Л.М. Цыганкова Цитокины в оценке иммунной системы у больных туберкулезом легких // Украинский пульмонологический журнал. - 2010. - №2. - 39-43.
2. Притулина Ю.Г., Криворучко И.В., Шенцова В.В., Филь Г.В., Астапченко Д.С., Сахарова Л.А. Анализ цитокинового статуса при ряде инфекционных заболеваний // Успехи современного естествознания. - 2014. - №2. - С. 16-20.
3. Исаева Р.Х., Антонюк И.А., Гридякина А.В., Евстафьева А.Е. Иммунологические изменения при черепно-мозговой травме // Международный журнал прикладных и фундаментальных исследований. - 2014. - №8-2. - С. 41-47).
4. Убшаева Ю.Б. Комплексный анализ уровня сывороточных цитокинов и полиморфизма их генов в прогнозе течения и эффективности терапии ревматоидного артрита: автореф. дис. канд. мед. наук: 14.01.22 / Ю.Б. Убшаева. - Волгоград, 2013. - 23 с. - С. 10.
5. Малинин С.А. Профилактика и лечение острого послеоперационного панкреатита после спленэктомий у онкологических больных: автореф. дис. канд. мед. наук: 14.01.12 / С.А.Малинин. - Ростов-на-Дону, 2011. - С. 15.
6. Плотникова М.А. Мультиплексные методы определения вирус-индуцированной экспрессии цитокинов на основе микроципов и ПЦР: дис. канд. биол. наук / М.А. Плотникова. - Санкт-Петербург, 2014. - 117 с. - С. 33.
7. Коненков В.И., Ракова И.Г., Авдошина В.В., Гельфгат Е.Л. Комплексная оценка уровня спонтанной продукции цитокинов в культуре мононуклеарных клеток периферической крови здорового человека // Цитокины и воспаление. - 2005. - №2. - С. 33-37.
8. Кубанов А.А. Содержание интерферона-g, фактора некроза опухоли-а, интерлейкинов-4 и -12 в цервикальном секрете у пациенток с папилломавирусной инфекцией // Вестник дерматологии и венерологии. - 2005. - №2. - (http://www.mediasphera.ru/journals/vestnik/120/1417).
9. Итоговый отчет по теме «Оценка иммуномодулирующего действия биологически активной добавки «Кавесан» в экспериментальных мышиных моделях и в условиях in vitro на человеческих клетках» / под ред. В.А. Козлова. - Новосибирск: ФГБУ «НИКИ» СО РАМН, 2013. - 38 с. - С. 10, 12.
10. Коненков В.И., Ракова И.Г., Авдошина В.В., Гельфгат Е.Л. Комплексная оценка уровня спонтанной продукции цитокинов в культуре мононуклеарных клеток периферической крови здорового человека // Цитокины и воспаление. - 2005. - №2. - С. 33-37.
11. Поспелова А.В., Бурмистрова А.Л., Хомич Ю.С., Самышкина Н.Е., Бахарева Л.И. Влияние грибов рода Candida на синтез цитокинов иммунными клетками периферической крови человека in vitro // Успехи современного естествознания. - 2006. - №2 - С. 86.
12. Пересторонин В.И. Патофизиологические аспекты развития хронического гнойного риносинусита: автореф. дис. канд. мед. наук: 14.03.03 / Пересторонин В.И. - Чита, 2013. - 24 с.
13. Егорова Е.В., Пересторонин В.И., Цыбиков Н.Н. Уровень цитокинов и аутоантител к ним в сыворотке крови и назальном секрете у больных хроническим гнойным риносинуситом // Врач-аспирант. - 2013. - №2. - http://vrach-aspirant.ru/articles/otorhinolaryngology/12578/.
14. Сведенцов Е.П. Функциональное состояние лейкоцитов после выхода из криоанабиоза: научное издание / Е.П. Сведенцов, Т.В. Туманова. - Екатеринбург: УрО РАН, 2007. - 80 с.
15. Щеглова О.О. Функциональное состояние лейкоцитов после выхода из холодового анабиоза при умеренно-низкой температуре: дисс. канд. биол. наук: 03.00.13, 14.00.29 / Щеглова О.О. - Киров, 2005. - 116 с.
16. Зайцева О.О., Полежаева Т.В., Сведенцов Е.П., Соломина О.Н., Утемов С.В. Эффективность применения оригинальных криофилактиков для сохранности лейкоцитов при -40°С // Cjournal of stress physiology & biochemistry. - 2011. - Vol. 7. - №4. - С. 198-206. - C. 204.
17. Svedentsov E.P., Chtcheglova O.O., Tumanova T.V., Solomina O.N. Conservation leukocytes in the conditions of cryoanabiosis (-40°C) // Journal of Stress Physiology & Biochemistry. - 2006. - Vol. 2. - №1, pp. 28-34. - P. 32.
18. Кузнецов K.B. Консервирование тромбоцитов замораживанием (экспериментальное исследование): автореф. дис. анд. мед. наук: 14.00.29 / К.В. - Киров, 2006. - 24 с. - С. 10.
Способ подготовки периферической крови для иммуноферментного определения спонтанной продукции цитокинов, включающий забор крови и перемешивание с антикоагулянтом, отличающийся тем, что после перемешивания антикоагулянта с кровью смесь оставляют при комнатной температуре на 20 мин для свободного осаждения эритроцитов, затем забирают 0,5 мл надосадочной лейкоцитарной взвеси и разводят ее дистиллированной водой до концентрации 5*109 лейкоцитов/л, замораживают при температуре -20°С, после размораживания полученную биологическую жидкость используют для определения цитокинов.