Способ получения препарата лютенурина из кубышки желтой (nuphar lutea (l.) smith)
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности, в частности к способу получения алкалоидов кубышки желтой (Nuphar lutea (L.), обладающих антимикробной активностью. Способ получения препарата Лютенурина, обладающего антимикробной активностью, из корневищ кубышки желтой (Nuphar lutea L.), заключающийся в экстракции сырья, извлечении алкалоидов и получении гидрохлоридов насыщением раствора алкалоидов хлористым водородом, при этом экстракцию измельченного сырья осуществляют 1,0-5,0% водным раствором фосфорной кислотой три раза, экстракты по мере поступления концентрируют и объединяют, нейтрализуют гидратом окиси кальция, затем высушенный осадок фосфата кальция, содержащий основание алкалоидов, экстрагируют этиловым спиртом 3 раза, объединяя экстракты, полученную реакционную массу суммы алкалоидов хроматографически разделяют на колонке с силикагелем, используя в качестве элюента хлороформ, из полученной фракции, обогащенной нуфлеином, получают гидродихлорид алкалоидов, при определенных условиях. Вышеописанный способ позволяет повысить эффективность технологии и содержание целевого алкалоида 6,6'-дигидрокситиобинуфаридина (нуфлеина), обладающего антимикробной активностью. 1 ил., 6 пр.
Реферат
Изобретение относится к химико-фармацевтической промышленности, в частности к способам получения алкалоидов кубышки желтой (Nuphar lutea (L.) Smith) - (С.К. Черепанов. Свод дополнений и изменений к "Флоре СССР" (т.т. I-XXX), Л., Наука, 1973) или (Nuphar luteum - Index kewensis, II, 1960) семейства кувшинковых (Nymphaceae). Препарат Лютенурин, получаемый из корневищ этого растения, обладающий протистоцидным и сперматоцидным действием, активным в отношении трихомонад, патогенных грибов, оказывающий бактериостатическое действие в отношении грамположительных микроорганизмов, используется для лечения урогенитальных заболеваний, в частности для лечения трихомонадных кольпитов и уретритов, а также в качестве контрацептивного средства (Я.А. Алешкина, С.А. Вичканова, М.А. Рубинчик, Т.Н. Ильинская. Препарат Лютенурин. Авт. свид. 145858, 04.05.1967, бюл. №10, 28.07.1967; Лютенурин, Lutenurinum, ФС 42-948-75; Лютенурин, Lutenurin, Lutenurine, Проспект ЦБНТИ МП, 89 с.; Лютенурин, в кн.: Полный современный справочник лекарственных препаратов, 2 изд., С.А. Кржижановский и М.Б. Вититнова, Изд. Дом "Ринол Классик", М., 2002, с. 950). Препарат обладает широким спектром антимикробной активности в отношении грамположительных бактерий (стафилококки, стрептококки), спорообразующих и кислотоустойчивых бактерий и патогенных грибков типа Candida albicans, Microsporum lanosum, Trichophyton gypeum, а также противотрихомонадной и сперматоцидной активностью (Фитопрепараты ВИЛАР: научно-справочное издание, М., Борус-Пресс, 2009, 256 с.).
Используемый в медицинской практике препарат Лютенурин, представляющий собой сумму алкалоидов тиобинуфаридина, C30H42N2O2S, и нуфлеина, C30H42N2O4S (6,6'-дигидрокситиобинуфаридина) в виде гидрохлоридов. Действующим началом препарата Лютенурина является алкалоид нуфлеин (1) (Т.Н. Ильинская, А.Д. Кузовков, Т.Г. Монахова, Химическое изучение алкалоидов кубышки желтой в книге: "Лекарственные растения. Химия", Том 15, ВИЛАР, под ред. А.И. Баньковского, "Колос", Москва, 1969, с. 322-333).
Технология получения Лютенурина была впервые разработана во Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР). Исходным сырьем для производства препарата использованы корневища кубышки желтой, заготавливаемой на территории РФ, содержащей 0,4% суммы алкалоидов (нуфлеин, тиобинуфаридин, нуфарин, нуфамин, неотиобинуфаридин, изомерные нуфаридины и дезоксинуфаидины, тионуфлютин, и другие (Атлас лекарственных растений России, Москва, 2006, с. 155-156). Изучение структуры алкалоидов кубышки также проводилось в Университетах Mc Master (Онтарио - Канада) и Варшавы (Польша) (La Londe и Wrobel) (R.T. La Londe, C.F. Wong, K.C. Das, J. Am. Chem. Soc, 95, 6342 (1973). J.T. Wrobel, B. Bobeszko, T.I. Martin, D.B. Maclean et al. Can. J. Chem., 51, 2810 (1973). Ch.F. Wong, R.T. LaLonde, Phytochemistry, 9(8), 1851-1854 (1970); 9(11), 2417 (1970). A. Iwanow, K. Woltasiewicz, J.T. Wrobel, Phytochemistry, 25(9), 2227-2231 (1986). RT. LaLonde, C.F. Wong, Phytochemistry, 11, 3305-3306 (1972).). Препарат и способ его получения были запатентованы в ряде стран (Пат. Франции №1417969, Пат. Англии №968042, Пат. США №3147246, Пат. Японии №447778). Структура действующего компонента препарата нуфлеина была подтверждена методом ЯМР-спектроскопии (М.Е. Перельсон, Т.Н. Ильинская, О.Н. Толкачев, Химия природных соединений, 1975, №6, 768-770). Близкие по структуре алкалоиды кубышки имеют подобные физико-химические характеристики.
Разработанная первоначально технология производства Лютенурина (Я.А. Алешкина, С.А. Вичканова, М.А. Рубинчик, Т.Н. Ильинская. Авт. свид. №148858,11.09.1959), опубликованная в монографии В.П. Захарова, Н.И. Либизова и Х.А. Асланова «Лекарственные вещества из растений и способы их производства», Ташкент, Изд. «ФАН», УзССР, 1980, стр. 109-112, включает стадии подготовки сырья, экстракции, получения соли и очистки готового продукта. Для этого высушенные и измельченные корневища подщелачивают 10% раствором аммиака при перемешивании, а затем экстрагируют дихлорэтаном, последовательно пятикратно, каждый раз фильтруя экстракт через сукно. Фильтраты обрабатывают серной кислотой, кислотную фазу отделяют, нейтрализуют аммиаком, выпавший осадок фильтруют, промывают водой и сушат на воздухе. Полученную порошкообразную сумму алкалоидов растворяют в серном эфире, раствор отделяют от осадка декантацией. Объединенные экстракты сушат, фильтруют, упаривают до 1/10 первоначального объема, приливают пятикратный объем петролейного эфира, выпавший осадок отделяют декантацией, надосадочную жидкость вновь сушат поташом, фильтруют, а затем в полученный раствор пропускают сухой хлористый водород до кислой реакции. Осадок Лютенурина отфильтровывают, промывают петролейным эфиром, протирают через капроновую сетку и сушат на противнях 2-3 суток до полного удаления растворителя, а затем просеивают через капроновое сито. Выход готового продукта, согласно регламенту, составляет 65%.
Недостатками данной технология являются: длительность процесса, использование токсичных и огнеопасных растворителей.
В опубликованном ранее патенте изложена технология получения препарата Лютенурина (Шейченко О.П., Шейченко В.И., Толкачев О.Н., Фатеева Т.В., Шипулина Л.Д., Быков В.А., Сокольская Т.А., патент РФ 2292218, 27.01.2007), которая заключается в следующем: высушенные и измельченные корневища кубышки желтой трижды экстрагируют водно-спиртовым раствором фосфорной кислоты, объединенные экстракты упаривают до водного кубового остатка, последний обрабатывают бутанолом, водно-кислотную фазу отделяют, нейтрализуют последовательно раствором гидрата окиси аммония и затем - карбонатом кальция, фильтруют, промывают водой, основания алкалоидов извлекают спиртом. Целевую фракцию упаривают и гидрохлориды получают насыщением раствора алкалоидов хлористым водородом. Выход готового продукта в расчете на абсолютно сухое сырье - 0,35% или в расчете на содержание нуфлеина в сырье - 52%. Указанная технология получения препарата Лютенурина выбрана нами в качестве прототипа.
Недостатками известного метода по прототипу являются ценообразование и выделение углекислого газа в процессе нейтрализации фосфорной кислоты, требующих применения дополнительных технологических приемов, а также использования этилового спирта на головной стадии.
Техническая задача предлагаемого способа - повышение эффективности технологии, упрощение проведения технологических операций и повышение содержания целевого алкалоида 6,6'-дигидрокситиобинуфаридина (нуфлеина), обладающего антимикробной активностью.
Решение технической задачи достигается за счет использования способа получения препарата Лютенурина, обладающего антимикробной активностью, из корневищ кубышки желтой (Nuphar lutea L.), заключающийся в экстракции сырья, извлечении алкалоидов и получении гидрохлоридов насыщением раствора алкалоидов хлористым водородом. При этом экстракцию измельченного сырья осуществляют 1,0-5,0% водным раствором фосфорной кислотой при комнатной температуре в соотношении сырье:экстрагент, равном 1:20, полученный экстракт концентрируют и нейтрализуют гидратом окиси кальция, затем высушенный осадок фосфата кальция, содержащий основание алкалоидов, экстрагируют алифатическим спиртом или хлороформом, полученную реакционную массу суммы алкалоидов хроматографически разделяют на колонке с силикагелем, используя в качестве элюента хлороформ, из полученной фракции, обогащенной нуфлеином, получают гидродихлорид алкалоидов.
Полученный технический результат - исключены выбросы в атмосферу летучих веществ углекислоты и аммиака и пенообразование, повышена эффективность технологии производства препарата Лютенурина за счет исключения на головной стадии экстракции использования алифатических спиртов, упрощения проведения технологических операций, повышения содержания суммы хинолизидиновых алкалоидов в пересчете на нуфлеин до 81%.
Предлагаемая новая технология включает следующие стадии:
1. В качестве сырья используют корневища кубышки желтой, содержащие нуфлеин.
2. Экстракцию высушенных и измельченных корневищ кубышки желтой осуществляют водным раствором фосфорной кислоты 1-5%.
3. Водно-кислотный экстракт, содержащий алкалоиды, концентрируют в вакууме.
4. Полученный концентрат обрабатывают гидратом окиси кальция.
5. Отделяют выпавший осадок фосфатов кальция в смеси с алкалоидами в виде оснований, промывают его водой и сушат, предпочтительно, при комнатной температуре или в калорифере при температуре 60-80°C.
6. Обрабатывают высушенный осадок минеральных солей в смеси с алкалоидами алифатическим спиртом, например этанолом, или хлороформом при 45°C или при комнатной температуре, фильтруют.
7. Упаривают спиртовой фильтрат в вакууме.
8. Отделяют примеси минеральных солей.
9. Хроматографически разделяют полученную сумму алкалоидов на колонке с силикагелем, в качестве элюента используют хлороформ. Фракцию с преобладанием нуфлеина и тиобинуфаридина, обогащенную нуфлеином, упаривают и затем получают гидрохлориды как в прототипе.
10. Постадийный контроль над ходом технологического процесса осуществляют методом ТСХ, а количественное содержание суммы хинолизидиновых алкалоидов в полупродуктах и готовом продукте определяют спектрофотометрически и содержание нуфлеина в готовом продукте методом 1H ЯМР-спектроскопии.
Описание метода получения Лютенурина приведено в следующих примерах.
Пример 1. Измельченное сырье кубышки желтой в количестве 100 г экстрагируют 3% фосфорной кислотой (ортофосфорной кислотой) при комнатной температуре три раза по 3 часа в соотношении 1:20, при перемешивании, каждый раз добавляя новую порцию экстрагента, равную слитому маточному раствору. Третий экстракт используют для экстракции свежего сырья следующей загрузки. Объединенные экстракты (2,41 л) концентрируют до 1,12 л, нейтрализуют добавлением гидрата окиси кальция в количестве 100 г, при перемешивании, в течение 60 минут, осадок Са3(PO4)2 отделяют, промывают дистиллированной водой 3 раза по 30 мл и сушат при комнатной температуре. Высушенный фосфат кальция, содержащий основания алкалоидов, экстрагируют этиловым спиртом 3 раза по 500 мл при работающей мешалке. Объединенные экстракты упаривают в вакууме. Получают 0,84 г суммы алкалоидов из 100 г сырья без учета влаги. Хроматографирование алкалоидов проводят на колонке с силикагелем L 40/100 для колоночной хроматографии (Chemapol) в соотношении 1:10 (вещества-сорбент). Элюирование алкалоидов проводят хлороформом.
Первые две фракции элюата, не содержащие нуфлеина, отделяют, а нуфлеинсодержащие фракции 4-15 объединяют и упаривают, получают 0,45 г оснований, содержащих нуфлеин. Отбор фракций проводят под контролем на ТСХ.
Гидрохлориды алкалоидов получают пропусканием сухого газообразного хлористого водорода (из генератора для его получения из серной кислоты и хлористого аммония) в высушенный над поташом раствор смеси серного и петролейного эфиров (1:5) оснований алкалоидов. Выпадает осадок гидрохлоридов с содержанием суммы хинолизидиновых алкалоидов в пересчете на нуфлеин 78-80% (спектрофотометрический метод анализа). Выход готового продукта - 0,45%.
Пример 2. Экстракцию водным раствором фосфорной кислотой на головной стадии проводят, как в примере 1. Затем фильтруют, упаривают кислый раствор 2,100 л в вакууме до объема 0,60 л и экстрагируют бутанолом 3 раза по 0,70 л; 0,60 л; и 0,50 л, отделяют водную фазу, остатки бутанола удаляют в вакууме, остаток разбавляют водой и вновь упаривают для удаления остатков бутанола. Кислый кубовый остаток нейтрализуют гидратом окиси кальция при перемешивании. Выпавший осадок фосфатов кальция и алкалоидов отделяют, промывают водой и сушат при комнатной температуре. Полученный продукт экстрагируют хлороформом, сушат поташом, объединяют экстракты, фильтруют и упаривают, затем на хроматографической колонке отделяют нуфлеинсодержащую фракцию. Получают гидрохлориды суммы алкалоидов, как в примере 1, с выходом 0.42-0.45% с содержанием в них хинолизидиновых алкалоидов, в пересчете на нуфлеина бисангидродихлорид, не ниже 60%.
Пример 3. Осуществляют аналогично примеру 1, используя 5%-ную фосфорную кислоту на головной стадии экстракции. Высушенный осадок фосфатов кальция в смеси с алкалоидами экстрагируют хлороформом, далее известным способом получают гидрохлориды суммы алкалоидов с выходом 0,42% и содержанием в них хинолизидиновых алкалоидов в пересчете на нуфлеин - 77%.
Пример 4. Способ осуществляют, как в примере 2, отличающийся тем, что выпавший осадок фосфатов кальция вместе с алкалоидами обрабатывают этиловым спиртом. Спиртовые экстракты упаривают, полученную смолообразную сумму экстрактивных веществ разделяют, как выше, на колонке с силикагелем. Гидрохлорид получают, как в примере 1. Выход гидрохлоридов алкалоидов - 0,40-0,42% с содержанием в них фуранохинолизидиновых алкалоидов в пересчете на нуфлеина бисангидродихлорид не ниже 60% (78-81%).
Пример 5. Способ осуществляют аналогично примеру 1, за исключением использования 1%-ной фосфорной кислоты на головной стадии экстракции. На стадии экстракции высушенного осадка фосфатов кальция в смеси с алкалоидами используют изопропиловый спирт. Получают гидрохлориды суммы алкалоидов с выходом 0,4% с содержанием в них суммы хинолизидиновых алкалоидов 78%.
Пример 6. Способ осуществляют, как в примере 2. Он отличается тем, что объединенные этанольные экстракты алкалоидов после обработки твердых продуктов нейтрализации упаривают, остаток растворяют в 5%-ном растворе соляной кислоты, объединенные кислотные растворы подщелачивают до pH 9 25%-ным раствором гидрата окиси аммония, а затем упаривают в вакууме. Сухой остаток обрабатывают хлороформом. Хлороформный экстракт промывают водой, высушивают сульфатом натрия и упаривают в вакууме.
Остаток хроматографируют на колонке с силикагелем, собирая хлороформные фракции, содержащие нуфлеин, из которых получают гидрохлориды алкалоидов, как в примере 1. Выход готового продукта - 0,42-0,45% с содержанием в них фуранохинолизидиновых алкалоидов в пересчете на нуфлеина бисангидродихлорид - 79%.
Далее приведены данные антимикробной активности полученного продукта. В лаборатории микробиологических исследований ФГБНУ ВИЛАР была изучена антимикробная активность препарата, полученного по заявляемому способу (в виде соли) в сравнении с прототипом.
Изучение бактериостатической активности в опытах in vitro
При изучении бактериостатической активности в опытах in vitro использовали метод двукратных серийных разведений препарата в жидких питательных средах.
Микроорганизмы
В качестве одного из показательных патогенных тест-микроорганизмов использовали грамположительный кокк - Staphylococcus aureus 209-Р.
Среды
При определении бактериостатической активности образцов препарата использовали мясо-пептонный бульон (МПБ).
Методика исследований
Бактериостатическую активность в опытах in vitro изучали методом серийных разведений препарата в жидкой питательной среде (МПБ). При изучении образцов препарата в первую пробирку, содержащую 4 мг препарата, добавляли питательную среду в количестве 4 мл для получения первоначальной концентрации 1000 мкг/мл и затем, путем двукратных разведений, готовили ряд убывающих концентраций образцов препарата. Последняя пробирка с чистой средой (без добавления препарата) служила контролем.
После этого все пробирки (опытные и контрольные) засевали тест-культурой микроорганизма.
Взвесь тест-культуры готовили в изотоническом растворе натрия хлорида по бактериальному стандарту мутности 10 ЕД (109 микробных тел/мл), затем в каждую пробирку вносили по 0,2 мл взвеси, содержащей 104 микробных тел/мл. Посевы инкубировали в термостате при температуре 37°C в течение 24 ч. Опыты проводили три раза.
Учет результатов.
Антибактериальный эффект изучаемых образцов препарата определяли по минимальной ингибирующей рост бактерий концентрации (МИК), при которой визуально не наблюдали роста микроорганизмов. Результаты исследования представлены в таблице.
Результаты исследования
В таблице 1 показана высокая бактериостатическая активность всех изученных образцов препарата в концентрации 1 мкг/мл в отношении изученного штамма Staphylococcus aureus 209-Р. При этом следует отметить, что активность препарата, полученного по заявляемому способу (в виде соли), по активности не отличается от прототипа.
ВЫВОДЫ
1. Предлагаемый способ прост в исполнении, повышает эффективность технологии производства препарата Лютенурина.
2. Изучена антибактериальная активность образцов препарата лютенурина, полученного по заявляемому способу в сравнении с прототипом. Установлена высокая антибактериальная активность всех изученных образцов препарата в концентрации 1 мкг/мл в отношении Staphylococcus aureus 209-Р.
3. На основании полученных результатов можно сделать вывод о целесообразности получения препарата Лютенурин по заявляемому способу.
ОПРЕДЕЛЕНИЕ ПОДЛИННОСТИ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АНТИМИКРОБНОГО ПРЕПАРАТА ИЗ КУБЫШКИ ЖЕЛТОЙ
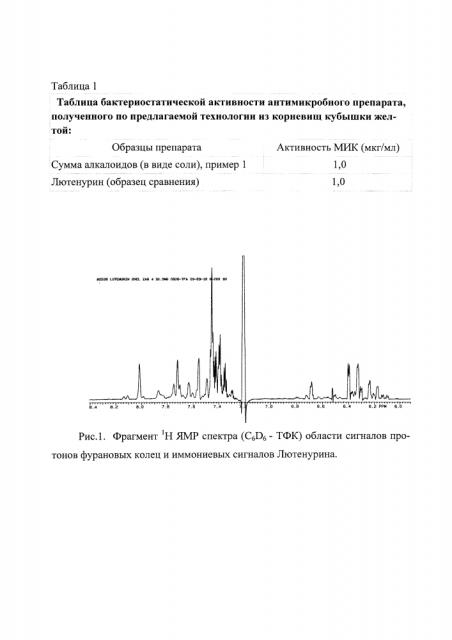
Препарат Лютенурин, получаемый из корневищ кубышки желтой, представляет собой смесь веществ, относящихся к классу хинолизидиновых алкалоидов. Согласно данным 1Н ЯМР (рис. 1) в субстанции Лютенурина преобладает алкалоид нуфлеин, обладающий биологической активностью.
В представительной области спектра наиболее интенсивные сигналы принадлежат алкалоиду нуфлеину. В 1Н ЯМР спектре раствора нуфлеина в смеси растворителей бензол - трифторуксусная кислота (Рис. 2) химические сдвиги сигналов имеют следующие значения: 6,31 и 6,44 м.д. (β протоны фурановых колец), 7,41 и 7,57 м.д. (а протоны фурановых колец) и 7,73 и 8,03 м.д. (протоны иммониевого фрагмента). Отмечена слабая зависимость положения сигналов от соотношения компонентов растворителя (бензол - трифторуксусная кислота).
Способ получения препарата Лютенурина, обладающего антимикробной активностью, из корневищ кубышки желтой (Nuphar lutea L.), заключающийся в экстракции сырья, извлечении алкалоидов и получении гидрохлоридов насыщением раствора алкалоидов хлористым водородом, отличающийся тем, что экстракцию 100 г измельченного сырья осуществляют 1,0-5,0% водным раствором фосфорной кислотой три раза по 3 часа при комнатной температуре в соотношении сырье:экстрагент, равном 1:20, каждый раз добавляя новую порцию экстрагента, равную слитому маточному раствору, экстракты по мере поступления концентрируют и объединяют, нейтрализуют гидратом окиси кальция, затем высушенный осадок фосфата кальция, содержащий основание алкалоидов, экстрагируют этиловым спиртом 3 раза по 500 мл экстрагента, объединяя экстракты, полученную реакционную массу суммы алкалоидов хроматографически разделяют на колонке с силикагелем, используя в качестве элюента хлороформ, из полученной фракции, обогащенной нуфлеином, получают гидродихлорид алкалоидов.