Противовирусное средство на основе экстракта культуры "бородатых корней" ("hairy roots") селитрянки шобера (nitraria schoberi l.)
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к противовирусному средству на основе экстракта культуры «бородатых корней» («hairy roots») селитрянки Шобера (Nitraria schoberi L.), представляющему собой сухой растительный экстракт. Сухой растительный экстракт содержит сухие экстрактивные вещества в количестве не менее 42,7%, суммарные белки в количестве не менее 28±6 мг/г, полисахариды в количестве не менее 205±17 мг/г, фенольные соединения в количестве не менее 9±1 мг/г, флавоноиды в количестве не более 5 мг/г. Изобретение обеспечивает расширение сырьевой базы для изготовления противовирусных средств и ассортимента противовирусных средств в отношении вируса гриппа А субтипов Н3N2 и Н5N1. 1 з.п. ф-лы, 4 ил., 5 табл., 5 пр.
Реферат
Изобретение относится к средствам на основе фитоэкстрактов из культуры "hairy roots" растения Nitraria schoberi в условиях in vitro и in vivo, обладающих противовирусной активностью в отношении вируса гриппа и может быть использовано в биотехнологии, генной инженерии, фармацевтике, вирусологии, медицине и ветеринарии.
Селитрянки (Nitraria) - это галофитные кустарники семейства селитрянковые (Nitrariaceae). Виды рода Nitraria обладают лекарственными свойствами, поскольку богаты флавонолами, дубильными веществами, катехинами, антоцианами, пектиновыми веществами, сахарами [Высочина Г.И., Банаев Е.В., Кукушкина Т.А., Шалдаева Т.М., Ямтыров М.Б. Фитохимическая характеристика сибирский видов рода Nitraria (Nitrariaceae). Растительный мир Азиатской России. 2011. №2(8). С. 108-113]. Кроме того селитрянки накапливают алкалоиды, необычные в структурном отношении и перспективные в плане биологической активности [Норматов М, Юнусов С.Ю. Исследование алкалоидов Nitraria schoberi: структура нитрарина. Химия природ, соед. 1968. №2. С. 139; Пахритдинов Б.М., Новгородова Н.Ю., Норматов М, Юнусов С.Ю. Тетраметилентетрагидро-β-карболин из Nitraria schoberi. Химия природ, соед. 1970. №5. С. 641-642; Османов 3., Ибрагимов А.А., Юнусов С.Ю. Алкалоиды Nitraria sibirica. Химия природ, соед. 1982. №1. С. 126-127; Zaree R., Farhadi М., Mohammdzadeh Z., Goudarzi G.R. Extraction and comparison of alkaloids in different organs during different phonological periods of Nitraria schoberi. Annals of Biological Research. 2013. 4 (2): 130-135; Mohamed A.A, Ali S., El-Baz F.K., Hussein S. R. Comparative Study of Antioxidant Activities of Nitraria retusa and Quantification of Its Bioactive Components by GC/MS. Int. J. Pharm. Sci. Rev. Res. 12/2014. 29(47): 241-246]. Недавно установлено цитотоксическое действие листовых экстрактов N. retusa на клетки меланомы [Boubaker J., Bhouri W., Ben Sghaier M., Bouhlel I., Skandrani I., Ghedira K., Chekir-Ghedira L. Leaf extracts from Nitraria retusa promote cell population growth of human cancer cells by inducing apoptosis. Cancer Cell International. 2011. 11:37; Boubaker J., Bzeouich I.M., Nasr N., Ghozlen H.В., Mustapha N., Ghedira K., Chekir-Ghedira L. Phytochemical capacity of Nitraria retusa leaves extracts inhibiting growth of melanoma cells and enhancing melanogenesis of B16F 10 melanoma. BMC Complementary and Alternative Medicine. 2015. 15:300]. Экстракты плодов, листьев и корней Nitraria schoberi обладают мощными антиоксидантными свойствами, препятствуя образованию свободных радикалов [Sharifi-Rad J. Hoseini-Alfatemi S.M., Sharifi-Rad M., Iriti M. Free Radical Scavenging and Antioxidant Activities of Different Parts of Nitraria schoberi L. Journal of Biologically Active Products from Nature. 2014. V. 4, N. 1, 2014. P. 44-51]. Дальнейшие исследования показали, что экстракты плодов селитрянки Шобера, помимо антиоксидантной, характеризуются антимикробной, антифунгицидной и противовоспалительной активностями [Sharifi-Rad J. Hoseini-Alfatemi S.M., Sharifi-Rad M., Teixeira da Silva J. A. Antibacterial, antioxidant, antifungal and anti-inflammatory activities of crude extract from Nitraria schoberi fruits. 3 Biotech. 2015. V.5. Р.677-684].
Nitraria schoberi имеет дизъюнктивный ареал (Прикаспийская, Туранская низменности; Китай (Джунгария), Афганистан, Северный Иран, Сирия; Закавказье; Алтайский край, юго-восток Западной Сибири, Казахстан, Крым, отроги южных Карпат), произрастая на солонцеватых грунтах пустынь и полупустынь, щебнистых наносах низкогорий, засоленных гипсовых почвах предгорий, приморских песчано-глинистых низинах, на берегах соленых озер. Особенности биологии вида затрудняют его интродукцию, поэтому сбор лекарственного сырья для получения ценных метаболитов трудно осуществим.
Решение проблемы дефицита сырья возможно при применении альтернативных биотехнологических подходов, позволяющих использовать культуры клеток, тканей и органов как «фабрики» для производства биологически активных веществ (БАВ) [Rao S.R., Ravishankar G.A. Plant cell cultures: Chemical factories of secondary metabolites. Biotechnology Advances 20.2002. P. 101-153]. Технологии in vitro имеют ряд преимуществ перед традиционным сбором сырья лекарственных растений, которые состоят в возможности круглогодичного получения ценных метаболитов в контролируемых условиях, обеспечивающих стандартизацию процесса. Поскольку в большинстве случаев биосинтез вторичных метаболитов в каллусных и суспензионных культурах протекает не так активно, как в исходных растениях, наиболее перспективной системой in vitro является культура «бородатых корней» ("hairy roots"). «Бородатые корни», полученные путем целенаправленной генетической модификации растительных клеток с помощью Agrobacterium rhizogenes, характеризуются быстрым ростом на безгормональных питательных средах, их морфологической особенностью является утрата геотропической ориентации корней и проявление у них плагиотропного роста. Культуры «hairy roots» способны продуцировать как ценные метаболиты, характерные для исходного растения [Parr A.J., Hamill J.D. Relationship between Agrobacterium rhizogenes transformed hairy roots and intact, uninfected Nicotiana plants. Phytochemistry. 1987. 26:3241-3245; R. Tropane alkaloid production by Agrobacterium rhizogenes transformed hairy roots cultures of Atropa baetica Wilk. (Solanaceae). Plant Cell Rep.1999. V. 1. P. 418-423], так и новые вещества, являющиеся их предшественниками или производными [Fukui Н, Feroj-Hasan AFM, Ueoka Т, Kyo М. Formation and secretion of a new brown benzoquinone by hairy roots cultures of Lithospermum erythrorhizon. Phytochemistry.1998. V. 47. P. 1037-1039; Fukui H, Feroj-Hasan AFM, Kyo M Formation and secretion of a unique quinone by hairy roots cultures of Lithospermum erythrorhizon. Phytochemistry. 1999. V. 51.P.511-515]. Причем уровень биосинтеза этих веществ сопоставим, а в некоторых случаях и превышает уровень их биосинтеза в интактных растениях [ N, Oksman-Caldentey К.М. Agrobacterium rhizogenes-mediated transformation: roots cultures as a source of alkaloids. Planta Med. 2002. V.68.P. 859-868].
Предшествующий уровень техники
Работы по размножению видов рода Nitraria немногочисленны. Известны традиционные методы размножения селитрянок. Например, Nitraria retusa тиражируют, используя одревесневшие черенки [Suleiman М.K., Bhat N.R., Jacob S., Thomas R.R. Effect of Growth Regulators on Rooting of Hardwood Cuttings of Lycium shawii, Nitraria retusa and Farsetia aegyptia. Journal of Agricultural Science and Technology. 2011. Р. 414-419]. Однако традиционные способы возделывания культур не всегда могут обеспечить получение стандартизированного и экологически чистого сырья.
Существуют методы культивирования разных видов селитрянок в культуре in vitro. Например, К. Садерсан с соавторами размножали селитрянку, притупленную через соматический эмбриогенез и органогенез, используя пазушные почки [Sudhersan С, AboEl-Nil М., Hussain J. Tissue culture technology for the conservation and propagation of certain native plants. Journal of Arid Environments. 2003. 54: 133-147]. Китайскими авторами при размножении селитрянки сибирской [Zhang Qichang, Li Shuangfu, Qi Qige. Micropropagation of Nitraria sibirica. J. of northeast forestry university. 2008 Issue: 4. P. 12-13,28; QU Qi-ge, LI Shuang-fu, Zhang Qi-chang, Zhang Ying-nan. Multiple Shoots Induction and Rapid Propagation of Nitraria sibirica. Acta Horticulturae Sinica 2007. Issue 3. P. 791-792] и селитрянки тангусской [Guo YeHong; Lin HaiMing; Wu Rui. Research on tissue culture and medium of Nitraria tangutorum. Acta Prataculturae Sinica. 2009. Issue 6. P. 59-64] получены адвентивные побеги стеблевого происхождения и каллусные культуры листового происхождения. Однако культивирование растений-регенерантов и не дифференцированно растущих клеток растений не всегда гарантирует сохранение биосинтеза видоспецифичных соединений в условиях in vitro, а также предполагает использование регуляторов роста в составе питательной среды, что ограничивает возможность дальнейшего использования получаемой растительной массы и тем самым снижает ценность метода. Культуры «бородатых корней», в противоположность недифференцированным клеточным культурам, отличаются быстрым ростом на безгормональных средах, генетической и биосинтетической стабильностью [Pistelli L, Giovannini A. Ruffoni В, Bertoli A. Hairy roots cultures for secondary metabolites production //Adv Exp Med Biol. 2010. V. 698. С. 167-184].
Известен аналог, касающийся получении культуры "hairy roots" копеечника чайного [Гусева А.В., Вдовитченко М.Ю., Кузовкина И.Н., Альтерман И.Е. Культура корня hed.th. (Hedysarum theinum krasnob.) - продуцент изофлавонов // Патент РФ №2360964, Бюл. №19 от 10.07.2009]. Культура "hairy roots " Hedysarum theinum обладала способностью к синтезу видоспецифичных изофлавонов. Химический анализ вторичных метаболитов подтвердил, что сохраняется способность к синтезу изофлавонов, характерных для корней целого растения - ононина, гликозида тексазина, малонилононина, формононетина.
Однако для корневой культуры Hedysarum theinum не показана противовирусная активность в отношении вируса гриппа А, в частности вируса гриппа человека субтипа H3N2 и высокопатогенного вируса гриппа птиц субтипа H5N1 с пандемическим потенциалом.
Известно средство, полученное на основе сверхкритической CO2-экстракции надземной части селитрянки Шобера (Nitraria schoberi L.) с последующим выделением методом тонкослойной хроматографии препарата назлинина для лечения сердечно-сосудистой системы (Патент Китая № CN102584832, МПК C07D 487/04, опубл. 18.07.2012 г.).
Наиболее близким аналогом (прототипом) является средство, полученное на основе этанольного экстракта галофитных видов селитрянки, в частности (Nitraria retusa), обеспечивающее снижение диабетической гиперхолестеринемии и обладающее высокой эффективностью ингибирования дифференциации преадипоцитов, которая лечит или снижает ожирение (заявка США №20140148399, МПК A61K 36/185, опубл. 29.05.2014).
Однако для выше указанных аналогов, в том числе и прототипа, касающихся средств на основе галофитных видов селитрянки не показана противовирусная активность в отношении вируса гриппа А, в частности вируса гриппа человека субтипа H3N2 и высокопатогенного вируса гриппа птиц субтипа H5N1 с пандемическим потенциалом. Кроме того, сырье для изготовления экстрактов получают традиционными методами размножения селитрянок, что ограничивает сферу их применения.
Техническим результатом заявляемого изобретения является расширение сырьевой базы для изготовления противовирусных средств и ассортимента противовирусных средств в отношении вируса гриппа А субтипов H3N2 и H5N1.
Указанный технический результат достигается тем, что противовирусное средство на основе экстракта культуры «бородатых корней» («hairy roots») селитрянки Шобера (Nitraria schoberi L.) представляет собой сухой растительный экстракт, приготовленный методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
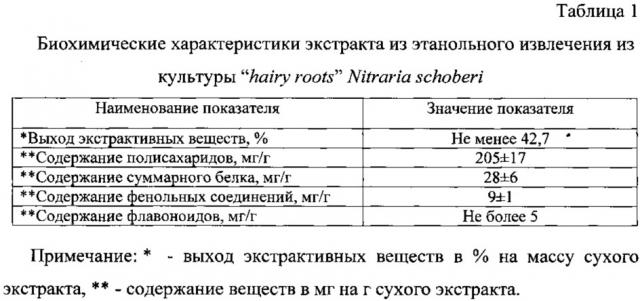
| сухие экстрактивные вещества | не менее 42,7% |
| суммарные белки | не менее 28±6 мг/г |
| полисахариды | не менее 205±17 мг/г |
| фенольные соединения | не менее 9±1 мг/г |
| флавоноиды | не более 5 мг/г, |
водный раствор которого обладает противовирусной активностью в отношении вируса гриппа А человека субтипа H3N2 и высокопатогенного вируса гриппа птиц субтипа H5N1 с пандемическим потенциалом в концентрации не менее 0,01 мг/мл в культуре клеток MDCK и в концентрации не менее 1,0 мг/мл в модели экспериментальной гриппозной инфекции у мышей.
Для обеспечения противовирусной активности суточная доза сухого экстрактивного вещества составляет 25 мкг/г массы мыши, что соответствует суточной дозе 400 мкл/мышь (26,6 мкл/г массы мыши) водного раствора сухого экстрактивного вещества с концентрацией 1,0 мг/мл.
Изобретение иллюстрируется следующими графическими материалами. На фиг.1 представлена фотография формирования адвентивных корней на листовых эксплантах Nitraria schoberi трансформированных штаммом 15834 SWISS через три недели инкубации. Масштаб 1 см. На фиг.2 изображено фото культуры "hairy roots" из листовых эксплантов Nitraria schoberi, трансформированных штаммом 15834 SWISS в жидкой питательной среде БДС.На фиг.3 изображено фото трансформированных корней (масштаб 1 см) культуры "hairy roots" из листовых эксплантов Nitraria schoberi. На фиг.4 приведена диаграмма прироста сырой массы «hairy roots» N. schoberi за пассаж.
Ниже приведены примеры получения культуры «hairy roots» N. schoberi при помощи pRi Т-ДНК трансформации, а также сухого экстракта из этой культуры, изучения цитотоксических и противовирусных свойств экстрактов в перевиваемой культуре клеток MDCK и на лабораторных мышах в отношении вируса гриппа А субтипов H3N2 и H5N1.
Пример 1. Получение культуры "hairy roots" N. schoberi при помощи pRi Т-ДНК трансформации
Для получения культуры "hairy roots" N. schoberi при помощи pRi Т-ДНК трансформации используют стерильные проростки, полученные проращиванием семян в культуре in vitro. Семена предварительно обрабатывают концентрированной H2SO4 в течение 50 мин., промывают под проточной водой до нейтрального значения рН (проба по лакмусовой бумаге), стерилизуют H2O2, удаляют эндокарпий (околоплодник), выделяют зародыш и проращивают на питательной среде Мурасиге-Скуга (МС) при 22±1°C и 16-часовом фотопериоде при освещении 60 мкмоль ×м-2 с-1. Через две недели инкубации у ювенильных растений образуется пара настоящих листьев. Первичную культуру "hairy roots" N. schoberi получают, используя первичные листья стерильных двухнедельных проростков. Их надрезают скальпелем вдоль средней жилки и инокулируют в течение суток в жидкой питательной среде МС, содержащей суспензию агробактерий двухсуточного возраста. Трансформацию проводят, используя дикий (не модифицированный) штамм A. rhizogenes (15834 SWISS). Для проявления трансформации экспланты помещают на агаризованную среду Данстена и Шорта (БДС) [Dunstan D.I., Short К.С.Improved growth of tissue culturesof onion, Alllium сера. Physiol. Plant. 1977. V. 41: 70-72], не содержащую регуляторов роста, с добавлением антибиотика (цефотаксима 500 мг/л) для элиминирования бактерии и культивируют в условиях пониженного освещения (10 мкмоль ×м-2 с-1) в течение трех недель при температуре 22±1°C. Через три недели на первичных листьях появляются хорошо развитые, плагиотропно растущие корни, что является морфологическим признаком успешной генетической трансформации (фиг. 1). Образовавшиеся трансформированные корни отделяют от экспланта и культивируют в тех же условиях с пониженным содержанием цефотаксима в среде (250 мг/л), в течение 3-4 пассажей, длительность пассажа составляет три недели. Затем часть экспланта переносят в жидкую питательную среду и проводят погруженное культивирование в системе in vitro в колбах на шейкере (100 об./мин), в питательной среде того же состава, не содержащей антибиотик, при температуре 22±1°С, длительность пассажа - 25 суток.
Методом селекции выделена стабильно растущая линия культуры "hairy roots" N. schoberi от белого до светло-коричневого цвета (фиг. 2 и фиг. 3). Нарастание биомассы за цикл выращивания увеличивалось в 20-40 раз по сравнению с массой инокулюма (фиг.4). Культура «бородатых корней» Nitr. schob. обладает всеми признаками pRi Т-ДНК трансформированных корней, а именно интенсивным ростом на питательных средах простого состава, не содержащих регуляторов роста, плагиотропным ветвлением корней, а также генетической и биохимической стабильностью. По своей анатомии, морфологии и биохимии такие корни сопоставимы с корнями ювенильных растений, так как они не имеют вторичного роста, способствующего утолщению корней.
Пример 2. Получение сухого экстракта из культуры "hairy roots" Nitraria schoberi методом высушивания этанольного извлечения из измельченного и гомогенизированного сырья 5 г измельченного и гомогенизированого сухого сырья культуры "hairy roots" суспендировали в 100 мл 70%-го водного раствора этанола трехкратно в течение 8 часов общего времени экстрагирования при температуре 60°С. Затем объединенные охлажденные экстракты фильтровали через стеклянные фильтры, выпаривали на ротационном испарителе и высушивали при температуре 60°С в сушильном шкафу.
Пример 3. Определение биохимических характеристик этанольного экстракта
Определение суммы экстрактивных веществ проводили по методике ГФ XII изд., вып. 2. Количественное определение белка в образцах определяли по Бредфорду [Bradford М.М. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. - 1976 - №72. - C. 248-254.]. Методика проведения анализа содержания белка: К 200 мкл пробы добавляют 800 мкл раствора кумасси, аккуратно перемешивают. В контрольную пробирку вносят 200 мкл воды дистиллированной и 800 мкл раствора кумасси. Измеряют оптическую плотность при длине волны 595 нм. По калибровочному графику определяют концентрацию белка.
Суммарное содержание полисахаридов определяли спектрофотометрически модифицированным антроновым методом Дрейвуда, включающем кислотный гидролиз полисахаридов серной кислотой с получением моносахаридов, образующих с антроном окрашенные комплексы сине-зеленого цвета с максимумом спектра поглощения при 520-625 нм [Олейников Д.Н., Танхаева Л.М. Модификация антронового метода количественного определения углеводов и его применение для анализа растительного сырья, содержащего полисахариды. // Бюллетень сибирской медицины. 2006. Приложение 2. С. 118-119.]. При разбавлении реакционной смеси этиловым спиртом максимум спектра поглощения смещается до 430 нм. Определение содержания полисахаридов проводили в пересчете на глюкозу, используя предварительно построенный калибровочный график зависимости величины оптической плотности глюкозы (А=430 нм) от концентрации.
Методика проведения анализа содержания полисахаридов: К 75 мкл пробы добавляют 225 мкл антронового реактива, перемешивают. Кипятят на водяной бане в течение 10 мин. Пробирки охлаждают в холодной проточной воде. Добавляют 700 мкл спирта и каждую пробирку сразу встряхивают. В контрольную пробирку вместо раствора образца вносят воду дистиллированную. Измеряют оптическую плотность при длине волны 430 нм. По калибровочному графику определяют концентрацию полисахаридов.
Содержание фенольных соединений определяли спектрофотометрическим методом Фолина-Чикольте. Методика проведения количественного анализа фенольных соединений описана в работе [Проценко М.А., Костина Н.Е. Разработка и валидация методик количественного анализа фенольных соединений и флавоноидов в экстрактах из высших грибов // Химия растительного сырья. - 2015. - №3. - С. 117-126.].
Биохимические характеристики экстракта из этанольного извлечения из культуры "hairy roots" Nitraria schoberi приведены в таблице 1.
Пример 4. Определение цитотоксических и противовирусных свойств экстрактов из культуры "hairy roots" Nitraria schoberi в отношении вируса гриппа А в линии клеток MDCK
Получен водный раствор в концентрации не менее 0,01 мг/мл сухого растительного экстракта культуры «бородатых корней» («hairy roots») селитрянки Шобера (Nitraria schoberi L.), приготовленного методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
| сухие экстрактивные вещества не менее | 42,7% |
| суммарные белки не менее | 28±6 мг/г |
| полисахариды не менее | 205±17 мг/г |
| фенольные соединения не менее | 9±1 мг/г |
| флавоноиды | не более 5 мг/г |
Культура клеток. Для тестирования цитотоксичности и противовирусной активности препаратов использовали перевиваемую культуру клеток MDCK, полученную из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». По 100 мкл суспензии клеток MDCK в среде RPMI-1640 (ООО «Биолот», Россия), содержащей 5% сыворотки крови плодов коровы ("Gibco", США), вносили в лунки 96-луночных планшетов. Планшеты с клетками помещали в термостат при температуре +37°С, 5% CO2 и 100% влажности на 2-3 сут. до образования клеточного монослоя.
Вирусы. В экспериментах по тестированию противовирусной активности растительных экстрактов использовали штаммы вируса гриппа А: штамм вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) и адаптированный к лабораторным мышам штамм вируса гриппа человека A/Aichi/2/68 (H3N2), полученные из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» (п. Кольцово, Новосибирская обл.). Наработку вируса гриппа производили на 10-суточных куриных эмбрионах (КЭ), титрование вируса гриппа проводили на культуре клеток MDCK. Концентрацию вирусов в культуральной жидкости определяли путем титрования образцов в культуре клеток MDCK, рассчитывали по методу Спирмена-Кербера, выражали в десятичных логарифмах 50%-х тканевых цитопатических доз в мл (lg ТЦД50/мл) и представляли в виде М±m (±I95) Для 95%-го доверительного уровня (I95) [Закс Л. Статистическое оценивание. М.: Статистика; 1976; - 598 С]. Концентрация вируса гриппа субтипов A/H3N2 и A/H5N1 в вирусаллантоисной жидкости (ВАЖ) составляла 4,5 и 7,5 lg ТЦД50/мл соответственно.
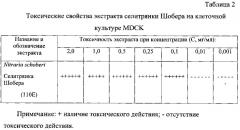
Определение токсичности экстрактов. Для определения токсических концентраций образцы экстрактов разводили в несколько раз средой RPMI-1640 (ООО «Биолот», Россия) и оценивали наличие токсического действия в монослое культуры клеток MDCK с помощью инвертированного микроскопа. Для этого 10 мг каждого образца экстракта растворяли в 1 мл среды RPMI-1640 (ООО «Биолот», Россия) и далее делали разведения растворов образцов в 5 раз, в 10, 20, 40, 100, 1000 раз средой, вносили по 100 мкл в соответствующие лунки планшета (по 6 лунок на каждое разведение) и ставили в термостат при температуре 37°С, 5% CO2 и 100% влажности на 2 сут. Через 2 сут с помощью инвертированного микроскопа оценивали наличие токсического действия в монослое клеток MDCK, инкубированных с разными концентрациями растительных экстрактов.
Как видно из таблицы 2 растворы исследуемого растительного экстракта в концентрации ≤0,01 мг/мл не вызывали токсического действия на клеточную культуру MDCK.
Определение противовирусной активности экстрактов in vitro. В опытах по определению противовирусной активности экстрактов из культуры "hairy roots'" Nitraria schoberi в отношении вируса гриппа готовили разведения вирусаллантоисной жидкости (ВАЖ) каждого вируса от 1 до 8 с десятикратным шагом с использованием поддерживающей среды RPMI-1640 (ООО «Биолот», Россия), содержащей 2 мкг/мл трипсина ТРСК (Sigma, США). В этих опытах использовали нетоксические для клеточной культуры MDCK концентрации растительных экстрактов.
Для определения противовирусной активности образцов в монослой культуры клеток MDCK вносили по 50 мкл выбранного разведения экстракта на поддерживающей среде RPMI-1640, содержащей 2 мкг/мл трипсина, и 50 мкл разведенной поддерживающей средой от 10-1 до 10-8 ВАЖ. Клетки инкубировали в течение 2 сут при температуре 37°С в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 2 сут в каждой лунке с помощью инвертированного микроскопа регистрировали цитопатическое действие (ЦПД) в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1%-й суспензией эритроцитов кур. За титр вируса в контроле и опыте принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке и выражали в lg ТЦД50/мл. Вирусингибирующее действие исследуемых экстрактов оценивали по снижению титра вируса в опыте по сравнению с контролем, для этого высчитывали индекс нейтрализации (ИН) вирусов под влиянием экстракта: ИН = Титр вирусаконтроль - Титр Вирусаопыт (lg).
В качестве контроля использовали:
1. Контроль клеток MDCK, культивируемых в питательной среде RPMI-1640 (ООО «Биолот», С-Петербург), содержащей 2 мкг/мл трипсина ТРСК (Sigma, США).
2. Контроль репродукции штаммов вируса гриппа Aychicken/Kurgan/05/2005 (H5N1) и A/Aichi/2/68 (H3N2) с 1 до 8 разведения с десятикратным шагом без внесения экстрактов.
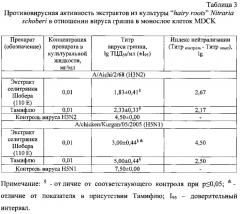
В процессе исследования ингибирования репродукции вируса гриппа человека A/Aichi/2/68 (H3N2) и вируса гриппа птиц Aychicken/Kurgan/05/2005 (H5N1) экстрактами из культуры «бородатых корней» селитрянки Шобера и эталоном сравнения (тамифлю) в монослое клеток MDCK были получены результаты, представленные в таблице 3. Как видно из таблицы, экстракт, полученный из этанольного извлечения из культуры "hairy roots" Nitraria schoberi, проявил значительный противовирусный эффект в отношении используемых в эксперименте штаммов вируса гриппа субтипов H3N2 и H5N1.
Индекс нейтрализации штамма вируса гриппа A/Aichi/2/68 (H3N2) под действием экстракта, полученного из этанольного извлечения из культуры «бородатых корней» селитрянки Шобера, при конечной концентрации сухих экстрактивных веществ в культуральной жидкости 0,01 мг/мл составил 2,67 lg. Индекс нейтрализации другого штамма вируса гриппа Aychicken/Kurgan/05/2005 (H5N1) под действием этого экстракта был более значительным и составил 4,50 lg (табл.3).
В экспериментах in vitro противовирусную активность этанольного экстракта из культуры "hairy roots" Nitraria schoberi сравнивали с активностью коммерческого противогриппозного препарата Тамифлю в отношении этих штаммов вируса гриппа. Как видно из табл. 3 Тамифлю и исследуемый растительный экстракт проявили сравнимую противовирусную активность в отношении вируса гриппа A/Aichi/2/68 (H3N2), в то время как в отношении вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) экстракт из культуры «бородатых корней» селитрянки Шобера проявил достоверно более высокое противовирусное действие на данный вирус.
Таким образом, экстракт, полученный методом этанольного извлечения из культуры «бородатых корней» селитрянки Шобера, обладает низкой токсичностью и выраженной противогриппозной активностью в культуре клеток MDCK. Водный раствор данного растительного экстракта в концентрации 0,01 мг/мл способен значительно ингибировать репродукцию вируса гриппа А субтипов H3N2 и H5N1 в культуре клеток MDCK.
Пример 5. Определение противовирусных свойств экстрактов из культуры "hairy roots" Nitraria schoberi в отношении вируса гриппа А на лабораторных мышах.
Получен водный раствор в концентрации не менее 1,0 мг/мл сухого растительного экстракта культуры «бородатых корней» («hairy roots») селитрянки Шобера (Nitraria schoberi L.), приготовленного методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
| сухие экстрактивные вещества | не менее 42,7% |
| суммарные белки | не менее 28±6 мг/г |
| полисахариды | не менее 205±17 мг/г |
| фенольные соединения | не менее 9±1 мг/г |
| флавоноиды | не более 5 мг/г |
Животные. В работе были использованы аутбредные мыши ICR массой 14-16 г, полученные из питомника ФБУН ГНЦ ВБ «Вектор». Мышей содержали на стандартном рационе с достаточным количеством воды, подвергали эвтаназии в соответствии с требованиями по гуманному содержанию и использованию животных в экспериментальных исследованиях [Руководство по содержанию и использованию лабораторных животных. Washington, D.C.: National Akademy Press; 1996. 138.].
Определение противовирусной активности экстрактов in vivo. В опытах in vivo по изучению противовирусных свойств экстракта, полученного из этанольного извлечения из культуры «бородатых корней» селитрянки Шобера, в отношении вируса гриппа использовали лечебно-профилактическую схему: раствор экстракта с концентрацией 1 мг/мл вводили перорально мышам (по 200 мкл/мышь) за час до заражения вирусом гриппа. Мышей инфицировали интраназально под легким эфирным наркозом при введении в обе ноздри суммарно 40 мкл соответствующего разведения штамма вируса гриппа A/Aichi/2/68 (H3N2) в дозе 25 ЛД50 (50%-х летальных доз), применение которой приводило к гибели 100% животных. Вирус гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) вводили мышам в дозе 10 ЛД50, вызывающей гибель 100% животных. Далее раствор экстракта вводили 2 раза в сутки в течение 5 суток (включая день заражения животных вирусом). За животными наблюдали в течение 16 суток.
Высчитывали процент выживаемости животных в опыте и контроле, коэффициент защиты (КЗ) и среднюю продолжительность жизни (СПЖ) мышей. При определении СПЖ в каждой экспериментальной группе учитывали число животных, проживших определенное количество дней после заражения до гибели, и число выживших животных. За максимальное значение СПЖ для выживших животных принимали 16 суток, т.е. гарантированное время прекращения гибели инфицированных мышей. КЗ высчитывали по формуле: % гибели мышей в контроле - % гибели мышей в опыте.
Статистическая обработка результатов. Статистическую обработку и сравнение результатов осуществляли стандартными методами [Закс Л. Статистическое оценивание. М.: Статистика; 1976; - 59 8 С] с помощью пакета компьютерных программ «Statistica 6.0» (StatSoft Inc. 1984-2001) с оценкой достоверности отличий (р≤0,05) для 95% доверительного уровня (I95). Сравнение доли выживших животных в инфицированных группах проводили по критерию χ2. СПЖ мышей представлены как среднее значение ± стандартное отклонение (M±Sm). Для сравнения СПЖ мышей использовали U-критерий Манна-Уитни [Закс Л. Статистическое оценивание. М.: Статистика; 1976; - 598 С].
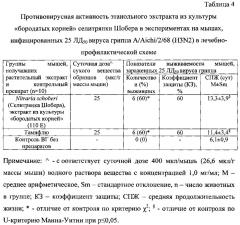
В таблице 4 представлены результаты определения противовирусной активности экстракта, полученного из этанольного извлечения из культуры «бородатых корней» селитрянки Шобера, на лабораторных мышах в отношении вируса гриппа A/Aichi/2/68 (H3N2) в лечебно-профилактической схеме. Как видно из таблицы 4, в опытах in vivo, проведенных по лечебно-профилактической схеме, экстракт, полученный из этанольного извлечения из культуры «бородатых корней» селитрянки Шобера, проявил достоверный протективный эффект по влиянию на процент выживаемости мышей, инфицированных вирусом гриппа A/Aichi/2/68 (H3N2).
В инфицированной группе сравнения (введение Тамифлю) выжило 60% животных, тогда как в контрольной инфицированной группе (введение дистиллированной воды) погибло 100% животных (табл.4).
Средняя продолжительность жизни (СПЖ) мышей, получавших экстракт из этанольного извлечения из культуры «бородатых корней» селитрянки Шобера, а также СПЖ мышей, получавших коммерческий противогриппозный препарат Тамифлю, были достоверно выше, чем в контроле (табл.4). Также были проведены эксперименты на лабораторных мышах по оценке противовирусных свойств экстракта, полученного из культуры "hairy roots" Nitraria schoberi, в отношении вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1). В этих экспериментах исследуемый растительный экстракт и коммерческий препарат Тамифлю проявили достоверный защитный эффект по сравнению с контрольной группой инфицированных мышей (табл.5).
СПЖ мышей, получавших растительный экстракт и Тамифлю, также были достоверно выше, чем в контроле (табл. 5).
Таким образом, этанольный экстракт из культуры «бородатых корней» селитрянки Шобера имеет высокую биологическую активность, которая проявляется в том, что он эффективно ингибирует репродукцию вируса гриппа А субтипов H5N1 и H3N2 в культуре клеток MDCK и достоверно защищает лабораторных мышей при их инфицировании вирусом гриппа в дозах, вызывающих 100% летальный эффект. Этот растительный экстракт может использоваться в качестве основы для новых высокоэффективных противовирусных препаратов для профилактики и лечения гриппа, что подтверждает достижение заявленного технического результата.
1. Противовирусное средство на основе экстракта культуры «бородатых корней» («hairy roots») селитрянки Шобера (Nitraria schoberi L.), представляющее собой сухой растительный экстракт, приготовленный методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
| сухие экстрактивные вещества | не менее 42,7% |
| суммарные белки | не менее 28±6 мг/г |
| полисахариды | не менее 205±17 мг/г |
| фенольные соединения | не менее 9±1 мг/г |
| флавоноиды | не более 5 мг/г, |
водный раствор которого обладает противовирусной активностью в отношении вируса гриппа А человека субтипа H3N2 и высокопатогенного вируса гриппа птиц субтипа H5N1 с пандемическим потенциалом в концентрации не менее 0,01 мг/мл в культуре клеток MDCK и в концентрации не менее 1,0 мг/мл в модели экспериментальной гриппозной инфекции у мышей.
2. Противовирусное средство по п. 1, отличающееся тем, что для обеспечения противовирусной активности суточная доза водного раствора сухого экстрактивного вещества с концентрацией 1,0 мг/мл составляет 400 мкл/мышь или 26,6 мкл/г массы мыши.