3d in vitro двухфазный костно-хрящевой конструкт
Иллюстрации
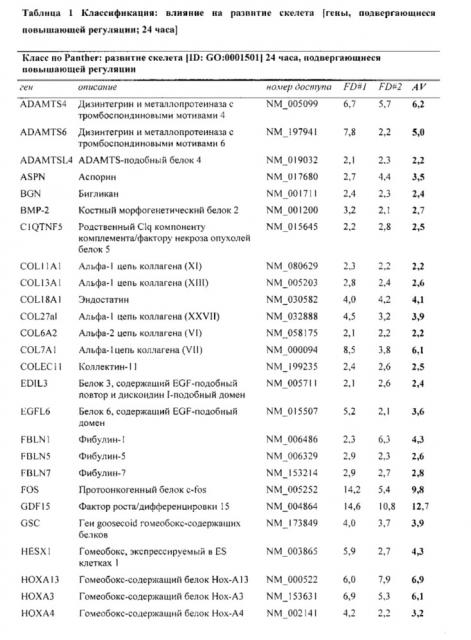
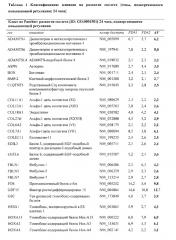
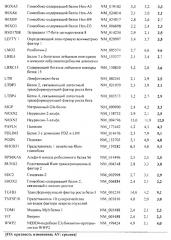
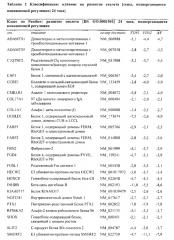
Показать всеИзобретение относится к биотехнологии. Описан 3D in vitro двухфазный костно-хрящевой «органоид», содержащий слой искусственной хрящевой ткани/агрегатов хондрогенных клеток и слой искусственной костной ткани, где искусственная костная ткань содержит придающий структуру каркас и структуру костного мозга; где структура костного мозга в искусственной костной ткани получена путем посева мезенхимальных стволовых клеток на придающий структуру каркас и где слой искусственной хрящевой ткани/агрегатов хондрогенных клеток контактирует по меньшей мере с одной поверхностью слоя искусственной костной ткани, и способы его получения и применения. Изобретение расширяет арсенал средств для медицинской диагностики. 7 н. и 7 з.п. ф-лы, 13 ил., 5 табл., 2 пр.
Реферат
ПРЕДПОСЫЛКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Многочисленные заболевания связаны с дегенеративными изменениями в суставном хряще или процессами неправильной дифференцировки в костном мозге. Заболевания опорно-двигательного аппарата представляют третий из наиболее затратных факторов в лечении заболеваний в Германии после заболеваний сердечно-сосудистой системы и заболеваний пищеварительной системы. Одной из предпосылок для успешного лечения таких заболеваний является понимание клеточных процессов в костном мозге, которые лежат в основе этих заболеваний или связаны с ними. Таким образом, например, возможно лечение лейкоза путем замещения гемопоэтической системы пациента. В то же время, также аутоиммунные заболевания, такие как ревматоидный артрит или красная волчанка, регулируются долгоживущими плазматическими клетками и Т-клетками памяти, которые находятся в специализированных нишах костного мозга.
Костный мозг является многофункциональной многоклеточной тканью, которая, помимо прочего, расположена в полости трубчатых костей. Ткань развивается во время эмбрионального развития примерно на 4 месяце в условиях эндохондрального окостенения при развитии трубчатых костей. Костный мозг характеризуется пористой структурой, образованной губчатой костью и специализированной соединительной тканью, пронизанной многочисленными тонкостенными кровеносными сосудами, синусоидами костного мозга. Одной из главных функций костного мозга является обеспечение подходящего окружения для дифференцировки кроветворных клеток гемопоэтической системы. Гемопоэтическая стволовая клетка (HSC) представляет собой исходную точку для этих процессов дифференцировки, при этом гемопоэтическая стволовая клетка находится в недифференцированном состоянии в нишах гемопоэтических стволовых клеток в структурах губчатой кости в костном мозге. Ниши гемопоэтических стволовых клеток делятся на два функционально различных подтипа. В остеобластной нише гемопоэтические HSC взаимодействуют со специализированными остеобластами посредством различных молекул адгезии и сигнальных молекул, в результате чего HSC удерживаются в округленном непролиферирующем состоянии. После мобилизации HSC стволовые клетки мигрируют в сосудистые ниши стволовых клеток, расположенные в синусоидах, где HSC проявляют повышенную пролиферацию. В соответствии с сегодняшним пониманием ниш гемопоэтических стволовых клеток в костном мозге наименьшая единица в системе ниш стволовых клеток формируется комбинацией остеобластной ниши и сосудистой ниши, расположенной в синусоидном кровеносном сосуде губчатой кости. Помимо функциональных структур ниш стволовых клеток в современных исследованиях раскрывается, что костный мозг является вместилищем для иммунологической памяти. Мезенхимальные стромальные клетки (MSC) служат в качестве клеточных структурных элементов ниш, обеспечивающих выживание плазматических клеток и Т-клеток памяти. В заключение, биологические функциональные свойства костного мозга зависят от ряда клеток, таких как HSC, MSC, эндотелиальные клетки и остеобласты, и их надлежащего взаимодействия в пространственном компартменте.
Гиалиновый хрящ суставов, благодаря своим свойствам высокой эластичности при сжатии и очень гладкой поверхности, обеспечивает возможность движения суставов со слабым трением. Основная часть этой ткани образована множеством белков внеклеточного матрикса, тогда как клеточный компонент, хондроциты, представляет собой редкие вкрапления в этом матриксе, либо по отдельности, либо малыми группами (хондрон). Отсутствие нервных волокон и кровеносных сосудов и, как результат, низкая обеспеченность ткани кислородом и питательными веществами создает особое микроокружение для хондроцитов. Ткань хряща можно разделить на несколько слоев, при этом, вследствие горизонтальной ориентации молекул матрикса самый верхний слой может противодействовать трению, и вследствие вертикальной ориентации расположенные ниже средний и нижний слои могут амортизировать усилие, создаваемое движением. Хотя хондроциты появляются на ранних этапах эндохондрального окостенения при первоначальном процессе мезенхимальной конденсации, и эти клетки вносят существенный вклад в процесс роста костей в ходе формирования эпифизов, ткань гиалинового хряща в суставе развивается только на очень позднем этапе во время эмбриогенеза. Полностью дифференцированные, полностью функциональные слои хряща образуются только после рождения при начале механической стимуляции ткани. У взрослого организма гомеостаз хрящевой ткани сильно зависит от вида и силы механической нагрузки и микроокружения заключенных в ней хондроцитов.
Были предприняты многочисленные попытки разработки и получения in vitro моделей и тест-систем для костной и хрящевой ткани. Тем не менее, эти подходы были направлены на раздельное обеспечение либо костной, либо хрящевой ткани. Следовательно, эти модели все-таки только частично и недостаточно представляют естественное окружение, в котором происходит развитие и гомеостаз ткани кости, костного мозга и хряща.
Целью настоящего изобретения является преодоление одной или нескольких проблем известного уровня техники.
ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение направлено на трехмерную (3D) in vitro модель, в которой учитывается тесное взаимодействие и совместное функционирование хрящевой и костной ткани. Настоящее изобретение предусматривает 3D in vitro двухфазный костно-хрящевой «органоид», содержащий:
a) слой искусственной хрящевой ткани и
b) слой искусственной костной ткани, где искусственная костная ткань содержит придающий структуру каркас и структуру костного мозга;
где слой искусственной хрящевой ткани контактирует по меньшей мере с одной поверхностью слоя искусственной костной ткани.
Искусственную хрящевую ткань в 3D in vitro двухфазном костно-хрящевом «органоиде» можно получить с использованием мезенхимальных клеток-предшественников, предпочтительно с использованием мезенхимальных клеток-предшественников, включающих по меньшей мере 50% клеток или состоящих из клеток, которые представляют собой CD105+, CD106+, CD44+, CD73+, CD90+ и CD13+, более предпочтительно из выделенных первичных хондроцитов. В частности, искусственную хрящевую ткань можно получить с помощью способа согласно настоящему изобретению, определенного ниже.
Структуру костного мозга в искусственной костной ткани в 3D in vitro двухфазном костно-хрящевом «органоиде» согласно настоящему изобретению получают путем посева мезенхимальных стволовых клеток на придающий структуру каркас. Структуру костного мозга в искусственной костной ткани получают предпочтительно путем посева мезенхимальных стволовых клеток на придающий структуру каркас и путем добавления гемопоэтических стволовых клеток после культивирования мезенхимальных стволовых клеток на придающем структуру каркасе в течение 2-10 дней, предпочтительно в течение 5-8 дней, более предпочтительно в течение 7 дней.
Придающий структуру каркас из искусственной костной ткани в 3D in vitro двухфазном костно-хрящевом «органоиде» согласно настоящему изобретению предпочтительно содержит биологический или небиологический материал или состоит из него, более предпочтительно 3D керамический каркас.
В соответствии с другим аспектом настоящее изобретение направлено на способ получения 3D in vitro двухфазного костно-хрящевого «органоида» согласно настоящему изобретению. Указанный способ включает следующие этапы или состоит из таких этапов:
посев мезенхимальных стволовых клеток на придающий структуру каркас;
культивирование указанных мезенхимальных стволовых клеток в течение 2-10 дней на указанном придающем структуру каркасе, предпочтительно в течение 5-8 дней, более предпочтительно в течение 7 дней;
добавление гемопоэтических стволовых клеток к мезенхимальным стволовым клеткам, культивируемым на придающем структуру каркасе, и культивирование полученной смеси в течение по меньшей мере 5 дней, предпочтительно в течение от 5 дней до 8 недель, более предпочтительно в течение от 1 недели до 4 недель для того, чтобы получить слой искусственной костной ткани, содержащей придающий структуру каркас, засеянный структурой костного мозга;
обеспечение искусственной хрящевой ткани, полученной с помощью способа по любому из пп. 13-15, и
размещение слоя указанной искусственной хрящевой ткани по меньшей мере на одной поверхности указанного слоя искусственной костной ткани.
В соответствии с другим аспектом настоящее изобретение направлено на трансплантат, содержащий 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению.
Кроме того, настоящее изобретение предусматривает фармацевтическую композицию, содержащую 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению или трансплантат согласно настоящему изобретению и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Настоящее изобретение также направлено на способ in vitro скрининга веществ, которые модулируют свойства хрящевой или костной ткани, включающий следующие этапы:
обеспечение образца 3D in vitro двухфазного костно-хрящевого «органоида» согласно настоящему изобретению;
разделение соответствующего образца на порции;
инкубирование по меньшей мере одной порции с веществом, подлежащим скринингу; и
сравнение параметров, измеренных у обработанной порции и другой порции, которую не инкубировали с веществом, подлежащим скринингу.
В соответствии с дополнительным аспектом настоящего изобретения предусматривается автономное устройство по типу 3D in vitro двухфазного костно-хрящевого «органоида»-на-чипе, содержащее по меньшей мере один резервуар для подачи среды, по меньшей мере одну секцию для роста органа, содержащую по меньшей мере одну полость для органа, вмещающую 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению, где резервуар для подачи среды соединен по меньшей мере с одной секцией для роста органа микроструйным питающим каналом.
Настоящее изобретение также направлено на способ получения агрегатов хондрогенных клеток, включающий следующие этапы:
a) обеспечение мезенхимальных клеток-предшественников; и
b) культивирование мезенхимальных клеток-предшественников в не обеспечивающих адгезию условиях с образованием агрегатов хондрогенных клеток.
Мезенхимальные клетки-предшественники, применяемые в этом способе, предпочтительно включают по меньшей мере 50% клеток или состоят из клеток, которые представляют собой CD105+, CD106+, CD44+, CD73+, CD90+ и CD13+. Более предпочтительно, указанные мезенхимальные клетки-предшественники включают или состоят из выделенных первичных хондроцитов.
Настоящее изобретение основывается на данных, что на развитие и гомеостаз как костной ткани, так и хрящевой ткани оказывают влияние присутствие и взаимодействие обеих тканей. Давно известно, что на формирование и дифференцировку костной ткани оказывают влияние присутствие, длительность воздействия и направление физических усилий, прикладываемых к развивающейся кости. В естественном окружении эти усилия зачастую прикладываются к костной ткани через ее поверхность, контактирующую с хрящевой тканью. Одной функцией хрящевой ткани является надлежащая передача ударных усилий, которые создаются движением тела, нижележащей костной ткани. Это взаимодействие не только оказывает влияние на ориентацию и прочность костной ткани, но также воздействует на определение границ и организацию костного мозга и ниш стволовых клеток внутри кости. Не подлежит сомнению, что организация и дифференцировка костного мозга и ниши стволовых клеток оказывает значительное воздействие на иммунную систему индивида. Следовательно, обе ткани, костную ткань и хрящевую ткань, следует рассматривать как формирующие один общий орган. 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению отражает это положение и обеспечивает возможность имитации влияния, которое оказывает присутствие обеих тканей на развитие и дифференцировку костной ткани, соответственно, на организацию и дифференцировку костного мозга и ниш стволовых клеток, и хрящевой ткани. Таким образом, 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению впервые обеспечивает возможность изучения влияния тесного взаимного влияния обоих типов тканей друг на друга. В частности, когда 3D in vitro двухфазный костно-хрящевой «органоид» применяется в тест-системе, где слой искусственной хрящевой ткани может подвергаться воздействию определенных физических усилий посредством механической стимуляции, обеспечивается модельная система, которая точно имитирует естественные условия и, следовательно, обеспечивает возможность получения новых данных о биологии этих тканей, а также подходящая система для скрининга в отношении веществ, которые взаимодействуют с этими тканями или процессами.
Далее приведено более подробное описание различных аспектов настоящего изобретения. Каждый определенный таким образом аспект можно комбинировать с любым другим аспектом или аспектами, если только явным образом не указано иное. В частности, любой признак, указанный как предпочтительный или полезный, можно комбинировать с любым другим признаком или признаками, указанными как являющиеся частью настоящего изобретения или указанными как предпочтительные или преимущественные.
Настоящее изобретение направлено на 3D in vitro двухфазный костно-хрящевой «органоид». В контексте настоящего изобретения выражение «органоид» обозначает искусственный, созданный de novo, агрегат функциональных клеток из различных типов клеток in vitro, который проявляет по меньшей мере одну функцию, являющуюся типичной для соответствующего органа или ткани, предпочтительно, который проявляет большинство функций, являющиеся типичными для соответствующего органа или ткани.
3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению содержит слой искусственной хрящевой ткани. Искусственная хрящевая ткань представляет собой хрящевую ткань, которая была получена и собрана de novo и in vitro. Обычно искусственная хрящевая ткань содержит полностью или по меньшей мере частично дифференцированные хондроциты и компоненты внеклеточного матрикса, включающие коллаген II, IX и XI.
Существуют многочисленные методики получения искусственной хрящевой ткани in vitro, доступные специалисту в данной области техники. Поскольку хрящевая ткань представляет собой более чем простой 2D слой хондроцитов, предпочтительной является искусственная хрящевая ткань, созданная с помощью методик 3D культивирования. Подходящие методики кратко изложены в Tortelli and Cancedda («Three-dimensional cultures of osteogenic and chondrogenic cells: A tissue engineering approach to mimic bone and cartilage in vitro», European Cells and Materials (2009), 17, 1-14). Слой искусственной хрящевой ткани можно, например, получить с помощью методик, включающих культивирование и/или организацию клеток или клеточных агрегатов посредством инкапсулирования в гидрогеле, культивирования в микромассе, образования клеточных осадков высокой плотности и применения биосовместимых разлагаемых или неразлагаемых каркасов. Другой предпочтительный способ получения искусственной хрящевой ткани по настоящему изобретению, дополнительно описывается ниже как способ получения агрегатов хондрогенных клеток.
Чтобы обеспечить слой искусственной хрящевой ткани, искусственную хрящевую ткань получают с использованием мезенхимальных стволовых клеток (MCS), также называемых мезенхимальными клетками-предшественниками. Предпочтительно, применяют выделенные мезенхимальные клетки-предшественники. Выражение «выделенный» означает, что мезенхимальные клетки-предшественники представляют собой клетки, которые были выделены из естественного источника, или их соответствующее потомство, которое, например, было получено в результате пролиферации клеток. Применяемые мезенхимальные клетки-предшественники предпочтительно получают из хрящевой ткани донора, индивида или пациента. Предпочтительно, мезенхимальные клетки-предшественники представляют собой первичные клетки, которые не были трансформированы или иммортализированы. В частности, мезенхимальные клетки-предшественники могут включать или состоять из взрослых мезенхимальных клеток-предшественников. Такие взрослые мезенхимальные клетки-предшественники получают из не являющейся эмбриональной хрящевой ткани донора, индивида или пациента. Мезенхимальные клетки-предшественники можно получить из хрящевой ткани из любой донорской ткани, которая дифференцировалась так, что содержит хрящевую ткань. Предпочтительно, мезенхимальные клетки-предшественники получают из хрящевой ткани сустава, более предпочтительно из хряща колена или локтя донора. Мезенхимальные клетки-предшественники предпочтительно представляют собой человеческие клетки. Человеческие мезенхимальные клетки-предшественники получают из хрящевой ткани, взятой от человека. Мезенхимальные клетки-предшественники могут включать по меньшей мере 50% клеток, которые представляют собой CD105+, CD106+, CD44+, CD73+, CD90+ и CD13+, или могут состоять из клеток, которые представляют собой CD105+, CD106+, CD44+, CD73+, CD90+ и CD13+. Предпочтительно, мезенхимальные клетки-предшественники включают или состоят из выделенных первичных хондроцитов, таких как, например, человеческие первичные хондроциты.
3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению содержит слой искусственной костной ткани, где искусственная костная ткань содержит придающий структуру каркас и структуру костного мозга. Искусственная костная ткань представляет собой костную ткань, которая была получена и собрана de novo и in vitro. Обычно искусственная костная ткань содержит полностью или частично дифференцированные остеобласты, остеокласты и гемопоэтические стволовые клетки.
Существуют многочисленные методики получения искусственной костной ткани in vitro, доступные специалисту в данной области техники. Поскольку костная ткань обычно представляет собой более чем простой 2D слой клеток определенного типа, предпочтительной является искусственная костная ткань, созданная с помощью методик 3D культуры. Подходящие методики кратко изложены в Tortelli and Cancedda («Three-dimensional cultures of osteogenic and chondrogenic cells: A tissue engineering approach to mimic bone and cartilage in vitro», European Cells and Materials (2009), 17, 1-14). Слой искусственной костной ткани можно, например, получить с помощью методик, включающих культивирование и/или организацию клеток или клеточных агрегатов посредством культивирования в микромассе и применения биосовместимых разлагаемых или неразлагаемых каркасов. Подходящие методики культивирования и каркасы известны в уровне техники. Например, можно применять биоразлагаемые или неразлагаемые каркасы, содержащие или состоящие из биологического или небиологического материала. Было описано применение в качестве каркаса синтетических полимеров, а также применение каркасов на основе коллагена, каркасов на основе металлов, таких как, например, каркасы на основе титана, или каркасов на основе керамики.
Клетки, применяемые для получения искусственной костной ткани, могут включать мезенхимальные стволовые клетки (MSC) и гемопоэтические стволовые клетки (HSC). Предпочтительно, применяют выделенные MSC и/или выделенные HSC. Выражение «выделенный» означает, что MSC и/или HSC представляют собой клетки, которые были выделены из естественного источника или их соответствующее потомство, которое, например, было получено вследствие пролиферации клеток. Применяемые MSC и/или HSC предпочтительно получают из подходящей ткани донора, индивида или пациента. Предпочтительно, MSC и/или HSC представляют собой первичные клетки, которые не были трансформированы или иммортализированы. В частности, MSC и/или HSC могут включать или состоять из взрослых MSC и/или HSC. Такие взрослые MSC и/или HSC получают из ткани, не являющейся эмбриональной, предпочтительно из костной ткани или ткани костного мозга донора, индивида или пациента. MSC и/или HSC предпочтительно представляют собой человеческие клетки. Человеческие MSC и/или HSC предпочтительно получают из кости или ткани костного мозга человеческого происхождения.
Предпочтительный способ получения искусственной костной ткани по настоящему изобретению включает посев и культивирование MSC на керамическом 3D каркасе. Заселенный керамический 3D каркас культивируют в течение предварительно определенного периода времени, а затем могут добавлять HSC. В предпочтительном варианте осуществления HSC добавляют после культивирования MSC на керамическом каркасе в течение 2-10 дней. Затем заселенный керамический 3D каркас дополнительно культивируют либо в условиях статического культивирования, либо в перфузируемой системе для постоянной подачи питательных веществ. Методики создания искусственной костной ткань можно дополнительно изменить. Например, можно добавлять факторы роста или другие сигнальные молекулы для поддержки функций костного мозга. Можно применять условия гипоксии, которые подобны тем, с которыми сталкивается костный мозг в естественных условиях. Может потребоваться оптимизировать период культивирования, а также последовательность введения различных типов клеток в каркас. Помимо MSC и HSC для создания искусственной костной ткани можно применять дополнительные типы клеток. Эти дополнительные клетки могут включать типы клеток, которые в норме встречаются в структурах кости или костного мозга, например, иммунные клетки, эндотелиальные клетки и т.п.
3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению можно применять в качестве инструмента для исследований in vitro и/или in vivo. Его можно применять для изучения биологии одного или нескольких его компонентов. В качестве альтернативы, его можно применять в способе in vitro и/или in vivo скрининга в отношении веществ, которые модулируют свойства хрящевой или костной ткани.
Настоящее изобретение также направлено на трансплантат, содержащий 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению, и на фармацевтическую композицию, содержащую 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению или трансплантат согласно настоящему изобретению и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
В дополнительном аспекте настоящее изобретение направлено на способ in vitro скрининга веществ, которые модулируют свойства хрящевой или костной ткани, включающий следующие этапы:
обеспечение образца 3D in vitro двухфазного костно-хрящевого «органоида» согласно настоящему изобретению;
разделение соответствующего образца на порции;
инкубирование по меньшей мере одной порции с веществом, подлежащим скринингу; и
сравнение параметров, измеренных у обработанной порции и другой порции, которую не инкубировали с веществом, подлежащим скринингу.
В предпочтительном варианте осуществления, порцию помещают в автономное устройство по типу орган-на-чипе перед инкубированием порции с веществом, подлежащим скринингу.
Вкратце, способ согласно настоящему изобретению делает возможным идентификацию и анализ веществ, которые оказывают влияние на хрящевую или костную ткань, при помощи 3D in vitro двухфазного костно-хрящевого «органоида» согласно настоящему изобретению. Образец, который, как следует понимать, содержит определенное количество продуктов-объектов настоящего изобретения, разделяют на несколько порций. Получают по меньшей мере две подгруппы; одну используют для скрининга, тогда как другая служит в качестве отрицательного контроля. Предпочтительно, количество частей для скрининга превышает количество частей для контроля. Обычно многочисленные части подвергают скринингу с высокой пропускной способностью. Вещества, подлежащие скринингу в способе согласно настоящему изобретению, не ограничены каким-либо образом. В варианте осуществления настоящего изобретения вещества выбраны из группы нуклеиновых кислот, в том числе интерферирующие РНК, рибозимов, аптамеров, антител, пептидов, углеводов, полимеров, малых молекул с молекулярным весом от 50 до 1000 Да и белков, предпочтительно антител, цитокинов и липокалинов. Эти вещества зачастую доступны в библиотеках. Предпочтительным является инкубирование отдельного соединения в отдельной порции образца. Тем не менее, также возможно изучать суммарный эффект веществ при помощи инкубирования по меньшей мере двух веществ в одной порции. Дополнительную подгруппу объектов одновременно инкубируют в отсутствие веществ. Процесс инкубирования зависит от различных параметров, например, типов клеток и чувствительности выявления, при оптимизации которых следуют обычным процедурам, известным специалистам в данной области техники. Идентификацию эффективных веществ в контексте настоящего изобретения предпочтительно осуществляют косвенно, например, путем определения паттернов экспрессии и/или жизнеспособности клеток, которые изменяются. Определение можно осуществлять в определенный момент и сопоставлять с силой сигнала вначале эксперимента и у отрицательного контроля. Подходящие тесты известны специалистам в данной области техники или могут быть легко разработаны в обычном порядке.
В настоящем изобретении также раскрывается автономное устройство по типу 3D in vitro двухфазный костно-хрящевой «органоид»-на-чипе, включающее автономное устройство по типу орган-на-чипе, которое описано в WO 2009/146911, и 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению.
Автономное устройство по типу 3D in vitro двухфазного костно-хрящевого «органоида»-на-чипе согласно настоящему изобретению создано для обеспечения возможности получения или поддержания 3D in vitro двухфазного костно-хрящевого «органоида» согласно настоящему изобретению в формате миниатюризированного чипа, подходящем для наблюдения в реальном времени при помощи визуализации живых клеток и, например, двухфотонной микроскопии, и его применения, например, для тестирования активности, фармакодинамики и фармакокинетики соединений или для изучения самосборки, гомеостаза, повреждения, регенерации или взаимодействия органов или «органоидов» и ниш стволовых клеток, а также явлений созревания, старения, смерти и хронобиологии. Для этой цели автономное устройство по типу 3D in vitro двухфазного костно-хрящевого «органоида»-на-чипе согласно настоящему изобретению содержит по меньшей мере один резервуар для подачи среды, по меньшей мере одну секцию для роста органа, содержащую по меньшей мере одну полость для органа, вмещающую 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению, где резервуар для подачи среды соединен по меньшей мере с одной секцией для роста органа микроструйным питающим каналом.
Объект настоящего изобретения обеспечивает возможность получения миниатюризированной in vitro культуры «органоида», содержащего хрящевую и костную ткань. Полученный 3D in vitro двухфазный костно-хрящевой «органоид» согласно настоящему изобретению подходит для долговременного культивирования вплоть до 3 месяцев, при культивировании, например, в условиях, обеспечивающих возможность постоянной подачи кислорода и питательных веществ, как, например, в условиях постоянной перфузии.
Объект настоящего изобретения обеспечивает возможность интеграции механических стимулов для имитации, например, физических усилий, создаваемых движением тела, и индукции сосудистых структур в «органоиде» и, следовательно, обеспечения окружения, которое приближается к естественным условиям. Исходя из этих свойств, объект настоящего изобретения обеспечивает возможность получения различных научных данных в области тканевой инженерии, молекулярной биологии клетки и дифференцировки тканей, а также в регенеративной медицине. Объект настоящего изобретения также может привести к замене дорогостоящих и трудоемких экспериментов на животных на тесты in vitro.
На данный момент не было попыток получить 3D in vitro «органоид», который объединяет функционально взаимосвязанные ткани кости, костного мозга и хряща в одной единой интегрированной системе, которая совместима с методиками длительного культивирования, такими как перфузионная культура, и которая позволяет осуществлять индукцию васкуляризации. Воздействуя на систему механическими силами или другими стимулами, естественное окружение будут имитировать в такой степени, которая не достигалась никогда ранее.
В другом аспекте настоящее изобретение направлено на in vitro способ получения агрегата хондрогенных клеток. Способ включает следующие этапы:
a) обеспечение выделенных мезенхимальных клеток-предшественников; и
b) культивирование мезенхимальных клеток-предшественников в не обеспечивающих адгезию условиях с образованием агрегата хондрогенных клеток.
Было обнаружено, что выделенные мезенхимальные клетки-предшественники способны формировать трехмерный клеточный агрегат, который проявляет хондрогенную дифференцировку без влияния эмбриональных клеток. Этот эффект достигается при помощи культивирования мезенхимальных клеток-предшественников в не обеспечивающих адгезию условиях. Можно продемонстрировать, что при таких не обеспечивающих адгезию условиях культивирования мезенхимальные клетки-предшественники располагаются свободно по отношению друг к другу и конденсируются в клеточный агрегат, который проявляет экспрессию маркеров, специфических для хондрогенной дифференцировки, и который, следовательно, обозначают как агрегат хондрогенных клеток.
Ниже предусматривается более подробное описание различных аспектов настоящего изобретения. Каждый определенный таким образом аспект можно комбинировать с любым другим аспектом или аспектами, если явно не утверждается иное. В частности, любой признак, указанный как предпочтительный или полезный, можно комбинировать с любым другим признаком или признаками, указанными как являющиеся частью настоящего изобретения или указанными как предпочтительные или преимущественные.
Способ согласно настоящему изобретению направлен на in vitro препарат из агрегата хондрогенных клеток. В контексте настоящего изобретения выражение «агрегат хондрогенных клеток» относится к агрегату функциональных клеток, проявляющему по меньшей мере одну функцию, которая является специфической для хондроцитов или хрящевой ткани. Предпочтительно, агрегат хондрогенный клеток согласно настоящему изобретению проявляет большую часть или, по сути, все функции органа или ткани для дифференцированных хондроцитов или хрящевой ткани. В частности, агрегат хондрогенных клеток согласно настоящему изобретению может вести себя подобно функциональной хрящевой ткани и/или способен индуцировать in vitro и/или in vivo развитие или дифференцировку хряща. Агрегат хондрогенных клеток согласно настоящему изобретению может характеризоваться повышенной экспрессией маркерных генов или белков, которые связаны с развитием или дифференцировкой хондроцитов или хрящевой ткани. Предпочтительно, агрегат хондрогенных клеток согласно настоящему изобретению может характеризоваться повышенной экспрессией коллагена II, IX и XI, а также пониженной экспрессией коллагена I и XII по сравнению с экспрессией в мезенхимальных клетках-предшественниках непосредственно перед культивированием в не обеспечивающих адгезию условий.
Агрегат хондрогенных клеток согласно настоящему изобретению формируют с помощью способа согласно настоящему изобретению. Агрегат хондрогенных клеток может представлять собой клеточный агрегат практически округлой или сферической формы. Он может иметь средний диаметр от 0,5 мм до 3 мм, предпочтительно средний диаметр от 0,5 мм до 2 мм. Агрегат хондрогенных клеток согласно настоящему изобретению не содержит какого-либо искусственного биологического или небиологического каркаса или носителя, который не происходит из клеток, применяемых в получении хондрогенного клеточного агрегата. Агрегат хондрогенных клеток согласно настоящему изобретению предпочтительно состоит из клеточного агрегата, сформированного при помощи способа согласно настоящему изобретению, где способ осуществляли без применения или добавления какого-либо биологического или небиологического каркаса или носителя, который не происходит непосредственно из клеток, применяемых в указанном способе.
В способе согласно настоящему изобретению применяются выделенные мезенхимальные клетки-предшественники. Выражение «выделенный» означает, что мезенхимальные клетки-предшественники представляют собой клетки, которые были выделены из естественного источника или их потомство, которое, например, было получено в результате пролиферации клеток. Применяемые мезенхимальные клетки-предшественники предпочтительно получают из хрящевой ткани донора, субъекта или пациента. Предпочтительно, мезенхимальные клетки-предшественники представляют собой первичные клетки, которые не были трансформированы или иммортализированы. В частности, мезенхимальные клетки-предшественники могут включать или состоять из взрослых мезенхимальных клеток-предшественников. Такие взрослые мезенхимальные клетки-предшественники получают из не являющейся к эмбриональной хрящевой ткани донора, субъекта или пациента. Мезенхимальные клетки-предшественники можно получить из хрящевой ткани из любой донорской ткани, которая дифференцировалась так, что содержит хрящевую ткань. Предпочтительно, мезенхимальные клетки-предшественники получают из хрящевой ткани сустава, более предпочтительно из хряща колена или локтя донора. Мезенхимальные клетки-предшественники, применяемые в способе согласно настоящему изобретению, предпочтительно представляют собой человеческие клетки. Человеческие мезенхимальные клетки-предшественники получают из хрящевой ткани, взятой от человека. Мезенхимальные клетки-предшественники могут включать по меньшей мере 50% клеток, которые представляют собой CD105+, CD106+, CD44+, CD73+, CD90+ и CD13+, или могут состоять из клеток, которые представляют собой CD105+, CD106+, CD44+, CD73+, CD90+ и CD13+. Предпочтительно, мезенхимальные клетки-предшественники включают или состоят из выделенных первичных хондроцитов, таких как, например, человеческие первичные хондроциты.
В способе согласно настоящему изобретению мезенхимальные клетки-предшественники можно культивировать в не обеспечивающих адгезию условиях на любой стадии после выделения. Однако формирование клеточных агрегатов дополнительно улучшается, если мезенхимальные клетки-предшественники перенесли культивирование, по меньшей мере в течение некоторого времени, в условиях прикрепленного 2D монослоя. Предпочтительно, мезенхимальные клетки-предшественники культивировались в 2D монослойной культуре в течение по меньшей мере 5 пассажей до культивирования в не обеспечивающих адгезию условиях. Для того чтобы гарантировать дедифференцированный фенотип, желательно культивировать мезенхимальные клетки-предшественники в условиях прикрепленного 2D монослоя в течение по меньшей мере 10 пассажей. Высокая эффективность формирования клеточных агрегатов сохраняется на протяжении широкого диапазона пассажей. Однако было обнаружено, что наилучшие результаты достигаются, если мезенхимальные клетки-предшественники культивировались в 2D монослойной культуре в течение по меньшей мере 5 пассажей и не более 20 пассажей. Предпочтительно, мезенхимальные клетки-предшественники культивируют в не обеспечивающих адгезию условиях после культивирования в 2D монослое в течение по меньшей мере 5 пассажей и не более 15 пассажей после выделения.
В способе согласно настоящему изобретению после обеспечения выделенных мезенхимальных клеток-предшественников мезенхимальные клетки-предшественники культивируют при не обеспечивающих адгезию условиях для формирования агрегатов хондроге