Гибридный белок, днк, генетическая конструкция, рекомбинантная клетка, вакцина на основе гибридного белка для профилактики и лечения туберкулеза (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к молекулярной биологии, биотехнологии, медицине и может быть использована для осуществления профилактики и лечения туберкулеза. Предложены гибридные белки для индукции специфичного иммунного ответа против Mycobacterium tuberculosis, включающие белки Ag85B, Tb10.4 M.tuberculosis, фрагменты флагеллина FliC S.Typhimurium, соединенные гибкими мостиками, кодирующие полинуклеотиды, генетические конструкции для экспрессии полинуклеотидов, рекомбинантные клетки и варианты вакцины для профилактики или лечения туберкулеза на основе описанного гибридного белка, потребитель разработанной вакцины - человек либо животное. Предложенная вакцина имеет эффективность, превышающую таковую БЦЖ. Изобретения, заявленные для получения данной вакцины, обеспечивают ее безопасность и простоту при производстве и применении. 5 н. и 3 з.п. ф-лы, 4 ил., 4 пр.
Реферат
Гибридный белок, ДНК, генетическая конструкция, рекомбинантная клетка, вакцина на основе гибридного белка для профилактики или лечения туберкулеза (варианты)
Группа изобретений относится к молекулярной биологии, биотехнологии, медицине и может быть использована для осуществления профилактики и лечения туберкулеза.
Туберкулез является инфекционным заболеванием, вызывающим наибольшее количество случаев с летальным исходом. По данным Всемирной организации здравоохранения (ВОЗ), туберкулезом ежегодно заболевает около 8 млн человек, и около 3 млн. заболевших погибает. Лечение туберкулеза осложняется тем, что широко распространены высокорезистентные штаммы микобактерий, вызывающие туберкулез с множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ). В связи с этим перспективным подходом в борьбе с данным заболеванием является профилактика. По инициативе ВОЗ с 2006 г. объявлена глобальная программа борьбы с туберкулезом «The Global Plan to Stop ТВ», согласно которой одно из ведущих мест занимает разработка вакцин нового поколения против туберкулеза. Согласно последнему докладу ВОЗ по туберкулезу, 2014 г., новая вакцина, которая поможет предотвратить передачу ТБ среди подростков и взрослых в развивающихся странах, будет самым экономически эффективным инструментом в смягчении эпидемии [http://www.who.int/immunization/research/forums_and_initiatives/07_Evans_GVIRF_TB_Vaccine_Progress.pdf].
На сегодняшний день единственной зарегистрированной и применяемой вакциной является BCG (БЦЖ), полученная из аттенуированного штамма Mycobacterium bovis и впервые введенная человеку в 1921 г. С 2006 года несколько стран прекратили использование БЦЖ для массовой вакцинации после вспышки БЦЖ-инфекции в Финляндии. США и Нидерланды никогда не использовали БЦЖ массово. Сомнительная эффективность вакцинации BCG и побочные эффекты обуславливают острую потребность в разработке эффективных и безопасных средств вакцинации против Mycobacterium tuberculosis.
В настоящее время данную проблему пытаются решить разными способами: разрабатываются и исследуются альтернативные БЦЖ вакцины, такие как живые вакцины с улучшенными свойствами, инактивированные вакцины, субъединичные вакцины, вакцины, полученные с использованием технологии рекомбинантной ДНК, комбинированные варианты. Однако вакцины, безопасной и простой при производстве и применении, которая имела бы эффективность, как минимум сравнимую с таковой БЦЖ, не существует на данный момент. В связи с этим задачей настоящего изобретения является создание обладающей вышеперечисленными свойствами вакцины против туберкулеза, которая также будет иметь низкую стоимость.
Из всех направлений разработки новых противотуберкулезных вакцин авторы настоящей группы изобретений считают наиболее перспективным использование вакцин, получаемых с использованием технологии рекомбинантной ДНК. Однако их эффективность варьирует и обуславливается массой факторов, одними из самых важных из которых являются подбор компонентов и их форма (структура).
Для создания настоящего изобретения были выбраны иммунодоминантные секретируемые антигены M.tuberculosis - белок Ag85B комплекса белков 85 и белок ТВ10.4 (culture-filtrate protein-7). Данные белки высококонсервативны среди различных штаммов микобактерий, а также способны вызывать иммунный ответ, что позволяет полагать, что возможно получение кросс-реактивного иммунного ответа [WO 96/15241, дата приоритета 14.11.94 US]. Важно, что указанные белки не имеют гомологии с известными белками других организмов, что обеспечивает специфичность их действия. Также показано, что белок ТВ10.4 обладает адъювантным действием при введении в комплексе с белками микобактерий [ЕА 012037 В1, дата приоритета 20041116].
Известны следующие решения на основе вышеперечисленных белков M.tuberculosis.
Известна бактерия, в одном из вариантов реализации изобретения - микобактерия, содержащая плазмидные ДНК, кодирующие в одном из вариантов изобретения Ag85b и ТВ10.4 [WO 2008150969 A9, дата приоритета 31.05.2007]. Однако введение живой микобактерий, пусть и аттенуированной, несет в себе риски. Использование вакцины на основе белка является более безопасной альтернативой.
Известна вакцина HyVAC IV/Aeras, которая содержит белки Ag85B и ТВ10.4, а также сложный адъювант IC31, содержащий синтетический антимикробный пептид KLKL5KLK, действие которого направлено на усиление взаимодействия антиген-презентирующих клеток с антигеном, и лиганд TLR9 ODN1a, обладающий иммуностимулирующим действием. Данная вакцина проходит На фазу клинических испытаний http://www.who.int/immunization/research/forums_and_initiatives/07_Evans_GVIRF_TB_Vaccine_Progress.pdf]. Однако производство действующего агента вакцины, представленного четырьмя компонентами, полноразмерными белками и пептидами, получаемыми с использованием совершенно разных механизмов, является технически сложным. Более того, при использовании химически синтезированных молекул, в том числе и белковых, следует понимать, что их часть может быть представлена энантиомерами, что может приводить к непредсказуемым результатам в организме при применении. Понятие энантиомерии играет важную роль в фармацевтике, поскольку разные энантиомеры лекарственных веществ, как правило, имеют различную биологическую активность. Использование живых систем для получения пептидных молекул позволяет получить молекулы природной структуры, гомогенную смесь.
Известна нуклеиновая кислота, кодирующая белки Ag85A, Ag85B и ТВ10.4 Mycobacterium tuberculosis под контролем промотора, а также аденовирусный вектор, несущий такую нуклеиновую кислоту, в результате в организме введения синтезируется слитый белок, а также известна противотуберкулезная вакцина на основе такого аденовирусного вектора, которая может дополнительно содержать адъювант [US 8609402 В2, дата приоритета 20041116].
Известен аденовирусный вектор для лечения активной формы туберкулеза, несущий нуклеиновую кислоту, кодирующую белки Ag85A, Ag85B и ТВ10.4, в одном из вариантов изобретения в организме введения с него синтезируется гибридный белок, также может дополнительно вводиться адъювант [WO 2012/038367 А1, дата приоритета 20100920].
Однако использование аденовируса для доставки иммуногена также несет в себе риски. Вирусные векторы имеют ряд недостатков, в их числе то, что они дорогостоящи и могут вызывать воспалительную реакцию, что исключает повторное введение вектора. Также вирусные вектора обладают способностью реплицироваться, что снижает степень контроля над экспрессией таргетного белка, что, в свою очередь, не всегда желательно и применимо.
Вирусные векторы и модифицированные патогены имеют и риски наследования, что может препятствовать их использованию у человека [R.R. Redfield et al., New Engl. J. Med. 316, 673 (1987); L. Mascola et al., Arch. Intern. Med. 149, 1569 (1989)].
Использование рекомбинантного гибридного белка позволит уменьшить количество компонентов вакцины, соответственно, упростить и удешевить ее производство, соответственно, и ее стоимость, при сообщении вакцине безопасности.
Известен способ получения гибридной конструкции TB10.4-Hsp16.3, по которому гены, кодирующие данные белки, клонируют по разным сайтам рестрикции в плазмиде; полученной плазмидой трансформируют клетки E.coli [WO 201288739 A1, дата приоритета 29.12.2010].
Известна гибридная конструкция, содержащая хоты бы один домен белка Mycobacterium, способный вызывать иммунный ответ у млекопитающего, например, Ag85B, и домен выхода из фаголизосомы, например, из Listeria [WO9910496_A1, дата приоритета 22.08.1997].
Известна гибридная конструкция TB10.4-Ag85B-антиген, вызванный голоданием микобактерий (вырабатывается, как минимум, в 6,5 раз больше после того, как подвергнуть микобактерию голоданию) [WO2006136162_A2, дата приоритета 23.06.2005].
Однако возможно добиться дополнительного увеличения иммуногенности вакцины с использованием адъюванта.
Известен гибридный полипептид, одним из вариантов изобретения является белок на основе белка семейства ESAT-6 и белка MPT59 (Ag85B), либо одного Т-клеточного эпитопа MPT59, а также композиция, дополнительно содержащая адъювант из DDA, Quil A, poly I:C, неполного адъюванта Фрейнда, IFN-γ, IL-2, IL-12, MPL и MDP [US7867502_B1, дата приоритета 13.07.1999].
Известна вакцина, содержащая гибридный белок, содержащий аминокислотные последовательности, кодирующие гибридные белки Ag85B-TB10.4, дополнительно может применяться адъювант [WO 2005/061534 A2, дата приоритета 23.12.2003].
Известна фармацевтическая композиция, содержащая гибридный белок, содержащий аминокислотные последовательности Rv0288 (TB10.4) и хотя бы один агент из фрагмента в том числе Ag85B, дополнительно может применяться адъювант [US 6991797 B2, дата приоритета 02.07.1993].
Известна иммуногенная композиция, содержащая микобактериальные антигены в форме отдельных полипептидов, либо в форме одного или более слитых белков, либо совместно отдельных полипептидов и слитых белков, слитый белок содержит антигены M. tuberculosis Ag85B, TB10.4 и ESAT6, также дополнительно может применяться адъювант [WO 2014/009438 A2, дата приоритета 10.07.2012].
Известна иммуногенная композиция, содержащая гибридный белок, который дополнительно содержит Ag85B, TB10.4, а также содержащая адъювант [US 8101193 B2, US 7968105 B2, US 8293250 B2, US 8703151 B2, дата приоритета 23.06.2005].
Известен гибридный белок, в одном из вариантов гипотетически содержащий белок Rpf (Mycobacterium Resuscitation Promoting Factor) в качестве адъюванта и белки Ag85B, TB10.4 [WO 2014/009433 A1, дата приоритета 10.07.2012]. Однако, данная конструкция не охарактеризована структурно, последовательность приведена лишь для гибридного белка, содержащего белки RpfB - Dhyb, Ag85B, TB10.4 и ESAT6, RpfB-Dhyb-Ag85B-TB10.4-ESAT6 из 849 а.о. Последний белок достаточно велик, что затрудняет принятие им конформации, при которой возможно одновременное функционирование всех требуемых компонентов белка, что может привести к трудностям при реализации заявленных функций.
Использование адъюванта позволяет усилить иммуногенность вакцин, однако важно подобрать адъювант, который позволит индуцировать наиболее специфичный по отношению к патогену иммунный ответ, в данном случае способный стимулировать Т-клеточный иммунный ответ, наряду в B-клеточным, а также который будет способствовать формированию местного иммунитета. Авторы настоящего изобретения сочли флагеллин наиболее оптимальным вариантом для данных целей.
Флагеллин – белок бактериальных жгутиков, присутствующих у многих бактерий, в том числе патогенных. Флагеллин - лиганд TLR5 (Toll-like receptor 5). Взаимодействие флагеллина с TLR-5 стимулирует созревание макрофагов и дендритных клеток – антиген-презентирующих клеток, что приводит к выработке иммунного ответа [Mc Dermott P.F..High-affinity interaction between Gram-negative flagellin and a cell surface polypeptide results in human monocyte activation. Infect. Immun. - 2000. – V. 68. – p.:5525–5529; Means T.K. et al. The Toll-like receptor 5 stimulus bacterial flagellin induces maturation and chemokine production in human dendritic cells. J.Immunol. - 2003. – V.170. – p.:5165–5175]. Флагеллины индуцируют формирование сывороточных и секреторных антител, Th1- и Th2- ответ как на сами флагеллины, так и на совместно введенные антигены.
Известна вакцинная композиция, содержащая один или более из источников белков DosR и, в одном из вариантов, адъювант, в одном из вариантов - из бактериальных флагеллинов [WO 2006/104389 A1, дата приоритета 31.03.2005].
Известна композиция для вакцинации, содержащая полипептид, включающий антигенные части в одном из вариантов осуществления белков Ag85B и TB10.4, также содержащая нуклеиновую кислоту, кодирующую лиганд CD40, либо пептид, который обладает способностью связываться с лигандом CD40 и активировать рецептор CD40, экспрессированный на антитело-продуцирующих В-лимфоцитах, которая в одном из вариантов изобретения также содержит флагеллин [WO 2010/034974 A2, дата приоритета 24.09.2008]. Данное изобретение авторы настоящего изобретения считают прототипом. Недостатком прототипа изобретения является многокомпонентность, три разных компонента в составе одной вакцины. Более того, гибридный белок не охарактеризован структурно, лишь обозначены его компоненты. Также предлагается использовать полноразмерный флагеллин, причем не указана его принадлежность к тому или иному организму, а также не указан тип флагеллина, например, для флагеллина Salmonella - FliC или FljB.
Флагеллин, в зависимости от происхождения из того или иного микроорганизма, различается и состоит из 259–1250 аминокислотных остатков, что, безусловно, влияет на его свойства.
Различия в структуре флагеллина наблюдаются и среди одного бактериального вида. Так, большая часть сероваров Salmonella enterica двухфазные, т.е. у них чередуется экспрессия разных жгутиковых антигенов (фаз). Это обусловлено возможностью нахождения в активном состоянии только 1 из 2 генов флагеллина (fliC и fljB), локализующихся в разных локусах хромосомы [Baker S., Hardy J., Sanderson K.E. et al. A novel linear plasmid mediates flagellar variation in Salmonella Typhi. PLoS Pathog, 2007, 3(5): e59. doi:10.1371/journal.ppat.0030059], FliC – phase 1 flagellin (STF), fljB – phase 2 flagellin (STF2). Данные флагеллины имеют одинаковый N-конец, гомологичный, различающийся на несколько а.о., С-конец, а также различный домен D3, соответственно, имеют различную структуру и могут иметь различные эффекты.
Таким образом, указание микроорганизма, флагеллин которого используется, а также типа используемого флагеллина (например, для Salmonella) является существенным.
Более того, известные флагеллиновые адъюванты проявляют значительные побочные эффекты, и, в частности, собственную антигенную активность и системные провоспалительные свойства при введении in vivo.
Связывание флагеллина с TLR-5 происходит только в мономерной форме [Абатуров А. Е. Роль TOLL-подобных рецепторов в рекогниции патоген-ассоциированных молекулярных структур инфекционных патогенных агентов и развитии воспаления. Ч.3. Рекогниция лигандов TLR/А. Е. Абатуров, А. П. Волосовец, Е. И. Юлиш // Здоровье ребенка. - Донецк, 2012,N N 7.-С.157-164], однако при получении полноразмерных флагеллинов они могут полимеризоваться, и сохранение их в растворе в мономерной форме, при этом сохраняющей правильную конформацию, требует специальных условий. При этом совместное использование такого раствора и иных агентов, например, антигена(ов), может негативно сказаться на конформации последних и, соответственно, свойствах. Получается, совместное использование полноразмерного флагеллина и антигена(ов) может не привести к желаемому результату, за счет инактивации одного из агентов при несовпадении условий сохранения активности.
В связи с вышесказанным реализация изобретения, описанного в публикации WO 2010/034974 A2, ставится под вопрос.
Авторами настоящего изобретения предложено неожиданное оригинальное решение, которое лишено данных недостатков.
Технический результат от использования изобретения заключается в упрощении, удешевлении и сокращении сроков производства противотуберкулезного иммуногена - активного агента для вакцины, и, соответственно, вакцины против туберкулеза, - за счет производства лишь одного компонента, гибридного белка, взамен производства множества отдельных компонентов вакцинной смеси (аналоги), при сохранении требуемой активности выбранных для включения в состав гибридного белка белков за счет длины и созданной структуры белка, в которой иммуногенные эпитопы соединены гибкими мостиками.
Технический результат от использования изобретения заключается в увеличении эффективности и предсказуемости результата использования противотуберкулезного иммуногена - активного агента для вакцины, и, соответственно, вакцины против туберкулеза, за счет использования одного компонента, сочетающего в себе и функции специфического микобактериального антигена, и адъюванта, опосредующего оптимальный для подавления развития туберкулезной инфекции иммунитет, правильную конформацию которого, опосредующую полноценное функционирование всех его компонентов, легко обеспечить также благодаря отсутствию иных молекул, требующих иных условий для сохранения активности.
Наконец, технический результат от использования изобретения выражается в расширении спектра противотуберкулезных иммуногенов - активных агентов вакцин и, соответственно, вакцин против туберкулеза. При противопоказаниях к применению аналогов, либо нежелании использовать аналоги ввиду их вышеописанных недостатков, данная вакцина позволит осуществить защиту против туберкулеза. В связи с тем, что проблема туберкулеза стоит очень остро, а выведение на рынок препарата удается не многим, данное изобретение позволит увеличить шансы в борьбе с данной инфекцией.
Введение иммуногена, соответственно, вакцины, предпочтительно – внутримышечное. Также возможно использование для иммунизации поверхности слизистой, поскольку иммунитет, индуцированный в одной области слизистой, может индуцировать развитие иммунитета на дистальной области слизистой [McGhee, J. R. et al. The mucosal immune system: from fundamental concepts to vaccine development. Vaccine 1992, 10:75-88]. Формирование местного иммунитета важно для предотвращения инфицирования микобактериями. Содержание в составе гибридного белка фрагментов флагеллина также способствует данному процессу, так, известно, что в респираторном тракте флагеллин индуцирует синтез IgA и вызывает Th2-ассоциированный ответ [Soloff AC, Barratt-Boyes SM. Enemy at the gates: dendritic cells and immunity to mucosal pathogens. Cell Res. 2010 Aug;20(8):872-85. doi: 10.1038/cr.2010.94. Epub 2010 Jul 6]. Иммунизация поверхности слизистой также значительно облегчает доставку иммуногена.
Сущность изобретения
Предложена группа изобретений: гибридный белок для индукции специфичного иммунного ответа против Mycobacterium tuberculosis, включающий белки Ag85B, Tb10.4 Mycobacterium tuberculosis, иммуногенные фрагменты флагеллина FliC Salmonella enterica serovar Typhimurium, компоненты конструкции соединены гибкими мостиками, охарактеризованный последовательностью аминокислот SEQ ID NO.: 1, либо SEQ ID NO.: 2, либо SEQ ID NO.: 3, либо SEQ ID NO.: 4; полинуклеотид, кодирующий такой гибридный белок, кодонно оптимизированный для экспрессии в клетках продуцента гибридного белка; генетическая конструкция для экспрессии в клетках продуцента такого полинуклеотида, включающая, помимо полинуклеотида, элементы, позволяющие реализовать указанное назначение; рекомбинантная клетка, продуцирующая описанный гибридный белок, представленная прокариотическим организмом, либо клеткой эукариотического организма; вакцина для профилактики или лечения туберкулеза, содержащая описанный гибридный белок в качестве активного агента, в эффективном количестве, а также физиологически приемлемый носитель или буферный раствор, потребитель вакцины - человек либо животное. Предложенная вакцина имеет эффективность, превышающую таковую БЦЖ. Изобретения, заявленные для получения данной вакцины, обеспечивают ее безопасность и простоту при производстве и применении.
Подробное описание изобретения
Предложена группа изобретений: гибридный белок, ДНК, генетическая конструкция, рекомбинантная клетка, вакцина на основе гибридного белка для профилактики или лечения туберкулеза (варианты).
Предложены гибридные белки, каждый включает иммуногенные фрагменты белков Ag85B, Tb10.4 Mycobacterium tuberculosis и FliC Salmonella enterica serovar Typhimurium, соединенные гибкими мостиками; белки охарактеризованы последовательностью аминокислот SEQ ID NO.: 1, SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4.
Предложены полинуклеотиды, кодирующие описанные гибридные белки, кодонно оптимизированные для экспрессии в клетках продуцента гибридного белка. При известности аминокислотной последовательности белка специалист в данной области сможет получить нуклеотидную последовательность. Кодонную оптимизацию проводят самостоятельно, используя информацию о частоте встречаемости кодонов у продуцента, например, в базе данных [например, Nakamura Y, Gojobori Т, Ikemura Т. Codon usage tabulated from international DNA sequence databases: status for the year 2000. Nucleic Acids Res. 2000 Jan 1; 28(1):292], либо с использованием специализированных программ, например представленной на сайте http://www.encorbio.com/protocols/Codon.htm.
Предложены генетические конструкции для экспрессии в клетках продуцента описанных полинуклеотидов; каждая конструкция включает, помимо полинуклеотида, элементы, позволяющие реализовать указанное назначение. Под генетической конструкцией подразумевается рекомбинантный вектор, который может быть представлен, в зависимости от совместимости с продуцентом, вирусным, плазмидным, фосмидным, космидным или иным возможным вектором. К примеру, при выборе в качестве продуцента клеток Е.coli, ген может быть в составе бактериофага, например, на основе фага λ, либо плазмиды, например, на основе pBR, либо pUC, и подобное. При использовании в качестве продуцента организма Bacillus subtilis ген может быть, например, в составе плазмиды на основе pUB. При использовании в качестве продуцента дрожжей генетическая конструкция может быть представлена, например, плазмидой на основе YEp, либо YRp, либо YCp, либо YIp.
Генетическая конструкция, обеспечивающая синтез белка в клетках продуцента, должна содержать элементы для поддержания и амплификации, преимущественно в больших количествах, и эффективного функционирования согласно назначению, а также для селекции трансформанта.
Под элементами для поддержания и амплификации подразумевается ориджин репликации. Подходящий ориджин репликации для, например, плазмидного вектора представлен, например, pM1 (der.), Co1E1 (der.) и F1, pUC и F1, SV40, но не ограничивается ими. Также может содержаться элемент для интеграции конструкции в геном продуцента. Например, 3' АОХ1 или 18S рРНК для дрожжей.
Под элементами для эффективного функционирования, для экспрессии закодированного белка, подразумеваются сигналы инициации транскрипции, промотор, сигналы инициации трансляции, старт-кодон и стоп-кодон(ы), терминирующие транскрипцию последовательности, регуляторные последовательности.
При использовании в качестве рекомбинантной клетки, продуцирующей гибридный белок, организма Escherichia coli промотор может быть представлен, например, промотором оперона лактозы, оперона триптофана; дрожжей - например, промотором гена кислой фосфатазы, гена алкогольдегидрогеназы, гена глицеральдегид-3-фосфатдегидрогеназы, гена метаболизма галактозы; грибов - например, промотором гена целлобиогидролазы, либо α-амилазы, либо глюкоамилазы, либо глицеральдегид-3-фосфатдегидрогеназы, либо гена abp1; растений - например, промотором CaMV 19S RNA или CaMV 35S RNA, либо промотором гена нопалинсинтетазы. При использовании в качестве рекомбинантной клетки, продуцирующей гибридный белок, клеток млекопитающего, например, промотор может быть представлен природным промотором (например, СаМ kinase II, CMV, nestin, L7, BDNF, NF, MBP, NSE, p-globin, GFAP, GAP43, тирозингидроксилаза, субъединица 1 каинатного рецептора и субъединица В глутаматного рецептора и другие) либо синтетическим. Пример терминирующей последовательности для клеток млекопитающих - таковая бычьего гормона роста (BGH), клеток растений - гена нопалин синтетазы (NOS Т).
Сигналы инициации трансляции - последовательность Шайна - Дальгарно [Карр L.D., Lorsch J.R. The molecular mechanics of eukaryotic translation // Annual Review of Biochemistry 73/2004, 657-704] у прокариот и последовательность Козак у эукариот [Kozak М. (1986) "Point mutations define a sequence flanking the AUG initiator codon that modulates translation by eukaryotic ribosomes", Cell 44, 283-292]. При использовании клеток млекопитающих последовательность Козака непосредственно перед стартовым кодоном ATG позволяет увеличить экспрессию [Kozak М. Recognition of AUG and alternative initiator codons is augmented by G in position +4 but is not generally affected by the nucleotides in positions +5 and +6. EMBO J. 1997; 16(9):2482-2492].
Под элементами для селекции трансформанта подразумевают, как правило, ген, обуславливающий устойчивость к антибиотику, либо ген, завершающий ауксотрофию. При использовании бактерии в качестве продуцента селективный маркер может быть представлен, например, геном устойчивости к ампициллину, либо канамицину, либо тетрациклину; дрожжей - например геном LEU2, либо TRP1, либо URA3; грибов -например геном устойчивости к биалафосу, либо гигромицину, либо ауреобасидину, либо блеомицину; растений - например геном устойчивости к канамицину, либо биалафосу; клеток млекопитающих - например геном устойчивости к неомицину.
Регуляторные последовательности - нуклеотидные последовательности, способные повлиять на экспрессию гена на уровне транскрипции и/или трансляции, а также на механизмы, обеспечивающие существование и поддержание функционирования генетической конструкции. Возможные регуляторные последовательности по отношению к промотору - это энхансер, для увеличения уровня экспрессии через улучшение взаимодействия РНК-полимеразы и ДНК, инсулятор, для модулирования функций энхансера, сайленсеры; либо их фрагменты, для снижения уровня транскрипции, например для тканеспецифической экспрессии, 5' нетранслируемая область до промотора, включая интрон. Генетическая конструкция по настоящему изобретению в одном из вариантов дополнительно содержит от одной из вышеприведенных регуляторных последовательностей, в зависимости от варианта вектора, основанного на выборе промотора и желаемых параметрах экспрессии таргетного гена.
Для получения секретируемых гибридных белков, охарактеризованных SEQ ID NO.: 1-4, на N-конец последовательности помещают сигнальный пептид, подходящий для используемого продуцента. Примеры таких секреторных последовательностей описаны в литературе [например, для E.coli - в патенте РФ №2198179, дата приоритета 15.09.1999, для дрожжей - в патенте РФ №2143495, дата приоритета 08.07.1994, патенте США №4546082, дата приоритета 17.06.1982, европейских заявках на изобретение №116201, 123294, 123544, 163529, 123289, заявке на изобретение Дании 3614/83, дата приоритета 08.08.1983, для растений - в статьях Kapila J, Rycke RD, Van Montagu M, Agenon G (1997) An Agrobacterium-mediated transient gene expression system for intact leaves. Plant Sci 122: 101-108, Stiefel, V., Ruiz-Avila, L., Raz, R., Valles, M.P., Ghez, J., Pages, M., Martinez-lzquierdo, J.A., Ludevid, M.D., Langdale, J.A., Nelson, Т., and , P. (1990). Expression of a maize cell wall hydroxyproline-rich glycoprotein gene in early leaf and root vascular differentiation. Plant Cell 2, 785-793].
Могут содержаться и иные элементы, требуемые для функционирования экспрессионной системы.
Предложены рекомбинантные клетки, продуцирующие описанные гибридные белки, прокариотического, либо эукариотического организма. Прокаритический продуцент представлен, например, Escherichia coli, Bacillus subtilis, эукариотический продуцент - грибами, клетками растений, млекопитающих.
Примеры приведены для наглядности реализации изобретений (генетическая конструкция, рекомбинантная клетка), но реализация ими не ограничивается. На сегодняшний момент в научной литературе (например, учебники по молекулярной биологии, биотехнологии, статьи, например доступная по адресу http://www.labome.ru/method/Recombinant-Protein-Expession-Vector-Host-Systems.html, специализированные сайты в интернете с базами данных, например векторов) описано множество экспрессионных систем, а также методик их создания и работы с ними, в связи с чем специалисту понятно, что представленное описание группы изобретений позволяет их осуществить.
Предложены варианты вакцины для профилактики или лечения туберкулеза, каждый вариант содержит один из описанных гибридных белков в качестве активного агента, в эффективном количестве, а также физиологически приемлемый носитель или буферный раствор. Фармацевтически приемлемые носители или буферные растворы известны из уровня техники и включают те, которые описаны в различных текстах, таких как, например, Remington's Pharmaceutical Sciences. В качестве потребителя вакцины может выступать как человек, так и животное, в том числе из домашних или сельскохозяйственных животных.
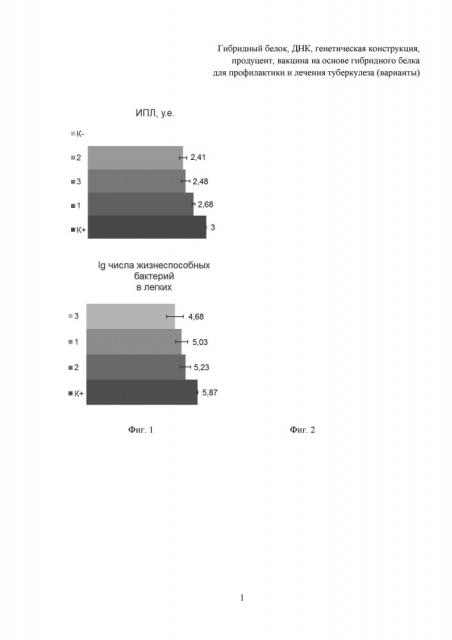
Авторами настоящего изобретения проведены лабораторные исследования, подтверждающие возможность реализации охарактеризованных изобретений. Полученные результаты исследований проиллюстрированы следующими примерами.
Пример 1. Моделирование гибридных белков (SEQ ID NO.: 1 - SEQ ID NO.: 4) для противотуберкулезной вакцины.
Для моделирования белков были произведены следующие действия:
1. Поиск иммуногенных эпитопов белков Ag85B, Tb10.4, FliC с помощью программы CPREDS (http://ailab.cs.iastate.edu/bcpreds/predict.html)
2. Построение модели целого белка для определения ориентации доменов
3. Построение моделей для каждого домена (с использованием образцов 3D структур и ab initio)
4. Докинг моделей с использованием модели целого белка.
Для получения наиболее реалистичных результатов в автоматическом режиме использовали алгоритм I-Tasser для моделирования белков.
Смоделированные гибридные белки состоят из 546 а.о., представлены их аминокислотные последовательности - SEQ ID NO: 1 - SEQ ID NO: 4. Анализ аминокислотных последовательностей данных белков с помощью программы ProtParam (http://au.expasy.org/tools/protparam.html) показал, что гибридные белки имеют молекулярную массу 57,2 кДа, pI 4.79.
Пример 2. Получение высокоочищенных гибридных белков с использованием прокариотического организма
Перевели аминокислотные последовательности рассчитанных гибридных белков в нуклеотидные (1731 п.н.), одновременно проведя кодонную оптимизацию для экспрессии в клетках E.coli в ручном режиме и добавив фланкирующие ген сайты рестрикции NdeI/XhoI. Синтезировали рассчитанные гены химически.
Полученные гены клонировали в бактериальном экспрессионном векторе рЕТ28а(+) по рестрикционным сайтам NdeI и XhoI по инструкции к вектору.
Для создания штамма-продуцента использовали клетки E.coli штамма BL21 Star (DE3) (Invitrogen, USA), с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3), содержащие в геноме λDe3 лизоген и мутацию rne131. Мутированный ген rne (rne131) кодирует усеченную форму РНКазы Е, что уменьшает внутриклеточное разрушение мРНК, приводя к увеличению ее ферментативной стабильности. Ion- и ompT-мутации по генам протеаз позволяют получать непротеолизированные рекомбинантные белки в больших количествах.
Подготавливали клетки Е. coli штамма BL21 с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3) следующим образом. Инкубировали клетки при +37°С в течение ночи в 5 мл L-бульона, содержащего 1% триптон, 1% дрожжевой экстракт и 1% натрий хлористый. Разводили культуру свежим L-бульоном в 50-100 раз и выращивали на качалке при +37°С до оптической плотности 0,2-0,3 при длине волны 590 нм. При достижении оптической плотности более 0,3 культуру разводили свежим L-бульоном до оптической плотности 0,1 и растили 30 мин. Переносили 100 мл культуры в стерильную центрифужную пробирку и осаждали клетки при +4°С на 5000g в течение 10 мин. Супернатант сливали, клетки ресуспендировали в деионизованной воде в исходном объеме с последующим центрифугированием. Процедуру отмывки повторяли трижды. После отмывки осадок клеток ресуспендировали в малом объеме деионизованной воды и центрифугировали 30 сек. при 5000 об/мин на микроцентрифуге.
Трансформацию компетентных клеток осуществляли методом электропорации. Для этого 1 мкл десятикратно разведенной лигазной смеси добавляли к 12 мкл компетентных клеток, перемешивали и проводили электропорацию на электропораторе Eporator (Eppendorf, Германия) в стерильных кюветах для электропорации (Eppendorf, Германия), объемом 100 мкл, щель 1 мм, при электрическом импульсе напряженностью 1,7 кВ длительностью 5 мсек.
После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ KCl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин при +37°С. 10-100 мкл клеточной суспензии высевали на селективную LB-среду (Gibko BRL, США), содержащую канамицин (100 мкг/мл), для отбора клонов, содержащих плазмиды (штаммов-продуцентов).
Выросшие колонии Е. coli проверяли на наличие плазмид со вставкой таргетного гена. Клон клеток, содержащих искомую плазмидную ДНК, считали штаммом-продуцентом гибридного белка. Таким образом были получены четыре штамма-продуцента гибридных белков, охарактеризованных SEQ ID NO.: 1 - SEQ ID NO.: 4.
Для культивирования полученных штаммов-продуцентов использовали стандартную агаризованную LB-среду, содержащую канамицин в концентрации 100 мкг/мл и глюкозу в концентрации 1% для блокирования неспецифической экспрессии.
Индукцию экспрессии проводили при достижении культурой клеток оптической плотности 0.6-0.8 оптических единиц при длине волны 600 нм. В качестве индуктора использовали 0.2% лактозу (Studier, 2005).
Для автоиндукции экспрессии по методу Штудиера (Studier, 2005) использовали среду PYP-5052, состоящую из 1% пептона (Gibco, США), 0.5% дрожжевого экстракта (Gibco, США), 50 мМ Na2HPO4, 50 мМ K2HPO4, 25 мМ (NH4)2SO4, 2 мМ MgSO4, 0.5% глицерола, 0.05% глюкозы и 0.2% лактозы.
В среду PYP-5052, содержащую канамицин в концентрации 100 мкг/мл, инокулировали единичную колонию штамма-продуцента. Ферментацию проводили при +37°С в термостатированном шейкере роторного типа при 250 об/мин в течение 20 часов до отсутствия существенного изменения ОП600 за 1 час. Отбирали аликвоту клеток на анализ экспрессии гена, кодирующего гибридный белок, методом электрофореза в ПААГ, а оставшуюся биомассу осаждали центрифугированием при 9000g.
Осажденные клетки лизировали с помощью 3 циклов соникации по 30 сек с перерывом в 2 мин на льду. Затем проводили разрушение телец включения путем инкубации с лизирующим буфером, содержащим 500 мМ натрий-фосфатный буфер, рН 8,0, 6М гуанидин гидрохлорид, 500 мМ хлористый натрий, в течение часа. К клеткам, собранным центрифугированием из 50 мл культуры, добавляли по 8 мл лизирующего буфера.
Колонку, содержащую Ni-НТУ сефарозу, предварительно уравновешивали буфером для нанесения (500 мМ натрий-фосфатный буфер, рН 8,0, 8 М мочевина, 500 мМ хлористый натрий, 10 мМ имидазол). Разрушенные тельца включения наносили на колонку. Далее промывали колонку двумя объемами буфера для нанесения (500 мМ натрий-фосфатный буфер, рН 8,0, 8 М мочевина, 500 мМ хлористый натрий, 10 мМ имидазол). После этого промывали колонку тремя объемами буфера для промывки (500 мМ натрий-фосфатный буфер, рН 8,0, 8 М мочевина, 500 мМ хлористый натрий, 30 мМ имидазол). Элюировали белок с помощью 5 мл буфера для элюции (500 мМ натрий-фосфатный буфер, рН 8,0, 8М мочевина, 500 мМ хлористый натрий, 200 мМ имидазол). Собирали фракции по 1 мл, анализировали электрофоретически в 12% ПААГ-ДДс-Na, фракции с целевым белком объединяли, концентрацию белка в них определяли по методу Бредфорд.
Получили препараты белков (SEQ ID NO.: 1-4) чистотой около 97-98%, по данным SDS-PAGE, концентрация гибридного белка в каждом препарате составила 1-2 мг/мл.
Пример 3. Получение высокоочищенных гибридных белков с использованием эукариотического организма
3.1. Получение высокоочищенных гибридных белков с использованием клеток грибов.
Перевели аминокислотные последовательности рассчитанных гибридных белков в нуклеотидные (1731 п. н.), одновременно проведя кодонную оптимизацию для экспрессии в клетках дрожжей Pichia pastoris в ручном режиме и добавив фланкирующие ген области для получения секретируемого белка, по инструкции к вектору для клонирования. Синтезировали рассчитанные гены химически.
Полученные гены клонировали в эукариотическом экспрессионном векторе pHIL-S1, по инструкции к вектору.
Подготавливали клетки дрожжей к трансформации. Провели культивирование и заморозку клеток Pichia pastoris штамма SMD1163, дефектного по нескольким протеазам дрожжей, что обеспечивает стабильность секретируемого белка. Клетки высевали в стерильных условиях на агар в среде YPD (1%- дрожжевой экстракт, 2%- пептон, 2%-глюкоза, 1 мМ дитиотрейтол), культивировали при 30°С, затем пересевали в суспензию и культивировали в течение 16 ч. Часть клеток ресуспендировали в YPD среде с добавлением 15% глицерина и замораживали при -86°С. Для получения компетентных клеток предварительно выращивали колонии клеток в чашке с агаром в YPD среде при 30°С в течение двух дней. Затем содержимое одной колонии выращивали в 10 мл YPD среды при 30°С в течение 16 ч. Разбавляли суспензию в YPD до ОП600 0.2 и конечного объема 10 мл и выращивали культуру до ОП600 0-8 в течение 4 часов. Суспензию клеток центрифугировали 5 мин при 500 g, выливали супернатант, ресуспендировали в 10 мл раствора I из набора для трансформации EasyComp Transformation Kit, вновь центрифугировали и ресуспендировали осадок в растворе I. Аликвоты компетентных клеток по 50-200 мкл разливали в стерильные пробирки объемом 1.5 мл, которые хранили при температуре -90°С до использования.
Для трансформации использовали набор EasyComp Transformation Kit, входящий в состав Pichia Easy Select Kit (Invitrogen), реакцию проводили по инструкции к набору. Полученную суспензию клеток рассевали в стерильную чашку на агаровый гель, приготовленный на среде YPD с добавлением 1М сорбитола и антибиотика ампициллина в конечной концентрации 100 мкг/мл. Через 3 суток получили несколько десятков колоний на чашку. Клетки из выросших колоний переносили на чашку с MMD (minimal medium dextrose)-агаром и культивировали чашку 2 дня при 30°С.
Клетки выросших на селективной среде колоний переносили в колбы и культивировали в 5 мл среды MGY на качалке (250 об/мин) в течение 1 суток до ОП600 5. После этого клетки осаждали центрифугированием при 3000 g 10 мин. Контроль экспрессии целевого гена осуществляли методом