Лекарственное средство для лечения фиброза печени, способ его получения и способ лечения фиброза печени
Иллюстрации
Показать всеИзобретение относится к области биохимии, биотехнологии и генетической инженерии, в частности к лекарственному средству для лечения фиброза печени на основе смеси двух невирусных плазмидных конструкций. Первая невирусная плазмидная конструкция представляет собой pC4W-HGFopt и содержит ген, кодирующий фактор роста гепатоцитов человека. Вторая - pVax1-UPAopt и содержит ген, кодирующий урокиназу человека. В указанном лекарственном средстве плазмидные конструкции содержатся в следующих концентрациях: pC4W-HGFopt - от 0,5 до 0,7 мг/мл; pVax1-UPAopt - от 0,3 до 0,5 мг/мл, причем суммарная концентрация ДНК составляет 1±0,01 мг/мл. Настоящее изобретение раскрывает способ получения указанного лекарственного средства и способ лечения фиброза печени с использованием указанного лекарственного средства в фармацевтически приемлемом количестве. Настоящее изобретение позволяет получить лекарственное средство для лечения фиброза печени, обладающее повышенной эффективностью, являющееся безопасным и упрощенным в получении. 3 н. и 9 з.п. ф-лы, 28 ил., 4 табл., 9 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и генетической инженерии, и может быть использовано при создании генно-терапевтических препаратов, предназначенных для использования в медицине, а именно в гепатологии для лечения фиброза печени различной степени тяжести.
Уровень техники
Из уровня техники известны лекарственные средства для лечения фиброза печени (Gene therapy by hepatocyte growth factor results in regression of experimental liver fibrosis RJGHC. - 2010. - Vol. 20. - No 4. - P. 22-28. N.A. Dzhoyashvili, N.I. Kalinina, I.B. Beloglazova, Z.I. Tsokolayeva, P.I. Makarevich, Yu.L. Perov, Ye.V. Parfenova, V.A. Tkachuk; Translational research on HGF: A phase I/II study of recombinant human HGF for the treatment of fulminant hepatic failure. Hepatol Res. 2008 Nov; 38 Suppl 1:S88-92. doi: 10.1111/j.1872-034X.2008.00432.X. Ido A, Moriuchi A, Marusawa H, Ikeda K, Numata M, Yamaji N, Setoyama H, Ida H, Oketani M, Chiba T, Tsubouchi H.; Urokinase-type plasminogen activator gene therapy in liver cirrhosis is mediated by collagens gene expression down-regulation and up-regulation of MMPs, HGF and VEGF. J Gene Med. 2006 Nov; 8(11): 1291-9 Bueno M, Salgado S, Beas-Zarate C, Armendariz-Borunda J.), в которых в качестве основного действующего вещества использованы плазмидные конструкции, содержащие по отдельности гены фактора роста гепатоцитов или урокиназы человека. Вышеупомянутые плазмидные генетические конструкции содержат белок-кодирующие участки ДНК соответствующих генов и при их введении в клетки млекопитающих в результате процессов транскрипции и трансляции обеспечивают синтез и последующую секрецию из клеток белков фактора роста гепатоцитов или урокиназы. Биологическая активность соответствующих белков обеспечивает поддержание функции и деления клеток печени-гепатоцитов, а также разрушение белков внеклеточного матрикса, откладывающихся в ткани при фиброзе. Способ лечения фиброза печени основан на многократном внутривенном введении указанных средств в количествах не более 3,75 мг/кг (для грызунов).
Однако для достижения терапевтического эффекта таких моногенных препаратов требутся многократное введение терапевтических плазмид, что удорожает лечение и делает его более продолжительным.
Наиболее близким, известным из уровня техники, является лекарственное средство и способ лечения экспериментального фиброза печени с помощью одновременного введения животным аденовирусов, несущих генетические конструкции, с которых происходит синтез белков - фактора роста гепатоцитов (HGF) и урокиназы (Treatment of experimental hepatic fibrosis by combinational delivery of urokinase-type plasminogen activator and hepatocyte growth factor genes. Lin Y, Xie WF, Chen YX, Zhang X, Zeng X, Qiang H, Chen WZ, Yang XJ, Han ZG, Zhang ZB. Liver Int. 2005 Aug; 25(4):796-807). Введение вирусных частиц с терапевтическими генами обеспечивает эффективное заражение клеток печени и секрецию ими соответствующих белков, биологическая активность которых приводит к уменьшению фибротического поражения ткани печени.
Несмотря на высокую эффективность данный подход имеет ряд ограничений и недостатков. Получение вирусных частиц существенно удорожает производство препарата и значительно повышает требования к обеспечению безопасности. Использование вирусных частиц на основе аденовируса не позволяет использовать данный способ лечения фиброза у пациентов, поскольку не может быть одобрен регламентирующими органами в связи с побочными эффектами, связанными с введением в организм частиц вируса.
Заявляемое решение основано на использовании препарата, включающего смесь невирусных плазмидных конструкций, содержащих гены HGF и урокиназы, которые при одновременном введении в клетки печени обеспечивают синтез и секрецию соответствующих белков, биологическая активность которых способствует излечиванию от фиброза. В то же время, создание заявляемого препарата существенно проще, чем получение вирусных частиц, поскольку производство невирусных конструкций не требует применения специальных мер безопасности, необходимых при работе с вирусами. Используемые невирусные конструкции удовлетворяют критериям безопасности, установленными регламентирующими органами для лечения заболеваний человека, и выгодно отличаются от моногенных препаратов на основе урокиназы и фактора роста гепатоцитов, поскольку эффективнее за счет использования синергического действия сразу двух биологически активных белков. Способ лечения с использованием заявляемого средства требует меньшего времени и количества введений препарата для достижения лучшего терапевтического эффекта по сравнению с существующими аналогами на основе моногенных препаратов.
Раскрытие изобретения
Задачей изобретения является создание высокоэффективного и безопасного генотерапевтического препарата, предназначенного для направленного лечения фиброза печени.
Техническим результатом, на достижение которого направлено заявленное изобретение, является обеспечение безопасного и упрощенного производства препарата, а также его безопасное использование в клинике, как для медицинских работников, так и для пациентов. Данный результат достигается за счет использования невирусных конструкций, содержащих терапевтические гены.
Для заявляемого препарата характерны следующие преимущества: простота получения в больших количествах, биологическая безопасность получения, высокая стабильность, сочетание сразу двух биологически активных компонентов. Для заявляемых способов применения лекарственного средства характерны простота применения, безопасность для медицинского персонала и пациентов, более высокая эффективность по сравнению с аналогами, сокращение числа вводимых доз, необходимых для достижения терапевтического эффекта.
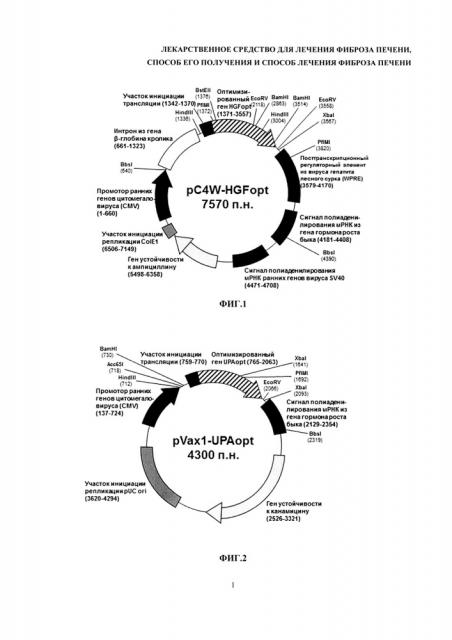
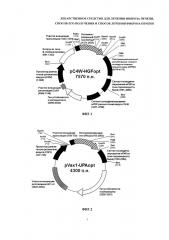
Поставленная задача решается тем, что лекарственное средство для лечения фиброза печени в качестве активно действующего вещества содержит смесь из двух плазмидных конструкций, содержащих терапевтические гены HGF и урокиназы человека. Входящие в состав заявляемого средства плазмидные конструкции могут содержаться в следующем соотношении: pC4W-HGFopt (кодирует HGF) в интервале концентраций от 0,5 до 0,7 мг/мл; pVax1-UPAopt (кодирует урокиназу) от 0,3-0,5 мг/мл, причем суммарная концентрация ДНК должна составлять 1+/-0,01 мг/мл. Лекарственное средство может представлять собой жидкую субстанцию или лиофильно высушенный препарат. В одном из вариантов выполнения средства входящие в него плазмидные ДНК содержат следующие регуляторные элементы: для плазмиды pVax1-UPAopt промотор ранних генов цитомегаловируса (в скобках указано положение в нуклеотидной последовательности 137-724), старт ко дон трансляции в оптимальном окружении (759-770), оптимизированная кДНК урокиназы (765-2063), сигнал полиаденилирования мРНК гормона роста быка (3129-2354); для плазмиды pC4W-HGFopt промотор ранних генов цитомегаловируса (1-660), последовательность интрона бета-глобина (661-1323), старт кодон трансляции в оптимальном окружении (1342-1370), оптимизированная кДНК HGF (1371-3557), посттранскрипционный регуляторный элемент из вируса гепатита лесного сурка (3579-4170), синал полиаденилирования мРНК гормона роста быка (4181-4408). (Фиг. 1, 2, 25, 26). Эти регуляторные элементы обеспечивают высокий уровень продукции белков урокиназы и фактора роста гепатоцитов человека, при введении данных плазмидных ДНК в клетки млекопитающих, в том числе человека.
Поставленная задача решается тем, что способ получения заявляемого лекарственного средства включает получение бактериальных штаммов-продуцентов, несущих плазмиды с генами HGF и урокиназы человека, наращивание биомассы бактерий, несущих соответствующие плазмидные конструкции, выделение и очистка ДНК плазмидных конструкций с последующим смешением. Очистку проводят с достижением конечного содержания примесей на 1 мг: белки E.coli - не более 10 мкг (≤1%), РНК E.coli - не более 10 мкг (≤1%), геномная ДНК E.coli - не более 10 мкг (≤1%), бактериальные эндотоксины - не более 40 ЕЭ, и содержанием суперспиральной формы плазмидной ДНК - не менее 800 мкг (≥80%) смешением полученных водных растворов плазмидных конструкций в пропорциях 50-70% pC4W-HGFopt:30-50% pVax1-UPAopt с последующей лиофильной сушкой до остаточной влажности не более 0,005 мг на 1 мг. По итогам очистки нуклеотидную последовательность получаемых плазмидных конструкций подтверждают с помощью анализа длин фрагментов, получающихся при гидролизе специфическими ферментами - эндонуклеазами рестрикции, определяют уровень примесей, чистоту и концентрацию растворов, соответствующих плазмидных ДНК.
В одном из вариантов осуществления способа плазмидная конструкция pC4W-HGFopt имеет нуклеотидную последовательность гена HGF, представленную на фиг. 25, а плазмидная конструкция pVax1-UPAopt имеет нуклеотидную последовательность гена урокиназы, представленную на фиг. 26.
Поставленная задача решается также тем, что способ лечения фиброза печени включает введение заявляемого лекарственного средства в организм млекопитающего в фармацевтически приемлемом количестве. В одном из вариантов способа возможно 2-кратное с интервалом 2-3 дня внутривенное введение заявляемого средства в количестве, не превышающем 3,75 мг/кг для грызунов и 0,3125 мг/кг для человека. При использовании лиофильно высушенного средства, перед введением в организм млекопитающего его предварительно растворяют в изотоническом растворе.
Таким образом, лекарственное средство включает в себя смесь из двух невирусных плазмидных конструкций, одна из которых содержит терапевтический ген фактора роста гепатоцитов, вторая - ген урокиназы человека. Плазмидные конструкции обеспечивают высокий уровень секреции соответствующих биологически активных белков (в культуре клеток - в интервале от 5 до 1000 нг на 1 мл среды) при введении в клетки млекопитающих, в том числе человека.
Способ получения лекарственного средства включает следующие стадии: создание бактериальных штаммов продуцентов, содержащих невирусные плазмидные конструкции, кодирующие урокиназу и фактор роста гепатоцитов, получение бактериальной биомассы, содержащей вышеупомянутые плазмидные конструкции, выделение и очистку соответствующих плазмидных конструкций, получение смеси растворов плазмидных конструкций с суммарной концентрацией ДНК 1+/-0,2 мг/мл, содержащей определенные пропорции отдельных компонентов (в интервале концентраций от 0,3 до 0,70 мг/мл индивидуальных плазмид), получение лиофилизованных (высушенных) препаратов плазмидных конструкций.
Способ лечения фиброза печени включает одно или многократное, в зависимости от тяжести фиброза печени, введение заявленного препарата в виде водного изотонического раствора, который можно получить растворением лиофилизованного препарата, взятого в терапевтически приемлемом количестве (например, 3,75 мг/кг - для животных и 0,3125 мг/кг - для человека для внутривенного введения).
После введения в пораженную печень плазмидные конструкции экспрессируются в течение одной-двух недель, обеспечивая повышение продукции HGF и урокиназы. Биомишенями этих белковых факторов являются специфичные рецепторы на поверхности гепатоцитов, клеток Ито и макрофагов печени, белки c-met и uPAR. Факторы роста, продуцируемые в результате введения в пораженную печень плазмидных конструкций, взаимодействуют со специфичными биомишенями. Взаимодействие HGF со своей биомишенью приводит к активации каскадов внутриклеточной сигнализации, в результате чего происходят подавление апоптоза, стимуляция пролиферации гепатоцитов, а также предотвращение активации дифференцировки клеток Ито в про-фибротические миофибробласты, что обусловливает ускоренное восстановление количества функционально активных клеток печени. Взаимодействие урокиназы со своим рецептором на поверхности клеток-мишеней вызывает как активацию каскадов внутриклеточной сигнализации, так и запуск околоклеточного протеолиза. В результате происходит подавление активности трансформирующего фактора роста, подавление экспрессии генов коллагена 1α1, фибронектина, ингибитора активатора плазминогена 1 типа и тканевого ингибитора матриксных металлопротеиназ 1 типа, а также повышение продукции матриксной металлопротеиназы-13, что обусловливает непосредственное анти-фибротическое действие исследуемого лекарственного средства.
Кроме того, при изучении свойств урокиназы авторами настоящего изобретения было выявлено, что помимо тромболитической активности, урокиназа обладает способностью участвовать в регуляции ремоделирования органов и тканей, регуляции клеточной пролиферации и миграции, регуляции клеточной дифференцировки, а также в процессах регуляции регенерации. Обнаружено, что урокиназа принимает участие в регуляции активности множества факторов роста, как протеолитически активируя их, так и влияя на экспрессию их рецепторов.
Краткое описание чертежей
Изобретение поясняется чертежами.
На фиг. 1 и 2 представлены схемы плазмидных конструкций: на фиг. 1 - плазмидная конструкция, несущая UPA - ген урокиназы, на фиг. 2 - HGF - ген фактора роста гепатоцитов. Цифрами обозначены положения нуклеотидов.
На фиг. 3 представлен характерный спектр поглощения высокоочищенной плазмидной ДНК в диапазоне длин волн от 240 нм до 320 нм.
На фиг. 4 - анализ спектров поглощения растворов ДНК с разными разбавлениями.
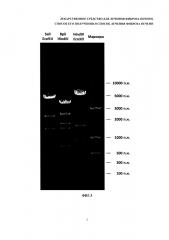
На фиг. 5 - электрофоретический анализ продуктов гидролиза плазмидных ДНК рестриктазами.
На фиг. 6 - график зависимости длины пробега от логарифма размера фрагмента.
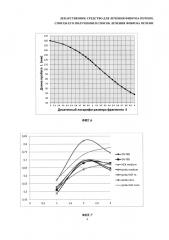
На фиг. 7 - результаты измерения пролиферативной активности культуры клеток под действием HGF, по оси абсцисс указано время, по оси ординат - значения среднего времени удвоения количества клеток.
На фиг. 8 - фотографии стеллатных клеток мыши, увеличение 40х, сразу после выделения (слева), на следующий день (справа), светятся вакуоли с ретинолом.
На фиг. 9-13 - результаты измерения относительных уровней мРНК белков внеклеточного матрикса стеллатных клеток, обработанных средой, содержащей урокиназу, секретируемую клетками HEK293, трансфицированными плахмидой pVax1-UPAopt. На фиг. 9 представлено изменение уровня мРНК альфа-гладкоклеточного актина (α-SMA) при добавлении кондиционированной среды клеток линии HEK. На фиг. 10 - изменение уровня мРНК трансформирующего фактора роста бета (TGF-β) при добавлении кондиционированной среды клеток линии HEK. На фиг. 11 - изменение уровня мРНК тканевого ингибитора матриксных металлопротеиназ (TIMP-1) при добавлении кондиционированной среды клеток линии HEK. На фиг. 12 - изменение уровня мРНК коллагена I типа при добавлении кондиционированной среды клеток линии HEK. Фиг. 13 - изменение уровня мРНК коллагена III типа при добавлении кондиционированной среды клеток линии HEK.
На фиг. 14 представлены фотографии гистологически окрашенных срезов ткани печени. Группа отрицательного контроля (сверху А и В). Мыши, которым в течение Недель 1-4 вводили 30% CCl4 на оливковом масле в дозе 1 мкл/1 г массы тела. В течение Недель 5-6 животные этой группы не получали никакого лечения. Пикросириус красный (слева А), гематоксилин-эозин (справа В), увеличение 10х. Группа терапии (снизу С и D). Недели 1-4 - индукция фиброза, Недели 5-6 - введение комбинации плазмид HGF и uPA 1 раз в неделю методом гидродинамического удара. Пикросириус красный (слева С), гематоксилин-эозин (справа D), увеличение 10х.
На фиг. 15 и фиг. 16 представлены фотографии гистологически окрашенных срезов печени мышей. Группа положительного контроля (препарата сравнения). Недели 1-4 - индукция фиброза, Недели 5-6 - введение 1 раз плазмиды HGF методом гидродинамического удара методом гидродинамического удара в дозе 3,75 мкг плазмидной ДНК на 1 г массы тела. Группа здоровых животных. Пикросириус красный (слева), гематоксилин-эозин (справа). Увеличение 10х.
На фиг. 17 - кинетическая кривая ПЦР.
На фиг. 18 - уровень мРНК компонентов внеклеточного матрикса в печени мышей.
На фиг. 19 - фотографии иммуногистохимически окрашенных срезов печени. Иммуногистохимичесское окрашивание срезов печени на коллаген I типа. Контрольная группа (без терапии) (А), группы терапии (В), группа терапии HGF (С), здоровый контроль (D).
На фиг. 20 - мммуногистохимическое окрашивание срезов печени на альфа-гладкоклеточный актин. Контрольная группа (без терапии) (А), группы терапии (В), группа терапии HGF (С), здоровый контроль (D).
На фиг. 21 - зависимость изменения поглощения при 340 нм от времени образца реакционной смеси для измерения активности АЛТ. По оси абсцисс - время в минутах, по оси ординат - значения оптической плотности при 340 нм.
На фиг. 22 - гистограммы средних значений активности АЛТ, измеренные в условных единицах активности на литр. Количество животных в каждой группе было больше или равно четырем. 1 - контрольные животные с индуцированным фиброзом печени; 2 - животные с индуцированным фиброзом, которые получали разрабатываемое лекарственное средство; 3 - животные с индуцированным фиброзом, которые получали препарат сравнения; 4 - контрольные животные без фиброза, инъецированные оливковым маслом; 5 - здоровые мыши, которые не получали никаких инъекций.
На фиг. 23 - зависимость изменения поглощения при 340 нм от времени образца реакционной смеси для измерения активности ACT. По оси абсцисс - время в минутах, по оси ординат - значения оптической плотности при 340 нм.
На фиг. 24. - гистограммы средних значений активности ACT, измеренные в условных единицах активности на литр. Количество животных в каждой группе было больше или равно четырем. 1 - контрольные животные с индуцированным фиброзом печени; 2 - животные с индуцированным фиброзом, которые получали разрабатываемое лекарственное средство; 3 - животные с индуцированным фиброзом, которые получали препарат сравнения; 4 - контрольные животные без фиброза, инъецированные оливковым маслом; 5 - здоровые мыши, которые не получали никаких инъекций.
На фиг. 25 представлена нуклеотидная последовательность гена HGF, представленная в плазмидной конструкции pC4W-HGFopt (с №1371 по №3557).
На фиг. 26 - нуклеотидная последовательность гена урокиназы, входящая в плазмидную конструкцию pVax1-UPAopt (с №765 по №2063).
На фиг. 27 - структурная формула плазмидной ДНК pC4W-HGFopt.
На фиг. 28 - структурная формула плазмидной ДНК pVax1-UPAopt.
Осуществление изобретения
Для создания заявленного лекарственного средства используют две различные невирусные плазмидные конструкции, несущие терапевтические гены урокиназы и фактора роста гепатоцитов. Для создания лекарственного средства можно использовать любые плазмидные конструкции, которые обеспечивают продукцию урокиназы и фактора роста гепатоцитов при введении в клетки млекопитающих. Данные конструкции должны содержать элементы ДНК, которые обеспечивают высокий уровень транскрипции и трансляции соответствующих генов, обеспечивая высокий уровень синтеза и секреции кодируемых ими белков урокиназы и фактора роста гепатоцитов в клетках млекопитающих. В изобретении может быть использована последовательность гена HGF, оптимизированная для получения больших количеств белка, которая представлена в материалах патента RU 2385936. Схемы соответствующих конструкций и их полная структура приведены на Фиг. 1, 2, 27 и 28.
Урокиназа - фактор, который расщепляет ряд белков внеклеточного матрикса, способствует миграции клеток и ремоделированию ткани, стимулирует ангиогенез. Для продуцирования uPA используют ДНК, содержащую природный ген урокиназы человека. Исходная последовательность гена была модифицирована таким образом, чтобы при ее включении в состав эукариотического вектора обеспечивался более высокий уровень экспрессии названного белка в клетках, трансфицированных этой генетической конструкцией. Фактор роста гепатоцитов (HGF) стимулирует регенерацию печеночной ткани, оказывает защитное действие на гепатоциты и другие клетки, предотвращая их апоптоз, а также оказывает антифиброзное действие, индуцируя синтез протеиназ внеклеточного матрикса. HGF стимулирует миграцию резидентных стволовых клеток сердца из мест их локализации в участки повреждения, в частности, при инфаркте миокарда - в зону инфаркта. Для продуцирования HGF используют ДНК, содержащую природный ген фактора роста гепатоцитов человека, однако при его использовании не удается получить высокий уровень экспрессии данного белка.
Заявляемый препарат относится к фармакологической группе биологических препаратов для генной терапии, гепатопротекторов. Введение препарата внутривенно, может стимулировать процесс восстановления поврежденной фиброзом печени, влияя на выживаемость гепатоцитов, способствуя разрушению отложений коллагена и других белков, замещающих при фиброзе паренхиму печени.
Для получения больших количеств вышеупомянутых плазмидных конструкций, нанограммовые количества плазмидных ДНК (по отдельности) используют для трансформации коммерчески доступных штаммов кишечной палочки Esherichia coli, генотип которых позволяет использовать их для наработки больших количеств плазмидной ДНК. Трансформированные плазмидной ДНК бактерии размножают в приемлемой жидкой среде с необходимым антибиотиком для получения биомассы, содержащей плазмидную ДНК. Плазмидную ДНК выделяют и очищают, используя коммерчески доступные наборы или стандартные методы выделения плазмидной ДНК. Выделенные по отдельности плазмидные конструкции растворяют в бидистиллированной воде, доводя концентрацию ДНК в водном растворе до значения 1 мг/мл +/-0,2 мг/мл. Содержание примесей и состав плазмидных конструкций подтверждают доступными аналитическими методами, которые приняты для лабораторного анализа лекарственных средств, а также для определения качества и количества ДНК в растворе. Из полученных растворов индивидуальных плазмидных конструкций готовят смесь, содержащую водный раствор плазмиды pC4W-HGFopt (кодирует HGF человека) в пропорции от 30 до 70% и водный раствор плазмиды pVax1-UPAopt (кодирует урокиназу человека) в пропорции от 30 до 70%. В полученном таким образом препарате определяют количество примесей и соответствие препарата расчетной формуле, используя набор аналитических методов, принятых для анализа генотерапевтических конструкций, используемых в медицине. Для получения лиофилизованного препарата, водный раствор полученной смеси плазмид лиофильно высушивают. В результате получают сухой препарат с содержанием влаги не более 0,005 мг на 1 мг сухого вещества, который перед введением животным или пациентам растворяют в изотоническом водном растворе солей из расчета 1 мг на 1 мл раствора.
Для использования заявляемого лекарственного средства для лечения фиброза печени, лекарственное средство, если оно находится в сухом лиофилизованном состоянии, предварительно полностью растворяют в изотоническом стерильном солевом растворе в концентрации 1+/-0,01 мг/мл в дозах не более 3, 75 мг/кг для грызунов и не более 0,3125 мг/кг для человека. Введение препарата проводят двукратно с интервалом в 2-3 дня внутривенно. Эффективность лечения фиброза печени проводят гистологически и иммуногистохимически через 1-3 недели после введения последней дозы препарата, используя окрашивание срезов ткани печени с помощью гематоксилина и эозина и пикросириуса красного, а также с помощью специфических антител на коллаген по стандартным методикам с последующей визуализацией и документированием изображений. Уровень мРНК белков внеклеточного матрикса в образцах тканей печени, определяют используя метод обратной транскрипции-полимеразной цепной реакции с использованием в качестве матрицы образцов тотальной РНК, выделенной из тканей печени. Снижение уровня этих мРНК свидельствует об успешности лечения фиброза. Восстановление ткани печени также определяют, определяя уровень ферментов-метилтрансфераз ALT и AST в сыворотке крови с помощью стандартных диагностических наборов. Снижение уровней этих ферментов свидетельствует об успехе лечения. Для определения эффективности лечения фиброза сравнивают данные полученные в результате анализа состояния печени экспериментальных и контрольных здоровых мышей без фиброза печени.
Ниже представлены примеры реализации изобретения, которые не ограничивают настоящее изобретение, а лишь демонстрируют возможность его осуществления с достижением технического результата.
Пример 1. Получение штаммов продуцентов, необходимых для наработки лекарственного средства
Для трансформации и наработки плазмидной ДНК pC4W-HGFopt, которая содержит ген фактора роста гепатоцитов, используют штамм Е. coli XL1Blue-HGFopt, производный от штамма Е. coli XL1-Blue.
Для трансформации и наработки плазмидной ДНК pVAX-UPAopt, которая содержит ген урокиназы, используют штамм Е. coli XL1-Blue-UPAopt, производный от штамма Е. coli XL1-Blue.
Исходный штамм Е. coli XL1-Blue является музейным и хранится во Всероссийской Коллекции Промышленных Микроорганизмов. Полное видовое название исходного штамма Escherichia coli XL1-Blue.
Трансформированные штаммы Е. coli XL1-Blue-UPAopt и Е. coli XL1Blue-HGFopt отличаются от исходного штамма Е. coli XL1-Blue устойчивостью к антибиотику канамицину и ампициллину, соответственно, и обеспечиваемой введенной в состав штамма плазмидой pC4W-HGFopt или pVAX-UPAopt.
Генетические характеристики
Штамм бактерий E.coli XL1Blue-HGFopt имеет следующие генетические характеристики: endAl gyrA96(nalR) thi-1 recA1 relA1 lac glnV44 F'[::Tn10 proAB+lacIq Δ(lacZ)M15] hsdR17(rK- mK+), обладает устойчивостью к налидиксовой кислоте и тетрациклину и дополнительно содержит плазмиду pC4W-HGFopt в эписомном состоянии, придающую штамму устойчивость к ампициллину.
Штамм бактерий E.coli XL1Blue-UPAopt имеет следующие генетические характеристики: endA1 gyrA96(nalR) thi-1 recA1 relA1 lac glnV44 F'[::Tn10 proAB+lacIq Δ(lacZ)M15] hsdR17(rK- mK+), обладает устойчивостью к налидиксовой кислоте и тетрациклину и дополнительно содержит плазмиду pVAX-UPAopt в эписомном состоянии, придающую штамму устойчивость к канамицину.
Культурально-морфологические характеристики
Клетки мелкие, прямые, утолщенной палочковидной формы, грамотрицательные, неспороносные слабо подвижные, капсул и спор не образуют. Размер клеток около 4x1 мкм. Клетки хорошо растут на простых питательных средах. При росте на LB-агаре «BD» образуются круглые, гладкие, выпуклые, мутные, блестящие, серые колонии, с ровными краями. При росте в жидких средах (в среде LB) образуют интенсивную ровную муть.
Биологические характеристики
Аэроб. Температурный диапазон роста от плюс 4 до плюс 42°С при оптимуме pH 6,5-7,5. В качестве источника азота используют как минеральные соли в аммонийной и нитратной формах, так и органические соединения в виде аминокислот, пептона, триптона, дрожжевого экстракта и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Промышленные штаммы по предварительным оценкам не обладают патогенными, вирулентными, токсигенными свойствами. Исследование патогенных свойств штаммов будет проведено на последующих этапах разработки лекарственного препарата.
Способ получения штаммов-продуцентов
Штаммы-продуценты XL1Blue-HGFopt и XL1Blue-UPAopt для наработки плазмидных ДНК получали трансформацией исходного штамма Е. coli XL1-Blue плазмидой, соответственно, pC4W-HGFopt или pVAX-UPAopt, с последующим отбором рекомбинантных клонов на среде LB с ампициллином и канамицином, соответственно при 37°С.
Технология получения штаммов продуцентов трансформацией исходного штамма плазмидой не зависит в данном лабораторном процессе от типа плазмиды (pC4W-HGFopt или pVAX-UPAopt), поэтому в дальнейшем изложении не будет уточняться, какая именно плазмида используется в процессе, но подразумевается, что проводятся два идентичных процесса получения трансформированного штамма, содержащего одну из плазмид pC4W-HGFopt или pVAX-UPAopt. Остальные стадии технологического процесса до этапа смешивания двух субстанций и получения комбинированной субстанции так же проводятся одинаково для обоих трансформированных штаммов.
Для получения компетентных клеток бактерии исходного штамма Е. coli XL1-Blue высевали в стерильную пробирку емкостью 15 мл, содержащую 5 мл среды LB (1 л среды LB содержит 10 г триптона, 5 г дрожжевого экстракта, 10 г NaCl, pH среды доводят до 7,5 при помощи 1 М NaOH и стерилизуют автоклавированием). Пробирку инкубировали в течение ночи при 37°С в воздушном термостате. Культуру бактерий переносили в коническую стеклянную колбу емкостью 2 л, содержащую 400 мл среды LB и инкубировали в шейкере-инкубаторе при 37°С с покачиванием (300 об/мин) до того момента, когда оптическая плотность суспензии бактерий, измеренная при 600 нм, не составила 0,5. Далее суспензию клеток переносили в охлажденные до 4°С центрифужные стаканы емкостью 250 мл и центрифугировали в рефрижераторной центрифуге при 3000 g в течение 30 мин при 4°С. Осадок клеток суспендировали в 200 мл охлажденного до 4°С стерильного раствора 50 мМ CaCl2 и инкубировали суспензию при 0°С (во льду) в течение 30 мин, после чего суспензию клеток снова переносили в охлажденные до 4°С центрифужные стаканы и центрифугировали в рефрижераторной центрифуге при 3000 g в течение 30 мин при 4°С. Осадок клеток суспендировали в 40 мл охлажденного до 4°С стерильного раствора 50 мМ CaCl2, добавляли 6 мл стерильного глицерина, аликвотировали по 1 мл в ампулы для замораживания клеточных культур и замораживали в жидком азоте. Ампулы хранили при температуре минус 70°С.
Трансформацию компетентных клеток E.coli плазмидой проводили следующим образом. Ампулу с суспензией компетентных клеток, хранящуюся при минус 70°С, помещали в лед, дожидались размораживания, и 100 мкл суспензии переносили в стерильную пробирку емкостью 1,5 мл, находящуюся во льду. К суспензии бактерий добавляли 1 мкл стерильного раствора 1 мкг/мл плазмидной ДНК в буфере ТЕ (10 мМ Tris-HCl, 0,2 мМ EDTA) и инкубировали в течение 15 мин при 0°С (во льду). Далее пробирку помещали в водяную баню с температурой воды 43°С и инкубировали в течение 60 сек. После инкубации суспензию бактерий переносили на чашку Петри с микробиологическим агаром, приготовленным на среде LB и дополнительно содержащим 0,3 мг/мл ампициллина, и инкубировали в течение ночи при 37°С.
Колонии переносили в стерильные стеклянные колбы объемом 100 мл, содержащие 50 мл среды ТВ с 0,3 мг/мл ампициллина и инкубировали в шейкере-инкубаторе при 37°С с покачиванием (300 об/мин) в течение ночи для получения биомассы и измерения выхода плазмиды.
Пример 2. Культивирование бактерий и сбор биомассы для изготовления плазмидных ДНК pC4W-HGFopt и pVAX-UPAopt
Для получения биомассы для изготовления плазмидной ДНК pC4W-HGFopt (первого компонента субстанции) или pVAX-UPAopt (второго компонента субстанции), проводят следующие процедуры (шаги 1, 2 и 4 выполняют в ламинарном шкафу в стерильных условиях).
Размораживание и подращивание клеточных культур
1. Из колбы со средой с солями и амипициллином в стерильную стеклянную коническую колбу емкостью 250 мл переносят 50 мл среды при помощи серологической пипетки объемом 25 мл.
2. Из рабочего банка бактерий E.coli штамма-продуцента XL1Blue-HGFopt (в случае изготовления плазмидной ДНК pC4W-HGFopt) или штамма-продуцента XL1 Blue-UPAopt (в случае изготовления плазмидной ДНК pVAX-UPAopt), хранящегося при минус 70°С, размораживают одну ампулу и при помощи серологической пипетки объемом 1 мл переносят 1 мл культуры бактерий в колбу с 50 мл среды, приготовленную на предыдущем шаге.
3. Колбу помещают в шейкер-инкубатор и культивируют бактерии 24 ч при 37°С со скоростью качания 25 об/мин.
Выращивание культур в колбах и сбор биомассы
4. В 4 колбы объемом 2 л, содержащие по 1000 мл среды ТВ с солями и антибиотиком, вносят по 10 мл культуры бактерий, полученной на предыдущем шаге.
5. Колбы помещают в шейкер-инкубатор (Т-1) и культивируют бактерии 20 ч при 37°С со скоростью качания 250 об/мин.
6. По окончании культивирования из каждой колбы отбирают по 1 мл культуры бактерий при помощи серологической пипетки объемом 1 мл и измеряют оптическую плотность при длине волны 600 нм, которая должна быть не менее 3.
7. Культуру бактерий, полученную на шаге 5, переливают из 2 колб в 6 центрифужных стаканов объемом 470 мл, по 333 мл на стакан, уравновешивают стаканы попарно и центрифугируют при 6000 об/мин 30 мин на центрифуге (Ф-5) J-21C в роторе JA10 при 4°С.
8. Жидкость сливают, культуру бактерий из оставшихся 2 колб переливают в те же центрифужные стаканы, по 333 мл на стакан, уравновешивают стаканы попарно и центрифугируют при 6000 об/мин 30 мин на центрифуге (Ф-5) J-21C в роторе JA10 при 4°С.
9. Жидкость сливают, стаканы с осадком бактерий центрифугируют при 2000 об/мин 3 мин на центрифуге (Ф-5) J-21C в роторе JA10 при 4°С.
10. Остатки жидкости в стаканах убирают при помощи серологической пипетки объемом 5 мл.
11. Все осадки переносят при помощи шпателя из стаканов в предварительно взвешенную пробирку объемом 50 мл, взвешивают с целью определить вес биомассы и замораживают в морозильной камере при минус 70°С. Биомассу хранят не более 90 сут.
Пример 3. Характеристика лекарственного средства и подтверждение его подлинности
Лекарственное средство содержит следующие компоненты: ДНК (pC4W-HGFopt) 0,05 г, ДНК (pVAX-UPAopt) 0,05 г, натрия хлорид 0,9 г, вода для инъекций 100 мл. Структура соответствующих плазмид фиг. 1 и 2.
Описание. Субстанция представляет собой бесцветную прозрачную жидкость или лиофилизованный осадок, который перед внутривенным введением или для анализа необходимо растворить в изотоническом растворе.
Подлинность. Соответствует смеси плазмидных ДНК pC4W-HGFopt и pVAX-UP Aopt в весовой пропорции 1:1.
Определяют следующими методами.
1. Методом спектрофотометрии: в спектральном диапазоне 240 нм - 320 нм максимум поглощения должен быть единственным и находиться в пределах длин волн от 255 нм до 265 нм; отношение А260/А280 должно быть в пределах от 1,8 до 2,0; отношение А320/А260 не должно превышать 0,01. Примеры кривых поглощения растворов ДНК приведены на фиг. 3 и 4.
2. Методом рестрикционного анализа: при обработке рестриктазами Sail и BstEII размеры фрагментов должны составлять 715 п. н., 852 п. н, 1375 п. н., 2197 п. н. и 4658 п. н. (всего 5 фрагментов); при обработке рестриктазами BbsI и HindIII размеры фрагментов должны составлять 696 п. н., 1386 п. н., 1668 п. н., 2369 п. н. и 3820 п. н. (всего 5 фрагментов); при обработке рестриктазами HindIII и EcoRV размеры фрагментов должны составлять 554 п. н., 782 п. н, 886 п. н., 1532 п. н. и 5350 п. н. (всего 5 фрагментов). Количество наблюдаемых фрагментов для каждой обработки должно совпадать с указанным. Полученные в результате анализа значения размеров фрагментов не должны отличаться от указанных более чем на 20%. Отношение весового количества плазмидной ДНК pC4W-HGFopt к весовому количеству плазмидной ДНК pVAX-UPAopt должно быть в пределах от 0,8 до 1,2.
Прозрачность раствора. Раствор субстанции после размораживания должен быть прозрачным по сравнению с водой для инъекций.
Цветность раствора. Раствор субстанции после размораживания должен быть бесцветным по сравнению с водой для инъекций.
pH. pH раствора субстанции должен быть в пределах от 5,2 до 7,2. Определение проводят потенциометрическим методом.
Посторонние примеси
Содержание белков E.coli в субстанции должно быть не более 10 мкг на 1 мг ДНК плазмидной ДНК. Определение примеси белков E.coli методом иммуноферментного анализа.
Содержание РНК E.coli в субстанции должно быть не более 10 мкг на 1 мг плазмидной ДНК. Определение примеси РНК E.coli методом окрашивания SYBR Green II.
Содержание геномной ДНК E.coli в субстанции должно быть не более 50 мкг на 1 мг плазмидной ДНК. Определение примеси геномной ДНК E.coli методом полимеразной цепной реакции.
Содержание бактериальных эндотоксинов. Содержание бактериальных эндотоксинов в субстанции должно быть не более 93 ЕЭ/мл. Гель-тромб тест с лизатом амебоцитов мечехвоста Limulus polyphemus, количественный анализ методом В, по ОФС 42-0062-07 (ГФ XII, ч. 1, стр. 128-136).
Токсичность. Субстанция должна быть нетоксичной в дозе 0,1 мг плазмидной ДНК на мышь весом 19-21 г. Определение проводят на белых мышах. Тест-доза на одно животное 0,1 мг субстанции, разведенной стерильным 0,9%-ным раствором натрия хлорида для инъекций до конечного объема 0,5 мл. Субстанцию вводят в хвостовую вену. Подготовку животных и испытания осуществляют в соответствии с ОФС 42-0060-07 ГФ XII.
Стерильность. Субстанция должна быть стерильной. Испытание проводят методом прямого посева по ГФ XII, ч.1, ОФС 42-0066-07, стр. 155.
Количественное определение.
Концентрация нуклеиновой кислоты. Концентрация нуклеиновой кислоты в субстанции должна быть в пределах от 0,8 мг/мл до 1,2 мг/мл. Определение проводят методом спектрофотометрии.
Содержание хлорида натрия. Содержание натрия хлорида в субстанции должно быть в пределах от 0,85 г до 0,95 г на 100 мл. Определение проводят аргентометрическим титрованием по методу Фольгарда в модификации Колдуэлла и Мойера.
Содержание основного вещества. Содержание основного вещества в субстанции должно быть не менее 90%. Определение проводят методом электрофоретического разделения в агарозном геле.
Пример 4. Выделение и очистка плазми