Иммуностимулирующие олигодезоксинуклеотиды
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии. Предложен иммуностимулирующий неметилированный CpG-олигодезоксинуклеотид, вектор экспрессии, его содержащий, вакцина для предотвращения или борьбы с инфекционным заболеванием у птиц, содержащая указанные олигодезоксинуклеотид и/или вектор экспрессии и иммунологическое количество антигенного компонента, выделенного из патогенного для птичьих вируса или микроорганизма, а также применение олигодезоксинуклеотида в качестве лекарственного средства и для предотвращения инфекции у птичьих. Предложенный олигодезоксинуклеотид обладает высоким иммуномодулирующим действием и может быть использован в ветеринарии в качестве эффективного иммуностимулирующего компонента в вакцинах против инфекционных заболеваний птиц совместно с антигенным компонентом, выделенным из вируса или микроорганизма патогенного для птичьих. 5 н. и 24 з.п. ф-лы, 32 ил., 3 табл., 24 пр.
Реферат
Настоящее изобретение относится к иммуностимулирующим олигодезоксинуклеотидам, векторам и вакцинам, содержащим такие олигодезоксинуклеотиды, к их применению в качестве лекарственного средства, к их применению при предотвращении или борьбе с инфекционным заболеванием, к способам детекции таких олигодезоксинуклеотидов и к клеткам, которые можно использовать в этих способах.
В течение последних двух десятилетий в иммунологии было установлено, что иммунная система позвоночных обладает механизмами детекции микробной инфекции и инициации быстрой активации иммунной системы через рецептор-опосредованное распознавание уникальных характеристик патогенов, так называемых патоген-ассоциированных молекулярных паттернов (PAMP), взаимодействующих с когнатными распознающими патоген рецепторами хозяина (PRR) (Iwasaki A., Medzhitov R., 2001. Science 327, 291-295. Medzhitov R., 2009. Immunity 30, 766-775).
В настоящее время ясно, что определенные формы патогенной дезоксирибонуклеиновой кислоты (ДНК) относятся к числу таких PAMP. В 1995 году было опубликовано, что неметилированные мотивы CpG в бактериальной ДНК инициируют активацию B-клеток мыши (Krieg et al., 1995). В этом исследовании впервые описана связь между специфичным распознаванием бактериальной ДНК, содержащей иммунностимулирующие неметилированные CpG, и ранее известную супрессию CpG, а также широко распространенное метилирование CpG в ДНК млекопитающих. Показано, что наиболее эффективный стимулирующий B-клетки неметилированный оликодезоксинуклеотид CpG (CpG ODN) содержит элемент последовательности GACGTT.
Следующая значимая статья в данной области была опубликована лабораторией Shizuo Akira в Осаке/Япония (Hemmi et al., 2000). Посредством клонирования гена и подходом нокаута исследуемого гена у мышей было однозначно показано, что клеточный ответ у мышей на CpG-ODN является опосредованным Toll-подобным рецептором 9 (TLR9). Затем было показано, что CpG-ODN являются агонистами опосредованной TLR9 передачи сигналов преимущественно через путь NF каппа-B (Medzhitov, 2001). В последующее десятилетие был опубликован целый ряд исследований по темам фундаментальных исследований и по общим потенциальным иммунотерапевтическим применениям (например, описанные у Krieg, 2002, 2003, 2006, Klinman, 2004, Vollmer, 2005, Wilson et al., 2006, Kindrachuk et al., 2008, Dorn and Kippenberger, 2008, Vollmer and Krieg, 2009, Wilson et al., 2009). Ряд обзорных статей посвящен противоинфекционным применениям CpG-ODN (Krieg 2007), применению агонистов TLR9 в лечении злокачественной опухоли (Krieg, 2007, Weiner, 2009), активации TLR9 для лечения астмы и аллергии (Kline, 2007, Kline and Krieg, 2008, Fonseca and Kline, 2009) и применению в качестве адъювантов вакцины (Klinman et al., 2004, Klinman, 2006, Daubenberger, 2007, Wagner, 2009, Mutwiri et al., 2009, Klinman et al., 2009).
CpG ODN также описывали и обсуждали в качестве иммуностимулирующих средств и адъювантов вакцин при ветеринарном применении, в частности у крупного рогатого скота, свиней, овцы, собак, курицы и рыбы (Babiuk et al., 2003, Carrington and Secombes, 2006, Griebel et al., 2005, Mutwiri et al., 2003, Singh and O’Hagan, 2003, Werling and Jungi, 2003).
В области ветеринарного применения у кур описано применение олигодезоксинуклеотидов CpG, например, в вакцинах для защиты кур от болезни Ньюкасла (Linghua, 2007).
В настоящее время показано, что у курицы TLR21 действует как функциональный гомолог TLR9 млекопитающих при распознавании олигодезоксинуклеотидов CpG (Brownlie et al., 2009).
Конструирование конкретных CpG ODN в качестве иммуномодуляторов до сих пор являлось достаточно случайным. Это особенно относится к CpG ODN немлекопитающих. Причина этого является многофакторной; во-первых, не существует знаний о корреляции между иммуномодулирующими мотивами CpG для TLR человека и для TLR у не относящегося к человеку виду, не учитывая немлекопитающие виды. Во-вторых, не существует доступных клеточных систем с достаточно низким фоновым уровнем по отношению к уровню шума для избирательного тестирования эффектов очень низких концентраций CpG ODN. Кроме того, не существует доступных высокопроизводительных способов скрининга, и даже если они существуют, то не существует четкой корреляции между эффективностью in vivo по сравнению с in vitro CpG ODN в качестве иммуномодуляторов у немлекопитающих видов.
Таким образом, очевидно, что существует потребность в новых CpG ODN, которые обладают более высоким иммуномодулирующим действием и, таким образом, являются эффективными в низких дозах. Также существует необходимость в системах выбора избирательных и чувствительных CpG ODN для ветеринарных целей, для которых показана корреляция между in vitro и in vivo активностью CpG.
Одной из задач настоящего изобретения является предоставление таких новых CpG ODN.
В этом аспекте один из вариантов осуществления настоящего изобретения относится к иммуностимулирующему неметилированному олигодезоксинуклеотиду с общей формулой 5’[N1]x[N7]r{N3[N4]pCG[N5]qN6}n[N8]s[N2]z3’, где каждый N1 независимо представляет собой C или G, каждый N2 независимо представляет собой C или G, N3 представляет собой T, C или G при условии, что исключена комбинация, где N3 и N4 оба представляют собой C, каждый N4 и N5 независимо представляют собой C или T, N6=A, T, G или C, N7=A, T, C или G, N8=A, T, C или G, x=3-10, z=0-10, n=2-100, p=1-6 или 1-25, если N4=T, q=1-6 или 1-25, если N5=T, r=0-8 или 1-25, если N7=T, и s=0-8 или 1-25, если N8=T, или фармацевтически приемлемой соли указанного олигодезоксинуклеотида.
"Иммуностимулирующий неметилированный олигодезоксинуклеотид" относится к олигодезоксинуклеотиду, который содержит неметилированную динуклеотидную последовательность цитидин-фосфат-гуанозин, которая стимулирует инициацию сигнальных каскадов, приводящих к активации факторов транскрипции, таких как NF-kB или фактор регуляции интерферона 3 (IRF3). Именно эта активация в свою очередь приводит к экспрессии воспалительных цитокинов и других событий клеточной активации. Участки связывания NF-kB и экспрессия генов под влиянием NF-kB в том числе описаны Schindler and Baichwal (1994).
Термин олигодезоксинуклеотид означает короткий полимер нуклеиновой кислоты дезоксинуклеотидов, т.е. молекулу, содержащую большое число дезоксирибоз, связанных с фосфатной группой и взаимозаменяемым органическим основанием. Такое органическое основание представляет собой замещенный пиримидин или замещенный пурин. Примерами являются цитозин и тимин, соответственно аденин и гуанин.
Олигонуклеотиды по изобретению могут содержать модификации. Примеры таких модификаций представляют собой, например, модификации в фосфодиэфирный межнуклеозидный мостик, расположенный на 3’- и/или 5’-конце нуклеозида. Такие модификации относятся, в том числе, к замене фосфодиэфира, например, фосфотиоатом или фосфодитиоатом.
Другие модификации представляют собой, например, замену фосфодиэфирного мостика дефосфомостиком. Примеры дефосфомостиков представляют собой метилгидроксиламинные, формацетальные и диметиленсульфоновые группы.
Другие модификации представляют собой модификации, которые относятся к замене природного нуклеозидного основания искусственным нуклеозидным основанием, таким как 5-фторцитозин, 7-деаза-7-замещенный гуанин, 7-деаза-8-замещенный гуанин, 2-тиоурацил, дигидроурацил, 5-бромцитозин, 6-замещенные цитозины, N4-замещенные цитозины.
Другие модификации представляют собой модификации, касающиеся замены сахарного звена, β-рибозного сахарного звена или β-D-2’-рибозного сахарного звена модифицированным сахарным звеном, таким как, например, L-2’-дезоксирибоза или 2’-L-арабиноза.
Пособием, дающим дополнительное представление о олигонуклеотидах, является, например, "PCR Primer: A Laboratory Manual", Second Edition, 2003, Edited By Carl W. Dieffenbach, National Institute of Allergy and Infectious Diseases, Gabriela S. Dreksler, Uniformed Services University of the Health Sciences, Cold Spring Harbor Laboratory Press ISBN2 978-087969654-2.
Структура {N3[N4]pCG[N5]qN6}n, несущая мотив CpG, представляет собой активную иммуностимулирующую составную группу ODN по изобретению. Таким образом, настоящее изобретение относится к иммуностимулирующим олигодезоксинуклеотидам, которые содержат эту так называемую "основную цепь".
Выявлено, что основная цепь олигодезоксинуклеотида по изобретению структуры {N3[N4]pCG[N5]qN6}n должен содержаться по меньшей мере два раза, предпочтительно три раза. Таким образом, n должно равняться по меньшей мере двум. Также выявлено, что активность олигодезоксинуклеотидов увеличивается при увеличении n. Этот эффект выравнивается при увеличении n. В основном число n структуры основной цепи, таким образом, должно оставлять по меньшей мере 2. Предпочтительно диапазон n составляет 3≤n≤100, лишь вследствие того факта, что чем длиннее синтетическая последовательность, тем более трудно ее получать. В практическом осуществлении предпочтительно диапазон n составляет 2≤n≤18. Более предпочтительно диапазон n составляет 3≤n≤18, даже более предпочтительно диапазон n составляет 4≤n≤18, еще даже более предпочтительно диапазон n составляет 5≤n≤18.
Определение CpG ODN по изобретению стало возможным, в том числе с использованием более избирательной системы детекции по сравнению с системами, используемыми в настоящее время для детекции активации NF-kB. Brownlie at al. (2009) описали репортерную систему NF-kB на основе люциферазы. Другие системы основаны, например, на измерении транскрипта IL-8 или секреции цитокинов, или детекции секреции NO.
В отличие от этого, в настоящем изобретении использовали систему детекции на основе секретируемой щелочной фосфатазы (SEAP). SEAP представляет собой репортерный фермент в системах млекопитающих (Yang et al., 1997). Оказалось, что эта система является неожиданно чувствительной и, кроме того, неожиданно обеспечивает близкую корреляцию между in vitro и in vivo активностями тестируемых CpG ODN. Систему SEAP использовали с пара-нитрофенилфосфатом (pNPP) в качестве субстрата.
Другим улучшением по сравнению с существующими системами являлось введение и стабильное поддержание в клетках плазмиды, несущей ген SEAP. До настоящего времени во все системах детекции использовали транзиентную трансфекцию клеток с репортерным геном. Вследствие введения и стабильного поддержания в клетках репортерного гена впервые в настоящее время можно построить кривую доза-эффект. Такая кривая является обязательной, если необходимо проводить достоверное сравнение между активностями различных CpG ODN.
Таким образом, способы и клеточные линии, подробно описанные в разделе примеры, по настоящему изобретению позволяют впервые проводить достоверное параллельное сравнение между различными CpG ODN.
Дополнительное подробное описание используемой системы приведено в разделе примеры.
Вследствие того, что настоящие способы и клеточные линии теперь позволяют проводить такие достоверные параллельные сравнения между различными CpG ODN, возможно было определить, что олигодезоксинуклеотид по изобретению, где N6= A, T или C, обладает наиболее высоким уровнем активности, чем когда N6=G. Таким образом, в предпочтительной форме такого варианта осуществления N6= A, T или C.
По той же причине в другой предпочтительной форме N3 представляет собой T или G и N6=Y (Y=C или T).
В более предпочтительной форме этого варианта осуществления N3, N4, N5 и N6=T.
Другая предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N3, N4 и N5=T и N6=C.
Еще одна другая предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N3 представляет собой G и N6=T.
Другая предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N5=T и N6=C.
Также предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N5=C, N6=C и q=1.
Другая предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N4=Y и N5=Y.
Более предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N4=T и N5=Y.
Даже более предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где N4=T и N5=T.
Другая форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где x представляет собой 4-7 и r=0, или N7 представляет собой A или T.
Предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где x представляет собой 6 и r=0, или N7 представляет собой A или T.
Другая форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где z представляет собой 0-6 и s=0, или N8 представляет собой A или T.
Предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотиду по изобретению, где z представляет собой 0-3 и s=0, или N8 представляет собой A или T.
В еще другой форме этого варианта осуществления N1 представляет собой G.
В предпочтительной форме этого варианта осуществления N2 представляет собой G.
Хотя существует широкий диапазон для обоих количеств 3’- и 5’-концевых нуклеотидов, выявлено, что существует оптимальный диапазон для обоих значений. Выявлено, что, если s=0, или N8 представляет собой A или T, то количество [N2] нуклеотидов, которое образует 3’-фланкирующую область основной цепи олигодезоксинуклеотида по изобретению, предпочтительно находится в диапазоне от 0 до 5 нуклеотидов, более предпочтительно от 0 до 3 нуклеотидов.
Также выявлено, что, если r=0, или N7 представляет собой A или T, то количество [N1] нуклеотидов, которые образуют 5’-фланкирующую область основной цепи олигодезоксинуклеотида по изобретению, является оптимальным в диапазоне от 4 до 7 нуклеотидов.
В наиболее предпочтительной форме этого варианта осуществления r=0, или N7 представляет собой A или T и s=0, или N8 представляет собой A или T и n=5-18, и x=4-7, и z=0-3.
Как указано выше, возможны различные виды модификаций в фосфодиэфирных межнуклеозидных мостиках, расположенных на 3-’ и/или 5’-конце нуклеозида. Но в основном в зависимости от способа синтеза обычные распространенные типы связей между двумя нуклеотидами представляют собой: фосфодиэфирные (PDE) связи и фосфотиоатные (PTO) связи. С целью улучшения стабильности и иммуностимулирующего действия CpG ODN элементарные звенья синтетических олигодезоксинуклеотидов предоставлены с фосфотиоатами, таким образом, что они формируют PTO связи.
Неожиданно выявлено, однако, что, когда только [N1] нуклеотиды и [N2] нуклеотиды связаны PTO связями и другие нуклеотиды связаны PDE связями, эффективность олигодезоксинуклеотида по изобретению значительно увеличивается (В таких случаях связь N1 с N7 (GT) является PTO, тогда как связь N8 с N2 (TG) является PDE).
Это особенно относится к случаю, когда [N1] и [N2] нуклеотиды представляют собой G.
Таким образом, другая предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотидам по изобретению, где N1 и/или N2 имеют фосфотиоатную связь, другие нуклеотиды имеют фосфодиэфирную связь.
Выявлено, что для олигодезоксинуклеотидов по изобретению получают даже более эффективный олигодезоксинуклеотид, когда N7=T и N8=T.
Таким образом, другая предпочтительная форма этого варианта осуществления относится к олигодезоксинуклеотидам по изобретению, где N7=T и N8=T. В этом случае r и s независимо находятся в диапазоне 1-25.
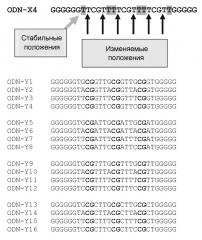
Не является необходимым, чтобы основная цепь олигодезоксинуклеотидов по изобретению, структура {N3[N4]pCG[N5]qN6}n, являлась идентичной для каждого n. Это значит, что олигодезоксинуклеотид по изобретению может выглядеть, в том числе как такой: {TTCGTT}{CTCGTG}{GTCGTA}. Такие серии трех различных последовательных различных основных цепей будут обозначены как гетерополимер. Участок трех идентичных копий будет называться гомополимером.
Предпочтительно олигодезоксинуклеотид по изобретению содержит гомополимер {N3[N4]pCG[N5]qN6}.
Олигодезоксинуклеотиды CpG по изобретению являются в большинстве случаев активными в наномолярных количествах как в тестовой системе in vitro, так и in vivo. Однако некоторые олигодезоксинуклеотиды CpG по изобретению являются активными даже в пикомолярных (субнаномолярных) количествах, их EC50 составляет ниже 1нМ.
Полумаксимальная эффективная концентрация (EC50) олигодезоксинуклеотида представляет собой количество олигодезоксинуклеотида, которое является необходимым для индукции количества репортерного фермента SEAP (который продуцирует окрашенный продукт, поглощающий при 405 нм) в репортерных клетках (HEK293-pNifty2-chicken TLR21 или HD11-pNifTy2Hyg), которое даст половину максимального поглощения. Если EC50 олигодезоксинуклеотида составляет менее 1нМ в этих клетках, считают, что он является активным в пикомолярных (субнаномолярных) количествах.
Показано, что многие из CpG ODN, которые соответствуют одной из четырех приведенных ниже общих формул, инициируют эффект in vitro в наномолярных количествах:
1) 5’[G]x{TTCGTN6}n[G]z3’, где N6=A или T, n=5-100, x=3-10, z=0-10
2) 5’[G]x{N3TCGTC}n[G]z3’, где N3=G или T, n=5-100, x=3-10, z=0-10
3) 5’[G]x{TTCGCC}n[G]z3’, где n=5-100, x=3-10, z=0-10
4) 5’[G]x{T[T]pCG[T]qT}n[G]z3’, где p=1-10, q=1-10, n=5-100, x=3-10, z=0-10
Для всех этих четырех формул по причинам эффективности n предпочтительно находится в диапазоне 5-18. X предпочтительно находится в диапазоне 4-9, 5-8, 6 или 7 в порядке предпочтения, и z предпочтительно представляет собой 8, 7, 6, 5, 4, 3, 2, 1 или 0 в порядке предпочтения. Где применимо p предпочтительно находится в диапазоне 1-5, и q предпочтительно находится в диапазоне 1-5.
Вполне возможно связывать олигодезоксинуклеотид по изобретению с носителем или гаптеном через реактивную химическую группу. Такое связывание усиливает иммуностимулирующее действие объединенных молекул.
Простые примеры таких компонентов представляют собой, например, дигоксигенин, аминогексил, техасский красный и биотин. Предпочтительные носители или гаптены представляют собой 3’- и 5’-меченный техасский красный и 5’-меченный дигоксигенин. В данной области хорошо известно связывание олигодезоксинуклеотидов с гаптенами/носителями.
Другой вариант осуществления изобретения относится к вектору, содержащему иммуностимулирующий неметилированный олигодезоксинуклеотид по изобретению. Такой вектор может представлять собой молекулу нуклеиновой кислоты, такую как плазмида, вирус, бактериофаг или любой другой используемый в молекулярной биологии вектор. Лишь в качестве примера: вектор, содержащий иммуностимулирующий неметилированный олигодезоксинуклеотид, например, может представлять собой молекулу ДНК, такую как плазмида, которую можно размножать в бактериях, в которые клонирован иммуностимулирующий неметилированнвй олигодезоксинуклеотид по изобретению. Такая плазмида предпочтительно содержит активный участок начала репликации, обуславливающий содержание большого количества плазмиды в хозяине. Выращивание таких бактерий в большом масштабе с последующим выделением плазмиды представляет собой альтернативу синтетическому способу получения иммуностимулирующего неметилированного олигодезоксинуклеотида по изобретению.
Одной из целей по настоящему изобретению является предоставление новых CpG ODN, которые можно использовать в качестве эффективных иммуностимулирующих компонентов в вакцинах, которые предотвращают или борются с инфекционным заболеванием, совместно с антигенным компонентом или генетической информацией, кодирующей антигенный компонент, и фармацевтически приемлемым носителем.
В основном термин антигенный компонент относится к композиции определенного состава, содержащей по меньшей мере один эпитоп, который может индуцировать, стимулировать или усиливать иммунный ответ при введении человеку или животному.
Антигенный компонент может представлять собой любые виды антигенного компонента, но предпочтительно выделенные из микроорганизма или вируса, который в своей форме дикого типа является патогенным для людей или животных.
Антигенный компонент может представлять собой целый патоген, предпочтительно в инактивированной или аттенуированной форме, экстракт патогена или иммуногенный белок патогена.
Если антигенный компонент представляет собой иммуногенный белок патогена, такой иммуногенный белок предпочтительно экспрессируется и его выделяют из культивируемых клеток in vitro.
Таким образом, другой вариант осуществления относится к вакцине для предотвращения или борьбы с инфекционным заболеванием, отличающейся тем, что указанная вакцина содержит иммуностимулирующее количество олигодезоксинуклеотида по изобретению и/или вектор по изобретению, иммуногенное количество антигенного компонента или генетической информации, кодирующей антигенный компонент, и фармацевтически приемлемый носитель.
Разумеется, что иммуностимулирующее количество олигодезоксинуклеотида и иммуногенное количество антигенного компонента строго взаимосвязаны. Одно из преимуществ настоящего изобретения заключается в том, что содержание олигодезоксинуклеотида по изобретению может снижать количество антигенного компонента, что является необходимым для предотвращения или борьбы с инфекционным заболеванием.
Количество антигенного компонента, которое является необходимым для предотвращения или борьбы с инфекционным заболеванием, называется иммуногенным количеством антигенного компонента.
Иммуностимулирующее количество олигодезоксинуклеотида представляет собой количество, которое способно уменьшать иммуногенное количество антигенного компонента, т.е. количество антигенного компонента, которое является необходимым для предотвращения или борьбы с инфекционным заболеванием.
Таким образом, в основном формулировки "иммуностимулирующее количество олигодезоксинуклеотида" и "иммуногенное количество" следует рассматривать относительно друг друга.
Само собой разумеется, что, если вакцина содержит генетическую информацию, кодирующую антигенный компонент, то количество антигенного компонента, экспрессируемого этой генетической информацией, должно быть достаточным для предотвращения или борьбы с инфекционным заболеванием, т.е. оно должно представлять собой иммуногенное количество.
Тот факт, что неметилированные олигодезоксинуклеотиды по изобретению являются иммуностимулирующими, означает, что они усиливают иммунологическую эффективность антигенных компонентов в вакцинах. По этой причине вакцины по изобретению во многих случаях содержат меньше антигенного компонента или генетической информации, кодирующей антигенный компонент, что является случаем, если олигодезоксинуклеотиды по изобретению не содержатся.
В некоторых случаях антигенный компонент, такой как без добавления иммуностимулирующих олигонуклеотидов, может обладать такими низкими иммунногенными свойствами, что следует вводить большие количества в любом случае, тем не менее, без получения желаемого иммуногенного уровня. В таких случаях антигенный компонент может содержаться в обычной высокой концентрации, однако теперь совместно с олигодезоксинуклеотидом по изобретению для получения, таким образом, желаемого уровня иммуногенности.
Таким образом, количество антигенного компонента или генетической информации, кодирующей антигенный компонент, которое следует вводить с олигонуклеотидом по изобретению, как правило, эмпирически равно или ниже количества, данного при отсутствии олигонуклеотида. Специалисту, принимающему участие в получении конкретных вакцин, известно такое количество для конкретной вакцины. Также в примерах приведено, например, подробное руководство о количестве антигенных компонентов, которое необходимо использовать, например, в трех различных инактивированных вирусных вакцинах: вакцине против вируса болезни Ньюкасла, вакцине против вируса инфекционного бронхита и вакцине против ринотрахеита индеек.
Количество олигодезоксинуклеотида по изобретению, которое необходимо вводить совместно с антигенным компонентом или генетической информацией, кодирующей антигенный компонент, зависит от выбранного олигодезоксинуклеотида и антигенного компонента.
Очень подходящее количество олигодезоксинуклеотида по изобретению, как правило, варьирует от 1 до 100 наномоль. Например, очень хорошие результаты получали in vivo с 1-10 мкг олигодезоксинуклеотидов по изобретению со средней длиной 30 дезоксинуклеотидов, для которых было показано, что они являются активными в тестах in vitro в наномолярном диапазоне.
Если олигодезоксинуклеотид выбран из группы олигодезоксинуклеотидов, которые являются активными в пикомолярном диапазоне, специалисту, будет понятно, что до тестирования наномолярных количеств следует тестировать количества ниже, возможно значительно ниже 1 наномоля, т.е. пикомолярные количества.
Вакцины по изобретению содержат фармацевтически приемлемый носитель. Природа такого носителя зависит, в том числе от пути введения. Если способ введения проводят через пероральный или интраназальный путь, носитель может являться таким простым как стерильная вода, раствор физиологической соли или буфер. Если предпочтительным путем введения инъекция, то носитель предпочтительно является изотоническим и имеет ограничения pH, которые делают его подходящим для инъекции. Тем не менее, некоторые такие носители широко известны в данной области.
Вакцины по изобретению в дополнение к антигенному компоненту или генетической информации, кодирующей антигенный компонент, и олигодезоксинуклеотиду по изобретению могут содержать адъювант. Адъюванты в основном представляют собой вещества, которые усиливают иммунный ответ хозяина неспецифическим образом.
Многие известные в данной области адъюванты являются подходящими, такие как полный и неполный адъювант Фрейнда, витамин E, неионные блокполимеры и полиамиды, такие как сульфат декстрана, карбопол и пиран, гидроксид алюминия. Также часто используемыми являются фосфат алюминия, сапонины, растительные масла, такие как токоферол и минеральные масла. Очень часто используемые эффективные адъюванты представляют собой эмульсии "масло-в-воде" и особенно эмульсии "вода-в-масле", далее также обозначаемые как адъюванты типа масло-в-воде и адъюванты типа вода-в-масле. Такие эмульсии хорошо известны в данной области. Таким образом, предпочтительно вакцина содержит адъювант типа вода-в-масле.
Предпочтительно антигенный компонент представляет собой, или его получают из вируса или микроорганизма, который в своей форме дикого типа является патогенным для птичьих.
Более предпочтительно указанные вирус или микроорганизм выбраны из группы, состоящей из вируса инфекционного бронхита, вируса болезни Ньюкасла, инфекционного бурсита (Гумборо), вируса анемии кур, птичьего реовируса, Mycoplasma gallisepticum, вируса ринотрахеита индеек, Haemophilus paragallinarum (ринита), поксвируса кур, вируса энцефаломиелита птиц, вируса синдром снижения яйценосности, вируса инфекционного ларинготрахеита, вируса герпеса индеек, видов Eimeria, Ornithobacterium rhinotracheale, Pasteurella multocida, Mycoplasma synoviae, видов Salmonella и Escherichia coli.
В другом варианте осуществления настоящее изобретение относится к иммуностимулирующему неметилированному олигодезоксинуклеотиду по изобретению для применения в качестве лекарственного средства.
В другом варианте осуществления настоящее изобретение относится к иммуностимулирующему неметилированному олигодезоксинуклеотиду по изобретению для применения при предотвращении или борьбе с инфекционным заболеванием у птичьих.
До настоящего времени во всех системах детекции использовали транзиентную трансфекцию клеток репортерным геном. Такая транзиентная система не обеспечивала достоверного параллельного сравнения эффективности CpG ODN. Как указано выше, основное усовершенствование в отношении существующих систем представляло собой введение и стабильное поддержание в клетках несущей репортерный ген плазмиды. Стабильное означает, что плазмида сохраняется в клетках после нескольких циклов клеточного деления.
Часто стабильное поддержание плазмиды получают выращиванием клеток под воздействием одного или более селективных средств, таких как антибиотики, ген устойчивости к которым содержится в плазмиде. Потеря плазмиды в дальнейшем вызывала бы гибель клетки, потерявшей плазмиду. Оставшиеся живые клетки все еще содержали бы плазмиду.
Таким образом, еще один другой вариант осуществления настоящего изобретения относится к клетке, содержащей рецептор TLR21 и плазмиду, кодирующую репортерный ген NF-kB, где плазмида является стабильно поддерживаемой в клетке. Такие клетки являются очень пригодными для использования в скрининге молекул CpG, более конкретно в скрининге молекул CpG по изобретению.
В примерах приведено подробное руководство о том, как получать такую клетку, содержащую плазмиду, кодирующую репортерный ген, который может стабильно поддерживаться в клетке.
Как указано выше, также показано, что системы детекции в зависимости от секретируемой щелочной фосфатазы (SEAP) очень подходят для используемой системы детекции.
Таким образом, предпочтительно репортерный ген представляет собой ген, кодирующий секретируемую щелочную фосфатазу.
В основном любая клетка или клеточная линия, несущая TLR21, которая обеспечивает введение и предпочтительно стабильное поддержание плазмиды, несущей репортерный ген NF-kB, предпочтительно ген SEAP, как описано выше, является подходящей для тестирования CpG ODN, специфичных к TLR21.
Предпочтительный пример такой подходящей клеточной линии для тестирования специфичных к TLR21 CpG ODN представляет собой клеточная линия HD11 курицы.
Таким образом, предпочтительно клеточная линия для применения в системе детекции представляет собой клеточную линию HD11, содержащую стабильную плазмиду, кодирующую репортерный ген.
Клеточные линии курицы, такие как клеточная линия HD11, предоставляют целый набор TLR курицы. Они могут при определенных условиях генерировать определенную фоновую активность.
Таким образом, клеточные линии, не относящиеся к птичьим, такие как клеточные линии млекопитающего, являются более предпочтительными клеточными линиями. Примером такой клеточной линии млекопитающего является клетка HEK293, в которую клонирован TLR21. Такая клеточная линия является более специфично избирательной для активирующих TLR21 сигналов.
Таким образом, более предпочтительно клеточная линия для применения в системе детекции представляет собой клеточную линию млекопитающего HEK293, содержащую стабильно поддерживаемый репортерный ген и в клетку HEK293 которой клонирован TLR21.
Еще один другой вариант осуществления настоящего изобретения относится к способу детекции иммуностимулирующих олигодезоксинуклеотидов по изобретению, где такой способ включает этапы a) контактирования олигодезоксинуклеотида с клеткой по изобретению, b) детекцию уровня продукции репортерного гена.
В предпочтительной форме этого способа продукт репортерного гена представляет собой SEAP.
Более предпочтительная форма этого варианта осуществления относится к способу детекции иммуностимулирующих олигодезоксинуклеотидов по изобретению, где клетка представляет собой клетку клеточной линии курицы HD11 или клеточной линии HEK293, в которую клонирован TLR21 курицы.
ПРИМЕРЫ
Пример 1
Клонирование гена и гетерологическая экспрессия TLR21 курицы
Современные достижения в исследовании TLR курицы позволяют предположить, что TLR21 представляет собой функциональный гомолог TLR9 млекопитающих у видов птиц (Keestra 2008, Brownlie et al., 2009).
План клонирования гена TLR21
На основании последовательности NM_001030558 базы данных Genbank синтезировали пару праймеров для полимеразной цепной реакции (ПЦР) амплификации гена TLR21 курицы:
Ga-TLR21-прямой 1
GAAGCTTACCATGATGGAGACAGCGGAGAAGGC
Ga-TLR21-обратный 1
GGCGGCCGCTACATCTGTTTGTCTCCTTCCCTG
Праймеры конструировали таким образом, чтобы предоставлять фланкирующие рестрикционные сайты клонирования (подчеркнутые) и последовательность Козака (выделено курсивом) для кодонов начала транскрипции и стоп-кодонов (выделено жирным). ОТ-ПЦР проводили с использованием этих праймеров и тотальной РНК из селезенки курицы в качестве матрицы. Продукт ПЦР ожидаемого размера (~ 3000 п.н.) клонировали в pCR2.1-Topo и секвенировали 5 независимых клонов плазмид (P1, P2, P12, P13, P14).
ДНК последовательность TLR21 курица, как использовали.
AAGCTT ACC ATG ATGGAGACAGCGGAGAAGGCATGGCCCAGCACCAGGATGTGCCCCTCCCACTGCTGTCCACTCTGGCTGCTGCTGCTGGTGACAGTGACACTGATGCCGATGGTGCACCCGTATGGCTTTCGCAACTGCATTGAGGATGTCAAGGCACCTTTGTACTTCCGCTGCATCCAGCGCTTCCTGCAGTCGCCGGCCCTGGCAGTGTCTGACCTGCCACCACATGCCATCGCGCTCAATCTGTCATACAACAAAATGCGCTGCCTGCAGCCCTCTGCCTTTGCCCACCTGACACAGCTGCATACCCTGGACCTGACCTACAACCTCCTGGAGACCCTCTCCCCTGGTGCCTTCAATGGGCTGGGTGTGCTGGTGGTGCTGGACCTGTCTCACAACAAGCTGACCACACTTGCTGAAGGGGTGTTCAACAGCTTGGGCAACCTGTCCTCGCTGCAGGTACAACATAACCCCCTCAGCACGGTGTCACCAAGTGCTCTGCTACCCCTGGTCAACCTGCGCCGCCTGTCTCTACGGGGCGGGCGGCTGAATGGGTTGGGGGCAGTGGCAGTGGCAGTGCAGGGCTTGGCACAGCTGGAGCTGTTGGACCTATGTGAAAACAACCTGACAACGCTGGGGCCAGGCCCACCGCTACCCGCCTCGCTGCTCACCCTGCAGCTGTGCAACAACTCGCTGAGGGAGTTAGCGGGGGGCAGCCCGGAGATGCTATGGCACGTGAAGATACTCGACCTCTCCTACAACAGTATCTCACAGGCGGAGGTCTTCACCCAGCTCCACCTGCGCAACATCAGCCTGCTCCACCTGATCGGCAACCCCTTGGATGTCTTCCACCTGTTGGACATCTCTGACATCCAACCTCGCAGCCTGGATTTCTCTGGGTTGGTGCTGGGGGCTCAGGGGCTGGATAAGGTGTGCCTGAGGCTGCAGGGTCCCCAGGCCTTGCGGCGGCTGCAGCTACAACGCAACGGGCTGAAGGTGCTGCATTGTAATGCACTGCAGTTGTGTCCTGTGCTGAGAGAGCTGGACCTGTCCTGGAACCGGCTACAGCACGTGGGCTGTGCCGGCCGGCTGCTGGGCAAGAAGCAGCGGGAGAAGCTGGAAGTGCTGACAGTGGAACACAACCTGCTGAAGAAACTGCCGTCTTGCCTGGGGGCCCAGGTGCTGCCTCGGCTGTACAACATTTCCTTCCGCTTTAACCGCATCCTGACTGTTGGGCCCCAAGCCTTTGCCTACGCCCCGGCCCTGCAGGTGTTGTGGCTCAATATTAACAGCCTGGTGTGGCTGGACAGGCAGGCACTGTGGAGGCTGCACAACCTGACAGAGCTGCGCCTGGACAACAACCTGCTGACCGACCTCTATCACAACTCCTTCATTGACCTCCACAGACTGCGCACCCTCAACCTGCGCAACAACCGTGTCTCCGTCCTCTTCTCTGGTGTCTTCCAGGGGCTGGCTGAGCTGCAGACGCTGGATTTAGGGGGCAACAACTTGCGCCACCTGACTGCACAGTCACTGCAGGGGCTGCCCAAACTGCGCAGGCTGTACCTGGACCGCAACAGATTGCTGGAGGTGAGCAGCACTGTGTTCGCCCCAGTGCAGGCTACCCTGGGGGTGCTGGACCTGCGGGCCAACAACCTGCAGTACATCTCACAGTGGCTGCGCAAGCCGCCACCCTTCCGCAACCTGAGCAGCCTGTACGACCTGAAGCTGCAGGCGCAGCAGCCCTATGGACTGAAGATGCTGCCTCACTACTTCTTCCAGGGCTTGGTGAGGCTGCAGCAGCTGTCGCTGTCACAGAACATGCTGCGGTCCATCCCACCGGATGTCTTCGAGGACTTGGGCCAGCTGCGCTCCCTGGCATTGGCTGACAGCAGCAATGGGCTGCATGACCTGCCTGACGGCATCTTCAGAAACCTGGGCAACCTGCGGTTCCTGGACCTGGAGAATGCAGGGCTGCACTCGCTCACTCTGGAAGTCTTCGGCAATCTCAGCCGGCTGCAGGTGCTGCACTTGGCCAGAAACGAGCTGAAGACCTTCAATGACAGCGTTGCCAGCCGGCTGTCCTCCTTGCGCTACCTGGACCTGCGCAAGTGTCCGCTCAGCTGCACCTGTGACAACATGTGGCTGCAGGGCTGGCTGAACAACAGCCGTGTGCAGGTTGTCTACCCCTACAACTACACCTGTGGCTCACAGCACAATGCCTACATCCACAGCTTTGACACACACGTCTGCTTCCTGGACCTGGGGCTCTATCTCTTTGCTGGGACTGCACCGGCAGTGCTGCTGCTGCTGGTGGTGCCGGTGGTGTACCACCGCGCCTACTGGAGGCTGAAGTACCACTGGTACCTTCTGCGGTGCTGGGTCAACCAGCGGTGGCGGCGGGAGGAAAAGTGCTACCTCTATGACAGCTTTGTGTCCTACAATTCAGCTGATGAAAGTTGGGTGTTGCAGAAGCTGGTGCCTGAGCTGGAGCACGGTGCCTTCCGCCTCTGCTTGCACCACCGCGACTTCCAGCCGGGCCGCAGCATCATTGACAACATTGTGGATGCTGTCTACAACAGCCGGAAGACGGTGTGCGTGGTGAGCCGCAGCTACCTGCGCAGCGAGTGGTGCTCTCTAGAGGTGCAGTTGGCCAGCTACCGGCTGTTGGATGAGCGGCGTGACATCCTGGTACTGGTGCTGCTGGAGGACGTGGGTGATGCTGAGCTGTCTGCCTACCACCGCATGCGGCGGGTGCTGCTGCGGCGCACCTACCTGCGCTGGCCTCTTGACCCCGCAGCTCAGCCGCTCTTTTGGGCACGGCTGAAGAGGGCACTGAGGTGGGGAGAGGGAGGAGAGGAGGAGGAAGAAGAAGGTTTGGGTGGAGGGACGGGAAGGCCCAGGGAAGGAGACAAACAGATG TAG CGGCCGC
Трансфекция клеток НЕК293-pNifTy2-Zeo (клональная клеточная линия) посредством pcDNA3.1 (+)-нео-chiTLR21
Эмбриональные клетки почки человека (HEK) 293 были получены в 1970-х годах посредством вирусной трансформации (Graham et al., 1977) и в настоящее время являются доступными для научного сообщества посредством хранилищ клеточных линий, таких как ATCC.
pNifty2 представляет собой плазмиду, которая обеспечивает детекцию активации фактора транскрипции NF-kB, которая является основной для многих иммуностимулирующих активаций, в том числе активации Toll-подобного рецептора. Репортерный ген в pNifTy2, транскрипция/трансляция которого зависит от активации NF-kB, представляет собой секретируемую щелочную фосфатазу (SEAP). Более подробно описано в инструкции компании поставщика этой плазмиды: Invivogen. События трансформации/трансфекции pNifty2 отбирали в бактериях и клетках млекопитающих добавлением в среды для выращивания зеоцина.
Клетки HEK293 трансфицировали pNifTy2 общепринятыми способами (липофекция), выбирали стабильную клеточную линию, функциональные свойства оси NF-kB/SEAP устанавливали стимуляцией фактором некроза опухоли α человека (Sigma). Секретируемую SEAP в супернатанте культуры стимулируемых клеток определяли колориметрическим анализом в планшете для микротитрования с использованием хромогенного субстрата пара-нитрофенилфосфата (pNPP, 5 мМ) в щелочном буфере (50 мМ NaHCO3, pH9,6, 2 мМ MgCl2). Развитие окраски (λ=405 нм) наблюдали посредством спектрофотометра для прочтения планшетов для микротитрования. Такое считывание показаний также использовали для отбираемых клональных линий (способом предельного разведения) с высокими отношениями сигнала к шуму. Один из этих отбираемых клонов (мо