Сочетанная терапия афукозилированным антителом к cd20 с антителом к vegf
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к комбинированной терапии афукозилированным антителом к CD20 и антителом к VEGF для лечения рака, что может быть использовано в медицине. Применяют афукозилированное гуманизированное антитело B-Ly1 в комбинации с антителом к VEGF, а также композицию, содержащую указанные антитела для терапии CD20-экспрессирующего рака и лечения пациента, страдающего от CD20-экспрессирующего рака. Изобретение позволяет эффективно ингибировать рост CD20-экспрессирующих опухолей. 3 н. и 7 з.п. ф-лы, 1 ил., 2 табл.
Реферат
Данное изобретение относится к комбинированной терапии афукозилированным антителом к CD20 с анти-VEGF-антителом для лечения рака.
Уровень техники
Афукозилированные антитела
Опосредованные клетками эффекторные функции моноклональных антител могут быть усилены путем инженерии их олигосахаридного компонента, как описано в Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180; и US 6602684. Антитела типа IgG1, наиболее часто используемые антитела в иммунотерапии рака, представляют собой гликопротеины, которые имеют консервативный N-связанный сайт гликозилирования на Asn297 в каждом домене СН2. Два сложных двухантенных олигосахарида, присоединенных к Asn297, скрыты между СН2-доменами, образуя обширные контакты с полипептидным остовом, и их присутствие имеет важное значение для антитела, чтобы опосредовать эффекторные функции, такие как антителозависимую клеточную цитотоксичность (ADCC) (Lifely, M.R., et al., Glycobiology 5 (1995) 813-822; Jefferis, R., et al., Immunol. Rev. 163 (1998) 59-76; Wright, A., and Morrison, S.L, Trends Biotechnol. 15 (1997) 26-32). В Umana, P., et al. Nature Biotechnol. 17 (1999) 176-180 и WO 99/54342 показано, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), гликозилтрансферазы, катализирующей формирование олигосахаридов с симметричным разветвлением, значительно увеличивает in vitro ADCC-активность антител. Изменения в составе N297-углевода или его ликвидация также влияет на связывание с FcγR и C1q (Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180; Davies, J., et al., Biotechnol. Bioeng. 74 (2001) 288-294; Mimura, Y., et al., J. Biol. Chem. 276 (2001) 45539-45547; Radaev, S., et al., J. Biol. Chem. 276 (2001) 16478-16483; Shields, R.L, et al., J. Biol. Chem. 276 (2001) 6591-6604; Shields, R.L, et al., J. Biol. Chem. 277 (2002) 26733-26740; Simmons, L.C., et al., J. Immunol. Methods 263 (2002) 133-147).
Сообщалось об исследованиях, обсуждающих активности афукозилированных и фукозилированных антител, в том числе анти-CD20-антител (например, Iida, S., et al., Clin. Cancer Res. 12 (2006) 2879-2887; Natsume, A., et al., J. Immunol. Methods 306 (2005) 93-103; Satoh, M., et al., Expert Opin. Biol. Ther. 6 (2006) 1161-1173; Kanda, Y., et al., Biotechnol. Bioeng. 94 (2006) 680-688; Davies, J., et al., Biotechnol. Bioeng. 74 (2001) 288-294).
CD20 и антитела к CD20
Молекула CD20 (также называемая человеческим В-лимфоцитарным антигеном дифференцировки или Вр35) представляет собой гидрофобный трансмембранный белок, находящийся на пре-В и зрелых В-лимфоцитах (Valentine, М.А., et al., J. Biol. Chem. 264 (1989) 11282-11287; и Einfeld, D.A., et al., EMBO J. 7 (1988) 711-717; Tedder, T.F., et al., Proc. Natl. Acad. Sci. U.S.A. 85 (1988) 208-212; Stamenkovic, I., et al., J. Exp. Med. 167 (1988) 1975-1980; Tedder, T.F., et al., J. Immunol. 142 (1989) 2560-2568). CD20 экспрессируется на более чем 90% В-клеток неходжкинских лимфом (non-Hodgkin’s lymphomas, NHL) (Anderson, K.C., et al., Blood 63 (1984) 1424-1433), но он не найден на гемопоэтических стволовых клетках, про-В-клетках, нормальных плазматических клетках или других нормальных тканях (Tedder, T.F., et al., J, Immunol. 135 (1985) 973-979).
Существует два различных типа анти-CD20-антител, значительно различающихся по характеру их связывания CD20 и биологическим активностям (Cragg, M.S., et al., Blood, 103 (2004) 2738-2743; и Cragg, M.S., et al., Blood, 101 (2003) 1045-1051). Антитела I типа, такие как ритуксимаб (нефукозилированное антитело с содержанием фукозы 85% или выше), являются мощными в отношении опосредованной комплементом цитотоксичности.
Антитела II типа, такие как антитела тозитумомаб (В1), 11В8, АТ80 или гуманизированное B-Ly1, эффективно инициируют смерть клетки-мишени путем каспаза-независимого апоптоза с сопутствующим высвобождением фосфатидилсерина.
Общие особенности анти-CD20-антител I и II типа приведены в таблице 1.
| Таблица 1 | |
| Свойства анти-CD20-антител I и II типа | |
| анти-CD20-антитела I типа | анти-CD20-антитела II типа |
| эпитоп CD20 I типа | эпитоп CD20 II типа |
| Локализация CD20 на липидных рафтах | Нет локализации CD20 на липидных рафтах |
| Увеличена CDC (при изотипе IgG1) | Уменьшена CDC (при изотипе IgG1) |
| Антителозависимая клеточная | Антителозависимая клеточная |
| цитотоксическая активность (при изотипе IgG1) | цитотоксическая активность (при изотипе IgG1) |
| Полная связывающая способность | Уменьшенная связывающая способность |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Индукция апоптоза при перекрестном сшивании | Сильная индукция клеточной гибели без перекрестного сшивания |
VEGF и антитела к VEGF
Человеческий фактор роста эндотелия сосудов (VEGF/VEGF-A) описан, например, в Leung, D.W., et al., Science 246 (1989) 1306-1309; Keck, P.J., et al., Science 246 (1989) 1309-1312, и Connolly, D.T., et al., J. Biol. Chem. 264 (1989) 20017-20024. VEGF участвует в регуляции нормального и патологического ангиогенеза и неоваскуляризации, которые связаны с опухолями и внутриглазными нарушениями (Ferrara, N., and Davis-Smyth, Т., Endocr. Rev. 18 (1997) 4-25; Berkman, R.A., et al., J. Clin. Invest. 91 (1993) 153-159; Brown, L.F., et al., Human Pathol. 26 (1995) 86-91; Brown, L.F., et al., Cancer Res. 53 (1993) 4727-4735; Mattern, J., et al., Brit. J. Cancer. 73 (1996) 931-934; и Dvorak, H., et al., Am. J. Pathol. 146 (1995) 1029-1039). VEGF представляет собой гомодимерный гликопротеин, который был выделен из нескольких источников. VEGF демонстрирует весьма специфическую митогенную активность по отношению к эндотелиальным клеткам. VEGF имеет важные регуляторные функции в формировании новых кровеносных сосудов во время эмбрионального васкулогенеза и ангиогенеза во взрослой жизни (Carmeliet, P., et al., Nature, 380 (1996) 435-439; Ferrara, N., et al., Nature, 380 (1996) 439-442; обзор в Ferrara, N. and Davis-Smyth, Т., Endocrine Rev., 18 (1997) 4-25). Значение роли, которую играет VEGF, было продемонстрировано в исследованиях, показывающих, что инактивация отдельной аллели VEGF приводит к эмбриональной летальности из-за неудачного развития сосудистой сети (Carmeliet, Р., et al., Nature 380 (1996) 435-439; Ferrara, N., et al., Nature 380 (1996) 439-442). Кроме того, VEGF имеет сильную активность хемоаттрактанта по отношению к моноцитам, может индуцировать активатор плазминогена и ингибитор активатора плазминогена в эндотелиальных клетках, а также может индуцировать проницаемость капилляров. Из-за последней активности его иногда называют фактором сосудистой проницаемости (VPF, vascular permeability factor). Выделение и свойства VEGF были рассмотрены; см. Ferrara, N., et al., J. Cellular Biochem. 47 (1991) 211-218, и Connolly, J. Cellular Biochem. 47 (1991) 219-223. Альтернативный сплайсинг мРНК одного гена VEGF дает до пяти изоформ VEGF.
Нейтрализующие анти-VEGF-антитела подавляют рост различных человеческих опухолевых клеточных линий у мышей (Kim, K.J., et al., Nature 362 (1993) 841-844; Warren, R.S., et al., J. Clin. Invest. 95 (1995) 1789-1797; Borgstrom, P., et al., Cancer Res. 56 (1996) 4032-4039; и Melnyk, O., et al., Cancer Res. 56 (1996) 921-924).
В одном воплощении анти-VEGF-антитела включают моноклональное антитело, которое связывается с тем же эпитопом, что и моноклональное анти-VEGF-антитело А4.6.1, продуцируемое гибридомой АТСС НВ 10709; рекомбинантное гуманизированное моноклональное анти-VEGF-антитело, полученное в соответствии с Presta, L.G. et al., Cancer Res. 57 (1997) 4593-4599, в том числе, но не ограничиваясь им, антитело, известное как «бевацизумаб (BV)», также известное как «rhuMAb VEGF» или «AVASTIN». Бевацизумаб содержит мутированные человеческие каркасные области из IgG1 и антигенсвязывающие области, определяющие комплементарность, из мышиного моноклонального анти-hVEGF-антитела А.4.6.1, которое блокирует связывание человеческого VEGF с его рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, в том числе большая часть каркасных областей, получено из человеческого IgG1, и примерно 7% последовательности получено из мышиного антитела А4.6.1. Бевацизумаб имеет молекулярную массу примерно 149000 дальтон и является гликозилированным. Бевацизумаб и другие гуманизированные анти-VEGF-антитела более подробно описаны в патенте США №6884879 от 26 февраля 2005 года. Дополнительные предпочтительные антитела включают антитела серии G6 или В20 (например, G6-23, G6-31, В20-4.1), описанные в публикации заявки РСТ № WO 2005/1012359. Дополнительные предпочтительные антитела см. в патентах США №№ US 7060269, US 6582959, US 6703020; US 6054297, WO 98/145332, WO 96/130046, WO 94/110202, EP 0666868 B1; публикациях патентных заявок США №№ US 2006009360, US 20050186208, US 20030206899, US 20030190317, US 20030203409, US 20050112126 и в Popkov., M. et al., Journal of Immunological Methods 288 (2004) 149-164. Они характеризуются связыванием с человеческим и мышиным VEGF; это является необходимым условием для изучения их эффективности на стимулированном мышиным muVEGF ангиогенезе на мышиных моделях. «Антитело серии G6» в соответствии с данным изобретением представляет собой анти-VEGF-антитело, которое получено из последовательности антитела G6 или G6-производного антитела, полученного в соответствии с одной из фиг.7, 24-26 и 34-35 из публикации заявки РСТ № WO 2005/1012359. «Антитело серии В20» в соответствии с данным изобретением представляет собой анти-VEGF-антитело, которое получено из последовательности антитела В20 или В20-производного антитела, полученного в соответствии с одной из фиг.27-29 из публикации заявки РСТ № WO 2005/1012359.
WO 94/10202, WO 98/45332, WO 2005/00900 и WO 00/35956 ссылаются на антитела против VEGF. Гуманизированное моноклональное антитело бевацизумаб (продается под торговой маркой Avastin®) представляет собой анти-VEGF-антитело, используемое в терапии опухолей (WO 98/45331).
Ранибизумаб (торговое название Lucentis®) представляет собой фрагмент моноклонального антитела, полученный из того же родительского мышиного антитела, что и бевацизумаб (Avastin). Он гораздо меньше родительской молекулы и обладает аффинностью, созревшей для обеспечения более сильного связывания с VEGF-A (WO 98/45331). Он является антиангиогенным средством, которое было одобрено для лечения «влажного» типа возрастной макулярной дегенерации (ARMD, age-related macular degeneration), распространенной формы возрастной потери зрения.
Другое анти-VEGF-антитело, например, В20-4.1 описано в WO 2005/012359 A3 в US 2007/0141065.
Другое анти-VEGF-антитело, например, HuMab G6-31, описано в WO 2005/012359 A3.
Имеются сообщения о доклинических и/или клинических исследованиях с использованием комбинации бевацизумаба с ритуксимабом и другими лекарственными препаратами (например, Ganjoo, K.N. et al., Leuk Lymphoma. 47 (2006) 998-1005; Ruan, J. et al., Annals of Oncology 20 (2009) 413-424).
Сущность изобретения
Мы уже выяснили, что комбинация афукозилированного анти-CD20-антитела с анти-VEGF-антителом показало синергетические антипролиферативные эффекты.
Изобретение включает применение афукозилированного анти-CD20-антитела с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 для изготовления лекарственного средства для лечения рака в комбинации с анти-VEGF-антителом.
Одним из аспектов изобретения является способ лечения пациента, страдающего от рака, путем введения афукозилированного анти-CD20-антитела с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 в комбинации с анти-VEGF-антителом пациенту, нуждающемуся в таком лечении.
Другим аспектом изобретения является афукозилированное анти-CD20-антитело с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 для лечения рака в комбинации с анти-VEGF-антителом.
В одном воплощении содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
В другом воплощении содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
В одном воплощении афукозилированное анти-CD20-антитело представляет собой IgG1-антитело.
В другом воплощении указанный рак представляет собой CD20-экспрессирующий рак, предпочтительно B-клеточную неходжкинскую лимфому (NHL), где в одном воплощении указанное анти-CD20-антитело является гуманизированным B-Ly1-антителом.
В одном воплощении указанное анти-VEGF-антитело представляет собой бевацизумаб, антитело серии В20 или антитело серии G6, в одном воплощении антитело серии В20, и в одном воплощении бевацизумаб.
В одном воплощении указанное афукозилированное анти-CD20-антитело является гуманизированным B-Ly1-антителом, а указанное анти-VEGF-антитело является бевацизумабом, антителом серии В20 или антителом серии G6, и указанный рак является CD20-экспрессирующим раком, в одном воплощении B-клеточной неходжкинской лимфомом (NHL).
В одном воплощении афукозилированное анти-CD20-антитело связывается с CD20 с KD от 10-8 М до 10-13 М.
Одно воплощение изобретения представляет собой композицию, содержащую афукозилированное анти-CD20-антитело с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (в одном воплощении афукозилированное гуманизированное B-Ly1-антитело) и анти-VEGF-антитело (в одном воплощении бевацизумаб или антитело серии В20) для лечения рака.
Описание графических материалов
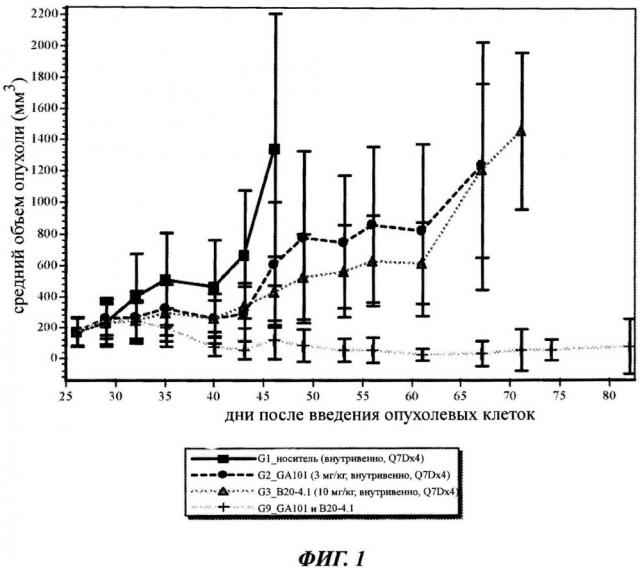
Фиг.1: Ингибирование роста опухоли in vivo у мышей с ксенотрансплантатом (клетками человеческой лимфомы SU-DHL-4); Сравнение анти-CD20-антитела (гликоинженерного гуманизированного B-Ly1 (B-HH6-B-KV1 GE=GA101)) и анти-VEGF-антитела В20-4.1, самостоятельно и в комбинации. Комбинация показывает синергетическое влияние на ингибирование роста опухоли.
Подробное описание изобретения
Изобретение включает применение афукозилированного анти-CD20-антитела изотипа IgG1 или IgG3 с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 для изготовления лекарственного средства для лечения рака в комбинации с анти-VEGF-антителом.
В одном воплощении содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
Термин «антитело» охватывает различные формы антител, в том числе, но не ограничиваясь ими, целые антитела, человеческие антитела, гуманизированные антитела и антитела, полученные путем генной инженерии, такие как моноклональные антитела, химерные антитела или рекомбинантные антитела, а также фрагменты таких антител до тех пор, пока сохраняются их характерные свойства в соответствии с изобретением. Используемые в данном документе термины «моноклональное антитело» или «композиция с моноклональным антителом» относятся к изготовлению молекул антитела единого аминокислотного состава. Соответственно, термин «человеческое моноклональное антитело» относится к антителам, демонстрирующим одинаковую специфичность связывания, которые имеют вариабельные и константные области, полученные из человеческих зародышевых последовательностей иммуноглобулина. В одном воплощении человеческие моноклональные антитела производят с помощью гибридомы, которая включает В-клетки, полученные из трансгенного, отличного от человека, животного, например из трансгенной мыши, с геномом, содержащим трансген человеческой тяжелой цепи и трансген человеческой легкой цепи, слитым с иммортализованной клеткой.
Термин «химерное антитело» относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида и по меньшей мере часть константной области, полученной из другого источника или вида, как правило полученному с помощью методик рекомбинантной ДНК. Особенно предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Такие мышиные/человеческие химерные антитела являются продуктом экспрессированных генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие вариабельные участки мышиного иммуноглобулина, и сегменты ДНК, кодирующие константные участки человеческого иммуноглобулина. Другими формами «химерных антител», охватываемыми данным изобретением, являются те, в которых класс или подкласс был модифицирован или изменен по сравнению с исходным антителом. Такие «химерные» антитела также называют «антителами с переключением класса». Способы получения химерных антител включают обычные методики рекомбинантной ДНК и генной трансфекции, в настоящее время хорошо известные в данной области. См., например, Morrison, S.L, et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; US 5202238 и US 5204244.
Термин «гуманизированное антитело» относится к антителам, в которых были изменены каркасные участки или «участки, определяющие комплементарность» (CDR, complementarity determining regions) так, чтобы они содержали CDR иммуноглобулина другой специфичности, отличной от родительского иммуноглобулина. В предпочтительном воплощении мышиный CDR прививают каркасному участку человеческого антитела для получения «гуманизированного антитела». См., например, Riechmann, L, et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Особенно предпочтительные CDR соответствуют тем из представленных последовательностей, которые распознают отмеченные выше антигены для химерных и бифункциональных антител.
Термин «человеческое антитело», используемый в данном документе, включает антитела с вариабельными и константными участками, полученными из человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела хорошо известны в данной области (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374). На основе такой технологии можно получить человеческие антитела против самых разнообразных мишеней. Примерами человеческих антител являются, например, описанные в Kellermann, S. A., et al., Curr Opin Biotechnol. 13 (2002) 593-597.
Термин «рекомбинантное человеческое антитело», используемый в данном документе, охватывает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, такие как антитела, выделенные из клетки-хозяина, такой как клетка NS0 или СНО, или животного (например, мыши), которое является трансгенным для человеческих генов иммуноглобулинов, или антитела, экспрессируемые с помощью рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельный и константный области, полученные из человеческих зародышевых иммуноглобулиновых последовательностей, в перегруппированной форме. Рекомбинантные человеческие антитела в соответствии с изобретением подвергали соматическому гипермутированию in vivo. Таким образом, аминокислотные последовательности участков VH и VL рекомбинантных антител являются последовательностями, которые, будучи полученными из и связанными с человеческими зародышевыми последовательностями VH и VL, не могут естественным образом существовать в наборе человеческих зародышевых антител in vivo.
Используемые в данном документе термины «связывание» или «специфическое связывание» относятся к связыванию антитела с эпитопом опухолевого антитела в анализе in vitro, предпочтительно в анализе плазменного резонанса (Biacore, GE-Healthcare, Упсала, Швеция) с очищенным антигеном дикого типа. Аффинность связывания определяется терминами ka (константа скорости ассоциации антитела из комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka). Связывание или специфическое связывание означает аффинность связывания (KD) 10-8 М или ниже, предпочтительно от 10-8 М до 10-13 М (в одном воплощении от 10-9 М до 10-13 М). Таким образом, афукозилированное антитело в соответствии с изобретением специфически связывается с опухолевым антигеном с аффинностью связывания (KD) 10-8 моль/л или ниже, предпочтительно от 10-8 М до 10-13 М (в одном воплощении от 10-9 М до 10-13 М).
Термин «нуклеиновокислотная молекула», используемый в данном документе, включает молекулы ДНК и РНК. Нуклеиновокислотная молекула может быть одноцепочечной или двуцепочечной, но предпочтительно является двуцепочечной ДНК.
«Константные домены» не участвуют непосредственно в связывании антитела с антигеном, но участвуют в эффекторных функциях (ADCC, реакция связывания комплемента и CDC).
Термин «вариабельный участок» (вариабельный участок легкой цепи (VL), вариабельный участок тяжелой цепи (VH)), используемый в данном документе, означает пару из легкой и тяжелой цепей, которая непосредственно участвует в связывании антитела с антигеном. Домены вариабельной человеческой легкой и тяжелой цепей имеют одинаковые общие структуры, и каждый домен содержит четыре каркасных участка (framework region, FR), последовательности которых в значительной степени консервативны, соединенные тремя «гипервариабельными участками» (или участками, определяющими комплементарность, CDR). Каркасные участки принимают конформацию b-листа, и CDR могут образовывать петли, связывающие структуру b-листа. CDR в каждой цепи удерживаются в их трехмерной структуре с помощью каркасных участков и образуют вместе с CDR из другой цепи антигенсвязывающий участок.
Термины «гипервариабельный участок» или «антигенсвязывающая часть антитела», используемые в данном документе, относятся к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельный участок содержит аминокислотные остатки из «участков, определяющих комплементарность», или «CDR». «Каркасными участками», или «FR», являются те участки вариабельного домена, которые отличаются от остатков гипервариабельных участков, определенных здесь. Таким образом, легкие и тяжелые цепи антитела содержат от N-конца к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В частности, CDR3 тяжелой цепи является участком, который вносит наибольший вклад в связывание антигена. Участки CDR и FR определены в соответствии со стандартной системой определения Кабата, Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или этими остатками из «гипервариабельной петли».
Термин «афукозилированное антитело» относится к антителу изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1) с измененной структурой гликозилирования в Fc-области на Asn297 с пониженным уровнем фукозных остатков. Гликозилирование человеческого IgG1 или IgG3 происходит на Asn297 как гликозилирование сердцевинного фукозилированного двухантенного сложного олигосахарида, заканчивающегося двумя остатками Gal. Эти структуры обозначаются как G0-, G1- (α1,6 или α1,3), или G2-гликанановые остатки в зависимости от количества концевых Gal-остатков (Raju, T.S., Bioprocess Int. 1 (2003) 44-53). Тип гликозилирования Fc-частей антитела в СНО описан, например, Routier, F.H., Glycoconjugate J. 14 (1997) 201-207. Антитела, которые рекомбинантно экспрессируются в негликомодифицированных клетках-хозяевах СНО, обычно фукозилированы на Asn297 в количестве по меньшей мере 85%. Следует понимать, что термин «афукозилированное антитело», используемый в данном документе, включает антитело, не имеющее фукозу в паттерне гликозилирования. Общеизвестно, что типичной позицией гликозилированного остатка в антителе является аспарагин в позиции 297 в соответствии с системой нумерации ЕС («Asn297»).
«Система нумерации ЕС» или «индекс ЕС» обычно используется, когда речь идет об остатке в константной области тяжелой цепи иммуноглобулина (например, индекс ЕС, о котором сообщается в сообщении Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), специально включенном в данный документ посредством ссылки).
Таким образом, афукозилированное антитело в соответствии с изобретением означает антитело изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), в котором количество фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (что означает, что по меньшей мере 40% или более олигосахаридов Fc-области на Asn297 являются афукозилированными). В одном воплощении содержание фукозы составляет от 40% до 60% олигосахаридов Fc-области на Asn297. В другом воплощении содержание фукозы составляет 50% или менее, и в еще одном воплощении содержание фукозы составляет 30% или менее от олигосахаридов Fc-области на Asn297. В соответствии с изобретением «количество фукозы» означает количество указанного олигосахарида (фукозы) в олигосахаридной (сахарной) цепочке на Asn297, связанное с суммой всех олигосахаридов (сахаров), присоединенных к Asn297 (например, сложных, гибридных и высокоманнозных структур), которое измеряется масс-спектрометрией MALDI-TOF и рассчитывается как среднее значение (подробный порядок определения количества фукозы, см., например, в WO 2008/077546). Кроме того, в одном воплощении олигосахариды в Fc-области имеют симметричное разветвление. Афукозилированное антитело в соответствии с изобретением может быть экспрессировано в гликомодифицированной клетке-хозяине, созданной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид с активностью GnTIII, в количестве, достаточном для частично фукозилированных олигосахаридов в Fc-области. В одном воплощении полипептид с активностью GnTIII является гибридным полипептидом. Альтернативно α1,6-фукозилтрансферазная активность клетки-хозяина может быть уменьшена или устранена в соответствии с US 6946292 для создания гликомодифицированных клеток-хозяев. Степень фукозилирования антитела может быть предопределена, например, в ферментативных условиях (например, по времени ферментирования) или при комбинации по меньшей мере двух антител с различной степенью фукозилирования. Такие афукозилированные антитела и соответствующие гликоинженерные способы описаны в WO 2005/044859, WO 2004/065540, WO2007/031875, Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180, WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739. Эти гликоинженерные антитела обладают повышенной ADCC. Другие гликоинженерные способы, дающие афукозилированные антитела в соответствии с изобретением, описаны, например, в Niwa, R., et al., J. Immunol. Methods 306 (2005) 151-160; Shinkawa, Т., et al., J Biol Chem, 278 (2003) 3466-3473; WO 03/055993 или US 2005/0249722.
Таким образом, одним из аспектов изобретения является применение афукозилированного анти-CD20-антитела изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), специфически связывающегося с CD20 с содержанием фукозы 60% или менее от общего числа олигосахаридов (сахаров) на Asn297, для изготовления лекарственного средства для лечения рака в комбинации с анти-VEGF-антителом. Предпочтительно содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
CD20 (также известный как B-лимфоцитарный антиген CD20, B-лимфоцитарный поверхностный антиген В1, Leu-16, BP35, ВМ5 и LF5; последовательность характеризуется записью в базе данных SwissProt P11836) представляет собой гидрофобный трансмембранный белок с молекулярной массой примерно 35 кДа, расположенный на пре-В и зрелых В-лимфоцитах (Valentine, M.A. et al., J. Biol. Chem. 264 (1989):11282-11287; Tedder, T.F., et al., Proc. Natl. Acad. Sci. U.S.A. 85 (1988) 208-212; Stamenkovic, I., et al., J. Exp. Med. 167 (1988) 1975-1980; Einfeld, D.A., et al., EMBO J. 7 (1988) 711-717; Tedder, T.F., et al., J. Immunol. 142 (1989) 2560-2568). Соответствующий человеческий ген относится к гену, который имеет 4 домена, пронизывающих мембрану, подсемейству А, члену 1, также известному как MS4A1. Этот ген кодирует члена семейства генов, пронизывающих мембрану, 4А. Члены этого возникающего семейства белков характеризуются общими структурными особенностями и похожими границами сплайсинга интронов/экзонов и демонстрируют уникальный характер экспрессии среди гемопоэтических клеток и нелимфоидных тканей. Этот ген кодирует В-лимфоцитарную поверхностную молекулу, которая играет важную роль в развитии и дифференциации В-клеток в плазматические клетки. Этот член семейства локализуется в 11q12, среди кластера членов семейства. Альтернативный сплайсинг этого гена приводит к двум вариантам транскрипции, которые кодируют один и тот же белок.
Термины «CD20» и «CD20-антиген» используются в данном документе как взаимозаменяемые и включают в себя любые варианты, изоформы и виды гомологов человеческого CD20, которые естественным образом экспрессируются клетками или экспрессируются на клетках, трансфицированных геном CD20. Связывание антитела изобретения с антигеном CD20 опосредует уничтожение клеток, экспрессирующих CD20 (например, опухолевой клетки) путем инактивации CD20. Уничтожение клеток, экспрессирующих CD20, может осуществляться по одному или более чем одному из следующих механизмов: клеточная гибель/индукция апоптоза, ADCC и CDC.
Синонимы CD20, принятые в данной области, включают B-лимфоцитарный антиген CD20, B-лимфоцитарный поверхностный антиген В1, Leu-16, Bp35, BM5 и LF5.
Термин «анти-CD20 антитело» в соответствии с изобретением обозначает антитело, которое специфически связывает CD20-антиген. В зависимости от связывающих свойств и биологической активности анти-CD20-антител с CD20-антигеном можно различать два типа анти-CD20-антител (тип I и тип II анти-CD20-антител) в соответствии с Cragg, M.S., et al., Blood 103 (2004) 2738-2743; и Cragg, M.S., et al Blood 101 (2003) 1045-1051, см. таблицу 2.
| Таблица 2 | |
| Свойства анти-CD20-антител I и II типа | |
| анти-CD20-антитела I типа | анти-CD20-антитела II типа |
| эпитоп CD20 I типа | эпитоп CD20 II типа |
| Локализация CD20 на липидных рафтах | Нет локализации CD20 на липидных рафтах |
| Увеличена CDC (при изотипе IgG1) | Уменьшена CDC (при изотипе IgG1) |
| Антителозависимая клеточная цитотоксическая активность (при изотипе IgG1) | Антителозависимая клеточная цитотоксическая активность (при изотипе IgG1) |
| Полная связывающая способность | Уменьшенная связывающая способность |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Индукция апоптоза при перекрестном сшивании | Сильная индукция клеточной гибели без перекрестного сшивания |
Примеры анти-CD20 антител II типа включают, например, гуманизированное антитело B-Ly1 IgG1 (химерное гуманизированное антитело IgG1, описанное в WO 2005/044859), 11В8 IgG1 (описанное в WO 2004/035607) и АТ80 IgG1. Обычно анти-CD20-антитела II типа изотипа IgG1 демонстрируют характерные CDC-свойства. Анти-CD20-антитела II типа имеют пониженную CDC (при изотипе IgG1) по сравнению с антителами I типа изотипа IgG1.
Примеры анти-CD20-антител I типа включают, например, ритуксимаб, HI47 IgG3 (ЕСАСС, гибридома), 2С6 IgG1 (описанное в WO 2005/103081), 2F2 IgG1 (описанное в WO 2004/035607 и WO 2005/103081) и 2Н7 IgG1 (описанное в WO 2004/056312).
Афукозилированные анти-CD20-антитела в соответствии с изобретением представляют собой в одном воплощении анти-CD20-антитело типа II, в другом воплощении афукозилированное гуманизированное антитело B-Ly1.
Афукозилированные анти-CD20-антитела в соответствии с изобретением проявляют повышенную антителозависимую клеточную цитотоксичность (ADCC) в отличие от анти-CD20-антител, не имеющих пониженного содержания фукозы.
Под используемым в данном документе термином «афукозилированное анти-CD20-антитело, имеющее повышенную антителозависимую клеточную цитотоксичность (ADCC)» понимается афукозилированное антитело с повышенной ADCC, что определяется любым подходящим способом, известным специалистам в данной области. Одним из принятых анализов ADCC in vitro является следующий:
1) анализ использует клетки-мишени, о которых известно, что они экспрессируют целевой антиген, распознаваемый антигенсвязывающим участком антитела;
2) в качестве эффекторных клеток анализ использует мононуклеарные клетки периферической крови человека (peripheral blood mononuclear cells, PBMC), выделенные из крови случайно выбранных здоровых доноров;
3) анализ проводится в соответствии со следующим протоколом:
I) PBMC выделяют с использованием стандартных процедур центрифугирования по плотности и суспендируют в количестве 5×106 клеток/мл в культуральной клеточной среде RPMI;
II) клетки-мишени выращивают с использованием стандартных способов культивирования тканей, собирают в экспоненциальной фазе роста с жизнеспособностью более 90%, промывают культуральной клеточной средой RPMI, метят 100 мкКюри 51Cr, дважды промывают культуральной клеточной средой и ресуспендируют в клеточной культуральной среде с плотностью 105 клеток/мл;
III) 100 мкл конечной клеточной суспензии переносят в каждую лунку 96-луночного микротитровального планшета;
IV) антитело серийно разводят от 4000 нг/мл до 0,04 нг/мл в клеточной культуральной среде, и 50 мкл полученных растворов антитела добавляют к клеткам-мишеням в 96-луночном микротитровальном планшете, тестируя в трех повторах различные концентрации антитела, охватывающие весь спектр концентраций;
V) для контроля максимального высвобождения (maximum release, MR) в три дополнительные лунки в планшете с мечеными клетками-мишенями вносят по 50 мкл 2% (VN) водного раствора неионогенного поверхностно-активного вещества (Nonidet, Sigma, St. Louis) вместо раствора антитела (п. IV выше);
VI) для контроля спонтанного высвобождения (spontaneous release, SR) в три дополнительные лунки в планшете с мечеными клетками-мишенями вносят по 50 мкл клеточной культуральной среды RPMI вместо раствора антитела (п. IV выше);
VII) затем 96-луночный микротитровальный планшет центрифугируют при 50g в течение 1 минуты и инкубируют в течение 1 часа при 4°С;
VIII) 50 мкл суспензии PBMC (п. V выше) добавляют в каждую лунку для получения отношения эффекторные клетки: клетки-мишени, равного 25: 1, и помещают планшеты в инкубатор в атмосферу с 5% CO2 при 37°С на 4 часа;
IX) из каждой лунки собирают бесклеточный супернатант и с помощью гамма-счетчика оценивают экспериментальный выброс радиоактивных веществ (experimentally released radioactivity, ER);
x) процент специфического лизиса рассчитывают для каждой концентрации антитела по формуле (ER-MR)/(MR-SR)×100, где ER представляет собой среднюю радиоактивность, подсчитанную (см. п. IX выше) для данной концентрации антитела, MR представляет собой среднюю радиоактивность, подсчитанную (см. п. IX выше) для контроля MR (см. п. V выше), a SR представляет собой среднюю радиоактивность, подсчитанную (см. п. IX выше) для контроля SR (см. п. VI выше);
4) «повышенная ADCC» определяется или как увеличение максимального процента специфического лизиса, наблюдаемого в диапазоне концентраций антитела, описанном выше, и/или как снижение концентрации антитела, необходимой для достижения половины максимального процента специфического лизиса, наблюдаемого в диапазоне концентраций антитела, описанном выше. Повышение ADCC соотносится с ADCC, измеренной в описанном выше анализе при посредничестве того же антитела, которое было получено с помощью того же типа клеток-хозяев с использованием тех же стандартных способов получения, очистки, составления и хранения, которые хорошо известны специалистам в данной области, но которое не было получено с помощью клеток-хозяев, созданных для сверхэкспрессии GnTIII.
Указанная «повышенная ADCC» может быть получена с применением гликотехнологии к указанным антителам, это означает повышение указанных естественных клеточно-опосредованных эффекторных функций моноклональных антител путем разработки их олигосахаридного компонента, как описано в Umana, Р. et al., Nature Biotechnol. 17:176-180 (1999) и US 6602684.
Термин «комплемент-зависимая цитотоксичность (CDC)» относится к лизису человеческих опухолевых клеток-мишеней с помощью антитела в соответствии с изобретением в присутствии комплемента. CDC измеряют предпочтительно путем обработки препарата клеток, экспрессирующих CD20, антителом анти-CD20 в соответствии с изобретением в присутствии комплемента. CDC считается найденной, если антитело в концентрации 100 нМ в течение 4 часов индуцирует лизис (клеточную гибель) 20% или более опухолевых клеток. Анализ проводят предпочтительно с опухолевыми клетками, мечеными 51Cr или Eu, и измеряют высвобождение 51Cr или Eu. Для контроля проводят инкубацию опухолевых целевых клеток с комплементом, но без антитела.
Антитело «ритуксимаб» (референсное антитело; пример анти-CD20-антитела I типа) является генно-инженерным химерным моноклональным антителом, содержащим человеческий гамма 1 и мышиный константный домен, направленным против человеческого антигена CD20. Это химерное антитело содержит человеческие гамма-1 константные домены и называется «С2В8» в US 5736137 (Andersen et. al.), изданном 17 апреля 1998 года при IDEC Pharmaceuticals Corporation. Ритуксимаб одобрен для лечения пациентов с рецидивирующей или рефракторной, низкой степени злокачественности или фолликулярной, CD20-положительной B-клеточной неходжкинской лимфомой. Исследования механизма действия in vitro показали, что ритуксимаб демонстрирует человеческую комплемент-зависимую цитотоксичность (CDC) (Reff, M.E., et. al., Blood 83 (1994) 435-445). Кроме того, он проявляет значительную активность в анализах, которые измеряют антителозависиму