Диагностическая система для выявления днк провирусов лейкоза и иммунодефицита крупного рогатого скота методом мультиплексной полимеразной цепной реакции
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики вирусных болезней животных. Описан способ выявления ДНК провируса лейкоза и иммунодефицита крупного рогатого скота методом мультиплексной ПЦР. Также описан набор для осуществления этого способа, содержащий две пары прямых и обратных олигонуклеотидных праймеров для выявления провирусов энзоотического лейкоза и иммунодефицита крупного рогатого скота. Предложенная группа изобретений может быть использована в научных исследованиях и ветеринарии. 2 н.п. ф-лы, 5 ил., 3 табл., 2 пр.
Реферат
Изобретение относится к области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики вирусных болезней животных для одновременного обнаружения провирусов лейкоза и иммунодефицита крупного рогатого скота в лимфоцитах крови животных методом мультиплексной полимеразной цепной реакции (ПЦР) и может быть использовано в научных исследованиях.
Семейство Retroviridae включает два патогенных для крупного рогатого скота (КРС) вируса: Bovine immunodeficiency virus (BIV) и Bovine leukemia virus (BLV). Ретровирусные инфекции КРС широко распространены в мире. В эндемичных регионах инфицированность животных ретровирусами значительна и постоянно увеличивается. Согласно мировым исследованиям, инфицированность молочных стад в Японии составляет 79.1% (Sota Kobayashi, Toshiyuki Tsutsui, Takehisa Yamamoto, Yoko Hayama, Ken-ichiro Kameyama, Misako Konishi, Kenji Murakami. Risk factors associated with within-herd transmission of bovine leukemia virus on dairy farms in Japan // Veterinary Research. - 2010. - 6), в Алматинской области доходит до 75,2% (К.Н. Мукантаев, К.К. Муканов, А.В. Шустов, К. Турсунов, Ш. Байдосова Современные аспекты серологической диагностики энзоотического лейкоза крупного рогатого скота // Биотехнология. Теория и практика. №3 2012. - С. 3-15).
Вирус иммунодефицита действует как иммуносупрессор, снижая устойчивость животных к другим инфекциям и инвазиям, так как поражает центральное звено иммунной системы - Т-хелперы. Возбудитель энзоотического лейкоза также угнетает иммунную систему, так как паразитирует в мононуклеарах крови, поражая преимущественно В-лимфоциты. В результате резко снижаются адаптивные возможности организма, специфическая и неспецифическая резистентности, что неизбежно приводит к развитию патологического процесса (Вирусология Т. 1: Пер. с англ. / Под ред. Б. Филдса, Д. Найпа, при участии Р. Ченока, Б. Ройзмана, Дж. Мелника, Р. Шоупа. - М.: Мир, 1989. - 492 с.).
Часто данные возбудители обнаруживаются у одного и того же животного в виде микстинфекции (Ларионова О.С., Красников А.В., Утанова Г.Х. Анализ инфицированности крупного рогатого скота ретровирусными инфекциями в Саратовской области // Аграрный научный журнал. №2/2015. С. 17-19.). По мнению ряда исследователей, это является следствием того, что энзоотический лейкоз крупного рогато скота (ЭЛ КРС) является BIV-ассоциированной инфекцией, при этом коинфекция обоими ретровирусами значительно усугубляет тяжесть течения заболевания и значительно снижает качество продукции животноводства (Snider TG, Luther DG, Jenny BF, Hoyt PG, Battles JK, Ennis WH, Balady J, Blas-Machado U, Lemarchand TX, Gonda MA. Encephalitis, lymphoid tissue depletion and secondary diseases associated with bovine immunodeficiency virus in a dairy herd. Comp Immunol Microbiol Infect Dis. 1996 Feb; 19(2): 117-131.; Snider, T.G., D.G. Luther, B.F. Jenny, P.G. Hoyt, J.K. Battles, W.H. Ennis, J. Balady, U. Blas-Machado, Т.X. Lemarchand, and M.A. Gonda. 1996. Encephalitis, lymphoid tissue depletion and secondary diseases associated with bovine immunodeficiency virus in a dairy herd. Сотр. Immunol. Microbiol. Infect. Dis. 19: 117-131).
Распространение ретровирусных инфекций среди скота приводит к значительному экономическому ущербу, складывающемуся из снижения количества и качества молочной и мясной продукции, падежа или вынужденного убоя животных, недополучения молодняка, а также потери его племенной ценности и ограничения в реализации, затрат на проведение противоэпизоотических мероприятий и обеззараживание молока (Галеев Р.Ф., Хусаинов Р.Ф. Лейкоз крупного рогатого скота. Уфа: Издательство «Новый стиль». 2009 г. - 220 с.).
Наиболее часто ретровирусы поражают высокопродуктивных молочных коров. Из-за возможности инфицирования клеток человека BLV - вирусом лейкоза крупного рогатого скота молоко от клинически больных лейкозом коров запрещено для питания (Buehring, G.C. Humains have antibodies reactive with Bovine Leukemia virus // G.C. Buehring, S.M. Philpott, K.Y. Choi // AIDS. Res. Hum. Retroviruses, 2003. V. 19. - P. 1105-1113). Молоко от носителей нельзя давать детям, оно разрешено к переработке только после обеззараживания (Правила по профилактике и борьбе с лейкозом крупного рогатого скота, Приказ Минсельхозпрода РФ от 11.05.1999 N 359).
При инфицировании крупного рогатого скота вирусом энзоотического лейкоза организм отвечает на заражение специфической реакцией - образованием антител, сроки выявления которых зависят от дозы вируса, а также от индивидуальных особенностей иммунной системы. Первые антитела могут быть обнаружены через 3-16 недель после заражения (Воробьев А.Л., Антюхов В.М. Лейкоз КРС: диагностика и проблемы оздоровления // Передовые технологии: Ветеринарная медицина http://borona.net/hight-technologies/veterinary/Lejkoz_KRS_diagnostika_i_problemy_ozdorovlenija.html).
У большинства отелившихся инфицированных коров снижается титр сывороточных антител на фоне высоких титров защитных иммуноглобулинов в молозиве. Восстановление происходит в основном через 14-30 суток, однако у 10% из этих животных сероконверсия может отсутствовать до 3 месяцев (Greinex М., Gardner I.A. Epidemiologic issues in the validation of veterinary diagnostic tests // Prev. Vet. Med. - 2000. - 45. - P. 3-22).
Возбудители энзоотического лейкоза и вирусного иммцнодефицита крупного рогатого скота обладают интегративным типом взаимодействия с клеткой, вирусы персистируют в организме пожизненно в виде провирусов, интегрированных в геном лимфоцитов хозяина, при этом свободные зрелые вирионы или их антигены, как правило, отсутствуют, что делает возбудителей «невидимыми» для иммунной системы, следовательно, индукции иммунного ответа может не быть (Супотницкий М.В. Эволюционная патология. К вопросу осмеете ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. - Москва: Вузовская книга, 2009. - 400 с.).
Метод ПЦР направлен на обнаружение ДНК возбудителя в исследуемом материале, что позволяет выявлять и исключать из эпизоотической цепи не только больных животных, но и латентных носителей вируса. Метод ПЦР обладает высокой чувствительностью и специфичностью, подходит для рутинной диагностики благодаря возможности автоматизации. Универсальность постановки реакции позволяет осуществлять многопараметрический анализ одного и того же объекта, например выявлять одновременно вирус лейкоза и иммунодефицита в лимфоцитах периферической крови животных (мультиплексная ПЦР). Специфичность метода ПЦР определяют праймеры - олигонуклеотиды, комплементарные части уникального и наиболее консервативного фрагмента вирусного генома. В случае применения мультиплексной ПЦР, к структуре праймеров предъявляют следующие требования:
- комплементарность выбранному фрагменту;
- отсутствие взаимо- и самокомплементарности;
- GC-состав ~ 40-60%;
- близкие температуры плавления праймеров;
- близкие температуры отжига праймеров;
- формирование ампликонов, отличающихся по размеру для каждой пары праймеров.
Известен способ диагностики лейкоза крупного рогатого скота, включающий выявление положительно реагирующих в реакции иммунодиффузии животных, гематологический метод исследования, у инфицированных животных определение процентного содержания Т-лимфоцитов методом спонтанного розеткообразования с эритроцитами барана (патент RU №2465588, опубликован 27.10.2012 г.).
Недостатками данного метода являются трудоемкость, многооперационность, невозможность обнаруживать латентных носителей вируса лейкоза - BLV и выявлять при этом животных, инфицированных BIV - возбудителем вирусного иммунодефицита крупного рогатого скота.
Известен способ определения антител к BIV и BLV в сыворотки крови животных методом ТИФА (твердофазный иммуноферментный анализ), основанный на обнаружении специфического комплекса антиген-антитело с помощью цветной реакции вследствие ферментирования субстрата энзимом, связанным с коньюгатом (L. Zheng, М. Swanson, J. Liao, С. Wood, S. Kapil, R. Snider, T.A. Loughin, and H.C. Cloning of the Bovine Immunodeficiency Virus gag Gene and Development of a Recombinant-Protein-Based Enzyme-Linked Immunosorbent Assay. Minocha Clin Diagn Lab Immunol. 2000 July; 7(4): 557-562; Gutierrez G., Alvarez I., Fondevila N., Politzki R., Lomornaco M., Rodriguez S., Dus Santos M.J., Trono Veterinary K. Detection of bovine leukemia virus specific antibodies using recombinant p24-ELISA // Microbiology. - 2009. - №137. - P. 224-234).
Недостатками метода являются невысокая информативность на ранних этапах заражения и в период физиологического изменения иммунологической реактивности организма, а также невозможность одновременного исследования на лейкоз и иммунодефицит КРС.
Известен способ обнаружения провирусов BIV и BLV в крови животных методом «гнездной» ПЦР, основанный на использовании 2-х пар праймеров при выявлении каждого из провирусов: «внешние» для первой амплификации и «внутренние» для второй амплификации (Brujeni GN, Poorbazargani ТТ, Nadin-Davis S, Tolooie M, Barjesteh N. Bovine immunodeficiency virus and bovine leukemia virus and their mixed infection in Iranian Holstein cattle.J Infect Dev Ctries. 2010 Oct 4; 4(9): 576-9).
Недостатками метода являются высокий риск контаминации образцов, реактивов, помещения и оборудования лаборатории образующимися ампликонами при проведении двухэтапной амплификации, многостадийность анализа и невозможность одновременного выявления BIV и BLV провирусов.
Известен способ тестирования вируса лейкоза КРС у крупного рогатого скота и в мясомолочных продуктах питания, включающий выделение ДНК (или получение кДНК), амплификацию с использованием флуоресцентно меченых праймеров BLV-F9 (5'AAAGACTCGCCAGACGCCT) и BLV-R8 (5'ATTGGGGATGAGATCTGCAA) и TaqMan-зонда BLV-PR2 (5'AAGACTCGCCAGACGCCTTCG), тестирование продуктов амплификации с помощью электрофоретического анализа или измерения уровня флуоресценции на флуориметре «Джин» (заявка на изобретение RU №2012144762, опубликована 27.04.2014 г.).
Недостатками метода являются необходимость использования флуоресцентной метки, что приводит к удорожанию анализа, снижению срока годности реактивов и необходимости использовать дополнительное оборудование для учета результатов, а также невозможность одновременного выявления провирусов BIV и BLV из-за неспецифичности праймеров для BIV.
Наиболее близким к заявленному изобретению является патент RU №2445370 от 28.10.2010, опубликован 20.03.2012 г., в котором для выявления провируса лейкоза крупного рогатого скота используют прямой и обратный олигонуклеотидные праймеры следующей структуры - PF2: 5'-TGA ACG GAC AAA TGG ACT GCT C-3'; PR2: 5'-CCG АСА GAG AGC GAG GAG AG-3', у которых отсутствуют самокоплементарные участки внутри каждого праймера и между прямым и обратным, температура отжига составляет 66°С для обоих олигонуклеотидов, GC состав - 50% для PF2 и 65% для PR2, и которые фланкируют область консервативного гена pol вируса лейкоза крупного рогатого скота размером 438 пар нуклеотидов. Полимеразную цепную реакцию проводят в объеме реакционной смеси - 25 мкл на 1 пробу ДНК следующего состава: буфер ПЦР (15 мМ MgCl) 5 мкл, дНТФ(10 мМ) 1 мкл, праймер PF2 (10 пмоль/мкл) 1 мкл, праймер PR2(10 пмоль/мкл) 1 мкл, полимераза Taq (5 ед./мкл) 0,2 мкл, вода (бидистиллированная) 11,8 мкл, проба ДНК 5 мкл. Температурно-временной режим проведения реакции для амплификатора «Терцик» («ДНК-технология», Россия): 95°С - 3 минуты; 94°С - 20 секунд, 62°С - 30 секунд, 72°С - 1 минута (цикл повторить 35 раз); 72°С - 3 минуты; 10°С - хранение. Проводят электрофоретическое определение размера амплифицируемого фрагмента нуклеотидной последовательности.
Но данный способ не может быть использован для выявления одновременно провируса иммунодефицита и лейкоза КРС из-за неспецифичности праймеров для BIV, что приводит к затратам времени и реактивов на проведение дополнительных исследований.
Технической задачей является разработка быстрого, высокоспецифичного и чувствительного, не дорогостоящего способа одновременного обнаружения ДНК провирусов энзоотического лейкоза и вирусного иммунодефицита крупного рогатого скота методом мультиплексной ПЦР путем формирования реакционной смеси, подбора условий для проведения ПЦР с ней, включающего минимальное количество манипуляций, что снижает риск контаминации в лаборатории при проведении анализа.
Технический результат заявляемого изобретения заключается в формировании реакционной смеси, включающей две пары специфических олигонуклеотидных праймеров, комплементарных один - участку консервативной области генома BIV, другой - консервативной области генома BLV, и подбора условий проведения мультиплексной ПЦР с ними. Это обеспечивает максимальную информативность, чувствительность и специфичность метода, минимизацию контаминации в лаборатории, а также возможность одновременно выявлять оба патогена.
Техническая задача решается, а технический результат достигается за счет одновременного использования двух пар прямых и обратных олигонуклеотидных праймеров для выявления провируса лейкоза КРС (pBLVf и pBLVr) и провируса иммунодефицита КРС (pBIVf и pBIVr), у которых отсутствуют самокоплементарные участки внутри каждого праймера и между прямым и обратным, проведения ПЦР в объеме реакционной смеси 25 мкл на 1 пробу ДНК и электрофоретического определения размера амплифицируемого фрагмента нуклеотидной последовательности. При этом праймеры отличаются тем, что имеют следующий нуклеотидный состав (5'-3'-):
pBLVf - TATTCCACCCTCGCAAGGC и
pBLVr - GGGCAGTTGATCCAGAGTCGT;
pBIVf - GTCTTCCCACATCCGTAACATCTCCT и
pBIVr - CCCCAGGTCCCATCAACATTCATCAG,
температура отжига составляет 58°С для обоих пар олигонуклеотидов, GC состав - 50,5% для BIV и 56,5% для BLV, и фланкируют область консервативного гена tax провируса лейкоза КРС (pBLVf и pBLVr) размером 609 пар нуклеотидов (п.н.) и область консервативного гена gag провируса иммунодефицита КРС (pBIVf и pBIVr) размером 382 п.н. Реакционная смесь отличается тем, что имеет следующий состав: буфер 10-кратный для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,4 мкл, праймеры pBLVf, pBLVr, pBIVf и pBIVr (10 пмоль/мкл) по 1 мкл, Taq полимераза (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 1,5 мкл, бидистиллированной воды - 11,4 мкл и пробы ДНК - 5 мкл. При этом амплификацию проводят в следующем режиме: тотальная денатурация 95°С - 3 мин, цикл денатурация (95°С - 20 или 60 сек) - отжиг (58°С - 20 или 60 сек) - элонгация (72°С - 40 или 60 сек), причем цикл денатурация - отжиг - элонгация повторяется 35 раз, заключительная элонгация 72°С - 5 мин. А при проведении гельэлектрофореза по наличию или отсутствию ампликонов длиной 382 п.н. для BIV и 609 п.н. - для BLV судят о наличии или отсутствии провирусов в лимфоцитах крови КРС.
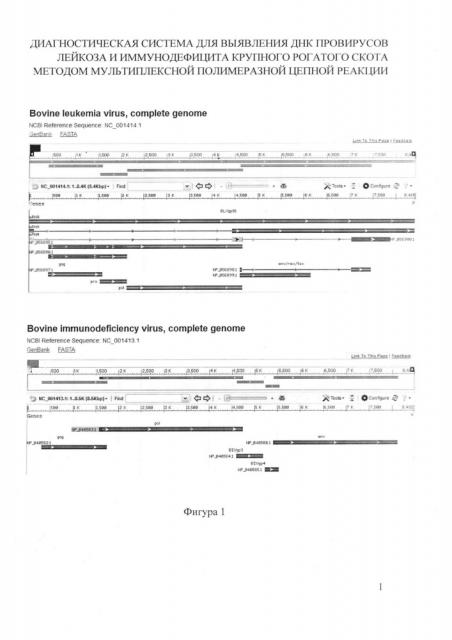
На фигуре 1 представлена схема строения геномов BIV и BLV.
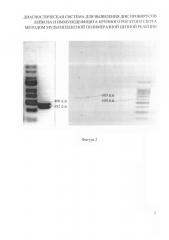
На фигуре 2 представлена электрофореграмма результатов определения размера продуктов амплификации при применении каждой из пар праймеров в отдельности с использованием маркера молекулярных масс с шагом 100 b.
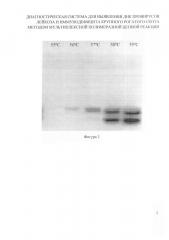
На фигуре 3 представлена электрофореграмма результатов подбора оптимальной температуры отжига для совместной работы двух пар праймеров в одной системе.
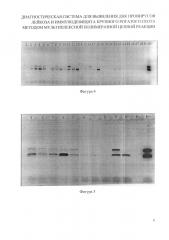
На фигуре 4 представлена электрофореграмма результатов исследования ДНК, полученной из лимфоцитов крови КРС разработанным способом.
На фигуре 5 представлена электрофореграмма результатов исследования тотальной ДНК периферической крови КРС разработанным способом.
Разработка способа диагностики вирусного иммунодефицита и лейкоза КРС осуществлялись в три этапа:
1. Подбор оптимально сочетающихся между собой двух пар праймеров.
2. Моделирование состава реакционной смеси для разрабатываемой диагностической системы.
3. Подбор условий температурно-временного режима проведения мультиплексной ПЦР.
1. Подбор оптимально сочетающихся между собой двух пар праймеров
Выбор пар праймеров осуществляли на основании анализа зарубежных и отечественных литературных источников. Проверку качества и термодинамический анализ праймеров выполняли с помощью программ OLIGO DNA/RNA primer analysis software, v. 5.0. (http.V/molbiol-tools.ca/molecular_biology_freeware.htm#Primer%20design) и BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) с использованием полногеномных сиквенсов BIV и BLV и их фрагментов, размещенных на ресурсе NCBI (http://www.ncbi.nlm.nih.gov/genome/?term=). Геномы BIV и BLV имеют размер ~ 8,4 kb и содержат три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5'-gag-pol-env-3'. Дополнительно геном BLV содержит регуляторные гены pol, rex и tax, геном BIV - гены BIVgp3 и BIVgp4 (Фиг. 1). При этом основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри праймеров и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига и плавления праймеров.
На основании проведенного литературного поиска и компьютерного анализа были отобраны две пары праймеров: pBLVf и pBLVr (Panei CJ1, Serena MS, Metz GE, Bravi ME, González ET, Echeverría MG. Analysis of the pX region of bovine leukemia virus in different clinical stages of Enzootic Bovine Leukemia in Argentine Holstein cattle. Virus Res. 2013 Jan; 171 (1): 97-102. doi: 10.1016/j.virusres.2012.08.001. Epub 2012 Nov 16); pBIVf и pBIVr (Колотвин В.В. Вирус иммунодефицита крупного рогатого скота: индикация инфекции и распространенность в хозяйствах Российской Федерации: автореферат диссертации на соискание ученой степени кандидата биологических наук. - Москва, 2007 г.), характеристики которых приведена в таблице 1.
Отобранные две пары олигонуклеотидных праймеров полностью соответствуют требованиям, предъявляемым к праймерам для мультиплексной ПНР: комплементарны выбранному фрагменту ДНК соответствующего провируса; имеют оптимальные размер, структуру и GC-состав; у них отсутствует взаимо- и самокомплементарность; температуры отжига и плавления праймеров близкие; продукты амплификации каждой пары праймеров отличаются по размеру. Как показано на электрофореграмме, ампликоны при применении праймеров pBIVf и pBIVr находятся чуть ниже уровня 400 п.н., при применении праймеров pBLVf и pBLVr - чуть выше уровня 600 п.н., что соответствует расчетным размерам ампликонов: 382 и 609 п.н. соответственно (Фиг. 2).
2. Моделирование состава реакционной смеси для разрабатываемой диагностической системы
Выделение и очистку нуклеиновых кислот из лимфоцитов крови КРС осуществляли методом нуклеосорбции на силикогеле с использованием набора «ДНК-сорб-В» (ООО ИнтерЛабСервис, Россия). ШГР - проводили в объеме реакционной смеси - 25 мкл на 1 пробу. Состав реакционной смеси представлен в таблице 2.
Состав реакционной смеси подбирали таким образом, чтобы концентрация ионов MgCl2 обеспечивала оптимальную скорость и точность работы фермента Taq-полимеразы, а концентрация дНТФ, праймеров и объем пробы способствовали повышению специфичности реакции. При использовании амплификатора с крышкой без нагрева, на смесь наслаивали 20 мкл минерального масла для ПЦР. При использовании амплификатора с нагревающейся крышкой, минеральное масло не использовали.
3. Подбор условий температурно-временного режима проведения мультиплексной ПЦР
Проведение ПЦР с использованием отобранных праймеров осуществляли на амплификаторах «АМПЛИ 4» («Биоком», Россия) и «Т100» («BioRad», США). Температурно-временной режим проведения реакции для амплификаторов представлен в таблице 3.
Для амплификаторов с активным регулированием температуры, по раствору в пробирке, например «Т100», время прохождения всех этапов амплификации (денатурация-отжиг-элонгация) короче, чем для амплификатора с матричным регулированием температуры, например «АМПЛИ 4». При 59°С и 58°С заметны две полосы в треке, причем при 58°С они одинаковые по ширине и интенсивности, а при 59°С полосы имеют разную ширину. Это свидетельствует о различной интенсивности работы праймеров в системе. При 57°С и 56°С заметна лишь полоса на уровне ампликона BLV, а при 55°С трек не содержат ни одной полосы. Оптимальной для работы обоих пар праймеров оказалась температура отжига 58°С (Фиг 3).
Учет осуществляли методом гельэлектрофореза в 1,5% агарозном геле с добавлением бромистого этидия в качестве интерколирующего красителя для ДНК. Результат учитывали на оборудовании фирмы «BioRad» (США). Для определения размера ампликонов, после проведения ПЦР с разработанными праймерами, использовали маркер молекулярных масс «1 kb DNA ladder» («Stratagene», США).
Пример 1. Проверка эффективности разрабатываемой диагностической системы для исследования лимфоцитов крови КРС
Материалом для исследования послужили 28 проб лимфоцитов периферической крови КРС из неблагополучного по лейкозу хозяйства. В качестве положительного контроля использовали ДНК, выделенную из лимфоцитов крови КРС, у которых носительство BLV было подтверждено в реакции иммунодиффузии (Правила по профилактике и борьбе с лейкозом крупного рогатого скота, утвержденные приказом Минсельхозпрода РФ от 11 мая 1999 г. №359), а наличие BIV - методом классической ПЦР (Методические указания по диагностике ВБИ-инфекции крупного рогатого скота методом полимеразной цепной реакции (ПЦР), утверждены академиком-секретарем отделения ветеринарной медицины РАСХН A.M. Смирновым 07.12.2006 г.). Пробы 2, 3, 4, 5, 8, 11, 16 содержат ДНК провирусов BIV и BLV, электрофоретическая подвижность ампликонов которых 382 п.н. и 609 п.н. соответственно, что совпадает с размерами ампликонов в положительном контроле (К+). Пробы 7, 9, 10, 12, 13, 17, 18, 22, 23 содержит только ДНК провируса BIV, пробы 1, 6, 14, 15, 19, 20, 21, 24, 25, 26, 27, 28 - отрицательные. В электрофоретической дорожке, соответствующей отрицательному контролю (К-), полосы отсутствуют (фиг. 4).
Пример 2. Проверка эффективности разрабатываемой диагностической системы для исследования периферической крови КРС
Материалом для исследования послужили 10 проб периферической крови КРС из неблагополучного по лейкозу хозяйства. В качестве положительного контроля использовали ДНК, выделенную из лимфоцитов крови КРС, у которых носительство BLV было подтверждено в реакции иммунодиффузии (Правила по профилактике и борьбе с лейкозом крупного рогатого скота, утвержденные приказом Минсельхозпрода РФ от 11 мая 1999 г. №359), а наличие BIV - методом классической ПЦР (Методические указания по диагностике ВБИ-инфекции крупного рогатого скота методом полимеразной цепной реакции (ПЦР), утверждены академиком-секретарем отделения ветеринарной медицины РАСХН A.M. Смирновым 07.12.2006 г.). Пробы 1, 2, 3, 4, 5, 9 содержат ДНК провирусов BIV и BLV электрофоретическая подвижность ампликонов которых 382 п.н. и 609 п.н. соответственно, что совпадает с размерами ампликонов в положительном контроле (К+). Пробы 6, 7, 10 содержат только ДНК провируса BIV, проба 8 - отрицательная. В электрофоретической дорожке, соответствующей отрицательному контролю (К-), полосы отсутствуют (фиг. 5).
Заявленное изобретение является доступным по стоимости, достоверным, высокочувствительным и высокоспецифичным способом выявления фрагментов провирусной ДНК провирусов иммунодефицита и лейкоза КРС в лимфоцитах крови животных в короткие сроки. При этом компьютерный анализ показал отсутствие реакции на гомологичные и гетерологичные организмы.
Предложенный способ апробирован с положительными результатами и регулярной воспроизводимостью этих результатов в 2015 году на 38 пробах ДНК, полученных из лимфоцитов и периферической крови КРС, принадлежащих частным владельцам и из фермерских хозяйств. Работу проводили на базе межкафедральной учебно-научно-исследовательской лаборатории «Геном» ФГБОУ ВПО «Саратовский ГАУ» и ФКУЗ РосНИПЧИ «Микроб» (г. Саратов).
1. Набор, включающий две пары прямых и обратных олигонуклеотидных праймеров для выявления провирусов энзоотического лейкоза (pBLVf и pBLVr) и иммунодефицита крупного рогатого скота (pBIVf и pBIVr), у которых отсутствуют самокомплементарные участки внутри каждого праймера и между прямым и обратным, отличающийся тем, что праймеры имеют следующий нуклеотидный состав (5-3'-):
pBLVf-TATTCCACCCTCGCAAGGC и
pBLVr-GGGCAGTTGATCCAGAGTCGT;
pBIVf-GTCTTCCCACATCCGTAACATCTCCT и
pBIVr-CCCCAGGTCCCATCAACATTCATCAG,
температуру отжига 58°С для обоих пар олигонуклеотидов, GC состав для pBIVf и pBIVr - 50,5% и для pBLVf и pBLVr - 56,5%, и фланкируют область консервативного гена tax провируса энзоотического лейкоза крупного рогатого скота (pBLVf и pBLVr) размером 609 пар нуклеотидов и область консервативного гена gag провируса иммунодефицита крупного рогатого скота (pBIVf и pBIVr) размером 382 пар нуклеотидов.
2. Способ выявления ДНК провирусов лейкоза и иммунодефицита крупного рогатого скота методом мультиплексной ПИР с использованием двух пар прямых и обратных олигонуклеотидных праймеров по п. 1, отличающийся тем, что готовят реакционную смесь следующего состава: буфер 10-кратный для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,4 мкл, праймеры pBLVf, pBLVr, pBIVf и pBIVr (10 пмоль/мкл) по 1 мкл, Taq полимераза (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 1,5 мкл, бидистиллированной воды - 11,4 мкл и пробы ДНК - 5 мкл, амплификацию проводят в следующем режиме: первичная денатурация при 95°С - 3 мин, цикл денатурация/отжиг/элонгация (95°С - 20 или 60 сек)/(58°С - 20 или 60 сек)/(72°С - 40 или 60 сек), повторяющийся 35 раз, и заключительная элонгация при 72°С в течение 5 мин, затем проводят гельэлектрофорез, и по наличию или отсутствию амплифицируемых фрагментов длиной 382 пар нуклеотидов - для Bovine immunodeficiency virus и 609 пар нуклеотидов - для Bovine leukemia virus судят о наличии или отсутствии провирусов иммунодефицита и лейкоза в лимфоцитах крупного рогатого скота.