Средство для ингибирования фермента альфа-амилазы
Иллюстрации
Показать всеИзобретение относится к средству для ингибирования фермента α-амилазы, где в качестве действующего вещества используют диметил 1,4-дитиепин-6,6-дикарбоксилат общей формулы (1)
,
которое может найти применение в качестве синтетического гипогликемического средства. 3 табл., 1 ил.
Реферат
Изобретение относится к новым химическим соединениям, обладающим биологической активностью, в частности к диметил-1,4-дитиепин-6,6-дикарбоксилату общей формулы (1)
Заявленное соединение обладает свойством ингибировать фермент α-амилазу. Соединение может найти применение в качестве синтетического гипогликемического средства, которое тормозит расщепление поли- и олигосахаридов, уменьшая образование и всасывание глюкозы в кишечнике.
В настоящее время в качестве антидиабетических средств используют бигуаниды, сульфонилмочевины, однако эти соединения обладают побочным действием, таким как молочнокислый ацидоз и гипогликемия, соответственно. Синтез бигуанидов осуществляется с использованием многостадийных реакций, отличающихся низкими выходами. Синтез сульфонилмочевин сопровождается использованием высокотоксичного фосфина (Заявка №2001105095/04, 13.07.1999. Дата публикации заявки: 10.09.2003). Поэтому поиск новых соединений, обладающих способностью ингибировать альфа-амилазу, является важной и актуальной задачей.
В отличие от сульфонамидных гипогликемических средств подобные соединения не увеличивают высвобождение инсулина и, следовательно, не вызывают гипогликемию [Н. Тосихиро, И. Масаюки, Ф. Нобухико, Н. Такеси, Ф. Хидеки. Производные глюкопиранозилоксипиразола и их применение в лекарственных средствах, Патент RU 2317302; Л.В. Недосугова. Фармакоэкономические аспекты лечения сахарного диабета второго типа. Сахарный диабет, 2002, №2. С. 76-79].
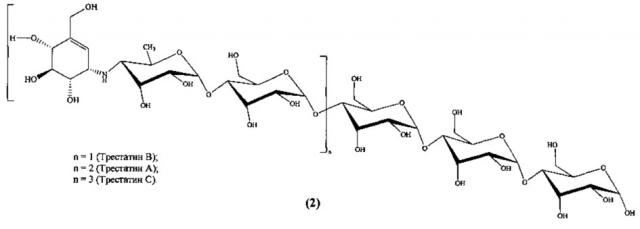
Известны ингибиторы α-амилазы [S.H. Yoon, J.F. Robyt. Study of the inhibition of four alpha amylases by acarbose and its 4IV-α-maltohexaosyl and 4IV-α-maltododecaosyl analogues. Carbohydr. Res., V. 338, №19, 2003, P. 1969-1980. J.L. Chiasson, R.G. Josse, R. Gomis, M. Hanefeld, A. Karasik, M. Laakso. Acarbose for prevention of type 2 diabetes mellitus: the STOP-NIDDM randomized trial. Lancet, 2002, 359, P. 2072-2077] трестатины - производные олигосахаридов, общей формулы (2)
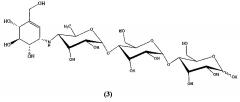
Известен ингибитор α-амилазы [J.F. Robyt. Inhibition, activation, and stabilization of α-amylase family enzymes. Biologia Bratislava, 2005, 60, P. 17-26; D.R. Buchanan, A. Collier, E. Rodrigues, A.M. Millar, R.S. Gray, B.F. Clarke. Effectiveness of acarbose, an alpha-glucosidase inhibitor, in uncontrolled non-obese non-insulin dependent diabetes. Eur. J. Clin. Pharmacol, 1988, 34(1), P. 51-53] акарбоза общей формулы (3), используемая в мировой клинической медицине как гипогликемическое лекарственное средство, тормозящее переваривание и всасывание углеводов в тонкой кишке:
Известны ингибиторы α-амилазы [P.M. Sales, P.M. Souza, L.A. Simeoni, D. Silveira. α-Amylase inhibitors: a review of raw material and isolated compounds from plant source. J. Pharm. Pharm. Sci, 2012, 15(1). P. 141-183] полифенолы общей формулы (4)
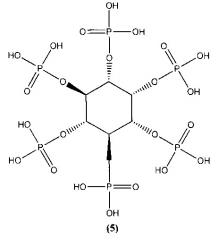
Известны ингибиторы α-амилазы [А.А. Халимжанов, Б. Тилеген, Н.С. Мамытова. Ингибирование α-амилазы из зерна пшеницы фитатом натрия, Изв. Нац. академ. наук Республики Казахстан, 2014, №4. С. 56-59] D-мио-инозитол-1,2,3,4,5,6-гексакисдигидрофосфорная кислота (фитиновая кислота) и ее соли общей формулы (5)
Известен ингибитор α-амилазы [Karthic, Kirthiram, Sadasivam, Thayumanavan. Identification of alpha amylase inhibitors from Syzygium cumini Linn seeds. Indian J Exp Biol, 2008, 46(9), 677-680] на основе семян Syzygium cumin и листьев Psidium guajava, водные экстракты которых проявляют выраженное ингибирующее действие на активность α-амилазы.
Целью изобретения является выявление ингибирующей активности по отношению к ферменту α-амилазы диметил 1,4-дитиепин-6,6-дикарбоксилата, полученного в одну стадию из доступных реагентов.
Результат достигается тем, что в качестве действующего вещества, ингибирующего активность α-амилазы, предлагается использовать диметил 1,4-дитиепин-6,6-дикарбоксилат общей формулы (1).
На рис. 1 приведена зависимость начальной скорости ферментативного гидролиза от начальной концентрации субстрата в обратных координатах в присутствии 0,3645 г/л (1).
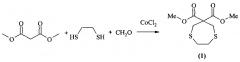
Получение диметил 1,4-дитиепин-6,6-дикарбоксилата общей формулы (1) основано на конденсации диметилового эфира малоновой кислоты, 1,2-этандитиола с дешевым и выпускаемым промышленностью формальдегидом. Продукт получают с выходом ~80% [Ахметова, и др. Гетероциклизация диметилмалоната с SH-кислотами и формальдегидом в присутствии катализаторов. ЖОрХ, 2013, Т. 49, №7, С. 1086-1091].
Сущность способа получения диметил 1,4-дитиепин-6,6-дикарбоксилата общей формулы (1) заключается во взаимодействии формальдегида CH2O с 1,2-этандитиолом и диметиловым эфиром малоновой кислоты в присутствии катализатора CoCl2 при мольном соотношении CH2O:1,2-этандитиол:диметиловый эфир малоновой кислоты:CoCl2 = 2:1:1:0.05 в растворителе CHCl3:С2Н5ОН (1:1) и атмосферном давлении в течение 8 ч. Реакция протекает по схеме
Спектральные характеристики соединений [В.Р. Ахметова, Н.С. Ахмадиев, В.М. Яныбин, Н.Ф. Галимзянова. Гетероциклизация диметилмалоната с SH-кислотами и формальдегидом в присутствии катализаторов. ЖОрХ, 2013, Т. 49, №7, С. 1086-1091]. Амилолитическую активность термостабильной α-амилазы микробного происхождения определяли с использованием ферментного препарата α-амилазы Termamyl® SC DS компании Novozymes. Определение необходимой концентрации рабочего раствора ферментного препарата проводилось по методике [ГОСТ Р 54330-2011 «Ферментные препараты для пищевой промышленности. Методы определения амилолитической активности. - М.: Стандартинформ, 2012. - 14 с.]. Метод основан на гидролизе крахмала ферментами амилолитического комплекса до декстринов различной молекулярной массы.
Амилолитическая активность характеризует способность амилолитических ферментов катализировать гидролиз крахмала до декстринов различной молекулярной массы и выражается числом единиц фермента в 1 г или мл препарата.
За единицу активности амилолитического фермента принято такое количество фермента, которое в строго определенных условиях температуры, pH и времени действия катализирует до декстринов различной молекулярной массы 1 г растворимого крахмала, что составляет 30% от введенного в реакцию.
1. Приготовление 1%-ного раствора крахмала (субстрат). 1 г крахмала помещают в мерную колбу вместимостью 100 мл, добавляют 25 мл воды и перемешивают. Затем добавляют в колбу еще 25 мл воды, помещают колбу в кипящую водяную баню, непрерывно перемешивая до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 10 мл ацетатного буферного раствора pH 4,7 и доводят объем жидкости до метки дистиллированной водой. Раствор крахмала готовят в день проведения анализа.
2. Приготовление ацетатного буферного раствора с pH 4,7.
Раствор А: 1 М раствор уксусной кислоты. 58 мл ледяной уксусной кислоты наливают в мерную колбу вместимостью 1000 мл и доводят объем до метки дистиллированной водой.
Раствор Б: 1 М раствор уксуснокислого натрия. 82 г уксуснокислого натрия помещают в мерную колбу вместимостью 1000 мл и доводят объем до метки дистиллированной водой.
Ацетатный буферный раствор с pH 4,7 готовят смешиванием равных объемов растворов А и Б. Проверяют значение pH на pH-метре.
3. Приготовление фосфатного буферного раствора с pH 4,8-8,0.
Раствор А: 0,0667 М раствор гидрофосфата натрия. 11,866 г гидрофосфата натрия 2-водного растворить в 1 л дистиллированной воды.
Раствор Б: 0,0667 М раствор дигидрофосфата калия. 9,072 г дигидрофосфата калия растворить в 1 л дистиллированной воды.
Поместить в колбу на 100 мл раствор А в объеме, указанном в таблице (в соответствии с необходимым значением pH), и довести до метки раствором Б.
Константы диссоциации ортофосфорной кислоты: pK1=2,15; pK2=7,21; pK3=12,0.
4. Приготовление 0,1 М раствора соляной кислоты. 8,2 мл соляной кислоты наливают в мерную колбу вместимостью 1000 мл и доводят объем до метки дистиллированной водой.
5. Приготовление основного раствора йода. 0,5 г йода и 5 г йодистого калия растворяют в бюксе с притертой крышкой в малом количестве воды. Содержимое осторожно перемешивают при плотно закрытой крышке бюкса. После полного растворения йода раствор переносят в мерную колбу с притертой пробкой вместимостью 200 мл и доводят объем до метки дистиллированной водой. Раствор хранят в темноте и используют в течение 1 месяца.
6. Приготовление рабочего раствора йода. 2 мл основного раствора йода разводят 0,1 М раствором соляной кислоты в мерной колбе вместимостью 100 мл. Перед применением рабочего раствора проверяют на фотоэлектроколориметре его оптическую плотность, пользуясь светофильтром с максимумом пропускания при длине волны 453 нм и толщине пропускающего слоя 1 см. Оптическая плотность раствора йода должна составлять 0,21-0,23. В случае отклонения оптической плотности раствора от этой величины ее приводят к необходимой, добавляя несколько капель кислоты или основного раствора йода.
7. Приготовление основного раствора ферментного препарата. 0,1 г исследуемого препарата взвешивают в стаканчике вместимостью 25-30 мл. Навеску тщательно растирают стеклянной палочкой с небольшим количеством воды, количественно переносят в мерную колбу вместимостью 100 мл, доводят дистиллированной водой до метки, перемешивают и при необходимости фильтруют. Раствор ферментного препарата может храниться в течение 1 суток при температуре от +0,2 до -4°C.
8. Приготовление рабочего раствора ферментного препарата. Рабочий раствор фермента готовят из основного раствора, разбавляя его так, чтобы в 5 мл рабочего раствора содержалось такое количество фермента, которое обеспечивает в принятых условиях гидролиз крахмала от 20 до 70%. Для этого берут различные количества основного раствора в зависимости от активности исследуемого препарата и разбавляют водой до 50 мл (при испытании препарата с активностью от 20 до 700 ед/г) и до 200 мл (при активности от 700 ед/г и выше). Количество основного раствора препарата, которое необходимо взять для приготовления рабочего раствора фермента, находят по таблице 2.
С выбранной концентрацией фермента была проведена серия осахариваний растворов крахмала различной концентрации для определения зависимости начальной скорости ферментативной реакции от начальной концентрации субстрата. Для большей точности и удобства представления зависимости начальной скорости от начальной концентрации субстрата отображаются на графиках в обратных координатах 1/Vо и 1/Sо, где зависимость приобретает линейный характер.
На графике Лайнуивера-Берка точка пересечения прямой с осью ординат будет иметь значение, равное обратной величине максимальной скорости реакции 1/Vmax.
Полученные значения начальных скоростей и расчетные значения 1/[So] и 1/Vo для графиков в обратных координатах сведены в таблицу 3.
На рис. 1 видно, что линейные зависимости 1/Vo от 1/[So] для опытов с веществом (1) и контрольных опытов имеют параллельное взаимное расположение. Это указывает на бесконкурентный механизм ингибирования. Ингибитор связывается только с фермент-субстратным комплексом и лимитирует протекание реакции осахаривания на стадии отщепления продукта и освобождения активного центра фермента. Начальная скорость реакции в этом случае при любых значениях начальной концентрации субстрата будет снижена на постоянную величину.
Таким образом, предлагаемое соединение синтезируется в одну стадию с использованием доступных и недорогих реагентов и не требует дорогих методов выделения целевого вещества и его очистки, что делает его значительно дешевле и доступнее известных аналогов. Проведенные исследования показали наличие у предлагаемого вещества свойств ингибировать α-амилазы.
Средство для ингибирования фермента α-амилазы, отличающееся тем, что в качестве действующего вещества используют диметил 1,4-дитиепин-6,6-дикарбоксилат общей формулы (1)