Способ получения катализатора с наноразмерными частицами платины
Иллюстрации
Показать всеИзобретение относится к электролитическим способам нанесения покрытий на углеродный носитель из растворов металлов группы платины и может быть использовано для получения платиноуглеродных катализаторов, используемых в химических источниках тока, в частности в низкотемпературных топливных элементах. Способ получения катализатора с наноразмерными частицами платины заключается в электроосаждении платины на углеродный носитель в виде суспензии с добавкой гексахлорплатиновой кислоты концентрацией 10-250 г/дм3 в двухэлектродной ячейке с разделенным анодным и катодным пространством. Анод выполнен из инертного материала. Под действием постоянного электрического тока, отнесенного к единице площади поверхности катода и равного 4-10 А/см2, при перемешивании углеродной суспензии в католите с помощью магнитной мешалки происходит электроосаждение платины на углеродный носитель. Технические результаты: получение катализатора с закрепленными на углеродном носителе нанокристаллами платины размером менее 5 нм с совокупной электрохимически активной площадью поверхности наночастиц платины более 30 м2/г (Pt) при равномерном распределении наночастиц платины по поверхности углеродного носителя. 3 з.п. ф-лы, 1 табл., 5 ил., 8 пр.
Реферат
Изобретение относится к электролитическим способам нанесения покрытий на углеродный носитель из растворов металлов группы платины и может быть использовано для получения платиноуглеродных катализаторов, используемых в химических источниках тока, в частности в низкотемпературных топливных элементах.
Основной характеристикой в гетерогенном катализе является эффективная удельная поверхность катализатора, то есть поверхность частиц катализатора, на которой протекают электрохимические процессы, отнесенная к массе нанесенного на носитель катализатора. В настоящее время получены катализаторы, содержащие наночастицы, размер которых лежит в диапазоне 1-100 нм.
Большинство известных способов получения катализатора с наночастицами платины на углеродном носителе осуществляется химическими методами, заключающимися в восстановлении соединений платины на углеродном носителе.
Известны химические методы получения металл-углеродных наноструктурированных композиционных материалов. В первую очередь, это методы синтеза в жидкой фазе, наиболее распространенными из которых являются так называемые боргидридный (Ma Н-С., Effect of borohydride as reducing agent on the structures and electrochemical properties of Pt/C catalyst/ Ma H-C., Xue X-Z., Liao J-H. et al. // Appl. Surface Science. - 2006. - V. 252. - P. 8593-8597) [1], (RUS 2367520, МПК B01J 23/42, B01J 21/18, B82B 1/00, B01J 37/34, опубл. 20.09.2009) [2], формальдегидный (Zhenhua Zhou, Preparation of highly active Pt/C cathode electrocatalysts for DMFCs by an improved aqueous impregnation method / Zhenhua Zhou, Suli Wang, Weijiang Zhou, Luhua Jiang, Guoxiong Wang, Gongquan Sun, Bing Zhou, Qin Xin // J.Physical Chemistry Chemical Physics. - 2003. - №5. - 5485-5488) [3], (US 9343747, МПК H01M 6/00; H01M 4/88; H01M 4/92; H01M 8/10 опубл. 17.04.2014) [4], полиольный (Григорьев C.A. Синтез и исследования наноструктурных катализаторов для электрохимических систем с твердым полимерным электролитом / Журн. Электрохимическая энергетика. - 2009. - Т. 9. - №1. - с. 18-24) [5].
Эти способы находятся на стыке науки и искусства экспериментатора, т.к. даже незначительное изменение одного из параметров или условий синтеза может привести к ухудшению характеристик катализатора. В то же время каждый из данных способов обладает своими достоинствами и недостатками.
Химические методы синтеза в жидкой фазе (в растворах) являются достаточно простыми и не требуют дорогостоящего оборудования. В то же время они трудоемки, не всегда характеризуются высокой степенью воспроизводимости, не позволяют контролировать рост нанообъектов. Введение в состав раствора токсичной органической фазы негативно влияет на характеристики получаемых платиноуглеродных катализаторов вследствие адсорбции органических молекул на поверхности и в порах углеродного носителя и последующего влияния на электрохимические реакции.
Более перспективными, с точки зрения управления морфологией поверхности катализатора и чистоты получаемого продукта, представляются электрохимические способы получения наночастиц.
Электрохимические процессы могут осуществляться в двух-, трех- или четырехэлектродных ячейках с применением различных режимов: гальваностатического, потенциостатического, импульсного режима, режима переменного тока и т.д. Для контроля роста наночастиц металлов широкие возможности представляет варьирование потенциала и плотности пропускаемого тока (Смирнова Н.В. Электрохимическое разрушение платины - новый путь синтеза наноразмерных Pt/C катализаторов для низкотемпературных топливных элементов / Смирнова Н.В., Куриганова А.Б. // Инженерный вестник Дона. - 2011. - Т. 15. - №1. - С. 310-314) [6].
Известен способ получения Ме/С наноструктурированных композиционных материалов электроосаждением металлов на закрепленный носитель (Багоцкий В.С, Топливные элементы. Современное состояние и основные научно-технические проблемы / B.C. Багоцкий, Н.В. Осетрова, A.M. Скундин // Журн. Электрохимия. - 2003. - Т. 39. - №. 9. - С. 1027-1045) [7]. На поверхность стеклографитового электрода после предварительной подготовки с помощью полимерного связующего Nafion закрепляется пористый слой углеродного носителя. Углеродная суспензия наносится на торец стеклоуглеродного электрода и после высушивания покрывается небольшим количеством раствора Nafion с целью более прочного закрепления слоя на торце диска. Последующее электроосаждение платины на стеклографитовый вращающийся дисковый катод с нанесенным слоем углеродного порошка проводится в трехэлектродной ячейке при комнатной температуре. Электролитом при этом является раствор, содержащий смесь 1 М H2SO4 и 5 мМ H2PtCl6. Во время протекания электрического тока на поверхности углерода формируются наночастицы платины. Следует отметить, что осаждение платины протекает неравномерно - только на поверхности слоя углеродного порошка. В глубине закрепленного слоя носителя рост наночастиц не наблюдается, что подтверждается данными, полученными сканирующей электронной микроскопией (Беленов С.В. Влияние добавки этиленгликоля на морфологические особенности электролитических осадков платины / Беленов С.В., Гебретсадик В.Й., Гутерман В.Е., Скибина Л.М., Лянгузов Н.В. // Журн. Конденсированные среды и межфазные границы. - 2015. - Т. 17. - №1 - с. 37-49 фиг. 3) [8]
Развитием способа [8] являются способы получения катализатора с наноразмерными частицами платины, в которых при пропускании переменного электрического тока через ячейку с платиновыми электродами можно добиваться их разрушения на наночастицы платины (Куриганова А.Б., Электрохимический способ получения нанодисперсного Pt/C катализатора и перспективы его применения в низкотемпературных топливных элементах / Куриганова А.Б. Герасимова Е.В., Леонтьев И.Н., Смирнова Н.В., Добровольский Ю.А. // Международный научный журнал "Альтернативная энергетика и экология". - 2011. - №5. - С. 58-62) [9], (Леонтьева Д.В. Синтез Pt-NiO/c катализаторов для топливных элементов путем электрохимического диспергирования металлов под действием переменного импульсного тока / Леонтьева Д.В., Леонтьева Д.В., Смирнова Н.В. // Международный научный журнал "Альтернативная энергетика и экология". - 2012. - №10. - С. - 59-63) [10], (Липкин М.С. Изучение возможности катодной интеркаляции щелочных металлов в платину под действием переменного импульсного тока/ Липкин М.С., Смирнова Н.В., Куриганова А.Б. // Инженерный вестник Дона. - 2012. - Т. 19. - №1. - С. 60-64) [11].
Для получения наночастиц платины указанными способами не требуется введение в состав электролита токсичной органической фазы и нагревание, присущие химическим способам.
Наиболее близким по технической сущности к заявляемому изобретению является способ получения катализатора с наноразмерными частицами платины (RU 2424850 МПК6 B01J 37/34, B01J 23/42, B01J 32/00, В82В 1/00, опубликовано 27.07.2011) [12], принимаемый за прототип.
Платиновые электроды погружают в раствор гидроксида щелочного металла концентрацией 2-6 моль/л и подключают электроды к источнику переменного тока частотой 50 Гц. Среднюю величину тока, отнесенную к единице площади поверхности электродов, устанавливают в диапазне 0,3-1,5 А/см2. Известный способ позволяет получить наночастицы платины размером 5-80 нм без использования токсичных веществ и нагревания до высоких температур. При этом электрохимически активная площадь поверхности платины составляет не более 30 м2/г (Смирнова Н.В. Структурные и электрокаталитические свойства катализаторов Pt/C и Pt-Ni/C, полученных методом электрохимического диспергирования/ Смирнова Н.В., Куриганова А.Б., Леонтьева Д.В., Леонтьев И.Н., Михеикин A.L. // Кинетика и катализ. - 2013. - Т. 54. - №2. - С. 265-272) [13].
Недостатком способа-прототипа является невозможность получения наночастиц платины размером менее 5 нм и с электрохимически активной площадью поверхности платины более 30 м2/г (Pt). Первое обусловлено тем, что при разрушении платинового электрода в щелочной среде происходит отрыв зерен (нанокристаллов) или агломератов зерен металла размером 5 и более нанометров. Такой размер нанокристаллов определяется структурой исходного платинового электрода и не может быть изменен посредством изменения условий диспергирования платины. Второе обусловлено тем, что средний диаметр металлических наночастиц, полученных данным способом, значительно выше 5 нм, поэтому электрохимически активная площадь совокупной поверхности платины имеет низкое значение.
Задачей заявляемого способа является получение катализатора с закрепленными на углеродном носителе нанокристаллами платины размером менее 5 нм с совокупной электрохимически активной площадью поверхности наночастиц платины более 30 м2/г (Pt) при равномерном распределении наночастиц платины по поверхности углеродного носителя.
Указанные технические результаты достигаются тем, что способ получения катализатора с наноразмерными частицами платины заключается в электроосаждении платины в двухэлектродной ячейке с разделенным анодным и катодным пространством, анод которой выполнен из инертного материала, на углеродный носитель, диспергированный в водном растворе гексахлорплатиновой кислоты концентрацией 10-250 г/дм3, поддерживаемой путем периодического внесения порций концентрированного раствора в раствор электролита, и фонового электролита, находящемся в катодном пространстве, под действием постоянного электрического тока, отнесенного к единице площади поверхности катода и равного 4-10 А/см2, при перемешивании углеродной суспензии в католите с помощью магнитной мешалки.
В частных случаях выполнения:
- анод выполнен из графита;
- анод выполнен из платины;
- в качестве фонового электролита использован водный раствор серной кислоты концентрацией не менее 192 г/дм3.
В отличие от прототипа осаждение платины происходит на углеродный носитель не за счет разрушения металла, а за счет образования новых частиц путем восстановления платины на поверхности углеродного носителя в момент прикосновения частицы углерода к металлическому катоду, что позволяет получить наночастицы меньшего диаметра и с большей электрохимически активной площадью поверхности, чем у прототипа. При этом способ осуществляется без применения органических растворителей и повышенных температур.
Способ получения катализатора с наноразмерными частицами платины поясняется фигурами чертежей.
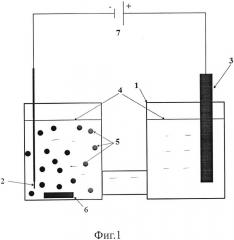
Фиг. 1 - Схема двухэлектродной ячейки с разделенным анодным и катодным пространством для осуществления заявляемого способа.
Фиг. 2 - Рентгеновская дифрактограмма Pt/C катализатора, полученного заявляемым способом.
Фиг. 3 - Фотография поверхности Pt/C катализатора, полученного электроосаждением на закрепленный на поверхности электрода углеродный носитель, описанным в статье [8].
Фиг. 4 - Фотография поверхности Pt/C катализатора, полученного заявляемым способом, подтверждающая равномерность распределения наночастиц платины по поверхности углеродного носителя.
Фиг. 5 - Циклическая вольтамперограмма Pt/C катализатора, полученная на бипотенциостате PINE.
Двухэлектродная ячейка для осуществления заявляемого способа (фиг. 1) содержит стеклянный корпус 1, в котором размещен катод 2, графитовый (платиновый) анод 3 в электролите 4, содержащем водный раствор серной кислоты концентрацией не менее 192 г/дм3 для создания достаточной электропроводности раствора электролита. В отсек, содержащий катод 2, помещают углеродную суспензию 5 на основе водного раствора, содержащего гексахлорплатиновую кислоту концентрацией 10-250 г/дм3, которая поддерживается путем периодического внесения порций концентрированного раствора кислоты в раствор электролита 4, и магнитный мешальник 6. Двухэлектродную ячейку устанавливают на магнитную мешалку. Катод 2 подключают к отрицательному полюсу источника постоянного тока 7, а анод 3 - к положительному полюсу и пропускают постоянный электрический ток, величина которого, отнесенная к единице площади поверхности катода 2, составляет 4-10 А/см2.
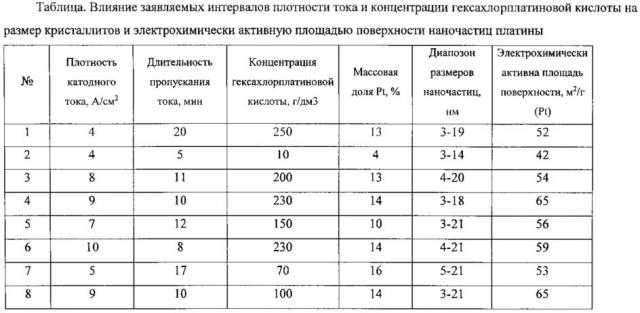
В результате электрохимической реакции происходит электроосаждение платины в виде наночастиц на поверхность углеродного носителя. Влияние заявляемых интервалов плотности тока и концентрации гексахлорплатиновой кислоты на размер кристаллитов и электрохимически активную площадь поверхности наночастиц платины подтверждены экспериментально и приведены в таблице.
Количество осажденной на углеродный носитель платины определяли методом гравиметрии. Для этого в прокаленный до постоянной массы тигель помещали навеску Pt/C материала порядка 0,01 г и выдерживали в течение 40 минут в муфельной печи, предварительно прогретой до температуры 800°С. По несгораемому остатку платины определяли процентное содержание металла в образце.
Для определения состава образца и наличия в нем наночастиц металлов использовали рентгенофазовый анализ. По полученным дифрактограммам (фиг. 2) определяли наличие платины в материале и средний размер (диаметр) ее частиц (кристаллитов). Определение среднего диаметра кристаллитов проводили по формуле Шеррера, в которую подставляли значение ширины пика на половине высоты максимального пика, отражаемого гранью металла 111:
D=Kλ/(FWHM cosθ),
где λ - длина волны монохроматического излучения (в Å),
FWHM - полуширина пика (в радианах),
D - средняя толщина «стопки» отражающих плоскостей в области когерентного рассеяния,
θ - половина угла отражения;
K=0.89 - постоянная Шеррера.
Микроструктуру образцов изучали методом сканирующей электронной микроскопии с полевой эмиссией (FE-SEM) на электронном микроскопе Hitachi SU8000. Съемку изображений (фиг. 4) вели в режимах регистрации вторичных и отраженных электронов при ускоряющем напряжении 5 кВ и рабочем расстоянии 9-10 мм. Сравнение микроструктуры образцов Pt/C материала, полученных способом, описанным в статье [8] (фиг. 3) и заявляемым способом (фиг. 4), подтверждает достижение равномерного распределения платины по поверхности углеродного носителя.
При проведении цикловольтамперометрического исследования использовали бипотенциостат AFCBP1 (PAIN). Для стандартизации поверхности платины и полного удаления примесей проводили 100 циклов развертки потенциала со скоростью 200 мВ/с в диапазоне потенциалов от 0 до 1 В (относительно СВЭ). Далее по площади пиков адсорбции и десорбции водорода (фиг. 5). проводили расчет количества электричества и оценку электрохимически активной площади поверхности платины, откуда следует, что количество электричества, затраченное на эти процессы, прямо пропорционально электрохимически активной площади поверхности платины.
Ниже приведены примеры выполнения изобретения.
Пример 1. Катализатор с наноразмерными частицами платины на углеродном носителе был изготовлен следующим образом. Материал получен в двухэлектродной ячейке. Анод - графит, катод - медная проволока. Плотность катодного тока 4 А/см2. Длительность пропускания тока 20 минут. Объем католита - 25 мл, масса углерода Vulkan-XC-72R составляет 0,5 г. Концентрированная гексахлроплатиновая кислота (H2РtСl6⋅6Н2O) подавалась в ячейку порциями для поддержания концентрации равной 250 г/дм3. Электролиз велся при постоянном перемешивании суспензии на магнитной мешалке. Полученную суспензию катализатора фильтровали, промывали дистиллированной водой, сушили при температуре 80°С в течение 1 часа. Вес наночастиц платины составил 13% от массы Pt/C катализатора. Размер наночастиц составил 3-19 нм. Электрохимически активная площадь поверхности составила 52 м2/г (Pt).
Пример 2. Процесс аналогичен приведенному в примере 1 и отличается тем, что длительность пропускания тока 5 минут. Концентрированная гексахлорплатиновая кислота (H2PtCl6⋅6H2O) подавалась в ячейку порциями для поддержания концентрации равной 10 г/дм3. Вес наночастиц платины составил 4% от массы катализатора. Размер наночастиц составил 3-14 нм. Электрохимически активная площадь поверхности составила 42 м2/г (Pt).
Пример 3. Процесс аналогичен приведенному в примере 1 и отличается тем, что плотность катодного тока равна 8 А/см2, длительность пропускания тока 11 минут. Концентрированная гексахлорплатиновая кислота (H2PtCl6⋅6H2O) подавалась в ячейку порциями для поддержания концентрации равной 200 г/дм3. Вес наночастиц платины составил 13% от массы катализатора. Размер наночастиц составил 4-20 нм. Электрохимически активная площадь поверхности составила 54 м2/г (Pt).
Пример 4. Процесс аналогичен приведенному в примере 2 и отличается тем, что плотность катодного тока равна 9 А/см2, длительность пропускания тока 10 минут. Концентрированная гексахлорплатиновая кислота (H2PtCl6⋅6H2O) подавалась в ячейку порциями для поддержания концентрации равной 230 г/дм3. Вес наночастиц платины составил 14% от массы катализатора. Размер наночастиц составил 3-18 нм. Электрохимически активная площадь поверхности составила 65 м2/г (Pt).
Пример 5. Процесс аналогичен приведенному в примере 2 и отличается тем, что плотность катодного тока равна 7 А/см2, длительность пропускания тока 12 минут. Концентрированная гексахлорплатиновая кислота (Н2PtCl6⋅6H2О) подавалась в ячейку порциями для поддержания концентрации равной 150 г/дм3. Вес наночастиц платины составил 10% от массы катализатора. Размер наночастиц составил 3-21 нм. Электрохимически активная площадь поверхности равна 56 м2/г (Pt).
Пример 6. Процесс аналогичен приведенному в примере 2 и отличается тем, что плотность катодного тока равна 10 А/см2, длительность пропускания тока 9 минут. Концентрированная гексахлорплатиновая кислота (H2PtCl6⋅6H2O) подавалась в ячейку порциями для поддержания концентрации равной 230 г/дм3. Вес наночастиц платины составил 14% от массы катализатора. Размер наночастиц составил 4-21 нм. Электрохимически активная площадь поверхности равна 59 м2/г (Pt).
Пример 7. Процесс аналогичен приведенному в примере 2 и отличается тем, что плотность катодного тока равна 5 А/см2, длительность пропускания тока 17 минут. Концентрированная гексахлорплатиновая кислота (Н2РCl6⋅6Н2O) подавалась в ячейку порциями для поддержания концентрации равной 70 г/дм3. Вес наночастиц платины составил 16% от массы катализатора. Размер наночастиц составил 5-21 нм. Электрохимически активная площадь поверхности равна 53 м2/г (Pt).
Пример 8. Процесс аналогичен приведенному в примере 2 и отличается тем, что плотность катодного тока равен 9 А/см2, длительность пропускания тока 10 минут. Концентрированная гексахлорплатиновая кислота (Н2РtCl6⋅6H2О) подавалась в ячейку порциями для поддержания концентрации равной 100 г/дм3. Вес наночастиц платины составил 14% от массы катализатора. Размер наночастиц составил 2-21 нм. Электрохимически активная площадь поверхности равна 65 м2/г (Pt).
Как видно из примеров 1-8 таблицы, предлагаемый способ позволяет получить катализаторы с размерами частиц платины 3-21 нанометров.
Разработана лабораторная технология электрохимического получения катализатора с наноразмерными частицами платины размером менее 5 нм с совокупной электрохимически активной площадью поверхности наночастиц платины более 30 м2/г (Pt) при равномерном распределении наночастиц платины по поверхности углеродного носителя.
Источники информации
1. Ma Н-С., Effect of borohydride as reducing agent on the structures and electrochemical properties of Pt/C catalyst/ Ma H-C, Xue X-Z., Liao J-H. et al. // Appl. Surface Science. - 2006. - V. 252. - P. 8593-8597.
2. RU 2367520, МПК B01J 23/42, B01J 21/18, B82B 1/00, B01J 37/34, опубл. 20.09.2009
3. Zhenhua Zhou, Preparation of highly active Pt/C cathode electrocatalysts for DMFCs by an improved aqueous impregnation method / Zhenhua Zhou, Suli Wang, Weijiang Zhou, Luhua Jiang, Guoxiong Wang, Gongquan Sun, Bing Zhou, Qin Xin // J. Physical Chemistry Chemical Physics. - 2003. - №5. - 5485-5488.
4. US 9343747, МПК H01M 6/00; H01M 4/88; H01M 4/92; H01M 8/10, опубл. 17.04.2014
5. Григорьев C.A. Синтез и исследования наноструктурных катализаторов для электрохимических систем с твердым полимерным электролитом/ Григорьев, С.А. // Журн. Электрохимическая энергетика. - 2009. - Т. 9. - №1. - с. 18-24.
6. Смирнова Н.В. Электрохимическое разрушение платины - новый путь синтеза наноразмерных Pt/C катализаторов для низкотемпературных топливных элементов / Смирнова Н.В., Куриганова А.Б. // Инженерный вестник Дона. - 2011. - Т. 15. - №1. -С. 310-314.
7. Багоцкий В.С. Топливные элементы. Современное состояние и основные научно-технические проблемы / B.C. Багоцкий, Н.В. Осетрова, A.M. Скундин // Журн. Электрохимия. - 2003. - Т.39. - №.9. - С. 1027-1045.
8. Беленов С.В. Влияние добавки этиленгликоля на морфологические особенности электролитических осадков платины / Беленов С.В., Гебретсадик В.Й., Гутерман В.Е., Скибина Л.М., Лянгузов Н.В. // Журн. Конденсированные среды и межфазные границы. - 2015. - Т. 17. - №1 - с. 37-49.
9. Куриганова А.Б. Электрохимический способ получения нанодисперсного Pt/C катализатора и перспективы его применения в низкотемпературных топливных элементах/ Куриганова А.Б., Герасимова Е.В., Леонтьев И.Н., Смирнова Н.В., Добровольский Ю.А. // Международный научный журнал "Альтернативная энергетика и экология". - 2011. - №5. - С. 58-62.
10. Леонтьева Д.В. Синтез Pt-NiO/c катализаторов для топливных элементов путем электрохимического диспергирования металлов под действием переменного импульсного тока / Леонтьева Д.В., Леонтьева Д.В., Смирнова Н.В. // Международный научный журнал "Альтернативная энергетика и экология". - 2012. - №10. - С. - 59-63.
11. Липкин М.С. Изучение возможности катодной интеркаляции щелочных металлов в платину под действием переменного импульсного тока / Липкин М.С., Смирнова Н.В., Куриганова А.Б. // Инженерный вестник Дона. - 2012. - Т. 19. - №1. - С. 60-64.
12. RU 2424850, МПК: B01J 1300, C01G 5500, В82В 100, опубл. 26.02.2009 - прототип.
13. Смирнова Н.В. Структурные и электрокаталитические свойства катализаторов Pt/C и Pt-Ni/C, полученных методом электрохимического диспергирования / Смирнова Н.В., Куриганова А.Б., Леонтьева Д.В., Леонтьев И.Н., Михейкин А.С. // Кинетика и катализ. - 2013. - Т. 54. - №2. - С. 265.
1. Способ получения катализатора с наноразмерными частицами платины, заключающийся в электроосаждении платины в двухэлектродной ячейке с разделенным анодным и катодным пространством, анод которой выполнен из инертного материала, на углеродный носитель, находящийся в катодном пространстве и диспергированный в водном растворе гексахлорплатиновой кислоты концентрацией 10-250 г/дм3 и фонового электролита, под действием постоянного тока, отнесенного к единице площади поверхности катода, равного 4-10 А/см2, при перемешивании углеродной суспензии в католите с помощью магнитной мешалки.
2. Способ по п. 1, отличающийся тем, что анод выполнен из графита.
3. Способ по п. 1, отличающийся тем, что анод выполнен из платины.
4. Способ по п. 1, отличающийся тем, что в качестве фонового электролита использован водный раствор серной кислоты концентрацией не менее 192 г/дм3.