Способ коррекции дисфункции факторов врожденного и адаптивного иммунитета при хронической почечной недостаточности в эксперименте
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, иммунологии, патофизиологии, в частности к оценке изучения иммунопатогенетических особенностей хронической почечной недостаточности (ХПН) и методам коррекции данной патологии на модели лабораторных животных. Для этого начиная с 21 суток моделирования хронической почечной недостаточности крысам пипеточным способом вводят блокатор кальциевых каналов препарат Амлодипин в дозе 0,25 мг/кг в сутки на одно животное в течение 7 дней. Регистрируют изменения факторов врожденного и адаптивного иммунитета по отношению к показателям лабораторных животных, не получавших Амлодипин. При этом устанавливают нормализацию состояния клеточных факторов врожденного иммунитета, их способность к фагоцитозу и генерации активных форм кислорода, интенсивность реакции гиперчувствительности замедленного типа, увеличение количества антителообразующих клеток в селезенке. Использование способа расширяет информацию о механизмах патогенеза ХПН, не требует дефицитных расходных материалов, доступен в практике исследовательских центров, важен при анализе эффективности действия блокаторов кальциевых каналов в терапии ХПН. 2 табл.
Реферат
Способ коррекции дисфункции факторов врожденного и адаптивного иммунитета при хронической почечной недостаточности в эксперименте
Способ коррекции дисфункции факторов врожденного и адаптивного иммунитета при хронической почечной недостаточности в эксперименте с использованием блокатора кальциевых каналов препарата Амлодипин заключается в коррекции дисфункций факторов врожденного и адаптивного иммунитета при хронической почечной недостаточности (ХПН) в эксперименте, проведенном на лабораторных животных (крысах) с использованием блокатора кальциевых каналов препарата Амлодипин в дозе 0,25 мг/кг в сутки на одно животное в течение 7 дней с регистрацией изменений показателей врожденного и адаптивного иммунитета периферической крови по отношению к показателям животных, не получавших блокатор кальциевых каналов. По динамике иммунологических показателей судят о иммуностимулирующем влиянии препарата Амлодипин при экспериментальной ХПН. Изобретение относится к экспериментальной медицине, иммунологии, патофизиологии, в частности к поиску способа повышения иммунологической эффективности терапии хронической почечной недостаточности с использованием препарата Амлодипин, на модели лабораторных животных, включающего комплекс методов изучения врожденного и адаптивного иммунитета, с целью разработки комплекса методов, позволяющих корректировать иммунные дисфункции у пациентов с хронической почечной недостаточностью.
Синдром хронической почечной недостаточности (ХПН) является важной проблемой современного здравоохранения, так как с ним связаны негативные последствия для здоровья и чрезвычайно высокие затраты на оказание медицинской помощи [Бикбов, Б.Т. Заместительная терапия больных с хронической почечной недостаточностью методами перитонеального диализа и трансплантации почки в Российской Федерации в 1998-2011 г. (Отчет по данным Российского регистра заместительной почечной терапии. Часть вторая) / Б.Т. Бикбов, Н.А. Томилина // Нефрология и диализ. - 2014. - Т. 16, №2. - С. 192-227]. По данным Российского регистра заместительной почечной терапии, на начало 2012 г. количество больных с терминальной ХПН, получающих заместительную почечную терапию, в РФ составило 28548 человек, или 199,6 на 1 млн. населения, ежегодный темп прироста составляет 9-10% [Бикбов Б.Т., 2014]. При ХПН наблюдаются глобальные изменения гомеостаза, иммунные дисфункции, приводящие к широкому спектру осложнений, определяющих качество и продолжительность жизни данной категории больных, эффективность базисной терапии. Ключевое место в структуре осложнений при ХПН занимают заболевания инфекционного, воспалительного генеза и атеросклерозобусловленная патология. Так, смертность от сепсиса у данной категории больных в 50 раз выше, чем в общей популяции, по другим данным смертность от сепсиса у диализных больных в 100-300 раз выше. По данным Российского регистра заместительной почечной терапии, сопутствующие заболевания инфекционного, воспалительного генеза и атеросклерозобусловленная патология встречаются более чем у 47% больных ХПН, получающих заместительную почечную терапию. В структуре летальности больных ХПН, находящихся на гемодиализе, инфекционные осложнения занимают 2 место после кардиоваскулярной патологии. Возникновение инфекционных и сердечно-сосудистых осложнений у больных ХПН связывают с вторичной иммунной дисфункцией [Kato, S. Aspects of immune dysfunction in end-stage renal disease / S. Kato, M. Chmielewski, H. Honda, R. Pecoits-Filho et al. // Clin. J. Am. Soc. Nephrol. - 2008. - Vol. 3(5). - P. 1526-1533]. В частности, активация эффекторов врожденного иммунитета рассматривается как один из факторов прогрессирования атеросклероза, эндотелиальной дисфункции, артериальной гипертензии, метаболического синдрома [Stinghen, А.Е. Immune mechanisms involved in cardiovascular complications of chronic kidney disease / A.E. Stinghen, S. Bucharles, M.C. Riella, R. Pecoits-Filho // Blood Purif. - 2010. - Vol. 29(2). - P. 114-20]. Депрессию адаптивного иммунитета связывают с высоким риском возникновения и неблагоприятными последствиями инфекционных заболеваний. Изменения иммунного статуса при ХПН являются многогранными, включают дисфункцию эффекторов врожденного и адаптивного иммунитета, дизрегуляцию иммунного ответа и приводят к повышенному риску инфекционных, злокачественных заболеваний, плохой реакции на вакцинацию, прогрессированию атеросклероза и связанных с ним кардиоваскулярных заболеваний.
Изучение механизмов иммунопатогенеза хронической почечной недостаточности (ХПН) и методов коррекции возникающих при данном заболевании дисфункций является актуальной проблемой современной фундаментальной медицинской науки и предпосылкой для создания средств патогенетической коррекции возникающих нарушений [Betjes, M.G. Immune cell dysfunction and inflammation in end-stage renal disease / M.G. Betjes // Nat. Rev. Nephrol. - 2013. - Vol. 5. - P. 255-265].
Поиск факторов, влияющих на нормализацию иммунного статуса при ХПН является актуальной и востребованной в клинических условиях проблемой современной фундаментальной медицины [Stinghen, А.Е., 2010]. В этом отношении интерес вызывает действие блокаторов кальциевых каналов, препарата амлодипин, используемого в терапии ХПН, действие которого основано на рецепторном связывании с дигидропиридиновыми рецепторами и блокировании кальциевых каналов, ингибировании трансмембранного перехода ионов кальция внутрь клетки. Ранее, исследованиями М.В. Осикова с соавторами показали, что применение иммуномодулирующей терапии при экспериментальной ХПН у лабораторных животных in vivo проявляет не только вазодилатирующее, гипотензивное, антиангинальное, спазмолитическое, но и способствует активации реакций врожденного и адаптивного иммунитета у экспериментальных животных (крыс) [Осиков М.В. Уровень эритропоэтина и иммунный статус организма у больных хронической почечной недостаточностью, находящихся на гемодиализе / М.В. Осиков, Л.Ф. Телешева, Ю.И. Агеев, А.А. Федосов // Современные проблемы науки и образования. - 2013. - №4; URL: www.science-education.ru/110-9973 (дата обращения: 31.01.2015)].
На сегодняшний момент для повышения эффективности терапии хронической почечной недостаточности предложен рад способов, в частности предложен «Способ лечения почечной недостаточности [Патент RU №98118878, МПК А61М 1/34. Способ лечения почечной недостаточности. Рос. Федерация, заявл. 16.10.1998; опубл. 20.07.2000. В.М. Клюжев, В.И. Гранкин, А.С. Девятое, A.M. Литвинов, Л.В. Шаплыгин, С.Е. Хорошилов, И.Л. Новосельцев, Л.В. Новицкий. Главный военный госпиталь им. акад. Н.Н. Бурденко], заключающийся в том, что авторами использовано комплексное сочетание гемодиализа и гемодиафильтрации с использованием мембран высокой проницаемости и замещением отфильтрованной плазменной жидкости в объемах, сравнимых с объемом внеклеточной жидкости, которое осуществляют для усиления эффекта детоксикации у больных в тяжелом состоянии с клиникой анурии и развивающимся отеком легких.
Недостаток метода - возможность использования только при проведении гемодиализа у больных в тяжелом состоянии с клиникой анурии и развивающимся отеком легких, метод не учитывает наличие иммунных дисфункций у пациента, метод не может быть использован при проведении исследовательских мероприятий in vivo для оценки эффективности лечения хронической почечной недостаточности.
Использование блокатора кальциевых каналов препарата амлодипин ранее было использовано для оптимизации функций клеток красной крови, в частности кровяных пластинок при метаболическом синдроме, в частности предложен «Способ быстрой оптимизации функций кровяных пластинок при метаболическом синдроме» [Патент №2272628 C1, МНК: А61К 31/4422, А61К 38/28, А61Р 3/10, А61Р 7/02, А61Р 9/12. Способ быстрой оптимизации функций кровяных пластинок при метаболическом синдроме. Рос. Федерация, заявл. 19.07.2004; опубл. 27.03.2006. И.Н. Медведев, Б.Д. Беспарточный. Патентообладатели: И.Н. Медведев, Б.Д. Беспарточный, Н.И. Громнацкий], где для терапии метаболического синдрома на фоне комплексно подобранной диеты вводят амлодипин в дозе 5 мг 1 раз в одно и то же время при лечении не менее 8 недель, регистрируются выраженные положительные изменения внутрисосудистой активности тромбоцитов за счет коррекции первичного гемостаза и уровня их антиоксидантной защищенности. Недостаток метода - возможность использования при проведении лечебных мероприятий, отсутствие широкого спектра параметров и анализа положительной динамики уровня показателей антиоксидантной системы с показателями иммунного статуса, взаимосвязь которых на сегодняшний день является доказанной.
Одним из способов коррекции иммунных нарушений является способ, предложенный Ю.А. Агеевым - Агеев Ю.И. Влияние эритропоэтина на показатели иммунного статуса при экспериментальной хронической почечной недостаточности [Электронный ресурс] / Ю.И. Агеев, М.В. Осиков, Л.Ф. Телешева, А.А. Федосов // Современные проблемы науки и образования. - 2014. - №3. - Режим доступа: www.science-education.ru/117-13594 (дата обращения: 21.06.2014), при котором было изучено влияние эритропоэтина на показатели иммунного статуса при экспериментальной хронической почечной недостаточности. В предложенном способе иммунокоррекции ХПН показано, что в экспериментальных условиях in vivo показано, что эритропоэтин при ХПН полностью или частично восстанавливает врожденный и адаптивный иммунитет по показателям количественного состава лейкоцитов в крови, поглотительной способности и кислородзависимого метаболизма нейтрофилов, Th1- и Th2-зависимого иммунного ответа, стимулирует функциональную активность изолированных интактных нейтрофилов и дозозависимо в диапазоне концентраций от 1,88 МЕ/л до 30 МЕ/л ограничивает гибель лимфоцитов, полученных от больных ХПН, что повышает иммунологическую эффективность терапии ХПН, но для комплексных терапевтических мероприятий требует одновременного введения препаратов, обладающих вазодилатирующим, гипотензивным, антиангинальним, спазмолитическим действием. Способ обеспечивает повышение качества терапевтических мероприятий при ХПН и может быль использован с целью терапии осложнений инфекционного и воспалительного генеза при хронической почечной недостаточности. Недостатком метода можно считать необходимость дополнительного введения в схему терапии лекарственных препаратов, обладающих вазодилатирующим, гипотензивным, антиангинальным, спазмолитическим действием.
Другим способом, послужившим прототипом исследования, стал метод коррекции иммунного статуса при хронической почечной недостаточности с использованием эритропоэтина, предложенный М.В. Осиковым с соавторами [Осиков М.В. Уровень эритропоэтина и иммунный статус организма у больных хронической почечной недостаточностью, находящихся на гемодиализе / М.В. Осиков, Л.Ф. Телешева, Ю.И. Агеев, А.А. Федосов // Современные проблемы науки и образования. - 2013. - №4; URL: www.science-education.ru/110-9973 (дата обращения: 31.01.2015).] Данный способ применяется в медицине, однако в связи с особенностями патогенеза ХПН в терапевтические мероприятия необходимо включение средств, проявляющих как иммуномодулирующие, так и вазодилатирующие, гипотензивные, антиангинальные, спазмолитические эффекты. Поскольку других подобных методов нами найдено не было, то данные способы взяты за прототип.
Для ХПН характерно развитие вторичной иммунной дисфункции с заинтересованностью факторов врожденного и адаптивного иммунитета, выраженной в активации эффекторов врожденного иммунитета, подавлении факторов адаптивного иммунитета, что в итоге приводит к высокому риску развития инфекционной патологии, атеросклерозобусловленных кардиоваскулярных и цереброваскулярных заболеваний [Betjes, M.G. Immune cell dysfunction and inflammation in end-stage renal disease / M.G. Betjes // Nat. Rev. Nephrol. - 2013. - Vol. 5. - P. 255-265. Cohen, G. Immune Dysfunction in Uremia-An Update / G. Cohen, W.H. // Toxins (Basel). - 2012. - Vol. 24, №4(11). - P. 962-90]
В основу нашего изобретения положена задача, заключающаяся создании способа повышения иммунологической эффективности терапии хронической почечной недостаточности в эксперименте с использованием блокатора кальциевых каналов препарата Амлодипин, проявляющего вазодилатирующее, гипотензивное, антиангинальное, спазмолитическое и иммунододулирующие эффекты в эксперименте in vivo.
Указанная техническая задача решается за счет того, что в нашем способе с использованием модели лабораторных животных (крыс) впервые в экспериментальных условиях ХПН использован метод оценки врожденного и адаптивного иммунитета при действии блокатора кальциевых каналов препарата Амлодипина и показаны иммуномодулирующие эффекты данного препарата, дающие возможность его активного использования в терапии ХПН в качестве средства, влияющего на факторы врожденного и адаптивного иммунитета.
Для проведения исследования по выявлению способа повышения иммунологической эффективности терапии хронической почечной недостаточности в эксперименте с использованием блокатора кальциевых каналов препарата Амлодипин эксперименты in vivo выполнены на 510 белых нелинейных крысах-самцах массой 200-220 г., находящихся в стандартных условиях вивария на типовом рационе в соответствии с нормами, утвержденными Приказом Минздрава СССР №1179 от 10.10.1983 г., свободном доступе к пище и воде при 12-14-часовом световом дне. Все манипуляции с экспериментальными животными выполнялись в соответствии с правилами гуманного отношения к животным, методическими рекомендациями по их выведению из опыта и эвтаназии, регламентированными «Правилами проведения работ с использованием экспериментальных животных (Приказ МЗ СССР №775 от 12.08.1977 г.) и положениями Хельсинской Декларации ВОЗ (1997). Моделирование ХПН у крыс создавали путем двухэтапной оперативной резекции 5/6 почечной ткани по методу Шуркалина Б.К. и соавт. в модификации Santos L.S. et al. и Hai-Chun Yang et al. [Шуркалин Б.К., Горский B.A., Фаллер А.П. Руководство по экспериментальной хирургии. - М.: Атмосфера, 2010. 176 с. Surgical reduction of the renal mass in rats: morphologic and functional analysis on the remnant kidney / L.S. Santos [et al.]// Acta Cir Bras. 2006. Vol. 21, №4. P. 252-257.; Yang H., Zuo Y., Fogo A.B. Models of chronic kidney disease // Drug Discov Today Dis Models. 2010. Vol. 7, №1-2. P. 13-19].
В условиях масочного эфирного наркоза, спонтанного дыхания крысу размещали на операционном столике с подогревом в положении на спине с фиксацией конечностей. Выстригали шерсть в области операционного поля (передняя брюшная стенка), поле обрабатывали антисептиком «Соната-Септ» (ООО «Уралхимфарм-плюс», Россия), после чего выполняли срединную лапаротомию с рассечением кожи, подкожной жировой клетчатки и мышц. Длина разреза составляла в среднем 3,5 см. I этап моделирования ХПН-правосторонняя нефрэктомия. После проведения лапаротомии в брюшную полость вводили 2-3 салфетки, смоченные водным раствором 0,05% хлоргексидина с целью ограничения операционного поля от окружающих тканей. Дном операционной раны являлась правая почка, стенками - боковая стенка брюшной полости и тампоны. Затем рассекали печеночно-почечную связку, вскрывали предпочечную фасцию, почку вывихивали на почечной ножке в вентральном направлении, вокруг почечной ножки накладывали и затягивали лигатуру из шелка №3. Наложение лигатуры повторяли с целью предотвращения ее случайного соскальзывания. После этого проводили отсечение почки дистальнее наложенных лигатур. Производили контроль гемостаза, извлечение тампонов из брюшной полости, послойное ушивали операционную рану. В послеоперационном периоде животных содержали в одиночных клетках с максимальным соблюдением требований асептики и антисептики. II этап моделирования ХПН проводили на седьмые сутки. Осуществляли повторное рассечение брюшной полости, рассечение предпочечной фасции, после чего проводили коагуляцию 80% поверхности единственной почки электроножом «ЭХВЧ 200-1» («Политом-1», Россия). ХПН развивалась на 21 сутки эксперимента. Для верификации ХПН определяли концентрацию в сыворотке креатинина, мочевины, мочевой кислоты. Для проведения исследования иммунных нарушений при экспериментальной ХПН и методах их коррекции блокатором кальциевых каналов 510 белых нелинейных крыс были случайным образом разделены на 3 группы. Группа 1 - контрольная, ложнооперированные животные (n=164). Группа 2 - животные с ХПН (n=196). Группа 3 - животные, которым на фоне ХПН и диализного метода вводили блокатор кальциевых каналов - препарат Амлодипин (n=150). Группа 4 - животные с ХПН, которым был проведен перинеальный диализ, без использования препарата Амлодипин (n=150). Использование перитонеального диализа у животных группы 4 обусловлено тем, что именно данный метод терапии является наиболее эффективным методом и распространенной альтернативой консервативной инфузионной терапии [Gregory C.R. Renal transplantation in cats. // Comp. Cont. Ed., 1993, 15. P. 1325-1339. 3. Gregory C.R. et al. Renal transplantation in clinical veterinary medicine. In Kirk R.W., Bonagura J.D. (eds) // Kirk's Current Veterinary Therapy XI, Small Animal Practice. Phil. W.B. Saunders Co, 1992. P. 870-875. 2, 3]. Используемый нами метод перитонеального диализа использует способность брюшины как эндогенной диализной мембраны к транспорту жидкости и растворенных веществ [Шестаков В.Н. и др. Состояние периферической крови у лабораторных животных при коррекции острой почечной недостаточности растворами для перитонеального диализа // Вестник службы крови России. - 2014. - №. 3. - с. 60-63]. Перитонеальный диализ выполнялся путем вливания в брюшную полость заданного объема перитонеальной диализующей жидкости через ранее установленный катетер, в объеме обычно 10-20 мл/кг, в перитонеальную полость. Диализат находится в брюшной полости от 30 до 120 минут, в зависимости от содержания глюкозы, а затем удаляется обратно через катетер. Во время каждого периода пребывания жидкости в брюшной полости происходило удаление растворенных веществ и ультрафильтрата. Удаление растворенных веществ из внеклеточной жидкости в перитонеальный диализат происходит под влиянием градиента концентрации, при этом перитонеальная мембрана функционирует как полупроницаемая диализная мембрана [Воронцов А.А. и др. Возможности трансплантации донорской почки у больных животных в терминальной стадии хронической почечной недостаточности // Ветеринарная патология. - 2006. - Т. 2. - №. 17. - С. 48-51]. Контрольной группе животных (группа 1) проводилась срединная лапаротомия с рассечением кожи, подкожной жировой клетчатки и мышц с последующим послойным ушиванием операционной раны наглухо. Исследования во всех группах проводили на 30 сутки от 1 этапа операции. Животным 3 группы, начиная с 21 суток эксперимента, пипеточным способом ежедневно вводили блокатор кальциевых каналов в составе препарата «Амлодипин-Тева» (международное непатентованное название: амлодипин, Израиль) в дозе 0,25 мг/кг в сутки на одно животное в течение 7 дней, суммарная доза составила 0,35 мг. Выбор среди материалов исследования пал именно на амлодипин в связи с тем, что это один из наиболее применяемых антигипертензивных препаратов из группы кальциевых блокаторов среди диализных пациентов. Забор крови проводили под общим ингаляционным наркозом (диэтиловый эфир) пункцией сердца в области левого желудочка в вакуумные пробирки фирмы «Вакуэт» (Австрия).
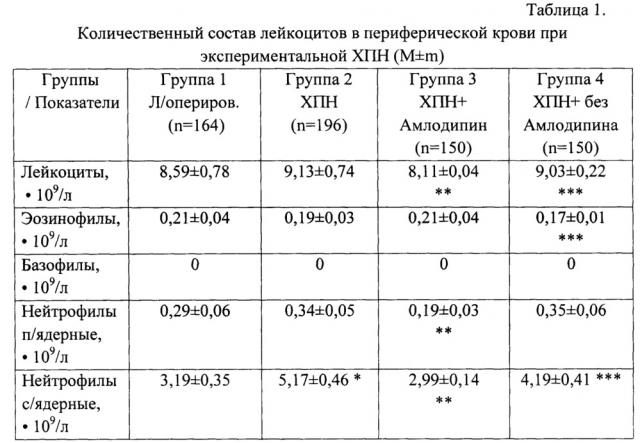
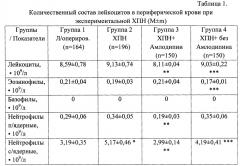
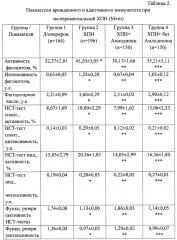
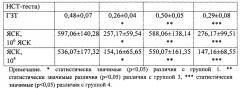
Количество лейкоцитов в периферической крови лабораторных животных определяли общепринятым методом в камере Горяева. Лейкоцитарную формулу подсчитывали в мазках крови, фиксированных метиловым спиртом и окрашенных азур II-эозином по Романовскому-Гимзе. Подсчитывали 200 лейкоцитов с дифференциацией эозинофилов, базофилов, метамиелоцитов, палочкоядерных и сегментоядерных нейтрофилов, лимфоцитов, моноцитов. Их количество выражали в относительных (%) и в абсолютных (⋅109/л) величинах. Исследование поглотительной способности фагоцитов периферической крови крыс проводили на модели поглощения частиц латекса. Для оценки фагоцитоза 200 мкл крови смешивали с 20 мкл взвеси частиц монодисперсного (диаметр 1,7 мкм) полистирольного латекса. После 60 минут инкубации при температуре 37°С из суспензии готовили препараты, которые высушивали, фиксировали метанолом и окрашивали азур II-эозином по Романовскому-Гимзе. С помощью иммерсионной микроскопии учитывали активность фагоцитоза - (%) клеток, захвативших хотя бы одну частицу латекса, интенсивность фагоцитоза - (у.е.) число поглощенных микросфер латекса в 100 подсчитанных клетках и фагоцитарное число - (у.е.) число поглощенных микросфер латекса на один фагоцит. Кислород-зависимый метаболизм фагоцитов оценивали в НСТ-тесте по методу (Маянского А.Н., Виксмана М.Е. Метод основан на восстановлении фагоцитами нитросинего тетразолия (НСТ) в его нерастворимую форму диформазан. Проводили спонтанный и индуцированный НСТ-тест. В пробирки с 0,2 мл крови добавляли 0,1 мл 0,2% раствора стандартно разведенного нитросинего тетразолия в 0,1 М фосфатном буфере (рН 7,4). Для оценки индуцированного НСТ-теста в каждую пробирку добавляли 20 мкл суспензии частиц монодисперсного (диаметр 1,7 мкм) полистерольного латекса (индуцированная серия) или 20 мкл 0,9% NaCl (спонтанная серия). После 30-минутной инкубации при температуре 37°С к реакционной смеси добавляли 3 мл 0,1% соляной кислоты для остановки реакции. Пробирки центрифугировали при 1000 об/мин в течение 5 мин. Надосадочную жидкость сливали, из осадка готовили мазки. После сушки препараты фиксировали метанолом и окрашивали 0,1% водным раствором сафранина. С помощью иммерсионной микроскопии определяли активность НСТ-теста - % клеток, восстанавливающих НСТ, и интенсивность НСТ-теста по активности восстановления НСТ. Параллельно с помощью НСТ-теста определяли способность нейтрофилов крови отвечать повышением метаболической активности на стимуляцию частицами латекса - индуцированный НСТ-тест. Для этого в пробирку с исследуемым материалом (200 мкл) и НСТ (100 мкл) добавляли 20 мкл взвеси монодисперсного полистирольного латекса, с диаметром частиц 1,7 мкм в концентрации 1×109 частиц/мл. Затем реакция и учет результатов производились вышеуказанным способом. Результаты выражали в %. Оценку гуморального Th2-зависимого иммунного ответа у крыс проводили по количеству антителообразующих клеток (АОК) в селезенке крыс, иммунизированных аллогенными эритроцитами, оценку клеточного Th1-зависимого иммунного ответа - по реакции гиперчувствительности замедленного типа (ГЗТ) у крыс, иммунизированных аллогенными эритроцитами. Интенсивность реакции ГЗТ, количество антителообразующих клеток рассчитывали как в абсолютных величинах, так и в пересчете на 106 ядросодержащих клеток (ЯСК)
Статистическую обработку результатов проводили с использованием пакета прикладных программ «Statistica v. 8.0 for Windows». Характеристика выборок представлена в формате «М ± m», где М - среднее арифметическое значение признака, m - стандартная ошибка среднего. Для анализа нормальности распределения данных применяли критерий Шапиро-Уилка, Проверку статистических гипотез в группах проводили с использованием непараметрических критериев (U - Манна-Уитни, WW - Вальда-Вольфовитца, Н - Краскела-Уоллиса).
Результаты исследования по оценке влияния блокатора кальциевых каналов препарата Амлодипин на иммунный статус лабораторных животных при экспериментальной ХПН показали нормализацию показателей факторов врожденного иммунитета, дисфункции которых регистрировались при экспериментальной ХПН, а именно снижение поглотительной способности фагоцитов, выраженную в снижении активности фагоцитоза, т.е. снижении количества активно фагоцитирующих клеток в кровотоке, интенсивности фагоцитоза и фагоцитарного числа, т.е. способности клеток поглощать частицы латекса по сравнению с показателями у лабораторных животных, получавших перитонеальный диализ, где не было зарегистрировано нормализации факторов врожденного иммунитета, а именно повышение поглотительной способности фагоцитов, нормализацию показателей активности и интенсивности фагоцитоза (табл. 1, 2). Кроме того, зарегистрировано снижение активности кислородзависимого метаболизма фагоцитов, нормализации активности и индекса спонтанного НСТ-теста, восстановление функционального резерва нейтрофилов периферической крови, отражающих соответственно количество клеток, генерирующих активных форм кислорода (АФК), и интенсивность генерации АФК отдельным фагоцитом. В группе животных, получавших перитонеальный диализ, нормализации кислородзависимого метаболизма нейтрофильных гранулоцитов периферической крови отмечено не было При оценке количественного состава лейкоцитов в периферической крови установлено, что применение блокатора кальциевых каналов препарата Амлодипин приводит к снижению относительного количества сегментоядерных нейтрофилов и общего количества нейтрофилов, повышению количества лимфоцитов и моноцитов. Пересчет показателей на абсолютные величины обнаружил снижение общего количества нейтрофилов за счет палочкоядерных и сегментоядерных форм. Отметим регуляторный характер влияния амлодипина на количественный состав лейкоцитов в периферической крови: после его применения количество нейтрофилов, лимфоцитов в крови не отличалось от соответствующих значений в группе ложнооперированных животных. При оценке функциональной активности нейтрофилов в периферической крови при ХПН в условиях применения препарата амлодипина отмечено достоверное изменение поглотительной способности и кислородзависимого метаболизма в нейтрофилах. Амлодипин нормализовал показатели активности фагоцитоза, интенсивность и фагоцитарное число. При этом интенсивность фагоцитоза и фагоцитарное число достигали значений в группе ложнооперированных животных (табл. 1, 2).
В группе 2 (ХПН), показатели врожденного иммунитета, в частности количество лейкоцитов и их функциональная активность были повышены. Полагают, что ведущим механизмом нейтрофильного лейкоцитоза при ХПН является снижение гибели полиморфноядерных лейкоцитов (ПЯЛ) путем апоптоза, что создает предпосылки для длительной циркуляции активированных клеток в крови. Факторами, подавляющими апоптоз ПЯЛ при ХПН, выступают вне- и внутриклеточный ацидоз, легкие цепи свободного иммуноглобулина, ингибиторы Са-АТФазы в цитоплазматической мембране эритроцитов, С5-компонент комплемента, накопление в крови фенилацетата, парааминогиппуровой кислоты, активация процессов свободно-радикального окисления и др. Повышение генерации АФК нейтрофилами у больных с ХПН, находящихся на гемодиализе, как установили шведские исследователи с использованием метода проточной цитометрии, связано с блокадой ключевого антиоксидантного фермента супероксидисмутазы. Кроме того, ацидоз при ХПН выступает не только как фактор пролонгации циркуляции нейтрофилов в крови, но и связан с активацией их поглотительной способности и кислородзависимого метаболизма, опосредованной повышением концентрации в цитоплазме Са2+. Активация фагоцитов при терминальной ХПН может быть связана с дисфункцией регуляторных Т-клеток с фенотипом CD4(+)CD25(bright+)FoxP3(+) [Deicher, R. Impact of parathyroidectomy on neutrophil cytosolic calcium in chronic kidney disease patients: A prospective parallel group trial / R. Deicher, В. Kirsch, М. Mullner, K. Kaczirek et al. // J. Intern. Med. - 2005. - Vol. 258. - P. 67-76] (табл. 2).
Амлодипин регулирует выраженность адаптивного иммунного ответа при экспериментальной ХПН, который, как было отмечено в табл. 2, снижен по показателям Th1- и Th2-зависимого иммунного ответа. Так, интенсивность реакции ГЗТ, отражающая Th1-зависимый иммунный ответ, в условиях применения ЭПО повышается и достигает значения в группе ложнооперированных животных. Количество АОК в селезенке крыс, демонстрирующее Th2-зависимый иммунный ответ, также повышается как в абсолютных величинах, так и в пересчете на 106 ЯСК в селезенке и не отличалась от соответствующих значений в группе ложнооперированных животных. Результаты исследования показали, что в условиях in vivo начиная с 21 суток эксперимента после введения пипеточным способом препарата Амлодипин в дозе 0,25 мг/кг в сутки на одно животное в течение 7 дней, при суммарной дозе 0,35 мг регистрируется нормализация функциональной активности фагоцитов у лабораторных животных с хронической почечной недостаточностью, получавших препарат Амлодипин, по отношению к лабораторным животным, не получавшим Амлодипин, выраженная в нормализации активности фагоцитов в периферической крови по способности клеток захватывать частицы латекса и генерации ими активных форм кислорода: активность фагоцитоза снижается на 33%, интенсивность фагоцитоза снижается на 50%, фагоцитарное число - на 35,8%, активность спонтанного НСТ-теста на 61,11% интенсивность спонтанного НСТ-теста - на 58,6%, интенсивность индуцированного НСТ-теста - на 58,7%, активность индуцированного НСТ-теста - на 30%, функциональный резерв нейтрофилов, рассчитанный по показателям активности НСТ-теста, нейтрофилов периферической крови возрастает на 39,24%, функциональный резерв нейтрофилов, рассчитанный по показателям интенсивности НСТ-теста, возрастает на 24,8%, интенсивность реакции ГЗТ, косвенно отражающая интенсивность Th1-зависимого иммунного ответа, увеличивается на 48%, количество антителообразующих клеток в селезенке снижается как в абсолютных величинах (на 54%), так и в пересчете на 106 ядросодержащих клеток (ЯСК) (на 49%).
Таким образом применение блокатора кальциевых каналов препарата Амлодипина при экспериментальной хронической почечной недостаточности приводит к полному или частичному восстановлению количественного состава лейкоцитов в крови, поглотительной способности и кислородзависимого метаболизма нейтрофилов, Th1- и Th2-зависимого иммунного ответа, тогда как при применении диализной процедуры у животных достоверного восстановления количественного состава лейкоцитов в крови, поглотительной способности и кислородзависимого метаболизма нейтрофилов, Th1- и Th2-зависимого иммунного ответа не зарегистрировано.
Применение способа повышения иммунологической эффективности терапии хронической почечной недостаточности в эксперименте с использованием блокатора кальциевых каналов препарата Амлодипин при экспериментальной хронической почечной недостаточности с использованием модели лабораторных животных позволяет расширить знания о иммунопатогенезе данного заболевания и предложить способ терапии и коррекции дисфункций факторов врожденного и адаптивного иммунитета с помощью блокатора кальциевых каналов препарата Амлодипин.
Предлагаемый способ отличается от существующих тем, что, используя иммунотропные эффекты препарата Амлодипин и положительные изменения факторов врожденного и адаптивного иммунитета, при его применении при экспериментальной хронической почечной недостаточности на модели лабораторных животных по отношению к ранее используемым методам, например перитонеального диализа, приобретается возможность более качественно, без использования человека как объекта исследований, оценить особенности патогенеза ХПН, роли блокаторов кальциевых каналов в повышении иммунологической терапии ХПН, спрогнозировать возможные исходы и риски, связанные с терапией данной патологии и иммуномодуляцией нарушенных иммунных функций. Ввиду корректности метода (уход от необходимости использования человека как объекта исследования), простоты выполнения манипуляций и дешевизны лабораторных методов исследования указанный способ оценки доступен большинству медико-биологических центров, занимающихся изучением соответствующей проблемы и имеющих разрешение на работу с лабораторными животными.
Заявляемый способ может найти широкое применение в иммунологии, патофизиологии, нефрологии при планировании и проведении экспериментов по изучению патогенеза хронической почечной недостаточности и разработке патогенетической коррекции иммунного статуса при хронической почечной недостаточности, что свидетельствует о его соответствии критерию "промышленная применимость".
Способ коррекции дисфункции факторов врожденного и адаптивного иммунитета при хронической почечной недостаточности в эксперименте, отличающийся тем, что начиная с 21 суток моделирования хронической почечной недостаточности крысам пипеточным способом вводят блокатор кальциевых каналов препарат Амлодипин в дозе 0,25 мг/кг в сутки на одно животное в течение 7 дней и регистрируют изменения факторов врожденного и адаптивного иммунитета по отношению к показателям лабораторных животных, не получавших Амлодипин, выраженные в нормализации состояния клеточных факторов врожденного иммунитета, их способности к фагоцитозу и генерации активных форм кислорода, интенсивности реакции гиперчувствительности замедленного типа, увеличению количества антителообразующих клеток в селезенке.