Способ оценки уровня антител, специфичных к различным вариантам hbsag вируса гепатита в
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к иммунобиотехнологии, и может быть использовано для оценки потенциала, эффективности и специфической активности вакцин против вируса гепатита В (ВГВ), для изучения антигенных свойств HBsAg с разными субтипами и несущих различные мутации, в том числе серологически значимые мутации иммунологического и вакцинального ускользания, а также для клинической диагностики. Сущность изобретения: при оценке уровня специфических по отношению к тому или иному варианту HBsAg антител, полученных в результате иммунизации, используют сэндвич-ИФА. В качестве иммуносорбента применяют полистироловые планшеты, покрытые поликлональными антителами к HBsAg. Планшеты обрабатывают нативным или рекомбинантным HBsAg, охарактеризованным по генотипу, субтипу и наличию мутаций, после чего добавляют тестируемую сыворотку. На финальном этапе планшеты обрабатывают конъюгатом антител к суммарным иммуноглобулинам IgG, IgM и IgA с пероксидазой хрена и выявляют связавшийся конъюгат по цветной реакции с ТМБ. Способ позволяет увеличить спектр тестируемых антител, специфичных к различным формам HBsAg вируса гепатита В, включая субтипические и мутантные формы, а также провести количественную оценку уровня этих антител. 6 ил., 2 пр.
Реферат
Изобретение относится к биотехнологии, в частности к иммунобиотехнологии, и может быть использовано для оценки потенциала, эффективности и специфической активности вакцин против вируса гепатита В (ВГВ), для изучения антигенных свойств HBsAg с разными субтипами и несущих различные мутации, в том числе серологически значимые мутации иммунологического и вакцинального ускользания, а также для клинической диагностики.
Классическая диагностика больных с ВГВ основывается не только на выявлении различных антигенов вируса, в частности HBsAg, но также на определении напряженности гуморального иммунитета, определяемого по уровню антител к антигенам этого вируса, в том числе анти-HBsAg антител [1]. Для оценки течения инфекционного процесса и его исхода важное клиническое значение имеет динамический контроль за системой HBsAg. Эффективность иммунизации оценивают по концентрации антител к HBsAg у вакцинированных лиц [2]. Тем не менее, широко распространенные во всем мире ИФА тест-системы для выявления антител к HBsAg ВГВ не способны различать анти-HBsAg антитела, обладающие разной специфичностью, т.е. направленные к разным вариантам HBsAg, мутантным и субтипическим. А это было бы актуально для разработки и/или оценки потенциала новых вакцин, направленных против гепатита В. Например, по концентрации пост-вакцинальных антител к какому-либо мутантному HBsAg можно сделать заключение о наличии серопротективного уровня в отношении данного мутанта ВГВ.
Соответствующие разделы нормативной документации на вакцины против гепатита В указывают, что специфическую активность вакцин можно определять как методом in vivo на лабораторных животных, так и методом in vitro с применением различных иммунохимических методов исследования. При оценке специфической активности вакцины методом in vivo проводится количественное определение уровня антител в сыворотках лабораторных животных к HBsAg с использованием подходящего иммунохимического метода (ИФА, РИА) [3, 4]. Определяется распределение уровней реактивности в сыворотке неиммунизированных животных и выбирается наибольший уровень реактивности неиммунизированного животного. Любой уровень антител сыворотки иммунизированного животного, превышающий уровень реактивности неиммунизированного животного, считается сероконверсией. Специфическая активность исследуемой вакцины по отношению к референс-препарату определяется статистическим методом пробит-анализа. В соответствии с требованиями Европейской фармакопеи, значение верхнего допустимого предела специфической активности, определенного при 95% доверительном интервале, должно быть не ниже 0,5.
Для определения специфической активности вакцин против гепатита В методом in vitro рекомендуется применять твердофазный иммуноферментный анализ (ИФА) и радиоиммунный анализ (РИА) с использованием моноклональных антител против иммуногенных эпитопов [4, 5, 6]. В процессе постановки реакции необходимо приготовить достаточное число разведений исследуемой вакцины и референс-препарата, полученные данные обрабатываются по методу параллельных линий. Критерии приемлемости для референс-препарата устанавливаются Национальным органом контроля в соответствии с результатами валидации метода. Существуют методы количественного электрофореза, иммунофлюоресценции и одиночной радиальной иммунодиффузии, однако на практике применяется исключительно метод ИФА с использованием валидированной иммуноферментной тест-системы «Abbott Auszyme Monoclonal», предназначенной для выявления - HBsAg. Принцип метода заключается в количественном определении HBsAg по отношению к референс-образцу специфической активности рекомбинантной вакцины против гепатита В. Тем не менее, не существует единого референс-препарата для всех вакцин [3]. Следует учитывать, что оценка специфической активности вакцин в данном варианте анализа вообще не направлена на выявление и характеризацию пост-вакцинальных антител и подразумевает только лишь оценку HBsAg антигена - специфического компонента вакцины.
Таким образом, вышеупомянутые методы не предназначены для углубленной характеристики спектра анти-HBsAg, получаемого в результате иммунизации, и не способны оценить достигаемый серопротективный уровень в отношении мутантных форм и субтипических вариантов HBsAg.
Для выявления анти-HBsAg были также предложены тест-системы, основанные на другом принципе. Например, в патенте RU 2360253 C2 от 27.06.2009 был описан способ выявления антител к антигенам вирусов гепатита А, В, С. Способ характеризовался тем, что одновременно определяли антитела классов G и М к антигенам вирусов гепатита А, В, С с помощью иммунохроматографического стрипа, состоящего из стекловолоконной несорбирующей матрицы, с нанесенными и иммобилизованными с помощью высушивания полосами, содержащими конъюгаты окрашенных частиц с моноклональными антителами к иммуноглобулинам G и М человека. Кроме стекловолоконной матрицы иммунохроматографический стрип содержит пластиковую подложку, покрытую адгезионным слоем с низкой проницающей способностью, на которой смонтирована микропористая нитратцеллюлозная мембрана с напыленной на прилежащую к подложке сторону защитной полимерной основой, причем на мембрану с незащищенной стороны нанесены перпендикулярно длинной стороне стрипа смеси антигенов вирусов гепатита А, В, С из растворов с концентрацией 0,1-1 мг/мл. Стрип смачивают исследуемой сывороткой крови и при обнаружении окрашенной полосы в районе полосы антигенов гепатита А выявляют антитела к антигену вируса гепатита А, при обнаружении окрашенной полосы в районе полосы антигенов гепатита В выявляют антитела к антигену вируса гепатита В, при обнаружении окрашенной полосы в районе полосы антигенов гепатита С выявляют антитела к антигену вируса гепатита С, которые образуются при связывании антител сыворотки крови с коньюгатами антител к иммуноглобулинам G и М с окрашенными частицами [7]. Таким образом, предложенный тип тест-системы не имеет возможности идентифицировать антитела с различной специфичностью по отношению к вариантам самого антигена вируса гепатита В.
Известна нанодиагностическая тест-система для выявления вируса гепатитов, включающая использование двухканального биосенсора "резонансное зеркало" с биочипом, состоящим из биосенсорной кюветы. В основании этой кюветы расположена призма с сопряженным с ней волноводом, образованным из слоя среды с высоким показателем преломления - "nel" и слоя кварца с низким показателем преломления "ncl" толщинами порядка нескольких сотен нанометров в зависимости от материала слоя, к чувствительной поверхности которого, являющейся одновременно поверхностью дна кюветы, иммобилизуются молекулы-зондов. Эти зонды образуют в биологической жидкости специфичные комплексы с макромолекулярными маркерами заболеваний в поверхностном к волноводу слое размером нескольких сотен нанометров. Это происходит путем взаимодействия молекул антител (анти-HBs) и HBsAg (антигена вируса гепатита В), и/или гибридизацией олигонуклеотидов с комплементарными участками к ДНК вируса гепатита В, с последующим определением изменения коэффициента преломления света в поверхностном слое на границе волновода (заявка на изобретение RU 2004134192/15). Недостатком данной системы является необходимость наличия специальных приборов для детекции и интерпретации полученных результатов. Кроме того, данный вариант не предусматривает дифференциацию специфичности анти-HBsAg.
Отдельной областью в разработке методов, позволяющих определять антитела к ВГВ, является разработка сывороточных панелей, охарактеризованных в отношении различных антигенов вируса гепатита В и антител к этим антигенам. Например, в патенте RU 2367960 C2 от 20.09.2009 разработанная панель содержит весь спектр антител к ВГВ и позволяет контролировать эффективность применяемого способа лечения гепатита В [8] (ближайший аналог). Однако данная панель включает только сыворотки, откалиброванные по HBsAg дикого типа, и не охарактеризована на содержание антител к HBsAg, относящегося к разным субтипам и мутантным формам.
Таким образом, в настоящее время не были описаны подходы по определению специфичности анти-HBsAg антител в сыворотках иммунизированных животных и людей, способные различать и определять полуколичественно (количественно) разновидности антител, специфических к мутантным вариантам HBsAg, а также к различным субтипам HBsAg. Такие методы отсутствуют, несмотря на существование моноклональных антител, распознающих различные мутантные и субтипические варианты HBsAg, и использование их в тест-системах по выявлению HBsAg, как, например, в опубликованной работе [9].
Предложенный способ оценки уровня специфических по отношению к тому или иному варианту HBsAg антител, полученных в результате иммунизации, основан на использовании метода сэндвич-ИФА. В качестве иммуносорбента применяются полистироловые планшеты, покрытые поликлональными антителами к HBsAg. Эти планшеты обрабатывают нативным или рекомбинантным HBsAg, охарактеризованным по генотипу, субтипу и наличию мутаций. Затем добавляют тестируемую сыворотку. Для каждой тестируемой сыворотки ставится дополнительный отрицательный контроль, выявляющий так называемый «собственный фон». Для этого сыворотки параллельно тестируются в лунках, в которые на предыдущей стадии проведения реакции вносили буфер для разведения образцов (например, ФСБ-Т) вместо HBsAg. С целью контроля за корректностью получаемых результатов при осуществлении способа можно использовать в качестве положительных контролей моноклональные антитела, реагирующие с HBsAg дикого типа, а также мутант- (или субтип-) специфические антитела (как описано в пр. 1). На финальном этапе планшеты обрабатывают конъюгатом антител к суммарным иммуноглобулинам IgG, IgM и IgA с пероксидазой хрена и выявляют связавшийся конъюгат по цветной реакции с ТМБ. При обработке полученных результатов из величины сигнала в лунках с соответствующим HBs-антигеном вычитают «собственный фон» данной конкретной сыворотки в лунках с ФСБ-Т-контролем. Эта «дельта» и представляет собой искомую величину специфической реакции.
Предложенный способ позволяет не только различать антитела, реагирующие с HBsAg дикого типа, или с HBsAg, несущим различные интересующие мутации, или субтипические варианты HBsAg, но и определять титр специфических антител в сыворотках.
Техническим результатом изобретения является увеличение спектра тестируемых антител, специфичных к различным формам HBsAg вируса гепатита В, включая субтипические и мутантные формы, а также количественная оценка уровня этих антител.
Сущность способа
Постановка состоит из следующих этапов:
1. В лунки планшета с иммобилизованными поликлональными антителами к HBsAg внести по 100 мкл раствора природного HBsAg дикого типа, мутантного HBsAg или рекомбинантного HBsAg и, для постановки контроля «собственного фона», внести ФСБ-Т. Инкубировать 1 ч при +37°C во влажной камере. Отмыть 5-кратно ФСБ-Т. Отбить планшет на сухую чистую влаговпитывающую бумагу.
2. Внести тестируемые образцы антисывороток в оптимальных для анализа разведениях по 100 мкл по схеме. Инкубировать 1 ч при +37°C во влажной камере. Отмыть 5-кратно ФСБ-Т. Отбить планшет на сухую чистую влаговпитывающую бумагу.
3. Приготовить раствор конъюгата (КГ) с пероксидазой хрена оптимальной концентрации.
4. Приготовленный рабочий раствор КГ по 100 мкл внести в лунки отмытого тест-планшета. Инкубировать 1 ч при +37°C во влажной камере. Отмыть 8-кратно ФСБ-Т. Отбить планшет на сухую чистую влаговпитывающую бумагу.
5. Приготовить рабочий раствор субстрата (ТМБ), добавив 6 мл раствора ТМБ к 6 мл дилюента для ТМБ.
6. Внести в лунки по 100 мкл раствора субстрата. Инкубировать 30 мин при +37°C во влажной камере.
7. Остановить реакцию добавлением 50 мкл 2М H2SO4 (стоп-реагент).
8. Считать результаты при длине волны 450 нм и дифференцирующей волне 620 нм.
Изобретение поясняется двумя примерами и иллюстрируется таблицами и графиками, представленными на фиг. 1-6.
Пример 1
Оценка уровня антител к HBsAg с мутацией G145R (Esc) в сыворотках мышей, иммунизированных рекомбинантными HBsAg дикого типа (референс-антиген) и HBsAg с данной мутацией.
Для иммунизации использовали следующие вакцины:
1. Референс-вакцина (ayw+adw). «Вакцина гепатита В рекомбинантная дрожжевая, суспензия для внутримышечного введения». Содержит в 0,5 мл 5 мкг HBsAg(adw), 5 мкг HBsAg(ayw) и 0,25 мг гидроксида алюминия.
2. «Бубо-Унигеп» (ayw+adw+Esc). Содержит в 1,0 мл 10 мкг HBsAg(adw), 10 мкг HBsAg(ayw), 10 мкг HBsAg(Esc) и 0,5 мг гидроксида алюминия.
Для характеризации спектра специфичности антител, полученных после иммунизации мышей, использовали несколько HBsAg:
1. Нативный HBsAg ИМБИО (субтип ayw). Рекомендуемая концентрация раствора 2 мкг/мл.
2. Нативный HBsAg с мутацией G145R - сыворотка «111» (субтип adw3). Рекомендуемое разведение 1/100.
3. Нативный HBsAg с мутацией G145R - сыворотка «2043» (субтип ayw2). Рекомендуемое разведение 1/100.
4. Рекомбинантный HBsAg (Esc-19), моделирующий нативный вариант с мутацией G145R.
В качестве положительного контроля (контрольных антител к HBsAg) использовали моноклональные антитела 11F3, наиболее активно реагирующие с HBsAg дикого типа, но практически не распознающие HBsAg, несущий мутацию G145R, а также моноклональные антитела Н2, наиболее эффективно реагирующие с HBsAg, несущий мутацию G145R. Оптимальная концентрация антител Н2 составляет 200 нг/мл, а концентрация антител 11F3 - 100 нг/мл. Детальная постановка эксперимента описана ниже.
1. В лунки планшета с иммобилизованными поликлональными антителами к HBsAg внесли по 100 мкл раствора природного HBsAg дикого типа - ИМБИО, мутантного HBsAg - сыворотки 111 и 2043, рекомбинатного HBsAg (Esc-19) и для постановки контроля «собственного фона» внесли ФСБ-Т. Инкубировали 1 ч при +37°C во влажной камере. Отмыли 5-кратно ФСБ-Т. Отбили планшет на сухую чистую влаговпитывающую бумагу.
2. Внесли тестируемые образцы мышиных антисывороток в оптимальных для анализа разведениях по 100 мкл. В контрольные лунки внесли по 100 мкл раствора моноклональных антител 11F3 и Н2 в оптимальных концентрациях. Инкубировали 1 ч при +37°C во влажной камере. Отмыли 5-кратно ФСБ-Т. Отбили планшет на сухую чистую влаговпитывающую бумагу.
3. Приготовили рабочий раствор конъюгата антител кролика специфичных к суммарным иммуноглобулинам (IgG, IgA, IgM) мыши с пероксидазой хрена с концентрацией 0,4 мкг/мл в буфере, состоящем из 9,6 мл ФСБ-Т и 2,4 мл нормальной кроличьей сыворотки.
4. Приготовленный рабочий раствор конъюгата по 100 мкл внесли в лунки отмытого тест-планшета. Инкубировали 1 ч при +37°C во влажной камере. Отмыли 8-кратно ФСБ-Т. Отбили планшет на сухую чистую влаговпитывающую бумагу.
5. Приготовили рабочий раствор субстрата (ТМБ), добавив 6 мл раствора ТМБ к 6 мл дилюента для ТМБ.
6. Внесли в лунки по 100 мкл раствора субстрата. Инкубировали 30 мин при +37°C во влажной камере.
7. Остановили реакцию добавлением 50 мкл 2М H2SO4 (стоп-реагент).
8. Считали результаты при длине волны 450 нм и дифференцирующей волне 620 нм.
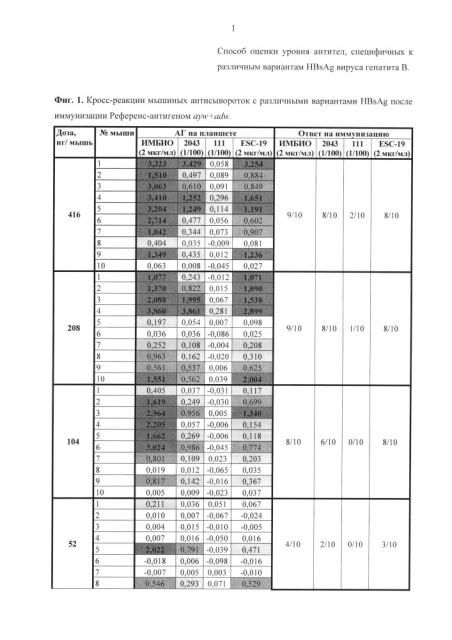
Результаты анализа сывороток после иммунизации референс-вакциной и вакциной Бубо-Унигеп приведены на фиг. 1-4. Из этих данных следует, что при однократной иммунизации мышей эти вакцины способствовали выработке антител, взаимодействующих с нативными мутантными антигенами 111 и 2043, а также с рекомбинантным мутантом Esc-19. Выработка антител происходила дозозависимым способом.
Сравнение количества антител, взаимодействующих с антигенами 2043 (ayw2) и 111 (adw3), после иммунизации вакциной с мутантом EscAg (G145R ayw2) показывает, что определяются антитела, выработанные на антиген соответствующего серотипа. Так, при иммунизации вакциной, содержащей мутантный антиген серотипа ayw2, количество мышей выработавших антитела именно к этому серотипу ayw2 (фиг. 4 - синий) намного превышает количество мышей, выработавших антитела к серотипу adw3 (фиг. 4 - зеленый).
Пример 2
Оценка уровня антител к HBsAg с мутацией G145R в сыворотках баранов, иммунизированных рекомбинантными HBsAg дикого типа (референс-антиген) и HBsAg с данной мутацией.
Для иммунизации использовали следующие вакцины:
1. Референс-вакцина (ayw+adw). «Вакцина гепатита В рекомбинантная дрожжевая, суспензия для внутримышечного введения». Содержит в 0,5 мл 5 мкг HBsAg(adw), 5 мкг HBsAg(ayw) и 0,25 мг гидроксида алюминия.
2. Вакцина «ESC-19». Содержит в 1,0 мл 22 мкг HBsAg (ESC-19) и 0,25 мг гидроксида алюминия. Расфасовано по 0,5 мл. Хранение при температуре +4°C.
Для характеризации спектра специфичности антител, полученных после иммунизации баранов, также используются HBsAg различных субтипов: ИМБИО (субтип ayw), сыворотка «111» (субтип adw3) и сыворотка «2043» (субтип ayw2) (см. выше).
Особенности данной постановки:
1. В лунки планшета с иммобилизованными поликлональными антителами к HBsAg внесли по 100 мкл раствора природного HBsAg дикого типа - ИМБИО, мутантного HBsAg - сыворотки 111, 2043 и для постановки контроля «собственного фона» внесли ФСБ-Т. Инкубировали 1 ч при +37°C во влажной камере. Отмыли 5-кратно ФСБ-Т. Отбили планшет на сухую чистую влаговпитывающую бумагу.
2. Внесли тестируемые образцы бараньих антисывороток в оптимальных для анализа разведениях по 100 мкл. Отмыли 5-кратно ФСБ-Т. Отбили планшет на сухую чистую влаговпитывающую бумагу.
9. Приготовили рабочий раствор конъюгата антител кролика специфичных к суммарным иммуноглобулинам (IgG, IgA, IgM) овцы с пероксидазой хрена с концентрацией 0,8 мкг/мл в буфере, состоящем из 7,6 мл ФСБ-Т, 2,4 мл нормальной козьей сыворотки и 2 мл 10% раствора БСА.
3. Приготовленный рабочий раствор конъюгата по 100 мкл внесли в лунки отмытого тест-планшета. Инкубировали 1 ч при +37°C во влажной камере. Отмыли 8-кратно ФСБ-Т. Отбили планшет на сухую чистую влаговпитывающую бумагу.
4. Приготовили рабочий раствор субстрата (ТМБ), добавив 6 мл раствора ТМБ к 6 мл дилюента для ТМБ.
5. Внесли в лунки по 100 мкл раствора субстрата. Инкубировали 30 мин при +37°C во влажной камере.
6. Остановили реакцию добавлением 50 мкл 2М H2SO4 (стоп-реагент).
7. Считали результаты при длине волны 450 нм и дифференцирующей волне 620 нм.
Результаты анализа сывороток после иммунизации приведены на фиг. 5 и фиг. 6. Как видно из представленных данных, ESC-антиген в составе моновакцины вызывал образование у иммунизированных овец специфических антител, реагирующих с нативным HBsAg дикого и мутантного типа. При этом итоговый иммунный ответ на нативные мутантные G145R варианты (ау и ad), развившийся после реиммунизации антигеном ESC-19, был намного сильнее, чем при реиммунизации референсной бивалентной вакциной.
Сравнение количества антител, взаимодействующих с мутантными антигенами, после иммунизации вакциной с мутантом EscAg (G145R) показывает, что определяются антитела, выработанные на соответствующий антиген. Так при двукратной иммунизации овец вакциной, содержащей мутантный антиген, уровень антител именно к мутантам G145R (фиг. 6 (В, С) - красный) намного превышает уровень антител к антигену дикого типа (фиг. 6 (А) - красный). И, наоборот, при вакцинации референс-вакциной определяется больше антител к антигену дикого типа, чем к мутантному антигену (фиг. 6 - зеленый).
Таким образом, предлагаемый способ дает возможность различать антитела, реагирующие с HBsAg дикого типа или с HBsAg разных серотипов, несущих мутацию G145R.
Источники информации
1. Ильина Е.Н., Фомина Е.Е., Артемов Е.К., Говорун В.М., Иваников И.О., Сюткин В.Е. Хронические вирусные заболевания печени // Методическое пособие для врачей - Москва. - 2011 г. - с. 21.
2. Кожанова Т.В., Клушкина В.В., Кюрегян К.К., Михайлов М.И. Оценка иммунологической эффективности массовой вакцинации против гепатита В // Медицинская вирусология - 2013. - Т. XXVIII (1). - с. 16-25.
3. Коровкин А.С. Сравнительная характеристика современных иммуноферментных тест-систем для определения специфической активности вакцин против гепатита В // Дисс. к.м.н. - Москва. - 2011 г. - с. 123.
4. Assay Of Hepatitis В Vaccine (rDNA) // European Pharmacopeia 4. - P. 175-176.
5. Saito H., Kurokawa M., Takahashi Т., Goto Y., Hashimoto T. Studies on the in vitro antigenicity test of the hepatitis В surface antigen preparation and its relationship to the in vivo potency estimate // Jpn. J. Med Sci. Biol. - 1983. - V. 36, N. 5. - P. 273-280.
6. Schofield T. In vitro versus in vivo concordance: a case study of the replacement of an animal potency test with an immunochemical assay // Dev. Biol (Basel). - 2002. - V. 111. - P. 299-304.
7. Зарайский Е.И., Яновский Ю.Г., Алехин А.И., Снегирева Н.С., Погорелова Л.В. Способ выявления антител к антигенам вирусов гепатитов // Патент RU 2360253 С2 от 27.06.2009. - с. 8.
8. Канев А.Н., Юдина И.В., Черепанова Н.С., Бектимиров Т.А., Шалунова Н.В., Мусина Е.Ф., Бочарова Н.Г. Способ изготовления панели сывороток для определения антител к вирусу гепатита В // Патент RU 2367960 С2 от 20.09.2009 г. - с. 13.
9. Swenson P.D., Riess J.T., Krueger L.E. Determination of HBsAg subtypes in different high risk populations using monoclonal antibodies // J. Virol Methods. - 1991. - V. 33, N. 1-2. - P. 27-38.
Способ оценки уровня антител, специфичных к различным формам HBsAg вируса гепатита В, в том числе субтипическим и мутантным формам, включающий сэндвич-ИФА, отличающийся тем, что образцы, содержащие HBsAg, охарактеризованный по генотипу, субтипу и наличию мутаций, наносят на полистироловые планшеты, покрытые поликлональными антителами к HBsAg, добавляют образец тестируемой сыворотки, затем планшеты обрабатывают конъюгатом антител к суммарным иммуноглобулинам IgG, IgM и IgA с пероксидазой хрена, и выявляют связавшийся конъюгат по цветной реакции с тетраметилбензидином, после чего проводят оценку уровня антител.