Способ получения биоактивной сорбционно-гелиевой композиции
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к способу получения биоактивной сорбционно-гелиевой композиции на основе модифицированной монтмориллонитсодержащей глины. Способ получения биоактивной сорбционно-гелиевой композиции на основе модифицированной монтмориллонитсодержащей глины для лечения гнойно-воспалительных ран, включающий модифицирование обогащенной монтмориллонитсодержащей глины спиртовыми экстрактами лекарственных растений, обладающих антисептическим действием, сушку готового фитоминералсорбента, его измельчение до порошкообразного состояния и диспергирование в воде вместе с гидроксиэтилцеллюлозой (ГЭЦ), затем при необходимости к полученной дисперсной системе добавляют поливинилпирролидон (ПВП) и ещё диспергируют при определенных условиях, при этом компоненты для осуществления способа берут в определенном соотношении. Вышеописанный способ позволяет получить биоактивную сорбционно-гелиевую композицию на основе монтмориллонитсодержащей глины, который позволяет создать паропроницаемое покрытие на ране и не мешает процессу эпителизации. 2 ил., 2 пр.
Реферат
Изобретение относится к медицинской промышленности, а именно к производству минеральных сорбентов медицинского назначения, используемых в качестве раневого покрытия при гнойно-деструктивных процессах.
Известно, что в области традиционной и ветеринарной медицины в качестве антибактериальных препаратов с ранозаживляющим действием используются препараты на основе антибиотиков.
В патенте РФ №2409369 описан способ получения кровоостанавливающего, противомикробного и ранозаживляющего средства, имеющего следующий состав, мас.%: поливинилпирролидон - 2,0-10,0, агар - 1,0-3,0, полиэтиленоксид - 1,0-3,0, аминокапроновая кислота - 0,01-5,0, гентамицин - 0,01-1,0, вода - остальное. Средство получают путем сшивания под действием ионизирующего излучения полимеров медицинского назначения. Средство обладает эластичностью, прочностью на разрыв, сорбционными свойствами по отношению к раневому экссудату, прозрачностью, что позволяет следить за течением раневого процесса, безболезненным удалением с раневой поверхности, создает оптимальный микроклимат в ране (влажность, температура), обеспечивает кровоостанавливающий, противомикробный и ранозаживляющий эффекты.
Недостатком этого способа является использование в составе антибиотика, что ограничивает его применение из-за возможных побочных реакций при использовании получаемого средства.
В настоящее время все большую популярность приобретают лекарственные средства, использующие антимикробные, противовоспалительные и ранозаживляющие свойства продуктов растительного происхождения.
Известен способ получения антибактериального средства с ранозаживляющими свойствами, описанный в патенте РФ №2304974. Проводят иммобилизацию белка на высокомолекулярном соединении (ВМС) и модификацию поверхности. В качестве ВМС используют метилцеллюлозу. На нее при температуре 50°С иммобилизуют нативный казеин козьего молока, полученный в результате флокуляции. Затем добавляют соль азотнокислого серебра и спиртовой раствор фукоидана при соотношении компонентов, обеспечивающих следующие соотношения компонентов средства, мас.%: нативный козий казеин 40-45, метилцеллюлоза 40-45, азотнокислое серебро 0,5-2,5, фукоидан 9,5-17,5. Изобретение позволяет расширить арсенал средств антибактериального и ранозаживляющего действия.
В патенте РФ №2159113 предлагается средство, обладающее противовоспалительным, ранозаживляющим и регенераторным действием. Изобретение заключается в том, что содержит противовоспалительный, антисептический и регенераторный (ПАР) компонент, растительные масла и биологически активный компонент растительного происхождения (БАК РП), при этом в качестве ПАР компонента содержит гидрооксид (гидроокись) алюминия, ксероформ и метилурацил, в качестве растительных масел - каротиносодержащие масла с витамином Е, а в качестве БАК РП - экстракты ромашки и календулы. Указанное средство может быть приготовлено в аптечных условиях, например, следующим образом. Берется аптечная посуда соответствующей емкости, например ступка, куда сначала засыпают порошок гидрооксида алюминия (20,0 г), затем добавляют порошок ксероформа (5,0 г). Смесь перемешивают и хорошо растирают. Затем вводят касторовое масло (30,0 г) и начинают тщательно взбивать смесь до получения однородной массы. При этом масло в данном случае выполняет роль эмульгатора. При постоянном взбивании смеси затем вводят последовательно порошок метилурацила (5,0 г), а затем, не прерывая сбивания, вливают экстракты календулы и ромашки (40,0 г) тоненькой струйкой для сохранения консистенции смеси и продолжают сбивать смесь до получения эмульсии. Все операции осуществляют при комнатной температуре без дополнительного нагревания. Полученную однородную массу расфасовывают и хранят при температуре 5oC - 15oC. Изобретение обеспечивает сокращение сроков заживления и регенерации ткани без побочных эффектов с гарантированным длительным действием, позволяющим снизить эксплуатацию раневой поверхности.
К недостатку можно отнести то, что средство готовится только в аптечных условиях.
Данного недостатка лишен способ по патенту РФ №2252018, согласно которому мазь для лечения как поверхностных, так и глубоко проникающих ожогов кожи, а также других кожных заболеваний получают путем помещения в металлический сосуд из нержавеющей стали, оборудованный механической мешалкой, термометром, теплообменным кожухом, а также крышкой с вентиляционным устройством и манометром, пищевого подсолнечного масла (плотность 0,920 кг/л) и пищевого оливкового масла (плотность 0,9118 кг/л), эту смесь, встряхивая, нагревают до температуры 145°С и добавляют при непрерывном встряхивании весовой 5% масляный состав экстракта растения Calendulae officinalis и подсолнечного масла, последовательно продолжая встряхивание, через 8-10 минут вводят ладан, канифоль, белый пчелиный воск и после полной гомогенизации полученной смеси при встряхивании добавляют основной галловокислый висмут и смесь охлаждают до температуры 40°С, после чего добавляют камфору, продолжая встряхивание в течение 8...10 минут, после чего через снабженный выпускным краном патрубок жидкая смесь стекает в дозатор, оборудованный системой охлаждения, а полученную в дозаторе мазь, используя один из известных способов, упаковывают в тубы, изготовленные из материалов, допущенных к использованию по нормам, соответствующим требованиям, принятым в фармации. Мазь очень эффективна для быстрого и успешного лечения ожогов III и IV степени. Она также используется для лечения язвы голени, а также в гинекологии для лечения воспаления шейки матки.
Недостатками способа являются длительность и применение достаточно высоких температур.
Известен способ получения средства для устранения дефектов кожи и лечения ран в виде геля на основе водорастворимых полисахаридов растительного происхождения (см. РФ №2454242). Готовят навески полисахаридов, количество которых рассчитывают исходя из желаемой плотности геля. Готовят водный раствор метилцеллюлозы, или карбоксиметилцеллюлозы, или смеси этих компонентов. Затем в этот раствор при постоянном перемешивании вводят рассчитанное количество водорастворимых полисахаридов растительного происхождения, к полученному раствору добавляют желаемые терапевтические или косметологические компоненты. Способ достаточно прост в осуществлении, получаемое средство обладает хорошо адгезирующими свойствами к свежей и мокнущей ране, образующими непосредственно на ране эластичное паропроницаемое покрытие, не требующее дополнительной фиксации. Однако его использование не дает возможности получить средство с хороший эффектом в обильно экссудатирующих ранах.
Кроме того, известен способ получения средства в виде геля на основе Аэросила (коллоидного диоксида кремния) в сочетании с порошком микроводоросли спирулина (Spirulina platensis) и настойкой чистотела (см. патент РФ №2121358). Аэросил предварительно обрабатывают в сушильном шкафу при температуре 250-300oC в течение 1-2 часов. Микроводоросль Spirulina platensis, выращенную по технологии НПП "Поиск", г. Самара, сушат, измельчают на шаровой мельнице. Настойку травы чистотела большого готовят методом мацерации 70% этиловым спиртом в соотношении сырье - экстрагент 1:10. Анестезин предварительно измельчают. В отдельной ступке в глицерин вводят анестезин. Затем приготовленную смесь смешивают с аэросилом, получают гель. Отдельно порошок Spirulina plat. смешивают с водой очищенной, в конце добавляют настойку чистотела. Смесь чистотела и Spirulina plat. вводят в приготовленный ранее гель и тщательно перемешивают.
Недостатком способа является необходимость предварительной обработки аэросила при высокой температуре, а также то, что полученный гель, обладающий выраженными ранозаживляющими свойствами и позволяющий разрешаться раневому процессу за 6-8 суток, не может быть использован на первой фазе раневого процесса из-за того, что диоксид кремния обладает низкой субстратной специфичностью по отношению к патогенной микрофлоре, поэтому требуется предварительное использование присыпки с микроводорослью спирулина /Spirulina platensis/, которая обладает выраженными некролитическими свойствами.
Применение сорбентов при лечении гнойных ран на первой фазе раневого процесса обеспечивает отток тканевой жидкости, биологически активных веществ и микробных токсинов, что в результате уменьшает воспалительную реакцию и отек. Сорбция тканевой жидкости препятствует проникновению бактерий во внутреннюю среду организма. Поэтому актуальной является разработка способа получения средства для лечения ран на основе природных сорбентов.
Например, известен способ получения, проявляющего антибактериальные свойства сорбента на основе монтмориллонитсодержащей глины, описанный в патенте РФ №2471549, включающий добавление к исходному сырью дистиллированной воды в соотношении 1:10 и выдержку в течение 24 часов. После взмучивания в течение одной минуты суспензию отстаивают в течение 20 минут, затем проводят отбор надосадочной суспензии с размером глиняных частиц менее 10 мкм из верхнего 10-сантиметрового слоя. Суспензию отстаивают, после седиментации осветленную воду декантируют, а осадок высушивают в сушильном шкафу при 70-105°С и измельчают на шаровой мельнице до размеров частиц не более 10 мкм. Процедура измельчения крупных агломератов плотной консистенции, образующихся после высушивания обогащенного сырья, не приводит к повышению содержания монтмориллонита, но дает возможность повысить удельную поверхность, общий объем пор и истинную плотность сорбента. Сорбент может быть использован также в качестве энтеросорбента для поглощения токсинов. Недостатком способа является то, что готовый продукт обогащения монтмориллонитсодержащей глины получают в виде порошка с недостаточно высоким антисептическим действием в отношении патогенной микрофлоры в гнойных ранах.
Указанного недостатка лишен способ получения композиционного сорбционного материала в виде фитоминералсорбента (Везенцев А.И. и др. «Научный результат», 2014, №2, с. 52 – 58), выбранный за прототип как наиболее близкий по технической сущности и количеству совпадающих признаков. Способ по прототипу включает модифицирование обогащенной монтмориллонитсодержащей глины (далее МСГ) спиртовыми экстрактами лекарственных растений из ромашки, календулы или чабреца в соотношении 1:3, сушку готового продукта при температуре 60-75°С. Срок заживления гнойной раны с образованием рубца при использовании полученных по указанному способу фитоминералсорбентов не превышает 21 суток (Буханов В.Д. и др. «Научные ведомости БелГУ, Серия: Медицина Фармация», 2014, №11, с. 177 – 180). Однако недостатком способа является получение готового продукта в виде порошка, которому свойственна высокая агрегация его частиц в экссудатирующей ране, что приводит к слишком быстрой дегидратации раны, прилипанию набухшего сорбента к регенерируемым в ране тканям и в результате замедляет процесс эпителизации.
Покрытие в виде геля является предпочтительным, т.к. создается паропроницаемый слой между тканями в ране и частицами сорбента, что препятствует агрегации монтмориллонита, тем самым способствуя процессам регенерации. Перевязка раны с гелиевым покрытием проводится менее болезненно, т.к. набухшие частицы сорбента удаляются легче.
Задачей предлагаемого изобретения является разработка способа получения биологически сорбционно-активной композиции в виде геля на основе минералов группы монтмориллонита и лекарственных растений для расширения ассортимента композиционных сорбционных материалов, предназначенных для лечения гнойных ран.
Технический результат изобретения состоит в том, что предложенный способ позволяет получить биологически сорбционно-активную композицию в виде геля, где частицы модифицированной монтмориллонитсодержащей глины стабилизированы в гелиевой фракции природных полисахаридов, что позволяет создать паропроницаемое покрытие на ране и не мешает процессу эпителизации, а наличие фитосоставляющей в виде экстракта из лекарственных растений угнетает действие патогенной микрофлоры в гнойной ране.
Задачу решают предложенным способом получения биоактивной сорбционно-гелиевой композиции, включающим модифицирование обогащенной монтмориллонитсодержащей глины спиртовыми экстрактами лекарственных растений в соотношении 1:3, сушку готового фитоминералсорбента при температуре 60-75°С, в который внесены следующие новые и обладающие изобретательским уровнем признаки:
- измельченный после сушки до порошкообразного состояния фитоминералсорбент диспергируют в воде вместе с гидроксиэтилцеллюлозой (далее ГЭЦ) с добавлением при необходимости поливинилпирролидона (далее ПВП), так, чтобы в полученной композиции соблюдался следующий количественный состав, мас.%: ГЭЦ –3,0 -4,0; фитоминералсорбент - 5,0 - 20,0; ПВП – 0 - 1,0; остальное – вода. При этом диспергирование смеси ГЭЦ, фитоминералсорбента и воды проводят при температуре 36-40°С в течение 15 мин, затем при необходимости к полученной дисперсной системе добавляют ПВП и диспергируют еще в течение 15 минут.
Новизну в отношении всей совокупности признаков заявленного способа подтверждает то, что из уровня техники не известен способ получения биологически сорбционно-активной композиции на основе минералов группы монтмориллонита и лекарственных растений в виде геля.
Изобретательский уровень заявленного способа подтверждают следующие признаки:
- качественный состав исходных компонентов, используемых для осуществления способа, а именно МСГ в качестве натурального сорбента и одновременно носителя биологически активных веществ экстрактов лекарственных растений, обладающих антисептическим действием, например, таких как календула, и/или ромашка, и/или эхинацея, и/или тмин, и/или чабрец; гидроксиэтилцеллюлоза (ГЭЦ) - натуральный растительный полисахарид как основной эмульгатор сорбционных частиц, благодаря чему на гнойных ранах образуется паропроницаемое покрытие, не требующее фиксации, поливинилпирролидон (ПВП), выполняющий роль стабилизатора при необходимости длительного хранения композиции;
- количественный состав исходных компонентов при следующих соотношениях, мас.%:
| ГЭЦ | 3,0 - 4,0 |
| Фитоминералсорбент | 5,0 - 20,0 |
| ПВП | 0 - 1,0 |
| Вода | до 100 |
Способ не требует использования дорогостоящего оборудования, высоких температур и характеризуется быстротой выполнения.
Полученный по предлагаемому способу фитоминералсорбент в виде геля характеризуется способностью ускорять процесс образования в гнойных ранах струпа, не оказывая при этом аллергическое, местнораздражающее, кумулятивное, мутагенное, тератогенное и канцерогенное действие, а также сокращать срок полного заживления раны в среднем на 7 дней с формированием менее заметного рубца и полным восстановлением кожи и ее придатков.
Для лучшего понимания изобретения ниже приведены примеры конкретного осуществления предлагаемого способа со ссылками на прилагаемые иллюстрации, где изобретение характеризуется следующими фигурами.
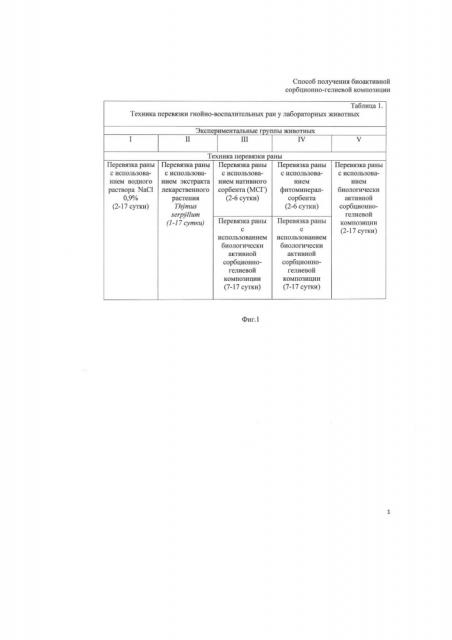
На фиг. 1 представлена Таблица 1 «Техника перевязки гнойно-воспалительных ран у лабораторных животных».
На фиг. 2 представлена Таблица 2 «Динамика изменения площади поверхности раневого дефекта(см2)», причем за фоновый показатель была принята площадь модельного ранения в начале эксперимента, знаком «*» отмечены достоверные значения по сравнению с фоновым значением, p≤ 0,1 при n=10.
Способ осуществляют следующим образом.
Измельчают монтмориллонитсодержащую глину (далее МСГ) и лекарственные растения, обладающие антисептическим действием, например календулу, и/или ромашку, и/или эхинацею, и/или тмин, и/или чабрец. Приведенный список лекарственных растений не является исчерпывающим. Для осуществления способа могут быть использованы и другие лекарственные растения, разрешенные к применению в медицинской практике, а также другие терапевтические компоненты.
Осуществляют седиментационное обогащение МСГ в воде, сушат и измельчают.
Получают экстракты лекарственных растений, обладающих антисептическим действием, например календулы, и/или ромашки, и/или эхинацеи, и/или тмина, и/или чабреца. Для получения экстракта ингредиенты используют в соотношении: сухое лекарственное растение к 40-70%-му этиловому спирту 1:10. Процесс экстракции ведут не менее 18 часов при температуре 18-25°C. Однако при повышении температуры до 60°C процесс экстракции сокращается до 9 часов.
Для получения фитоминералсорбента ингредиенты перемешивают в соотношении: экстракт лекарственного растения к обогащенной монтмориллонитсодержащей глине 3:1. Сушку полученного фитоминералсорбента проводят при температуре не более 60°C и измельчают до порошкообразного состояния.
Для получения гелиевой композиции в диспергатор последовательно загружают воду, ГЭЦ, фитоминералсорбент, при необходимости ПВП при следующих соотношениях, мас.%:
| ГЭЦ | 3,0-4,0 |
| Фитоминералсорбент | 5,0- 20,0 |
| ПВП | 0-1,0 |
| Вода | до 100 |
Диспергирование смеси ГЭЦ и фитоминералсорбента в воде проводят при температуре 36-40°С в течение 15 мин, затем при необходимости к полученной дисперсной системе добавляют ПВП и диспергируют еще в течение 15 минут.
Внесение в композицию ГЭЦ более 4,0 мас.% препятствует равномерному диспергированию системы, менее 3,0 мас.% - не дает образования гелиевой фракции и получается слишком жидкая и неустойчивая дисперсионная система, которую невозможно зафиксировать на гнойной ране.
Фитоминералсорбент для получения заявленного технического эффекта в отношении сорбционных свойств можно добавлять в диапазоне 5,0 - 20,0 мас.%, но наилучшими лечебными свойствами получаемый гель обладает при внесении в композицию фитоминералсорбента в количестве 14,0-15,0 мас.%.
ПВП, который обеспечивает длительный срок хранения гелиевой композиции, не рекомендуется добавлять больше 1,0 мас.%, т.к. в этом случае получают слишком густую суспензию, не удобную в использовании в качестве перевязочного средства за счет невозможности обеспечить равномерный слой покрытия на гнойной ране.
Примеры осуществления предлагаемого способа получения биоактивной сорбционно-гелиевой композиции.
1. Измельчают монтмориллонитсодержащую глину (далее МСГ) и лекарственное растение, обладающее антисептическим действием, например календулу, и/или ромашку, и/или эхинацею, и/или тмин, и/или чабрец. Приведенный список лекарственных растений не является исчерпывающим. Для осуществления способа могут быть использованы и другие лекарственные растения, разрешенные к применению в медицинской практике, а также другие терапевтические компоненты.
Проводят седиментационное обогащение монтмориллонитсодержащей глины, например, следующим способом: выдерживают суспензию глины в воде в течение 24 часов, взмучивают в течение одной минуты и отстаивают суспензию в течение 20 минут, затем отбирают надосадочную суспензию с размером глиняных частиц менее 10 мкм из верхнего 10-сантиметрового слоя, декантируют осветленную воду после седиментации суспензии и сушат осадок обогащенной МСГ в сушильном шкафу при 70-105°С с дальнейшим измельчением на шаровой мельнице до размеров частиц не более 10 мкм. При наличии соответствующего оборудования процесс сушки можно проводить при температуре до 900°C, что сокращает длительность процесса, но повышает его энергоемкость.
Для получения экстракта 1 г сухого лекарственного растения добавляют к 10 мл 40-70%-го этилового спирта. Процесс экстракции ведут не менее 18 часов при температуре 18-25°C. При повышении температуры до 60°C процесс экстракции сокращается до 9 часов. К одной части обогащенной монтмориллонитовой глины добавляют три части экстракта лекарственного растения, перемешивают и сушат при температуре не более 60°C. Полученный фитоминералсорбент измельчают до порошкообразного состояния. Далее смесь измельченного фитоминералсорбента с ГЭЦ в соотношении (3,5-5):1 помещают в диспергатор и заливают водой. Диспергирование осуществляют при температуре 36-40°C в течение 15 мин. Затем для получения геля с длительной седиментационной устойчивостью к полученной дисперсной системе добавляют не более 1,0 г ПВП и диспергируют в течение 15 минут.
2. Измельчают монтмориллонитсодержащую глину (далее МСГ) и лекарственное растение, обладающее антисептическим действием, например календулу, и/или ромашку, и/или эхинацею, и/или тмин, и/или чабрец. Приведенный список лекарственных растений не является исчерпывающим. Для осуществления способа могут быть использованы и другие лекарственные растения, разрешенные к применению в медицинской практике, а также другие терапевтические компоненты.
Проводят седиментационное обогащение монтмориллонитсодержащей глины, например, следующим способом: выдерживают суспензию глины в воде в течение 24 часов, взмучивают в течение одной минуты и отстаивают суспензию в течение 20 минут, затем отбирают надосадочную суспензию с размером глиняных частиц менее 10 мкм из верхнего 10-сантиметрового слоя, декантируют осветленную воду после седиментации суспензии и сушат осадок обогащенной МСГ в сушильном шкафу при 70-105°C с дальнейшим измельчением на шаровой мельнице до размеров частиц не более 10 мкм. При наличии соответствующего оборудования процесс сушки можно проводить при температуре до 900°C, что сокращает длительность процесса, но повышает его энергоемкость.
Для получения экстракта 1 г сухого лекарственного растения добавляют к 10 мл 40-70%-го этилового спирта. Процесс экстракции ведут не менее 18 часов при температуре 18-25°C. При повышении температуры до 60°C процесс экстракции сокращается до 9 часов. К одной части обогащенной монтмориллонитовой глины добавляют три части экстракта лекарственного растения, перемешивают и сушат при температуре не более 60°C. Полученный фитоминералсорбент измельчают до порошкообразного состояния. Далее смесь измельченного фитоминералсорбента с ГЭЦ в соотношении (3,5-5):1 помещают в диспергатор и заливают водой. Диспергирование осуществляют при температуре 36-40°C в течение 15 мин.
3. Пример подтверждения ранозаживляющих свойств полученной по предлагаемому способу биоактивной сорбционно-гелиевой композиции по примерам 1 или 2.
Ранозаживляющие свойства биологически активной сорбционно-гелиевой композиции изучали на белых линейных крысах обоего пола массой 200-300 г на модельных гнойно-воспалительных ранах. Кожно-мышечные раны наносили в межлопаточной области и инфицировали штаммом Escherichia coli в фиксированной заражающей дозе 2⋅108 микробных тел, под общим наркозом. Наркоз осуществляли хлоралгидратом (300 мг/кг) и золетилом (150 мг/кг) внутрибрюшинно. В опыте использовали физиологический раствор NaCl 0,9%, экстракт лекарственного растения , нативный сорбент в виде обогащенной МСГ, фитоминералсорбент, обогащенный спиртовым экстрактом и биологически активную сорбционно-гелиевую композицию. Всех экспериментальных животных разделили на пять групп по технике перевязывания раны (фиг. 1), каждая крыса была помещена в отдельную клетку с присвоением индивидуальной медицинской карты, в которую вносились клинические показатели течения раневого процесса.
Все исследования выполняли с соблюдением требований «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей» (Страсбург, 1986).
У всех лабораторных животных спустя сутки после нанесения ран наблюдалась отечность краев, наличие гнойного экссудата бело-зеленого цвета, вязкой консистенции с неприятным запахом. Перевязки начинали со вторых суток после нанесения раны в соответствии с техникой перевязывания раны (фиг. 1).
Эффективность препаратов оценивали по следующим критериям: скорость сокращения раневого дефекта поверхности, морфологическая картина гнойно-воспалительной раны на 3, 5, 7, 11 и 15 сутки, а также сроки полного заживления.
На третьи сутки после нанесения раны во всех экспериментальных группах наблюдались отек, гнойные выделения, некротические участки занимали значительную область раны. В I, II и V группах наблюдалась обильная экссудация. В III и IV группах экссудация была умеренная, однако присутствовали кровоизлияния.
На пятые сутки в III, IV и V группах экссудации не было, на незначительных участках раны присутствовал некроз, отмечали образование розовых корочек, которые имели ровную поверхность. У некоторых особей происходило образование первичного струпа, при его отделении наблюдалось образование сетки из капиллярных сосудов. В I и II группах экссудация была умеренная, некроз обширный, присутствовали гнойные выделения.
На седьмые сутки всем экспериментальным группам были сняты порты. В III и IV группах струп легко отторгался от здоровых тканей и формировалась грануляция и эпителизация, гнойные выделения имели место только в области стыка порта и кожи. В V группе у экспериментальных животных рана была влажная, однако экссудата не наблюдалось, при удалении струпа начиналось кровотечение, что указывает на образование сетки из капиллярных сосудов. У крыс I и II групп отмечали частичное образование струпа, на обширных участках раны присутствовал некроз и кровоизлияния. Струп практически не отделялся.
На одиннадцатые сутки у крыс I и II групп отмечали отторжение струпа и формирование грануляционной ткани и эпителизацию. В III, IV и V группах грануляции полностью сформировались, и со стороны кожных краев развивался процесс эпителизации.
В III-V группах полное заживление раны наблюдали в период с пятнадцатые по девятнадцатые сутки, что подтверждает сформировавшийся к этому времени рубец в III и IV группе и завершение процесса эпителизации со стороны кожных краев в V группе.
В то же время в I и II группах лабораторных животных на ранах образовывалась плотная морщинистая корочка. После ее отделения наблюдали незначительное кровотечение и выделение гнойного экссудата.
Таким образом, в опытных группах III, IV и V, в которых использовались соответственно нативный сорбент в виде обогащенной МСГ, фитоминералсорбент, обогащенный спиртовым экстрактом и биологически активная сорбционно-гелиевая композиция, полученная по предложенному способу, заживление ран шло наиболее интенсивно, сроки лечения гнойных ран сократились на 7 суток. При этом в группе, где перевязки осуществляли на протяжении всего периода предложенной биологически активной сорбционно-гелиевой композицией, образуется менее заметный рубец.
Стоит отметить, что площадь поверхности раневого дефекта животных в IV и V экспериментальных группах к 17 суткам достоверно уменьшилась (табл. 2), что указывает на активный процесс эпителизации раны.
Следовательно, результаты исследования подтверждают, что:
1. Наибольшая эффективность сокращения гнойно-воспалительной поверхности раны наблюдается в опытной группе V с обработкой раны биоактивной сорбционно-гелиевой композицией. Важно, что при использовании сорбционно-гелиевой композиции образуется менее заметный рубец с полным восстановлением кожи и ее придатков.
2. Особенности течения раневого процесса доказывают, что наибольшая выраженность противовоспалительного эффекта, коррелирующая с наименьшей экссудацией при макроскопическом исследовании и небольшой величиной отечности тканей, в опытных IV и V группах.
Наиболее ранние, выраженные и синхронные проявления регенераторного процесса обнаружены в опытах, где были использованы фитосорбент и биологически активная сорбционно-гелиевая композиция.
Способ получения биоактивной сорбционно-гелиевой композиции на основе модифицированной монтмориллонитсодержащей глины для лечения гнойно-воспалительных ран, включающий модифицирование обогащенной монтмориллонитсодержащей глины спиртовыми экстрактами лекарственных растений, обладающих антисептическим действием, в соотношении 1:3, сушку готового продукта фитоминералсорбента при температуре 60-75°С, отличающийся тем, что измельченный после сушки до порошкообразного состояния фитоминералсорбент диспергируют в воде вместе с гидроксиэтилцеллюлозой (ГЭЦ) при температуре 36-40°С в течение 15 минут, затем при необходимости к полученной дисперсной системе добавляют поливинилпирролидон (ПВП) и диспергируют еще в течение 15 минут, при этом компоненты для осуществления способа берут в следующем соотношении, мас. %:
ГЭЦ - 3,0-4,0;
Фитоминералсорбент - 5,0-20,0;
ПВП 0-1,0;
остальное - вода.