Триплоидная трансгенная линия березы с повышенной скоростью роста
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к cтерильному триплоидному трансгенному растению березы пушистой с ускоренными темпами роста по сравнению с нетрансформированным растением, содержащему ген gs1 с SEQ ID NO:1 и полученному путем агробактериального переноса указанного гена gs1 в березу Betula pubescens бп4а. Изобретение позволяет эффективно получать стерильное триплоидное растение березы с ускоренными темпами роста. 1 ил., 2 табл.
Реферат
Изобретение относится к области генетической инженерии и биотехнологии растений и может быть использовано для удешевления и ускорения процедуры получения посадочного материала и повышения качества саженцев для нужд целлюлозно-бумажной промышленности.
Несмотря на то, что Российская Федерация обладает примерно мировых запасов древесины, ее доступность в значительной степени ограничена. Доступная для переработки близость лесов является важным показателем для целлюлозно-бумажной промышленности. Интенсивные лесозаготовки при отсутствии вложений в восстановление лесов могут привести к полной потере конкурентоспособности отечественной ЦБП. Учитывая современное состояние лесного хозяйства и уровня развития генной инженерии растений, восстановление лесов должно производиться с использованием плантационного способа ведения лесного хозяйства, используя для этих целей высокопродуктивные формы лесных пород с новыми ценными признаками.
Береза является ценной породой и занимает значительную площадь земель России. Береза относится к культурам, малотребовательным к почвам и условиям окружающей среды, что немаловажно для нашей страны. Последние годы наблюдается снижение уровня производства в лесопромышленном комплексе и одним из путей интенсификации производства может быть плантационное ведение лесного хозяйства.
Задачей предлагаемого изобретения является получение стерильного триплоидного трансгенного растения березы, с ускоренными темпами роста. Это позволит в значительной степени удешевить получение посадочного материала и ускорить выход целевой древесины, а триплоидный статус трансгена позволяет решить проблему горизонтального переноса трансгена, так как триплоидные растения неспособны производить пыльцу и семена. Себестоимость таких трансгенов будет ниже за счет сокращения времени доращивания. Качество такого посадочного материала будет выше природных аналогов за счет скорости роста и устойчивости к внешним факторам, которой характеризуются триплоидные формы большинства видов растений.
Поставленная задача достигается за счет внедрения в геном березы гена глутаминсинтетазы сосны (GS1) (Kirby, E.G. The Overexpression of Glutamine Syntetase in
Transgenic Polar: A Review / E.G. Kirby, Gallardo, H. Man, R. El-Khatib // Silvae Genetica. - 2007. - V. 55. - P. 278-284), экспрессия которого при низкой доступности азота в почве, позволяет повысить эффективность ассимиляции неорганического азота.
Суть изобретения состоит в том, что в геном березы был интегрирован ген глутаминсинтетазы из P. sylvestris (GenBank Х69822), представленная в SEQ ID NO: 1 (gs1). Для этого был проведен ряд экспериментов по агробактериальной трансформации Betula pubescens (бп4а) геном глутаминсинтетазы сосны gs1. Для проведения агробактериального переноса был использован супервирулентный штамм СВЕ21, содержащий бинарный вектор pGS с геном gs1 под контролем 35S промотора.
Анализ известных продуктов, проведенный по научно-технической и патентной документации, показал, что совокупность существенных признаков предлагаемого продукта неизвестна из уровня техники, следовательно, он соответствует условию патентоспособности изобретения - «новизна».
Получение продукта реализуется следующим образом.
Трансформацию проводили по следующему протоколу:
1. В 50 мл жидкой среды Luria-Bertoni (LB) (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl), дополнительно содержащей 50 мг/л канамицина, добавляют 100 мкл суспензии агробактериальных клеток и инкубируют при 27-28°C в течение суток. Суспензию наросших клеток осаждают центрифугированием, промывают и ресуспендируют в 50 мл жидкой среды MS (Murashige Т. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture. // Physiol. Plant, 15 (1962) 473-497).
2. В чашки Петри заливают по 25 мл агаризованной среды MSm (соли MS+20 мМ KNO3+10 мМ NH4NO3) с добавлением 5 мг/л 6-бензилоаминопурин (6БАП)+5 мг/л зеатина.
3. Срезают листья с средней части побегов микрорастений березы (экспланты).
4. Экспланты заливают агробактериальной суспензией в среде MS и инкубируют 20 минут при комнатной температуре.
5. Затем экспланты подсушивают на фильтровальной бумаге и помещают на среду MSm.
6. Экспланты инкубируют в темноте в течение двух суток, после чего промывают в дистиллированной воде с добавлением цефотаксима (1 г/л) в течение 20-30 минут.
7. Отмытые экспланты подсушивают на фильтрах и раскладывают на среду MSm, содержащую 0,5 мг/л зеатина + 5 мг/л 6-бензиламинопурин (6БАП), 30 мг/л канамицина и 500 мг/л цефотаксима. На данной среде производится регенерация и селекция трансформантов.
Регенерировавшие растения, демонстрирующие нормальный рост в присутствии селективного агента канамицина, проверяют на наличие вставки гена с использованием метода полимеразной цепной реакции (ПЦР), параллельно оценивая регенераты на наличие агробактериальной контаминации. Для этого из микрорастений выделяли тотальную растительную ДНК по стандартной методике Rogers и Benedich (Rogers S.O., Bendich A.J. (1994). Extraction of DNA from plant, fungal and algal tissues. In:, Gelvin SB, Schilperoort RA (eds) Plant Molecular Biology Manual. Boston, MA: Kluwer Academic Publishers, D1: 1-8).
ПЦР анализ ДНК отдельных регенератов проводили в следующих условиях: реакционная смесь содержала 16 мМ (NH4)2SO4, 0,01% бычий сывороточный альбумин, 200 мкМ каждого дНТФ, 0,4 мкМ каждого праймера, 0,05 ед./мкл Taq-полимеразы, 1-5 нг/мкл растительной ДНК. Реакции проводили на амплификаторе MJ MiniTM Gradient Thermal Cycler (BIO-RAD). Режим амплификации: 3 мин денатурация при 96°C, 45 сек денатурация при 94°C, 45 сек отжиг при 58°C, элонгация 1 мин при 72°C, 5 мин достройка при 72°C, 31 цикл амплификации.
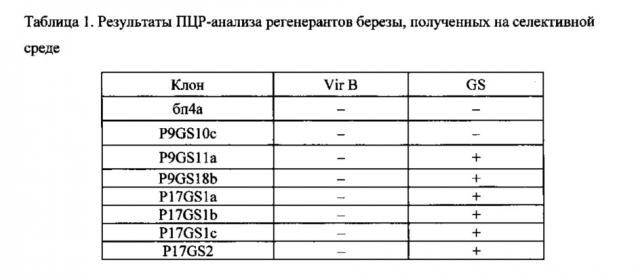
Все линии березы в первую очередь анализировались на наличие агробактериальной контаминации. Для этого геномную ДНК растений анализировали на присутствие агробактериального гена VirB. Для анализа использовали пару праймеров Vir-B1 (SEQ ID NO: 2). и VirB2 (SEQ ID NO: 3). Ожидаемый размер амплифицируемого фрагмента 670 п. н. Результаты анализа показали, что все семь анализируемых линий не были контаминированы агробактериями (Таблица 1). Следующим этапом стал ПЦР-анализ данных линий на наличие вставки гена GS с использованием пары праймеров gs-1 (SEQ ID NO: 4) и gs-2 (SEQ ID NO: 5). Проведенный ПЦР-анализ позволил выявить 6 линий березы, несущих вставку гена GS (Таблица 1). Трансформанты с подтвержденной вставкой гена GS и одна линия, в которой ПЦР-анализ не подтвердил наличие вставки гетерологичного гена, были размножены в условиях in vitro и после укоренения адаптированы к естественным условиям окружающей среды для последующих анализов.
Для выявления трансгенных линий, обладающих повышенной скоростью роста, был проведен всесторонний биометрический анализ. Оценка производилась на растениях, выращиваемых в условиях защищенного грунта в течение двух вегетативных сезонов. Оценивались такие биометрические параметры, как высота стебля, суммарный годовой прирост и диаметр корневой шейки.
Полученные линии были проанализированы на статус плоидности для выявления триплоидных форм. Для анализа плоидности использовали корневую меристему линий березы, корни растений регенерантов, которые подвергали предобработке 0,002 М раствором 8-оксихинолина утром (начиная с 8 утра) в течение 3 часов с последующей их фиксацией спиртово-уксусной смесью (3:1),. Давленые препараты, окрашенные ацетогематоксилином, изготавливали по методике (Топильская Л.А. Изучение соматических и мейотических хромосом смородины на ацетогематоксилиновых давленых препаратах / Л.А. Топильская, С.А. Лучникова, Н.П. Чувашина // Бюл. науч. информ. Центр, генет. лаб. им. И.В. Мичурина, 1975. - Вып. 22. - С. 107). Для каждого образца (линии) просматривали по 8-10 микропрепаратов. Всего было изготовлено и проанализировано 162 микропрепарата.
Число хромосом подсчитывалось на 20-30 метафазных пластинках. Основные этапы изготовления микропрепаратов: 1) Мацерация. Материал отмывают от фиксатора дистиллированной водой и помещают в 1N раствор HCl на 10 минут, а затем в 18% раствор HCl на 20 минут. 2) Тщательная промывка материала в двух, трех сменах дистиллированной воды. 3) Ополаскивание в 45% уксусной кислоте и помещение в свежую порцию на 20 минут. 4) Окрашивание материала ацетогематоксилином в течение двух часов при температуре 25-28°C. 5) Промывка материала в 45%-ной уксусной кислоте. Раздавливание объекта на предметном стекле в капле жидкости Гойера. Просмотр микропрепаратов осуществлялся на микроскопе Микмед 6 при увеличении 40×1,5×10 и 100×1.5×10. Микрофотосъемку проводили с использованием цифровой камеры окуляра DCM500 (USB 2.0; WEBBERS MYscope 500 М). Критерием для отнесения линии к тому или иному уровню плоидности являлось существенное преобладание (свыше 70%) клеток в корневой меристеме с определенным уровнем плоидности.
По результатам оценки плоидности, представленным в таблице 2, была отобрана трансгенная линии P9GS11a, демонстрирующие ускоренные темпы роста и характеризующиеся триплоидным статусом.
Перечень последовательностей:
Краткое описание чертежей
Фиг. 1. Результаты оценки высоты растений различных трансгенных линий березы и исходного (бп4а) генотипа.
Стерильное триплоидное трансгенное растение березы пушистой с ускоренными темпами роста по сравнению с нетрансформированным растением, содержащее ген gs1 с SEQ ID NO:1 и полученное путем агробактериального переноса указанного гена gs1 в березу Betula pubescens бп4а.