Способ диагностики у детей хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана техногенного происхождения
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к экологии человека и токсикологии. Для диагностики у детей хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана техногенного происхождения, проводят отбор проб крови. При повышенном содержании в крови указанных металлов, по сравнению с референтным уровнем, определяют функционально- и лабораторно-диагностические показатели у ребенка. Способ позволяет диагностировать у детей хронический гастродуоденит, ассоциированный воздействием металлов техногенного происхождения для предупреждения развития осложнений за счет своевременного назначения адекватной терапии. 1 з.п. ф-лы, 11 табл.
Реферат
Изобретение относится к области медицины, экологии человека, токсикологии, в частности, к способам диагностики токсического действия хрома, никеля, марганца и хлорорганических соединений (хлороформа и тетрахлорметана) (далее - ХОС), в виде проявления у детей, проживающих в условиях техногенной нагрузки среды обитания, хронических воспалительно-дегенеративных заболеваний желудочно-кишечного тракта (далее - ХВДЗ ЖКТ), а именно: хронического гастродуоденита (код, согласно Международной классификации болезней 10-го пересмотра - МКБ-10: К-29.9).
Изобретение может быть использовано для раннего выявления хронического гастродуоденита (далее - ХГД), ассоциированного с воздействием указанных металлов и ХОС при поступлении с атмосферным воздухом и питьевой водой, для последующего проведения в отношении таких детей направленных лечебно-профилактических мероприятий.
По классическому определению ХГД - это воспалительное заболевание слизистой двенадцатиперстной кишки и пилорической зоны желудка (см. Википедия).
В рамках настоящего решения под термином «Хронический гастродуоденит, ассоциированный с воздействием металлов и хлорорганических соединений» понимается хроническое рецидивирующее заболевание, сопровождающееся воспалительным процессом и морфологической перестройкой слизистой оболочки желудка и двенадцатиперстной кишки (очаговой или диффузной) по гипотрофическому варианту с гипосекреторными, гипомоторно-эвакуаторными нарушениями и вегетативной дисфункцией по парасимпатическому типу.
Среда обитания промышленных городов характеризуется многосредовым загрязнением химическими веществами, в том числе, металлами (чаще возможен ингаляционный путь поступления металлов в организм ребенка), а также хлорорганическими соединениями (хлороформ и тетрахлорметан, поступающих в организм с питьевой водой).
Хронические воспалительные болезни ЖКТ - наиболее часто встречающиеся заболевания детского возраста, в структуре которых преобладают заболевания гастродуоденальной локализации, доля которых составляет 58-65%. Выявляемость хронических заболеваний желудка и 12-перстной кишки у детей регионов РФ увеличилась за последние 5 лет на 48,2% и в структуре детской гастроэнтерологической патологии регистрируются в 100-150 случаев на 1000 детей. Получены новые данные, указывающие, что патологический процесс у детей носит сочетанный характер поражения, распространяется с желудка на 12-перстную кишку.
Одной из причин, определяющих рост и формирование особенностей течения хронических гастродуоденальных заболеваний, является воздействие опасных химических факторов среды обитания, прежде всего, металлов (хром, никель, марганец) и хлорорганических соединений. По статистическим данным в 2013-2014 г.г. марганец и его соединения относились к ведущим загрязнителями атмосферного воздуха, (превышающие ПДКс.с. в 5 и более раз), а никель и хром - к стабильно присутствующим на уровне 1,3-1,5 ПДКс.с. Среди основных загрязнителей питьевой воды особое внимание уделяется тригалометанам (хлороформ, тетрахлорметан и др.), стабильно регистрирующимся в 8-13% проб питьевой воды в концентрациях в 2-8 раза выше гигиенических нормативов. Опасность хронического воздействия загрязняющих веществ, указывающая на вероятность поражения органов ЖКТ при многосредовом поступлении (с питьевой водой и атмосферным воздухом) для соединений хрома6+, марганца по суммарному индексу, составляет от 1,41 до 3,65. А комплексное воздействие химических соединений (металлы и хлорорганические соединения) обуславливает возникновение дополнительных случаев заболеваний желудка и 12-перстной кишки на уровне в год.
Существующие методы диагностики хронического гастродуоденита не учитывают влияния химических факторов риска на возникновение и течение заболевания, что ограничивает их возможности и не позволяет адекватно оценивать тяжесть процесса и вероятность его прогрессирования, развитие осложнений в старших возрастных группах и повышает риск инвалидизации. В связи с этим, является актуальным научное обоснование и разработка технологии диагностики у детей ХГД, обусловленного воздействием опасных химических факторов.
Из уровня техники известен ряд технических решений, представляющих собой способы диагностики заболевания ХГД.
Из Патента РФ №2574914 известен способ неинвазивной диагностики хронического гастродуоденита у детей, согласно которому определяют уровень катионного антимикробного пептида β-2-дефензина в кале методом иммуноферментного анализа. При достижении концентрации катионного антимикробного пептида β-2-дефензина в интервале величин от 31,2 нг/г до 87 нг/г диагностируют наличие активного хронического гастродуоденита. При достижении концентрации катионного антимикробного пептида β-2-дефензина равной или более 87 нг/г диагностируют наличие хронического гастродуоденита высокой степени активности. Недостатком этого способа является то, что способ не учитывает содержание у пациента токсичных металлов и ХОС в биологических средах, повышенный уровень которых обуславливает повышение степени тяжести патологического процесса, а следовательно, предложенные критерии не будут адекватно отражать стадию течения хронического гастродуоденита в условиях многосредового воздействия металлов и ХОС.
Также известен способ диагностики хронического гастродуоденита и функциональной диспепсии (Патент РФ №2255337), включающий исследование клинико-лабораторных показателей, при этом дополнительно определяют спонтанную адгезию лейкоцитов и их чувствительность к модуляторам клеточной адгезии - фитогемаглютинину, теофиллину, тималину. При показателях функциональной активности лейкоцитов в пределах нормы устанавливают диагноз функциональной диспепсии. При показателях функциональной активности лейкоцитов, превышающих пределы нормы, диагностируют хронический гастродуоденит.
К недостатку данного известного способа относится использование сложных инвазивных методик. Кроме того, вышеуказанные показатели являются неспецифическими и участвуют в развитии различных патологических процессов, что снижает чувствительность и специфичность метода, а также усложняет интерпретацию полученных результатов, снижая степень их достоверности.
Известен способ диагностики хронического гастродуоденита и функциональной диспепсии (Патент РФ №2270610), включающий определение газохроматографическим методом в слюне уксусной, пропионовой и масляной кислот, и при концентрации любой из трех кислот: уксусной больше 0,910 ммоль/л, пропионовой больше 0,150 ммоль/л, масляной больше 0,013 ммоль/л диагностируют хронический гастродуоденит, а при концентрациях кислот: уксусной в пределах больше 0,010 до 0,910 ммоль/л, пропионовой до 0,150 ммоль/л, масляной до 0,013 ммоль/л диагностируют функциональную диспепсию.
Недостатками данного способа являются трудоемкость исследования, что затрудняет широкое использование вышеуказанного метода в практическом использовании, а также невозможность оценки степени поражения слизистой оболочки желудка.
Известен способ определения патологии гастродуоденальной зоны (Патент РФ №2128335), включающий кристаллографическое исследование с NaCl слюны, анализ результатов по системе кристаллизации NaCl и величине морфотипов жидкокристаллических структур, а также кристаллографическое исследование экссудата.
Недостатками данного способа являются трудоемкость исследования и субъективность при интерпретации полученных результатов анализа, что снижает его достоверность.
В авторском свидетельстве СССР №1409928 описан способ диагностики гастродуоденита у детей, согласно которому у пациента натощак собирают слюну, центрифугируют 10 мин. при 3000 об/мин, затем определяют содержание креатина, при значении которого более 73 мкмоль/л относительно нормы, делают вывод о наличии гастродуоденита.
Из патента РФ №2255337 известен способ дифференциальной диагностики хронического гастродуоденита и функциональной диспепсии у детей, у которых исследуют клинико-лабораторные показатели, при этом дополнительно определяют спонтанную адгезию лейкоцитов и их чувствительность к модуляторам клеточной адгезии - фитогемаглютинину (ФГА), теофиллину, тималину. При показателях функциональной активности лейкоцитов в пределах нормы: спонтанная адгезия нейтрофилов 28,03±2,0%; моноцитов 30,04±1,27%; лимфоцитов 20,81±0,97% и модулированной адгезии нейтрофилов: ФГА 31,02±1,27%, теофиллин 30,88±1,07%, тималин 32,66±2,01%; моноцитов: ФГА 32,15±1,11%, теофилин 31,02±2,07%, тималин 31,54±1,21%, лимфоцитов: ФГА 23,05±1,27%, теофиллин 22,14±1,12%, тималин 21,98±1,09% устанавливают диагноз функциональной диспепсии. При показателях функциональной активности лейкоцитов, превышающих пределы нормы, диагностируют хронический гастродуоденит.
Недостатком указанного способа является неспецифичность вышеуказанных показателей, которые участвуют в развитии многих других различных патологических процессов, что снижает чувствительность и специфичность метода, а также затрудняет интерпретацию полученных результатов при постановке диагноза.
При этом из уровня техники не были выявлены известные способы диагностики хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца и хлорорганических соединений (хлороформа и тетрахлорметана) техногенного происхождения, поэтому сделать выбор ближайшего аналога к заявляемому объекту не представляется возможным.
Технический результат, достигаемый предлагаемым изобретением, заключается в создании информативного и доказательного способа диагностики у детей хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана, техногенного происхождения, позволяющего в последующем назначить адекватную терапию и предупредить развитие осложнений.
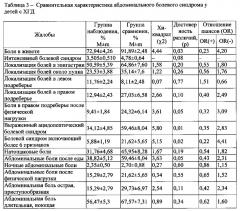
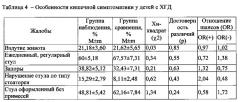
Поставленный технический результат достигается предлагаемым Способом диагностики у детей хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана техногенного происхождения, согласно которому у ребенка производят отбор пробы крови, устанавливают в ней содержание хрома, никеля, марганца, хлороформа и тетрахлорметана, и при повышенном содержании в крови указанных металлов, по сравнению с референтным уровнем более чем в 2 раза, а также при наличии в крови хлороформа и тетрахлорметана выше нижнего предела обнаружения, определяют функциональные диагностические показатели, характеризующие у ребенка: состояние вегетативной регуляции; функциональное состояние билиарного тракта; функциональное состояние печени; кислотность желудочного сока; состояние слизистой желудка и 12-перстной кишки; моторную функцию желудка и 12-перстной кишки, а также осуществляют определение в сыворотке крови ребенка уровень следующих лабораторных диагностических показателей: пепсиногена I, пепсиногена II, дофамина, серотонина, кортизола, тиреотропного гормона ТТГ, антиоксидантной активности АОА, глутатионпероксидазы ГлПО, малонового диальдегида МДА, гидроперекиси липидов, аспартатаминотрансферазы АСАТ, щелочной фосфатазы, фагоцитарной активности лейкоцитов: абсолютное число фагоцитов, фагоцитарное число, фагоцитарный индекс, иммуноглобулина A IgA и секреторного иммуноглобулина в слюне sIgA, и далее, если у ребенка выявлено отклонений от возрастной физиологической нормы не менее 80% указанных функциональных и лабораторных диагностических показателей, характеризующих наличие: нарушения вегетативной регуляции в виде ваготонического исходного вегетативного тонуса и асимпатикотонической реактивности; функционального нарушения билиарного тракта по типу гипомоторного нарушения желчного пузыря; пониженной кислотности желудочного сока; гипотрофии слизистой оболочки желудка и 12-перстной кишки; увеличения размеров печени и ее реактивное изменение, нарушения моторной функции желудка и 12-перстной кишки по гипомоторному типу с наличием дуоденогастрального, дуодено-бульбарного, бульбогастрального рефлюксов, и при наличии следующих отклонений лабораторных диагностических показателей: превышение относительно физиологической возрастной нормы уровня пепсиногена II более чем на 20%; кортизола более чем на 10-15%; ТТГ более чем на 10%; МДА более чем в 2 раза; гидроперекиси липидов более чем в 1,5 раза; АСАТ более чем в 1,3 раза; щелочной фосфатазы более чем в 1,4 раза; IgA более чем на 30%; а также снижение относительно физиологической возрастной нормы уровня пепсиногена I более чем на 15%; дофамина более чем на 20%; серотонина более чем на 15%; АОА более чем в 1,5 раза; ГлПО более чем в 1,5 раза; фагоцитарного числа и фагоцитарного индекса более чем в 1,2 раза; абсолютного числа фагоцитов более чем в 1,3 раза; sIgA более чем на 30%, диагностируют у ребенка хронический гастродуоденит, ассоциированный с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана техногенного происхождения.
Функциональные диагностические показатели определяют инструментальными методами: кардиоинтервалография, ультразвуковое исследование сканирование гепатобилиарной зоны и верхних отделов желудочно-кишечного тракта, рН-метрия, фиброгастродуоденоскопия.
Следует указать, что заболеваемость детского населения (на примере территорий Пермского края) болезнями органов пищеварения (далее - БОП) за последние 15 лет увеличилась в 3,4 раза и на 1 января 2014 г. составила , при этом ее прогнозный уровень к 2018 г. составил . В ходе изучения структуры БОП установлено, что на долю хронического гастродуоденита приходится 21,9-30,7% всей патологии желудочно-кишечного тракта у детей.
Для понимания существа вопроса следует пояснить, что проблема оценки влияния промышленного загрязнения окружающей среды на здоровье детского населения является актуальной для многих стран мира, в том числе и для России. Детская популяция представляет собой группу высокого риска, так как дети имеют ряд физиологических особенностей, характеризуются наличием критических периодов развития, большей чувствительностью к влиянию токсичных веществ.
При воздействии химических соединений, в первую очередь, страдают неспецифические звенья защитных систем, в частности, иммунная и биохимическая системы, обеспечивающие поддержание гомеостаза. Комплекс биохимических реакций, направленных на метаболизм и трансформацию токсических соединений экзогенного происхождения, определяет развитие адаптационно-компенсаторных процессов. Нарушение согласованности этапов биотрансформации, являясь одним из общих механизмов эндогенной интоксикации, способствует поддержанию воспаления и дисрегенерации при гастроэнтерологических заболеваниях.
Механизм повреждающего действия металлов: хрома, никеля, марганца, и ХОС является сложным и неоднозначным. Выделяют общие патоморфологические механизмы их реализации на клеточно-молекулярном уровнях: генотоксический, ферментотоксический и мембранотоксический. Мембранная концепция исходит из предпосылки, что металлы и ХОС обладают сильными прооксидантными свойствами.
Развитие ХГД у детей сопровождается повреждением тканей, вследствие избыточного образования в них активных форм кислорода, основным источником которых в гастродуоденальной зоне являются полиморфноядерные лейкоциты, инфильтрирующие слизистую оболочку желудка и 12-перстной кишки. Снижение активности системы антиоксидантной защиты способствует повышению активности свободнорадикальных процессов и усиленному образованию токсических продуктов, вызывающих мембрано-деструктивный эффект и освобождение медиаторов воспаления. Перекисное окисление липидов катализируется ионами металлов с переходной валентностью (никель, хром, марганец и др.), что на фоне снижения антиокислительной защиты приводит к повышению уровня МДА и снижению фракции восстановленного глутатиона и, в конечном итоге, приводит к мембранопатологическим процессам. Результатом мембрано- и ферментопатологического действия металлов является нарушение функции митохондрий, приводящее к снижению продукции макроэргов, падению активности АТФ-зависимых ферментных систем. Металлы являются сильными повреждающими агентами для эпителия тонкой кишки, вызывающими деградацию и хронический воспалительный процесс.
Анализ существующей научной и методической литературы позволил выделить общие закономерности и особенности механизма реализации повреждающего действия ряда металлов и хлорорганических соединений.
Никель - эссенциальный микроэлемент из группы металлов, при экзогенном поступлении которого в организм формируются морфофункциональные реакции, особенно отчетливо выявляющиеся в ЖКТ. Происходят дистрофические изменения эпителия верхушечных отделов ворсин, инфильтрация стромы плазматическими и лимфоидными клетками, увеличение количества гликопротеидов на поверхности эпителия и в бокаловидных клетках, повышение содержания рибонуклеиновых кислот в апикальных отделах эпителия ворсин. В тонком кишечнике обнаруживается выраженная пролиферация лимфогистиоцитарных элементов в строме ворсинок.
Хром - микроэлемент из группы металлов, при экзогенном поступлении которого существенно нарушается биологический процесс окисления, наблюдается угнетение тканевого дыхания, приводящее к подавлению энергетического обмена в клетках. Действие на слизистую оболочку ЖКТ способствует нарушению секреторной и моторной функций желудка, воспалительным изменениям и частому развитию гастродуоденитов, отмечается угнетение кислотообразующей функции при незначительном изменении пепсинообразования. В кровяном русле хром специфически связывается с трансферрином, который служит переносчиком не только железа, но и хрома, что приводит к развитию у больных с ХГД анемии.
Марганец - эссенциальный металл, играет важную роль в метаболизме клетки и защите клеточных мембран, концентрируется в митохондриях, при этом наиболее высокие его концентрации формируются в энтероцитах, печени, поджелудочной железе. При экспозиции марганца наблюдаются хронические гастриты с пониженной желудочной секрецией, нарушение белковообразовательной функции печени, витаминного и углеводного обменов (гипогликемизирующий эффект).
Тетрахлорметан относится к чрезвычайно опасным химическим веществам (1 класс опасности). В процессе своего метаболизма в эндоплазматической сети и микросомах клеток печени образует еще более токсичные свободные радикалы, а также хлороформ. Взаимодействие радикалов с фосфолипидами внутриклеточных мембран инициируют перекисное окисление липидов с последующим развитием цепной реакции свободно-радикального окисления, что приводит к подавлению активности мембраносвязанных ферментов, нарушению их белоксинтезирующей активности, выходу цитозольных ферментов в кровь, деструкции нуклеотидов, декомпартментализации кальция, к апоптозу и некрозу гепатоцитов. Метаболические превращения тетрахлорметана являются основой гепатотоксического действия.
Патогенетический механизм действия хлороформа на органы гастродуоденальной зоны является опосредованным, через нарушение нейрогуморальной регуляции. В тоже время, при хроническом поступлении хлороформа в организм с питьевой водой наблюдаются локальные воспалительные изменения слизистой оболочки желудка, кишечника. Токсичность хлороформа обусловлена воздействием промежуточных продуктов его метаболизма, количество которых увеличивается при ускоренном обмене веществ, свойственном детскому организму. Метаболиты образовывают ковалентные связи с микросомальными белками и ферментами, что способствует повреждению и гибели клеток. Показано, что соединения хлора окисляются в печени цитохромом Р-450 с образованием сильных реагентов - дигалокарбонилов, которые ответственны за энтеро- и гепатотоксичность.
Вот почему разработка способа диагностики у детей ХГД, обусловленного воздействием опасных химических факторов, является очень важной в плане ранней выявляемости данной патологии и последующих профилактических мероприятий.
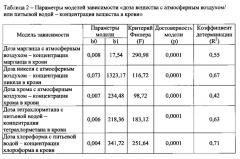
Благодаря тому, что в предлагаемом способе используют информацию о содержании хрома, никеля, марганца, хлороформа и тетрахлорметана в крови ребенка и заявляемые конкретные функциональные и лабораторные диагностические показатели, в совокупности характеризующие специфическое техногенное
происхождение хронического гастродуоденита, клиническая значимость которых доказана методом корреляционно-регрессионного анализа, обеспечивается дополнительная информационная связь изменений указанных лабораторных показателей с определенным, заявляемым превышением над референтным уровнем, содержания в крови указанных металлов и ХОС, что делает предлагаемый способ точным и достоверным.
Кроме того, результаты испытаний показали, что для установления точного диагноза возникновения ХГД, ассоциированного с внешнесредовым токсическим воздействием указанных металлов и ХОС техногенного происхождения, достаточно, чтобы у ребенка наблюдалось отклонение лабораторных диагностических показателей в следующих пределах:
- превышение относительно физиологической возрастной нормы уровня пепсиногена II более чем на 20%; кортизола более чем на 10-15%; ТТГ более чем на 10%; МДА более чем в 2 раза; гидроперекиси липидов более чем в 1,5 раза; АСАТ более чем в 1,3 раза; щелочной фосфатазы более чем в 1,4 раза; IgA более чем на 30%;
- снижения относительно физиологической возрастной нормы уровня пепсиногена I более чем на 15%; дофамина более чем на 20%; серотонина более чем на 15%; АОА более чем в 1,5 раза; ГлПО более чем в 1,5 раза; фагоцитарного числа и фагоцитарного индекса более чем в 1,2 раза; абсолютного числа фагоцитов более чем в 1,3 раза; slgA более чем на 30%, что было подтверждено параметрами модели. Причем достаточно, чтобы отклонения были в количестве не менее 80% от совокупности указанных функциональных и лабораторных показателей. Исследования показали, что достоверная корреляция между указанными лабораторными показателями и концентрацией хрома, никеля, марганца в крови достигается только при повышенном, по сравнению с референтным уровнем, содержанием более чем в 2 раза, и при одновременном наличии в крови хлороформа и тетрахлорметана выше нижнего предела обнаружения (предел обнаружения в химическом анализе - минимальное содержание определяемого вещества в пробе, сигнал от которого можно надежно отличить от фона. https://ru.wikipedia.org/wiki/).
При более низкой концентрации указанных химических веществ в пробе крови достоверная связь между этой концентрацией и лабораторными показателями в отношении ХГД не выявлена.
Это, по-видимому, обусловлено тем, что указанные металлы при их содержании в крови ниже указанной цифры оказывают повреждающее действие на ЖКТ только в пределах функционального расстройства желудка и 12-перстной кишки (1-я стадия), без повреждения слизистой желудка, как в случае ХГД.
Переход к установлению указанных выше лабораторных показателей и их отклонению от физиологической нормы необходим при наличии у ребенка изменений следующих функциональных диагностических показателей, характеризующих: нарушения вегетативной регуляции в виде ваготонического исходного вегетативного тонуса и асимпатикотонической реактивности; функционального нарушения билиарного тракта по типу гипомоторного нарушения желчного пузыря; пониженной кислотности желудочного сока; гипотрофии слизистой оболочки желудка и 12-перстной кишки; увеличения размеров печени и ее реактивное изменение, - нарушения моторной функции желудка и 12-перстной кишки по гипомоторному типу с наличием дуоденогастрального, дуоденобульбарного, бульбогастрального рефлюксов.
Таким образом, предлагаемый способ позволяет диагностировать с достаточной точностью ХГД у детей, обусловленный токсическими эффектами воздействия указанных металлов и ХОС. Все это позволит повысить эффективность профилактики и медикаментозного лечения заболевания у детей с точным диагнозом, обеспечить конкретное планирование санитарно-гигиенических мероприятий по предупреждению и устранению воздействия вредных химических веществ, обуславливающих экологически обусловленную патологию у детей.
Исходя из вышеизложенного, можно сделать вывод, что поставленный технический результат обеспечивается за счет совокупности всех операций предлагаемого способа, их последовательности и режимов его реализации.
При практической реализации предлагаемого способа осуществляют следующие операции в нижеуказанной последовательности:
1. Выбирают экологически неблагополучную территорию по высокой нагрузке химических факторов среды обитания. При этом, указанную территорию выбирают в отношении детского населения в возрасте 8-12 лет, проживающего на этой территории, которая характеризуется:
- повышенным уровнем заболеваемости детей (выше регионального и/или среднероссийского) гастродуоденальной патологией (МКБ-10: К-29.9). Для формирования указанного контингента детей, проводится ретроспектный анализ фактической заболеваемости ЖКТ по данным обращаемости за медицинской помощью. Выделяется группа детей в возрасте 8-12 лет (наиболее уязвимая возрастная группа по первичной манифестации исследуемой нозологической формы) с частотой обращаемости за медицинской помощью два и более раза в год;
- загрязнением атмосферного воздуха (на примере металлов) и воды хозяйственно-питьевого водоснабжения (на примере хлорорганических соединений) в концентрациях, превышающих гигиенические нормативы и определяющих основной вклад в формирование неприемлемого риска заболеваний ЖКТ; При этом исследование качества атмосферного воздуха и питьевой воды проводится согласно Постановлению правительства РФ от 02.02.2006 г. №60 «Положение о проведении социально-гигиенического мониторинга с изменениями от 04.09.2012 г.,
- наличием неприемлемого риска (НI>1,0) развития патологии ЖКТ, ассоциированной с аэрогенной экспозицией указанных металлов и пероральной экспозицией ХОС, воздействие которых лежит в основе формирования ХГД. Оценка риска развития указанного заболевания (МКБ-10:К-29.9) осуществляется по стандартизованной методике в соответствии с «Руководством по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду» (Р 2.1.10.1920-04);
2. Для обоснования маркеров негативных эффектов, характеризующих риск-ассоциированный патоморфоз заболевания ХГД, проводятся медико-биологические исследования, включающие комплекс клинических (анализ наследственности, анамнестических данных, особенностей клинического течения), функциональных, инструментальных (кардиоинтервалография, УЗИ гепатобилиарной зоны и верхних отделов ЖКТ, pH-метрия, фиброгастродуоденоскопия (ФГДС), лабораторных (биохимические, иммунологические, иммуноферментные, иммуногенетические), химико-аналитических исследований (содержание марганца, хрома, никеля, хлороформа, тетрахлорметана в крови).
3. У каждого ребенка из сформированной выборки проводят отбор пробы крови и устанавливают в ней содержание хрома, никеля, марганца, хлороформа и тетрахлорметана.
4. При повышенном содержании в крови указанных металлов, по сравнению с референтным уровнем более чем в 2,0 раза, а также при наличии в крови хлороформа и тетрахлорметана выше нижнего предела определения, определяют инструментальными методами функциональные диагностические показатели, характеризующие: состояние вегетативной регуляции; функциональное состояние гепатобилиарного тракта; функциональное состояние печени; кислотность желудочного сока; состояние слизистой желудка и 12-перстной кишки; моторную функцию желудка и 12-перстной кишки.
5. Также осуществляют исследование по определению в сыворотке крови ребенка уровня следующих лабораторных диагностических показателей: пепсиногена I, пепсиногена II, дофамина, серотонина, кортизола, ТТГ, АОА, ГлПО сыворотки крови, МДА, гидроперекиси липидов, АСАТ, щелочной фосфатазы; фагоцитарной активности лейкоцитов крови; иммуноглобулина А в слюне (sIgA) и в сыворотке крови (IgA).
6. Устанавливают отклонения от нормы указанных функциональных, и лабораторных диагностических показателей, характеризующие наличие:
- нарушения вегетативной регуляции по типу ваготонического исходного вегетативного тонуса и асимпатикотонической реактивности;
- функционального нарушения билиарной системы по типу гипомоторного нарушения желчного пузыря;
- пониженной кислотности желудочного сока;
- гипотрофии слизистой оболочки желудка и 12-перстной кишки;
- увеличения размеров печени и ее реактивное изменение,
- нарушения моторной функции желудка и 12-перстной кишки по гипомоторному типу с наличием дуоденогастрального, дуоденобульбарного, бульбогастрального рефлюксов;
при наличии превышения относительно физиологической возрастной нормы уровня:
- пепсиногена II более чем на 20%;
- кортизола более чем на 10-15%;
- ТТГ более чем на 10%;
- МДА более чем в 2 раза;
- гидроперекиси липидов более чем в 1,5 раза;
- АСАТ более чем в 1,3 раза;
- щелочной фосфатазы более чем в 1,4 раза;
- IgA более чем на 30%;
и снижения относительно физиологической возрастной нормы уровня
- пепсиногена I более чем на 15%;
- дофамина более чем на 20%;
- серотонина более чем на 15%;
- АОА более чем в 1,5 раза;
- ГлПО более чем в 1,5% раза;
- фагоцитарного числа и фагоцитарного индекса более чем в 1,2 раза;
- абсолютного числа фагоцитов более чем в 1,3 раза
- sIgA более чем на 30%;
7. Если у ребенка выявлено отклонений от нормы не менее 80% от количества указанных функциональных и лабораторных диагностических показателей, ставят ребенку диагноз хронического гастродуоденита, ассоциированного с воздействием хрома, никеля, марганца, хлороформа и тетрахлорметана техногенного происхождения.
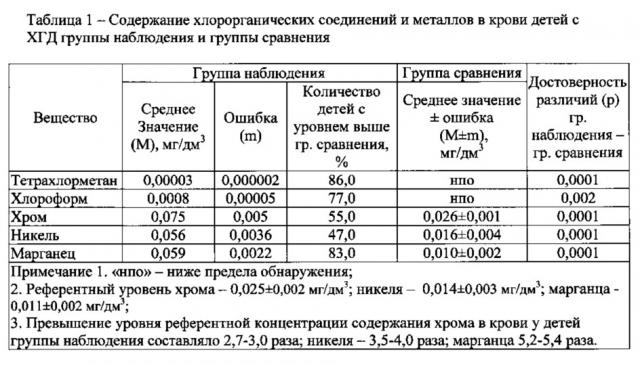
В качестве критериев оценки отклонений лабораторных показателей используются возрастные физиологические уровни: для содержания хрома, никеля, марганца - референтные уровни (Н. Тиц, 2003), для содержания ХОС - предел обнаружения в соответствии с методом определения ХОС в крови (МУК 4.1.2115-06 «Определение массовой концентрации хлороформа, 1,2-дихлорэтана, тетрахлорметана в биосредах (кровь) методом газохроматографического анализа равновесного пара»).
Основными методами исследований при реализации предлагаемого способа являлись:
- санитарно-гигиенические: сравнительный анализ результатов мониторинговых наблюдений; пространственно-временной анализ в среде ГИС с использованием программы УПРЗА «Эколог», версия 3.0 и «Эколог-средние» - 15 моделей по 3 элементам на площадке из 65000 точек; расчет коэффициентов и индекса опасности для 5 компонентов (Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду: Руководство 2.1.10.1920-04.М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004. 143 с.); эпидемиологические методы с использованием одномерного статистического анализа и построением трендовой модели с динамическим экспоненциальным сглаживанием (Четыркин Е.М. Статистические методы прогнозирования. М.: Статистика. 1977. 356 с.);
- диагностические: клинические (анализ наследственности, анамнестических данных, особенностей клинического течения), функциональные и инструментальные (кардиоинтервалография, ФГДС, рН-метрия, УЗИ-сканирование); лабораторные (общеклинические - гематологические показатели; биохимические - показатели окислительно-антиоксидантных процессов, ферментативной активности, воспалительных реакций (в сыворотке крови); иммуно-аллергологические - показатели клеточного, гуморального, специфического иммунитета; иммуноферментные - показатели обмена нейромедиаторов, гормонов щитовидной железы) (Медицинские лабораторные технологии и диагностика: справочник. Медицинские лабораторные технологии в 2-х томах / Под ред. А.И. Карпищенко. С-Пб: Интермедика, 2002. 408 с.);
- химико-аналитические методы исследования (газовая хроматография на газовом хроматографе Хроматэк-Кристалл-500, масс-спектрометрия с индуктивно связанной плазмой на масс-спектрометре Agilent 7500 сх).
Для доказательства правомерности применяемых в предлагаемом способе диагностических показателей был использован корреляционный анализ между полученными функциональными и лабораторными диагностическими показателями и содержанием хрома, никеля, марганца, хлороформа и тетрахлорметана в крови ребенка с использованием модели логистической регрессии, согласно которой рассчитывают вероятность негативного изменения маркера ответа организма (вышеуказанные диагностические показатели) при воздействии на организм маркера экспозиции (указанных токсикантов). Выявление и оценка связи между изменением показателей у детей и концентрацией указанных токсикантов в крови выполняется на основании расчета показателя отношения шансов (OR) и его доверительного интервала (DI). Критерием наличия связи «концентрация хрома, никеля, марганца, хлороформа и тетрахлорметана в крови - показатель ответа» является OR≥1. Обоснование маркеров ответа осуществляется на основании оценки параметров зависимости изменения показателя отношения шансов от концентрации этих металлов и наличия ХОС в крови, описываемой регрессионной моделью в виде экспоненциальной функции. В качестве критерия для проверки статистических гипотез используется критерий Фишера (F). Различия считаются статистически значимыми при вероятности р≤0,05.
Пример конкретной реализации предлагаемого способа:
1. Способ был апробирован на экологически неблагоприятной территории г. Чусового Пермского края. В ходе изучения структуры болезней органов пищеварения (БОП) установлено, что на долю ХГД приходится 21,9-30,7% всей патологии желудочно-кишечного тракта у детей. Наиболее неблагополучной ситуацией по заболеваемости детей ХГД из 12 промышленно-развитых регионов края характеризовался город Чусовой, минимальным уровнем заболеваемости - г. Кунгур.
Заболеваемость детского населения г. Чусовой ХГД за последние 15 лет увеличилась с до и с 2005 г. превышала среднекраевой в 1,2 раза.
Данные натурных наблюдений свидетельствуют о превышении гигиенических нормативов в атмосферном воздухе жилой застройки по марганцу, никелю, хрому на уровне 1,3-1,5 ПДКс.с. Расчетные концентрации загрязняющих веществ на участках селитебной территории составляют 1,8-2,2 ПДКс.с. В зонах экспозиции при этом находится около 1,5 тыс. детей.
Источниками питьевого водоснабжения населения г. Чусовой является вода поверхностных водоемов. Результаты мониторинговых наблюдений качества питьевой воды свидетельствуют о превышении гигиенических нормативов по содержанию преимущественно хлороформа в среднем до 2,5-2,8 ПДК (максимум до 5,3-7,3 ПДК) и тетрахлорметана - до 2,1 ПДК. Доля нестандартных проб составляет 52,5%-100%.
Расчет коэффициентов и индекса опасности при хронической многосредовой экспозиции с атмосферным воздухом и питьевой водой изучаемыми химическими факторами выявил недопустимый риск поражения центральной нервной системы (ЦНС) и гепатобилиарной системы, дисфункциональные нарушения которых инициируют развитие ХВДЗ ЖКТ, превышающий приемлемый уровень (HQ=1) в 27-44 раза по металлам и в 2,4 раза - по ХОС. Одновременное поступление данных загрязнений увеличивает риск поражения критических систем (HI=29-46). Долевой вклад металлов - 95%, ХОС - 5%.
2. Для обоснования у детей диагностических показателей диагностики ХГД, ассоциированного с воздействием хрома, никеля, марганца и хлорорганических соединений (хлороформа и тетрахлорметана), было проведено анамнестическое, клиническое, функциональное, инструментальное и лабораторное обследование. Группу наблюдения составили 320 человек в возрасте 8-12 лет с установленным ранее диагнозом - заболевание верхних отделов ЖКТ (МКБ-10: К-29.9) вне обострения (49% мальчиков и 51% девочек), проживающих постоянно на выбранной территории Пермского края (г. Чусовой). Группу сравнения составили 230 д