Способ нейропротекции в эксперименте
Иллюстрации
Показать всеИзобретение относится к области создания способа нейропротекции в эксперименте, включающего введение средства, содержащего биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С. Использование данного изобретения позволяет выполнить исследования нейропротекции на клеточной модели (in vitro), имитирующей условия in vivo, включающей введение в клеточную модель средства, содержащего биодеградируемые матриксы на основе фиброина шелка и пептид-агонист рецептора ПАР1, освобождаемого активированным протеином С. 2 з.п. ф-лы, 6 ил., 3 пр.
Реферат
Область техники
Изобретение относится к экспериментальной медицине и может быть использовано для проведения исследований нейропротекции на клеточной модели (in vitro), имитирующей условия in vivo, включающей введение в клеточную модель средства, содержащего биодеградируемые матриксы на основе фиброина шелка и пептид-агонист рецептора ПАР1, освобождаемого активированного протеина С.
Уровень техники
На сегодняшний день большинство используемых в терапии разных заболеваний лекарств имеют серьезные недостатки, связанные с наличием многочисленных побочных эффектов и противопоказаний. Кроме того, лечение острых тяжелых заболеваний часто связано с ограничением терапевтического окна, в течение которого необходимо использовать лекарства. Это часто сопровождается невысокой эффективностью лечебного процесса и нежелательными осложнениям и дальнейшей инвалидизацией.
Сложная ситуация складывается при лечении инсультов и тяжелых воспалительных заболеваний и травм. Ишемический инсульт - острое нарушение мозгового кровообращения, сопровождается гибелью клеток мозга и нарушением его функций вследствие тромбоза или тромбоэмболии сосудов мозга. По данным ВОЗ от инсультов в мире ежегодно умирают около 6,4 млн человек. Ежегодная смертность от инсульта в нашей стране - одна из наиболее высоких в мире. Летальность в остром периоде инсульта в России достигает 35%, возрастая на 15% к концу первого года после перенесенного инсульта. Инсульт - лидирующая причина инвалидизации населения.
Оптимизация лечения ишемического инсульта и тяжелых воспалительных заболеваний - одна из самых актуальных проблем медицины и патофизиологии.
В настоящее время для лечения ишемического инсульта, который вызван окклюзией сосуда, кроме классического применения антиоксидантов, антикоагулянтов и антиаггрегантов, используют технологию или механического удаления тромба(ов) в сосудах мозга или тромболитическую терапию с помощью тканевого активатора плазминогена (ТАП). ТАП - протеолитический фермент, (утвержденный FDA, США) стимулирует лизис тромбов, активируя образование протеазы - плазмина, и восстановление кровотока (реперфузию) окклюзированного сосуда. Проводить целенаправленный тромболизис с помощью ТАП трудная и сложная задача из-за многообразия факторов риска. ТАП вызывает не только тромболизис, ангио- и нейрогенез, но также тяжелое побочное действие, приводя к нарушению гематоэнцефалического барьера, геморрагии и гибели нейронов мозга в моделях инсульта на животных.
Как показали эксперименты на животных с экспериментальной ишемией мозга и первые доклинические исследования (в США), введение вместе с ТАП в острый период инсульта белка крови - активированного протеина С (АПС), блокирует вызванную ТАП гибель нейронов и стабилизирует ГЭБ.
Рецепторы, активируемые протеиназами (ПАР) опосредуют регуляторное влияние сериновых протеиназ на клетки разных тканей [Coughlin S.R. Thromb. Haemost. 2005. V. 3 (8). P. 1800-1814]. Эти рецепторы были впервые открыты в начале 1990-х годов, на данный момент их известно 4 типа - ПАР - 1, 2, 3 и 4.
ПАР-рецепторы относятся к семейству семидоменных трансмембранных рецепторов, сопряженных с G-белками. Внеклеточный N-конец ПАР содержит пептидную связь «активационного сайта», которая расщепляется сериновой протеиназой. Вновь образованный N-конец, так называемый «привязанный лиганд», взаимодействуя со второй внеклеточной петлей рецептора, приводит к изменению конформации молекулы ПАР и его активации. Активация ПАР является необратимой, после активации рецептор интернализуется и подвергается лизосомальной деградации.
Из семейства рецепторов, активируемых протеиназами, ПАР1 является наиболее изученным. ПАР1 был впервые идентифицирован как рецептор тромбина.
Настоящее изобретение подразумевает использование другого агониста ПАР1 - пептида, освобождаемого АПС при расщеплении ПАР1.
В частном варианте реализации пептид, освобождаемый АПС при расщеплении ПАР1 имеет структуру NPNDKYEPF амида.
Активированный протеин С (АПС) - сериновая протеиназа семейства трипсина, образуется в фазе инициации свертывания крови в результате ограниченного протеолиза протеина С крови тромбином, связанным с тромбомодулином эндотелия. Активация протеина С комплексом тромбин-тромбомодулин существенно ускоряется при связывании протеина С с рецептором на эндотелии сосудов - эндотелиальным рецептором протеина С.
В системе гемостаза АПС играет ключевую роль в реализации антикоагулянтной функции. АПС в присутствии кофактора - протеина S блокирует образование тромбина на ранней стадии свертывания крови механизмом отрицательной обратной связи [Hanson SR, Griffin JH, Harker LA, Kelly AB, Esmon CT, Gruber A. J Clin Invest. 1993. V. 92 (4). P. 2003-12], поскольку инактивирует необходимые кофакторы свертывания крови - факторы Va и VIIIa, специфично гидролизуя в каждом по три пептидные связи.
Наряду с антикоагулянтными функциями АПС оказывает цитопротекторное, антиапоптотическое, противовоспалительное действие. Недавние исследования показали, что АПС способен оказывать защитное действие при таких острых состояниях, как сепсис, диабетическая нейропатия, инсульт, рассеянный склероз и при прогрессирующих метастазах [Esmon СТ1, Glass JD. J Clin Invest. 2009. V. 119 (11). Р. 3205-7].
Показано, что АПС является нейроунокпротектором в стрессированных нейронах и в эндотелии мозга при гипоксии. Протекторное действие АПС было продемонстрировано не только на тканях мозга, но и в других органах и тканях. В экспериментах in vivo и in vitro показано защитное действие АПС на эндотелиальные клетки легких, слизистой желудка и пупочной вены, что приводило к восстановлению барьерных функций сосудистой стенки и улучшению кровотока в органах в условиях повреждающих воздействий, например эндотоксина, стресса, тромбина [Nakamura М., Gabazza Е.С., Imoto I., Yano Y., Taguchi O., Horiki N., Fukudome K., Suzuki K., Adachi Y. J Thromb Haemost. 2005. V. 3. Р. 2721-9].
Препараты рекомбинантного АПС (рАПС, Зигрис) разрешены FDA (США) для лечения системного воспаления (сепсиса) у детей и взрослых. Было показано, что рАПС снижает смертность больных с тяжелым сепсисом. Однако, недавно обнаружено, что ведение высоких концентраций рАПС на раннем этапе реперфузии не вызывало устойчивую нейропротекцию и не улучшало исход после глобальной ишемии головного мозга, остановки сердца и острого воспаления [Teschendorf Р, Padosch SA, F, Albertsmeier M, Schneider A, Vogel P, Choi YH, BW, Popp E. Neurosci Lett. 2008. V. 448 (2). P. 194-9].
Также были созданы модифицированные препараты рАПС, лишенные антикоагулянтной активности, но сохраняющие цитопротекторные свойства. Однако их преклинические исследования только начинаются и сохраняются возможности тяжелых побочных реакций на вводимый белок [Wang Т, Lee МН, Choi Е, Pardo-Villamizar СА, Lee SB, Yang IH, Calabresi PA, Nath A. PLoS One. 2012. V.7(8): e43950].
Раскрытие изобретения
Задачей изобретения является создание способа нейропротекции в эксперименте, включающего введение биодеградируемого полимерного матрикса на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемого АПС.
Поставленная задача решается способом нейропротекции в эксперименте, включающим введение биодеградируемого полимерного матрикса на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С, в котором иммобилизация пептида-агониста рецепторов ПАР1 на носитель проводят в водном растворе фиброина шелка с концентрацией от 0,05 до 0,2 мг/мл, при концентрации пептида от 1,0 до 1,5 мг/мл.
Техническим результатом, достигаемым при использовании изобретения, является эффект нейропротекции в эксперименте при введении в острый период стресса активированного протеина С (АПС), который блокирует вызванную тканевым активатором плазминогена гибель соответствующих клеток (нейронов, астроцитов и т.п.) т.е. действует в качестве антагониста.
Использование в способе пептидов-агонистов ПАР1, освобождаемых АПС, обусловлено их дешевизной по сравнению с рекомбинантным и модифицированным АПС. Однако есть опасность их быстрого расщепления пептидазами в организме.
Иммобилизация пептидов в полимерные матрицы или микрочастицы позволяет защитить пептиды от разрушения, а также регулировать скорость их выхода в условиях in vitro. В связи с этим особую значимость приобретает правильный выбор полимерной матрицы.
Использование полимерных матриц или микрочастиц на основе фиброинов шелка или полисахаридов - альгинатов и др. позволяет получать матрицы, которые являются не только биосовместимыми, но и биодеградируемыми, а следовательно, могут быть предложены для направленного нейропротекторного действия in vitro.
Однако до настоящего времени не были созданы препараты пептидов со свойствами АПС, иммобилизованные в биодеградируемые полимерные матрицы, и не было исследовано их нейропротекторное действие.
Известно, что одной из проблем фармакотерапии является поиск путей защиты фармпрепаратов от протеолиза и снижение дозировки препарата на фоне пролонгирования его действия. В качестве основных подходов решения этих проблем используют как «упаковку» препарата в микрочастицы, так и иммобилизацию на биодеградируемые полимерные носители. Безусловно, при такого рода манипуляциях с препаратом важно сохранение эффективности его биологического действия.
Воспалительный процесс, как известно, развивается постепенно и способен приобретать хронический характер. В связи с этим, несомненно актуальным является использование иммобилизованных форм синтезированного пептида - агониста рецепторов ПАР1 для коррекции как системного воспаления, перитонитов, так и нейровоспаления. В связи с этим целью наших следующих исследований стало выявление влияния синтезированного пептида - агониста рецепторов ПАР1, иммобилизованного на полимерные носители, на пролиферацию астроцитов и активацию тучных клеток в моделях воспаления in vitro.
В ходе проведения экспериментальных исследований на модели нейровоспаления in vitro показано, что иммобилизация пептида - агониста рецепторов ПАР1, освобождаемого АПС, на полимерные носители изменяет его биологическую активность. Более того, обнаружено, что характер действия исследуемого пептида на пролиферацию астроцитов в условиях их активации, вызванной тромбином, после иммобилизации меняется на противоположный по знаку. Так, если нативный пептид в условиях воспаления, вызванного тромбином, предотвращает повышение пролиферации астроцитов в культуре, то после иммобилизации на носители пептида - агониста рецепторов ПАР1, освобождаемого АПС, в той же концентрации не только не отменяет эффект тромбина, но и потенцирует его. Наблюдается значимое повышение пролиферации в присутствие пептида, иммобилизованного на матриксы и пленки. Но, в отличие от модели нейровоспаления, при провокации воспаления липополисахаридом (ЛПС) на перитониальных тучных клетках иммобилизация пептида - агониста рецепторов ПАР1, освобождаемого АПС, не изменяла направленности его эффекта, наблюдаемого у нативной формы пептида - агониста рецепторов ПАР1, освобождаемого АПС.
Таким образом, характер биологической активности пептида-агониста ПАР1, освобождаемого АПС, зависит от типа модели, в которой он используется. В модели системного воспаления, где в качестве объекта использовали перитониальные тучные клетки, иммобилизация пептида на полимерные носители не приводила к инвертированию его эффекта, хотя и изменяла его выраженность. В тоже время использование в качестве модели нейровоспаления активированных тромбином культивируемых астроцитов, показало смену действия пептида - агониста рецепторов ПАР1, освобождаемого АПС, по направленности. Возможно, что в используемой нами модели нейровоспаления иммобилизация пептида повышает его эффективность, т.к. наблюдаемый эффект проявляется в концентрации 30 мкМ соотносится с потенцирующим эффектом нативного пептида в концентрации 500 мкМ.
Сравнительный анализ активности пептида (протекторное, пролиферативное, противовоспалительное действия) до и после иммобилизации.
Для исследований патогенеза ишемических повреждений тканей основной проблемой является невозможность забора материала из живого организма, в связи с чем, отсутствует возможность наблюдения за процессами, протекающими в живых клетках при этой патологии. В качестве альтернативных методов проведения анализа все большее значение приобретают in vitro, т.е. модели на клеточных культурах, которые имитируют процессы, происходящие в живых организмах и максимально приближены к соответствующим процессам in vivo. Таким образом, клеточные культуры являются универсальным методом для исследования «физиологических» и патологических явлений, выяснения механизмов протекающих процессов. Для нейроисследований в качестве модельных клеток используют в основном такие виды клеток, как нейроны, астроциты и эндотелиальные клетки, что связано с тем, что данные типы клеток составляют единую функциональную единицу в организме при повреждениях нервных тканей. Также ранее было показано, что АПС в низких концентрациях блокировал освобождение гистамина и других медиаторов воспаления тучными клетками, активированными острым воспалением, через активацию ПАР1 (in vitro) и ускорял репаративные процессы при заживлении экспериментальной язвы желудка у крыс (in vivo). В связи с чем в предложенной модельной системе помимо нейроно, астроцитов и эндотелиальных клеток используют тучные клетки, эффект на которых также ярко выражен.
Также одним из основных модельных объектов, на котором проводился анализ активности синтезированного пептида, были выбраны тучные клетки. Это связанно с тем, что именно тучные клетки наиболее активно вовлекаются в процессы заживления ран, поскольку способны в ответ на активацию иммунными и неиммунными факторами освобождать множество сильных медиаторов, таких как медиаторы и модуляторы воспаления, пролиферации и миграции клеток преформированные в цитоплазматических гранулах тучных клеток (гистамин, нейтральные протеазы - химаза и триптаза, кислые гидролазы, катепсин G, карбоксипептидаза, гепарин- и хондроитин-сульфат протеогликаны и др.), а также медиаторы воспаления, которые синтезируются при активации клетки (ПАР, простагландин D2, лейкотриен С4, цитокины IL-4, IL-5, IL-6, IL-8, IL-13, TNF-альфа, MIP-1альфа (воспалительный белок 1а макрофагов), FGFb). Некоторые цитокины, как, например, TNF-CL могут быть преформированы в тучных клетках, а также вновь синтезироваться при активации клеток. Тучные клетки также освобождают такие регуляторы, как NO, TGF-бета1, активатор фибринолиза tPA (но не ингибиторы активатора плазминогена PAI-1 и РА1-2), и экспонируют рецепторы IgE, урокиназы. фактор роста (c-kit) и др.
Специфическое связывание тромбина с перитонеальными тучными клетками крысы предполагает наличие рецепторов тромбина на мембране этих клеток. Тромбин вызывает дегрануляцию культивируемых тучных клеток костного мозга и тучных клеток кожи. В высокой концентрации тромбин стимулирует дегрануляцию перитонеальных тучных клеток крысы. Доказательство существования на тучных клетках ПАР1 было ранее получено авторами, было показано повышение концентрации внутриклеточного Са2+ в ответ на действие TRAP-6 - агониста этого рецептора. Выявлена мРНК ПАР1 в перитонеальных тучных клетках. Было продемонстрированно, что контакт тромбина с тучными клетками, локализованными вдоль кровеносных и лимфатических сосудов во многих тканях и органах, происходит в участке повреждения ткани. У мышей с дефицитом тучных клеток отмечали учащение случаев фатальных тромбоэмболий после провокации тромбообразования по сравнению с нормальными животными. Также было обнаружено увеличение числа тучных клеток в верхних отделах сердца у больных с тромбозом предсердия и в адвентиции тромбированных глубоких вен конечностей. Секретируемые тучными клетками протеазы, зависимые от гепарина, способны расщеплять экзогенный тромбин. Но при воспалении, вызванном хроническим введением бактериального липополисахарида или солей тиогликолевой кислоты, способность клеток инактивировать тромбин значительно снижается.
Краткое описание чертежей
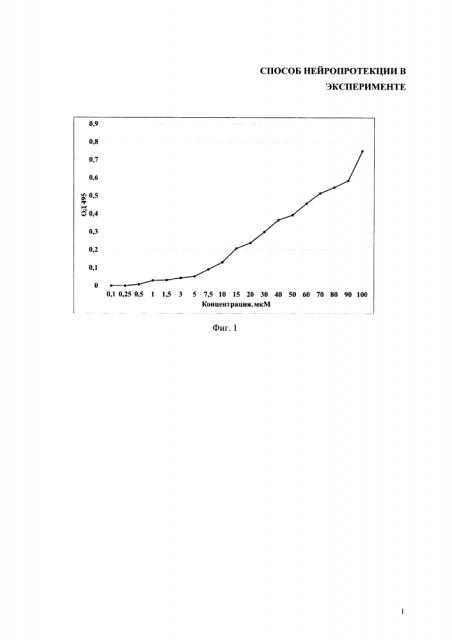
На фиг. 1 - Калибровочная кривая поглощения пептида-агониста рецепторов ПАР1, конъюгированного с FITC, в ФСБ при 495 нм;
На фиг. 2 - Калибровочная кривая поглощения пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, в ДМЕМ при 495 нм;
На фиг. 3 - Кинетика выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, из полимерного носителя в форме покрытия в ФСБ и культуральной среде ДМЕМ;
На фиг. 4 - Кинетика выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, из полимерного носителя в форме пленки в ФСБ и в культуральной среде ДМЕМ;
На фиг. 5 - Кинетика выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, конъюгированного с FITC, из полимерного носителя в форме трехмерного матрикса в ФСБ и в культуральной среде ДМЕМ;
На фиг. 6 - Влияние нативной и иммобилизованных форм исследуемого пептида - агониста рецепторов ПАР1, освобождаемого АПС, (АП9), на секрецию гистамина перитониальными тучными клетками при их активации липополисахаридом (ЛПС, 100 нг/мл). +, *, # - р<0,05 по сравнению с соответствующим контролем (условия без АП9).
Осуществление изобретения
Настоящее изобретение подкреплено следующими примерами. Стоит отметить, что данный способ находится на экспериментальной стадии изучения, что отражено в его назначении, и примеры носят экспериментальный характер.
Пример 1. Приготовление средства, включающего биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С, NPNDKYEPF амидом.
1 Этап. Подготовка рабочих растворов.
1.1. Подготовка раствора 1. Готовят раствор хлорида кальция в смеси этанола и воды. Молярное соотношение компонентов CaCl2:С2Н5ОН:H2O=1:2:8
1.2. Подготовка раствора 2.
Готовят навеску нитей хирургических нестерильных (100% натуральный шелк) из расчета 150 мг на 1 мл раствора 1 и переносят в емкость с раствором 1. Инкубируют в течение 5 часов на водяной бане при 70°C. Полученный раствор центрифугируют 15 минут при 13400 об/мин и супернатант диализуют против дистиллированной воды, проводя 4 смены диализа. Полученный раствор центрифугируют 15 минут при 13400 об/мин и определяют концентрацию фиброина по оптической плотности при 280 нм. Доводят раствор до концентрации фиброина 2 мг/мл и используют на Этапе 2.
1.3 Подготовка раствора 3. Для приготовления раствора пептида навеску вещества массой 3,5 мг растворяют в 20 мкл ДМСО и доводят объем раствора до 200 мкл стерильной dH2O и используют на стадии 2.
2 Этап. Обработка полимерного носителя.
2.1 К 150 мкл раствора 3 (концентрация - 17,5 мг/мл) добавляют 375 мкл dH2O. Таким образом, получается раствор пептида с концентрацией 5 мг/мл.
2.2 В лунки 48-луночного планшета вносят по 27,2 мкл раствора пептида с концентрацией 5 мг/мл, 5 мкл раствора фиброина шелка с концентрацией 2 мг/мл и 67,8 мкл dH2O. Переносят в лунки с раствором пептида полимерные носители в виде пленки или трехмерного матрикса. Обработку полимерного покрытия проводят в лунках 48-луночного планшета, дно которых покрыто полимерной пленкой из фиброина шелка. Для этого вносят в такие лунки по 13,6 мкл раствора пептида с концентрацией 5 мг/мл, 2,5 мкл водного раствора фиброина шелка с концентрацией 2 мг/мл и 34,9 мкл dH2O.
3 Этап. Сушка.
Полимерные носители оставляют высушиваться в лунках 48-луночного планшета в течение 24 часов.
4 Этап. Стерилизация.
Проводят газовую стерилизацию с использованием этиленоксида по ГОСТ Р ИСО 18472-2009
Пример 2. Исследование кинетики выхода пептида - агониста рецепторов ПАР1, освобождаемого АПС, из полимерного носителя.
Для исследования кинетики выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, и оценки влияния среды инкубации на кинетику выхода пептида из полимерных носителей использовали пептид, конъюгированный с флуоресцеин изотиоцианатом (FITC) строили калибровочные кривые. Для этого готовили растворы пептида, конъюгированного с FITC, с концентрацией от 0,1 мкМ до 100 мкМ в ФСБ и в среде ДМЕМ и измеряли поглощение при 495 нм спектрофотометром для микрообъемов Thermo Scientific NanoDrop 2000, позволяющим проводить измерения в объемах 0,5-2,0 мкл. Соответствующие калибровочные кривые представлены на фиг. 1 и 2.
Исследование кинетики выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, и оценки влияния среды инкубации на кинетику выхода пептида из полимерных носителей проводили на образцах, синтезированных в соответствии с утвержденными лабораторными технологическими регламентами. В лунки 24-луночного планшета к экспериментальным образцам добавляли по 2 мл среды инкубации: ФСБ или культуральную среду ДМЕМ и инкубировали при 37°C в присутствии 5% CO2 56 часов. В течение первых 9 часов каждый час и через 20, 24, 32, 48 56 часов отбирали пробы для определения концентрации вышедшего пептида. Данные, полученные при анализе проб вышедшего из полимерных носителей пептида-агониста рецепторов ПАР1 в форме покрытия, пленки и трехмерного матрикса, представлены на фиг. 3-5.
Как видно из графиков на фиг. 3-5 среда инкубации не влияет на кинетику выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, иммобилизованного на разных формах полимерного носителя. В течении первых 8-9 часов концентрация пептида в среде инкубации достигает почти максимальной: 29 мкМ. По результатам анализа установлено, что скорость выхода пептида-агониста рецепторов ПАР1, освобождаемого АПС, иммобилизованного на полимерных носителях зависит от типа носителя.
Применение препаратов пептида-агониста рецепторов ПАР1, освобождаемого АПС, иммобилизованного на полимерном носителе позволяет регулировать время высвобождения препарата и создавать оптимальные условия культивирования для различных типов клеток.
Пример 3. Исследование противовоспалительного действия иммобилизованной формы пептида - агониста рецепторов ПАР1, освобождаемого АПС, на культивируемые клетки мозга животных (астроциты) и тучные клетки в норме и при провокации воспаления in vitro
1. Материалы
- Пептид - агонист рецепторов ПАР1, освобождаемого АПС структуры NPNDKYEPF амид.
- Экспериментальные образцы средства, представляющего собой прозрачное полимерное покрытие толщиной 0,1 мм (=100 мкм) на культуральных стеклах диаметром 24 мм из фиброина шелка с иммобилизованный пептидом - агонистом рецепторов ПАР1, освобождаемого АПС.
- Экспериментальные образцы средства, представляющего собой прозрачную пленку из фиброина шелка толщиной 0,2 мм (=200 мкм), диаметром 14 мм с иммобилизованным пептидом - агонистом рецепторов ПАР1, освобождаемого АПС.
- Экспериментальные образцы средства, представляющего собой трехмерный пористый матрикс из фиброина шелка толщиной 2 мм, диаметром 14 мм, с размером пор 50-100 мкм, степень пористости 94%, с иммобилизованным пептидом - агонистом рецепторов ПАР1, освобождаемого АПС.
2. Выделение тучных клеток из перитонеальной полости самцов крыс
Животных наркотизируют эфиром, декапитируют и обескровливают. В брюшную полость вводят 10 мл буфера Hepes-NaCl, брюхо слегка массируют в течение 2 минут. Перитонеальную жидкость собирают и центрифугируют в течение 5 минут при 800 об/мин при охлаждении. Супернатант отбрасывают, осадок суспендируют в 2 мл буфера Hepes-NaCl. Данную суспезию переносят в пробирки, содержащие 25% и 35% фиколл и центрифугируют в течение 10 минут при 1200 об/мин при охлаждении.
Пул тучных клеток при центрифугировании проходит в слой фиколла, а другие клеточные элементы концентрируются на границе раздела фиколла. Осторожно собирают клеточные элементы с границы раздела и отбрасывают. Пул тучных клеток промывают в 5 мл сбалансированного раствора. После каждого промывания клетки центрифугируют по 10 минут при 1000, 900, 800 об/мин при охлаждении. Осадок тучных клеток после последнего промывания растворяют в малом объеме сбалансированного буфера. Далее производят подсчет тучных клеток в камере Горяева. После подсчета клеточную взвесь разводят сбалансированным буфером, исходя из необходимого количества клеток в эксперименте.
Статистическая обработка данных
Статистическую обработку результатов проводят с использованием программы GraphPad Prism 6. Для анализа используют непараметрическую статистику: Ман-Уитни тест и тест Краскела-Уоллеса для несвязанных выборок. Каждый из экспериментов проводят не менее 3 раз. n-число независимых экспериментов.
3. Алгоритм испытания
Тучные клетки, полученные от каждого животного распределяли по экспериментальным группам. В каждой группе 300 мкл клеточной суспензии инкубировали в течение часа с исследуемыми веществами при 37°C. Реакцию останавливают трехкратным объемом ледяного сбалансированного буфера. Далее пробы центрифугируют при 400 g в течение 10 минут, супернатант для определения содержания гистамина отбирают (1000 мкл) и переносят в охлажденные эппендорфы. К оставшимся 200 мкл добавляют 1000 мкл сбалансированного буфера, после этого осадок ресуспендируют и разрушают клетки кипячением на водяной бане в течение 5 минут. Затем вновь центрифугируют 10 минут при 400 g и отбирают 1000 мкл супернатанта для анализа остаточного гистамина в отдельные эппендорфы.
Для определения содержания гистамина в полученных пробах отбирают из эппендорфов по 500 мкл раствора и добавляют к нему 100 мкл IN NaOH; туда же добавляют 25 мкл 0,1% раствора ортофталевого альдегида в этаноле. Образовавшийся флуорофор стабилизируют подкислением раствора. Для этого через 4 минуты добавляют 50 мкл 3N HCl. После добавления каждого реактива смесь тщательно перемешивают.
Флуоресценцию измеряют на планшетном спетрофлуорометре при 460 нм, возбуждая при 355 нм.
Исследования показали, что использование способа, включающего введение средства, содержащего биодеградируемый полимерный матрикс на основе фиброина с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемым активированным протеином С, приводит к нейропротекторному действию на модели нейровоспаления, которое характерно для ряда патологических состояний.
1. Способ нейропротекции в эксперименте на клеточной модели, инкубируемой в физиологических условиях, включающий введение в среду культивирования 30 мкМ средства с допустимым отклонением от указанной величины не более чем на 10%, содержащего биодеградируемый полимерный матрикс на основе фиброина шелка Bombyx mori с иммобилизированным пептидом-агонистом рецептора ПАР1, освобождаемого активированным протеином С, в соотношении 99-99,9 мас. % : 0,1-1 мас. % фиброин : пептид.
2. Способ по п. 1, характеризующийся тем, что в качестве модели используют клетки мозга животных (астроциты) или тучные клетки.
3. Способ по п. 1, характеризующийся тем, что в качестве клеточной модели используют клетки в условиях стресса, которые создают посредством введения в клеточную модель провоспалительного агента - тромбина в конечной концентрации от 45-50 нМ или 1 мкг/мл соответственно.