Пластырь с регулируемой окклюзией
Иллюстрации
Показать всеИзобретение относится к медицине. Описан трансдермальный или для местного применения, содержащий биологически активное вещество пластырь с неокклюзионным слоем с обратной стороны, который состоит из текстильного материала, матрицы, образованной из одного или нескольких полимерных слоев по меньшей мере с одним фармацевтическим биологически активным веществом в одном или нескольких из этих слоев, в котором полимеры основы, образующие структуру слоя или слоев, являются неокклюзионными или лишь незначительно окклюзионными, а по меньшей мере в одном из этих полимерных слоев диспергирован несмешивающийся или лишь мало смешивающийся с полимером основы второй полимер с низкой проницаемостью для паров воды. Биологически активное вещество представляет собой диклофенак или одну из его фармацевтически приемлемых солей или анальгетик местного действия. Пластырь имеет более простую структуру и может быть просто получен. 10 з.п. ф-лы, 4 табл., 5 ил., 2 пр.
Реферат
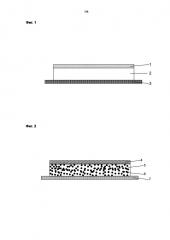
При трансдермальном или местном введении биологически активных веществ роговой слой представляет собой липофильный барьер, ограничивающий поглощение активного вещества. Одним из наиболее эффективных и применяемым практически в случае любой трансдермальной системы, имеющей системный эффект, физическим методом для снижения барьерных функций рогового слоя является окклюзия. Окклюзия достигается в результате применения практически непроницаемых для паров воды материалов для слоя с обратной стороны трансдермальной системы или/и применения непроницаемых для паров воды композиций прилегающих слоев или, соответственно, слоя, содержащего активные вещества, или слоев, содержащих активные вещества. Схематическое изображение такого пластыря показывает Фигура 1. Для слоев с обратной стороны в большинстве случаев применяются пленки из сложных полиэфиров. Правда, в принципе, ничто не говорит против других пленок с низкой проницаемостью для паров воды, таких как, например, пленки из полиэтилена или полипропилена. В качестве полимеров или контактных клеев с низкой проницаемостью для паров воды применяются, например, полиизобутилен или блок-сополимеры из стирола и бутадиена или стирола и изопрена. Специальные системы для местного применения, например, с нестероидными антиревматическими средствами, имеют размер, который соответствует площади поверхности, которую надлежит обработать, и, таким образом, размер, который для повышения комфорта при ношении подразумевает определенную растяжимость системы, образующей пластырь. Поскольку указанные выше окклюзионные материалы для слоя с обратной стороны при толщине, подходящей для этой цели, не обладают достаточной растяжимостью или эластичностью, то для таких пластырей часто применяются текстильные материалы. Правда, недостатком этих текстильных слоев с обратной стороны является то, что они из-за своих открытых пор обладают очень высокой проницаемостью для паров воды, а следовательно, не создают окклюзионных условий. Из этого следует, что окклюзия в случае пластырей с текстильными слоями с обратной стороны должна достигаться при помощи других непроницаемых для паров воды или по крайней мере малопроницаемых для паров воды прочих слоев. Естественно, для этого не могут выбираться нерастягивающиеся и неэластичные материалы. Проще всего окклюзии добиваются в результате применения малопроницаемых для паров воды контактных клеев, таких как контактные клеи на основе полиизобутилена или блок-сополимеров из стирола и бутадиена или изопрена. Однако при этом недостатком является то, что эти контактные клеи лишь очень плохо сцепляются с кожей, пропитываемой влагой под влиянием окклюзии, и легко отстают частично или полностью, в особенности в области суставов.
В международной заявке WO 01/91718 А2 описывается двухфазная матрица, в случае которой содержащая биологически активное вещество полиакрилатная фаза диспергирована во внешней, самоклеющейся композиции на основе полиизобутилена или блок-сополимеров стирол-бутадиен-стирол. В данном случае недостатком является то, что эффект окклюзии при целесообразной толщине слоя всегда является максимальным, а внешняя фаза, как уже обсуждалось выше, очень плохо сцепляется с влажной кожей. Единственным преимуществом такой матрицы является то, что биологически активное вещество находится в полимере с более высокой растворимостью до насыщения.
Полиакрилатные клеи или силиконовые клеи при таких условиях ведут себя в основном лучше, правда, по причине их высокой проницаемости для водяного пара сами они не могут создавать окклюзионных условий. Поэтому применение полиакрилатных или силиконовых клеев согласно уровню техники делало бы необходимым многослойные матрицы со слоями различного состава, таким образом, усложнялся бы способ изготовления, и важная для этой группы продуктов стоимость изготовления возрастала.
Поэтому существует потребность в окклюзионных пластырях с текстильным растяжимым слоем с обратной стороны и хорошо приклеивающимся на влажную кожу контактным клеем на основе полиакрилатов или силиконовых клеев, которые имеют как можно более простую структуру и могут быть просто получены.
Неожиданным образом решение проблемы согласно изобретению было найдено в том, чтобы малопроницаемый для водяных паров полимер, такой как, например, полиизобутилен или блок-сополимер из стирола и бутадиена или изопрена, диспергировать в слое (или слоях) матрицы, образованной из проницаемых для паров воды контактных клеев. При этом биологически активные вещества благодаря их физико-химическим свойствам большей частью содержатся в полиакрилатной фазе такой матрицы. При помощи количества непроницаемого для паров воды полимера и толщины матрицы окклюзионный эффект может варьироваться в широких пределах. Таким образом, в самом простом случае пластырь согласно изобретению состоит из текстильного слоя с обратной стороны, содержащего биологически активное вещество слоя матрицы на основе полиакрилатного или силиконового клея с диспергированным в нем непроницаемым для паров воды полимером и защитного слоя, который следует удалить перед применением. Структура такого пластыря представлена на Фигуре 2.
Таким образом, изобретение касается трансдермального или используемого для местного применения, содержащего биологически активное вещество пластыря с неокклюзионным слоем с обратной стороны, матрицей, образованной из одного или нескольких полимерных слоев по меньшей мере с одним фармацевтическим биологически активным веществом в одном или нескольких из этих слоев, который отличается тем, что полимеры основы, образующие структуру слоя или слоев, являются неокклюзионными или лишь незначительно окклюзионными, а по меньшей мере в одном из этих полимерных слоев диспергирован несмешивающийся или лишь мало смешивающийся с полимером основы второй полимер с низкой проницаемостью для паров воды.
Слой с обратной стороны предпочтительно состоит из текстильного материала, в частности, ткани или нетканого полотна или, соответственно, композиционного материала из таких полотен. В данном случае в качестве материалов рассматривают, например, хлопок, вискозу, сложные полиэфиры, полиамиды, полиуретаны или полипропилен. Полиуретан также подходит в качестве проницаемого для паров воды материала пленки.
Полимер основы, образующий структуру слоя матрицы, находящегося при использовании в контакте с кожей, предпочтительно представляет собой контактный клей. Подходящими контактными клеями являются, например, полиакрилатные клеи или силиконовые клеи. Предпочтительно матрица образована одним слоем.
Полимером с низкой проницаемостью для паров воды может быть, например, полиизобутилен, блок-сополимер стирол-изопрен-стирол или блок-сополимер стирол-бутадиен-стирол. Диспергированная фаза этого полимера предпочтительно имеет средний размер частиц от 5 до 50 мкм, в частности от 7 до 40 мкм, наиболее предпочтительно от 10 до 30 мкм. Доля диспергированных частиц в матрице, как правило, находится между 5 и 50% масс., предпочтительно 7 и 40% масс., в частности 10 и 30% масс.
Масса единицы поверхности матрицы, как правило, находится между 50 и 400 г/м2, предпочтительно между 60 и 300 г/м2, в частности между 70 и 200 г/м2.
Фармацевтическое биологически активное вещество может представлять собой нестероидный антиревматический препарат (сокр. НПВП - нестероидный противовоспалительный препарат, англ. сокр. NSAID - non-steriodal anti inflammatory drug). Эти препараты часто применяются местно наружно в области суставов, в частности, конечностей. Именно в этих местах применения, подверженным сильным механическим нагрузкам, трансдермальные терапевтические системы (ТТС) согласно изобретению оказываются особенно предпочтительными. Без претензии на полноту, речь идет о биологически активных веществах из группы диклофенака или одной из его фармацевтически приемлемых солей, кетопрофена, ибупрофена, флурбипрофена, напроксена, тиапрофеновой кислоты, индометацина, пироксикама, теноксикама, мелоксикама, флуфенаминовой кислоты или мефенаминовой кислоты. Предпочтительными солями диклофенака являются, например, натриевая соль диклофенака, калиевая соль диклофенака, диэтиламмониевая соль диклофенака или дигидроксиэтилпирролидиниевая соль диклофенака.
Кроме того, в качестве биологически активных веществ рассматривают эффективные при местном применении анальгетики, например лидокаин или тетракаин.
Помимо уже упомянутых полимеров и биологически активных веществ, еще могут использоваться другие многочисленные вспомогательные вещества, такие, которые известны в широком кругу специалистов для применения в ТТС.
Так могут, например, использоваться усилители проникающей способности, предпочтительно во внутренней фазе матрицы. В качестве усилителей проникающей способности рассматривают соединения из группы низкомолекулярных одно- или многоатомных спиртов, жирных кислот (предпочтительно олеиновую кислоту), жирных спиртов, простых эфиров жирных спиртов, полиоксиэтилированных жирных спиртов, сложных эфиров жирных кислот (в частности, моноглицериды и сложные моноэфиры с пропиленгликолем), сложных сорбитановых эфиров жирных кислот и полиоксиэтилированных сложных сорбитановых эфиров жирных кислот, а также диметилизосорбит.
Кроме того, принимаются в расчет поверхностно-активные тензиды, которые могут положительно влиять на стабильность двухфазного слоя матрицы, понижая поверхностное натяжение.
Непроницаемый для паров воды полимер внедрен в матрицу. Таким образом, он практически не входит в контакт с кожей и поэтому не оказывает отрицательного влияния на адгезионные характеристики контактного клея на коже.
При этом снижение проницаемости для паров воды основано на увеличении длины эффективного диффузионного пути для молекул воды. Это также означает, что величина эффекта зависит от количества диспергированного полимера и, естественно, от общей толщины слоя матрицы.
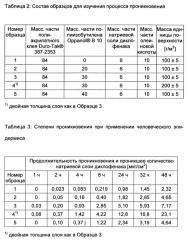
Эта взаимосвязь была экспериментально исследована на полиакрилатном клее и низкомолекулярном полиизобутилене. Для этого были получены клеевые пленки различной толщины и с различным содержанием полиизобутилена, и была измерена проницаемость для паров воды согласно методике стандарта DIN EN 13726-2 при размере образца 20 см2 при 37°С и 18% отн. влажности. Состав образцов и измеренная проницаемость для паров воды представлены в Таблице 1, а проницаемость для паров воды дополнительно на Фигуре 3. Проницаемость для паров воды в таком случае, как правило, лежит между 50 и 600 г/(м2 × 24 ч), предпочтительно между 100 и 500 г/(м2 × 24 ч), в частности между 150 и 400 г/(м2 × 24 ч).
| Таблица 1: | |||
| Состав образцов и проницаемость для паров воды | |||
| Доля полиакрилатного клея1) [% масс.] | Доля полиизобутилена2) [% масс.] | Масса единицы поверхности [г/м2] | Проницаемость для паров воды г/(м2 × 24 ч) |
| 100 | 0 | 106 | 376 |
| 90 | 10 | 100 | 399 |
| 80 | 20 | 97 | 308 |
| 70 | 30 | 95 | 276 |
| 70 | 30 | 190 | 129 |
| 60 | 40 | 99 | 245 |
| 1) Duro-Tak® 387-2353, фирмы Henkel | |||
| 2) Oppanol® В 10, фирмы BASF |
Как видно, 10% масс. полиизобутилена еще практически не оказывают эффекта, 20% масс. обладают уже заметным эффектом, а при 40% масс. проницаемость уменьшается почти вдвое. Как и ожидалось, проницаемость зависит также от толщины слоя, то есть проницаемость в результате дублирования уменьшается вдвое.
Кроме того, было исследовано влияние содержания полиизобутилена на степень проникновения из системы, образующей пластырь. Для этого в качестве биологически активного вещества была выбрана натриевая соль диклофенака и была введена в однослойную систему матрицы с текстильным слоем с обратной стороны. Если предположить, что гидрофильная соль биологически активного вещества растворима в полиизобутилене только в пренебрежимо малом количестве, то количество биологически активного вещества выбирали таким образом, что концентрация этого биологически активного вещества, несмотря на различное содержание полиизобутилена, во внешней полиакрилатной фазе во всех образцах оставалась одинаковой. Тем самым исключалось, чтобы различия в степени проникновения основывались не только на отличающейся сильной окклюзии, но и на различных термодинамических активностях.
Исследования процесса проникновения проводились с использованием хорошо известной специалисту диффузионной ячейки Франца и человеческого эпидермиса. Величины в таблицах представляют собой средние величины, в каждом из случаев для 4 независимых экспериментов.
Составы образцов и относящиеся к ним степени проникновения обобщены в Таблицах 2 и 3, а степени проникновения дополнительно графически представлены на Фигуре 4.
Результаты изучения процесса проникновения ясно показывают, что степень проникновения зависит от содержания полиизобутилена и повышенной в результате этого окклюзии. Другое объяснение не рассматривается, поскольку состав фазы, содержащей биологически активное вещество, во всех образцах остается постоянным, а добавление полиизобутилена даже снижает относительное содержание этой фазы в матрице. Правда, кажется, что оптимум содержания полиизобутилена лежит при 30% масс., поскольку 40% масс. показывают примерно такой же результат, как и 20% масс. В таком случае при более высоких содержаниях уменьшающаяся доля фазы, содержащей биологически активное вещество, а также удлиняющийся эффективный диффузионный путь для биологически активного вещества оказывают отрицательное влияние.
Поскольку внутренняя фаза, как показано на Фигуре 5, отделена от внешней фазы, и на молекулярном уровне не существует смеси, добавление внутренней фазы с низкой проницаемостью для паров воды не влияет на растворимость до насыщения для биологически активного вещества во внешней фазе, состоящей из полиакрилатов или силиконов. Это означает, что в таких системах на отдачу биологически активного вещества не влияет изменение растворимости до насыщения в фазе, содержащей биологически активное вещество, как, например, в указанной для примера публикации патента США US 6,235,306. В указанных в Таблице 2 и в использованных в изучении процесса проникновения в Таблице 3 композициях соотношение акрилатного клея и биологически активного вещества остается одинаковым, то есть различия в измеренных степенях проникновения могут объясняться только окклюзией, повышающейся вместе с количеством полиизобутилена.
Следующие ниже примеры изготовления служат для иллюстрации изобретения, однако не ограничивают тем самым объем притязаний.
Пример 1
Изготовление пластыря с натриевой солью диклофенака согласно композициям 1, 2, 3, 4 и 5
90 г полиизобутилена (Oppanol® В 10, фирмы BASF) растворяют в 110 г н-гептана при помощи перемешивания. В результате получается 200 г раствора полиизобутилена с содержанием твердого вещества 45% г/г.
20 г натриевой соли диклофенака при перемешивании растворяют в 774 г Duro-Tak® 387-2353 (содержание твердого вещества 36%), 150 г этилацетата и 33 г олеиновой кислоты. В результате получается 929 г содержащего активное вещество раствора полиакрилата с содержанием твердого вещества 34% г/г. Масса для нанесения покрытия получается в результате добавления приведенных в Таблице 4 количеств раствора полиизобутилена соответственно к 100 г содержащего активное вещество раствора полиакрилата.
| Таблица 4: | ||
| Составы композиций с 1 по 5 | ||
| Композиция | Полиизобутилен в матрице [% г/г] | Довесок раствора полиизобутилена [г] |
| 1 | 0 | 0 |
| 2 | 20 | 15,96 |
| 3,4 | 30 | 23,91 |
| 5 | 40 | 31,91 |
Дисперсии получаются в результате 10-минутного интенсивного механического перемешивания при 400 об/мин. Матрицы получаются при помощи нанесения покрытий из этих дисперсий на силиконизированные пленки из сложного полиэфира с толщиной 100 мкм с последующим удалением растворителя в результате 25-минутной сушки при 50°С. Толщина пленки нанесенного покрытия, еще содержащей растворитель, выбирается таким образом, что высушенная пленка матрицы имеет массу единицы поверхности 110 г/м2. Матрица для композиции 4 получается путем того, что уже высушенную пленку матрицы для композиции 3 один раз ламинируют с самой собой.
Высушенные пленки склеивают с биэластичной тканью из сложного полиэфира, и таким образом получают конечный ламинат.
Готовые пластыри или, соответственно, образцы для изучения процесса проникновения вырезаются из этого конечного ламината.
Пример 2
Изготовление пластыря, содержащего лидокаин
50 г лидокаина при перемешивании растворяют в 1164 г раствора полиакрилата (Duro-Tak® 387-2052, фирмы Henkel, содержание твердого вещества 47% г/г), 74 г этанола, 110 г этилацетата, 6 г ментола, 100 г олеиновой кислоты.
В этом растворе диспергируют 631 г раствора полиизобутилена (48% г/г в н-гептане). Эту массу наносят на силиконизированную пенку из сложного полиэфира до такой толщины, что после удаления растворителя (10 минут при комнатной температуре, 25 минут при 50°С) в результате получается масса единицы поверхности 135 г/м2. Высушенная пленка склеивается с биэластичной тканью из сложного полиэфира, и таким образом получают конечный ламинат.
Краткое описание рисунков и обозначений на чертежах
Фиг. 1: Окклюзионный пластырь с непроницаемым для паров воды слоем с обратной стороны
1 – непроницаемый для паров воды слой с обратной стороны,
2 – матрица, содержащая биологически активное вещество,
3 – удаляемая защитная пленка.
Фиг. 2: Пластырь согласно изобретению с регулируемой окклюзией
4 – слой с обратной стороны из текстильного материала,
5 – полимер основы, образующий структуру,
6 – частицы полимера с низкой проницаемостью для паров воды,
7 – удаляемая защитная пленка.
Фиг. 3: Проницаемость для паров воды как функция от содержания полиизобутилена и толщины слоя матрицы.
Фиг. 4: Доля полиизобутилена и суммарное проникшее количество натриевой соли диклофенака.
Фиг. 5: Частицы полиизобутилена, диспергированные в фазе полиакрилатного клея (масштаб: 500:1).
1. Трансдермальный или для местного применения, содержащий биологически активное вещество пластырь с неокклюзионным слоем с обратной стороны, который состоит из текстильного материала, матрицы, образованной из одного или нескольких полимерных слоев по меньшей мере с одним фармацевтическим биологически активным веществом в одном или нескольких из этих слоев, отличающийся тем, что фармацевтическое биологически активное вещество представляет собой диклофенак или одну из его фармацевтически приемлемых солей или анальгетик местного действия и полимеры основы, образующие структуру слоя или слоев, матричного слоя, находящегося при использовании в контакте с кожей, являются неокклюзионными или лишь незначительно окклюзионными и представляют собой контактные клеи, причем контактные клеи представляют собой полиакрилатные клеи, и по меньшей мере в одном из этих полимерных слоев диспергирован несмешивающийся или лишь мало смешивающийся с полимером основы второй полимер с низкой проницаемостью для паров воды, который представляет собой полиизобутилен, блоксополимер стирол-изопрен-стирол или блоксополимер стирол-бутадиен-стирол, причем доля диспергированных частиц этого второго полимера в матрице лежит между 7 и 40% масс.
2. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что матрица является однослойной.
3. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что диспергированная в полимере основы фаза полимера с низкой проницаемостью для паров воды имеет средний размер частиц от 5 до 50 мкм, предпочтительно от 7 до 40 мкм, в частности от 10 до 30 мкм.
4. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что доля диспергированных частиц полимера с низкой проницаемостью для паров воды лежит между 10 и 30% масс.
5. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что масса единицы поверхности матрицы находится между 50 и 400 г/м2, предпочтительно между 60 и 300 г/м2, в частности между 70 и 200 г/м2.
6. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что его проницаемость для паров воды, измеренная согласно методике стандарта DIN EN 13726-2, при размере образца 20 см2, при 37°С и 18% относительной влажности лежит между 50 и 600 г/(м2×24 ч), предпочтительно между 100 и 500 г/(м2×24 ч), в частности между 150 и 400 г/(м2×24 ч).
7. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что фармацевтическое биологически активное вещество представляет собой диклофенак или одну из его фармацевтически приемлемых солей.
8. Трансдермальный или для местного применения пластырь по п. 7, отличающийся тем, что фармацевтическое биологически активное вещество представляет собой соль диклофенака, в частности натриевую соль диклофенака, калиевую соль диклофенака, диэтиламмониевую соль диклофенака или дигидроксиэтилпирролидиниевую соль диклофенака.
9. Трансдермальный или для местного применения пластырь по п. 1, отличающийся тем, что анальгетик местного действия представляет собой лидокаин или тетракаин.
10. Трансдермальный или для местного применения пластырь по одному из пп. 1-9, отличающийся тем, что матрица содержит по меньшей мере один усилитель проникающей способности, предпочтительно в структурообразующем полимере основы.
11. Трансдермальный или для местного применения пластырь по п. 10, отличающийся тем, что усилитель или усилители проникающей способности представляют собой низкомолекулярные одно- или многоатомные спирты, жирные кислоты, предпочтительно олеиновую кислоту, жирные спирты, простые эфиры жирных спиртов, полиоксиэтилированные жирные спирты, сложные эфиры жирных кислот, сложные сорбитановые эфиры жирных кислот, полиоксиэтилированные сложные сорбитановые эфиры жирных кислот и/или диметилизосорбит.