Способ получения конъюгата гиалуронидазы с производными полиэтиленпиперазина и применение полученного конъюгата
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к вариантам способа получения активного конъюгата фермента гиалуронидазы с сополимером с использованием карбодиимидного или азидного метода конъюгации, очистки, концентрирования и лиофильного высушивания (или разбавления), при этом сополимер представляет собой водорастворимый сополимер N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния или его гидразида и 1,4-этиленпиперазина общей формулы: , где n составляет от 40% до 90% от общего количества звеньев, m составляет от 3% до 40% от общего количества звеньев, n+m+1=100%, полученный из поли-1,4-этиленпиперазина путем окисления, алкилирования и, в случае азидного метода, гидразинолиза. Также раскрывается лекарственное средство, обладающее свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, полученное одним из указанных вариантов способа, в форме суппозитория, мази, инъекции или косметического средства. Группа изобретений обеспечивает повышение гиалуронидазной активности, степени конъюгации, выхода, стабильности препарата при хранении. 4 н. и 11 з.п. ф-лы, 10 пр., 3 табл., 2 ил.
Реферат
Изобретение относится к созданию технологических процессов получения иммобилизованных ферментных препаратов. Оно может быть широко использовано в различных отраслях, особенно в фармацевтической промышленности, для производства стабильных, активных и безопасных в применении лекарственных препаратов пролонгированного действия.
Наиболее эффективным способом стабилизации соединений белкового или иного характера в физиологическом растворе является химическая конъюгация на высокомолекулярных носителях [Parveen S, Sahoo S.K., Clin Pharmacokinet. 2006; 45(10), c. 965; Duncan R., PEGylated Protein Drugs: Basic Science and Clinical Applications. Ed:. Basel 2009; Harris J.M, Chess RB. Effect of pegilation on pharmaceuticals. // Nat Rev Drug Discov, 2003, 2(3), c. 214.
Ковалентное связывание лекарственных белков с полимерным носителем многократно повышает конформационную стабильность белковых молекул и устойчивость к действию протеаз и специфических ингибиторов, что позволяет создавать макромолекулярные физиологически активные препараты пролонгированного действия на их основе [Некрасов А.В., Пучкова Н.Г., Иммунология, 2006; 27(2), с. 1].
На сегодняшний день известно множество полимерных носителей для получения конъюгатов с белковыми и небелковыми соединениями. Наиболее хорошо известны различные конъюгаты на основе полиэтиленгликоля (ПЭГ), которые используются в качестве лекарственных препаратов [Бейлон П.С., Паллерони А.В. / Конъюгаты интерферона, Патент РФ 2180595. Бург Й, Хильгер Б., Йозель Х.-П., Патент RU 2232163; Курочкин С.Н., Парканский А.А., Патент RU 2298560].
Известны водорастворимые полимерные гетероциклические амины, например, производные N-оксида поли-1,4-этиленпиперазина. Полимерные амины уникальны по своим свойствам и применимости в качестве полимерного носителя для конъюгации. Сополимер N-оксида 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний галогенида (полиоксидоний) нетоксичен, обладает антирадикальными и детоксикационными свойствами, биодеградируемый за счет N-оксидных групп. Сополимер разрешен к применению в медицинской практике и используется как иммуномодулятор, адъювант или полимерный носитель [Некрасов А.В., Пучкова Н.Г., Иванова A.С. Производные поли-1,4-этиленпиперазина, обладающие иммуномодулирующей, противовирусной, антибактериальной активностями. Патент RU №2073031]. Это делает актуальным и важным направления по разработке доступных и простых технологических процессов производства полимерных носителей, отвечающих всем предъявляемым к ним требованиям, и различных процессов конъюгации на их основе.
В патенте RU 2185388 (опубликован 20.07.2002) описывается окисление поли-1,4-этиленпиперазина в водном растворе, содержащем растворитель и окислитель, способном образовывать атомарный кислород в нормальных условиях. В качестве окислителя целесообразно использовать органические и неорганические перекиси и гидроперекиси, соли кислородсодержащих галогенокислот, озон, кислород, полученный электролизом воды.
В качестве кислотного растворителя можно использовать, например, концентрированный водный раствор уксусной кислоты.
Окисление целесообразно проводить путем смешивания поли-1,4-этиленпиперазина (ПЭП) с водным раствором уксусной кислоты (УК) и пероксида водорода (ПВ) в мольном соотношении: ПЭП:УК:ПВ=1:0,45:0,7. Процесс окисления проводят в гетерогенной среде до достижения полного растворения полимера. Затем проводят алкилирование полученного N-оксида поли-1,4-этиленпиперазина в присутствии алкилирующего агента, которое осуществляют в водной среде. В качестве алкилирующего агента рекомендуется использовать вещества, ковалентно связывающиеся с атомом третичного азота в полимерной цепи в условиях температур 30-100°С, например галогенокислоты или их эфиры циклического или ациклического строения.
Предпочтительно, в качестве алкилирующего агента использовать этиловый эфир бромуксусной кислоты.
Полученный в процессе алкилирования раствор сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида (С-ПНО) после очистки, например, ультрафильтрацией может быть использован для дальнейшего синтеза высокомолекулярных водорастворимых биогенных соединений, в частности конъюгатов или комплексов с биологически активными веществами.
В патенте RU 2556378 (опубликован 10.07.2015) описывается конъюгат гликопротеина, обладающего активностью эритропоэтина и его способ получения. Способ включает окисление полиэтиленпиперазина до N-оксида и алкилирование бромуксусной кислотой, с получением сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида), а также очистку полученного сополимера. Конъюгацию сополимера с эритропоэтином проводят карбодиимидным или гидразидным методом.
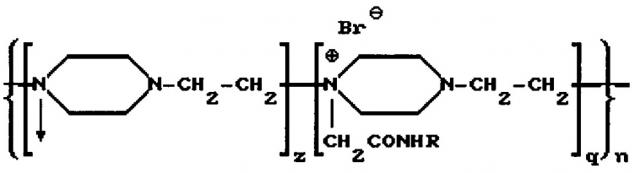
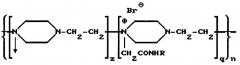
Наиболее близким к предлагаемому изобретению является изобретение, описанное в патенте RU 2112542 (опубликован 10.06.1998). Патент относится к препарату, содержащему конъюгат фермента гиалуронидазы, для лечения патологических состояний соединительных тканей. В патенте описывается способ получения конъюгата фермента гиалуронидазы с высокомолекулярным носителем - сополимером N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида (полиоксидонием), мол.м 40000-100000 Д, и соотношением фермент: носитель 1:(1-5) соответствующим общей формуле
где R - фермент гиалуронидазы; n=300-700 - количество элементарных звеньев; q=0,2-0,4 - количество алкилированных звеньев; z=0,4-0,8 - количество окисленных звеньев. При этом в качестве фермента в препарате может быть использована гиалуронидаза, выделенная из семенников крупного рогатого скота. Способ заключается в конъюгации гиалуронидазы с полиоксидонием с использованием азидного метода, либо метода активированных сукцинимидных эфиров. При использовании азидного метода конъюгат получают в две стадии: на первой - из полиоксидония получают гидразид полиоксидония, а на второй - получают конъюгат реакцией конденсации азида полиоксидония с ферментом. При использовании метода активированных эфиров вначале получают сукцинимидный эфир полиоксидония, а затем конъюгируют с ферментом. Конъюгированный препарат назван в описании как «Лонгидаза». Способ получения сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида в патенте не описывается.
Востребованность препаратов со свойствами препарата «Лонгидаза» на фармацевтическом рынке, экономические и экологические требования послужили причиной усовершенствования используемого в производстве процесса с целью исключения в нем определенных недостатков и повышения производительности.
Во всех вышеперечисленных патентах не рассматривается распределение молекулярных звеньев в структуре сополимера, или конъюгата, полученного на его основе.
Как показали исследования, распределение молекулярных звеньев в структуре сополимера оказывает влияние на свойства получаемого конъюгата, а именно на степень конъюгации, выходы целевого продукта и стабильность конъюгированных препаратов.
Задачей настоящего изобретения является разработка способа получения конъюгата фермента гиалуронидазы с полимерным носителем, содержащим сополимер N-оксида поли-1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида обладающего одновременно свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, пригодных для лечения патологических состояний соединительных тканей с улучшенными свойствами и повышенным выходом способа.
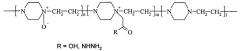
Решение поставленной задачи достигается способом получения активного конъюгата фермента гиалуронидазы с сополимером, содержащим N-оксид 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний галогенид с использованием карбодиимидного или азидного метода конъюгации, очистки, концентрирования и лиофильной сушки. Для конъюгации используют водорастворимый сополимер, который представляет собой сополимер N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния или его гидразидное производное и 1,4-этиленпиперазина общей формулы (I)
где n составляет от 40% до 90% от общего количества звеньев,
m составляет от 3% до 40% от общего количества звеньев,
n+m+1=100%,
полученный из поли-1,4-этиленпиперазина с использованием стадий окисления окислителем, способным образовывать атомарный кислород в нормальных условиях в присутствии мочевины, алкилирования низшей галогеналкановой кислотой или ее алкиловым эфиром и, в случае азидного метода, гидразинолиза.
Мочевину на стадии окисления добавляют в количестве 1-10 мас. %, предпочтительно 3-6%, мочевины в расчете на общую массу реакционной смеси, включая воду.
Для конъюгации используют гиалуронидазу из семенников животного происхождения (семенников крупного рогатого скота).
Очистку осуществляют поэтапно путем отмывки очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа.
Используемый сополимер является статистическим полимером, звенья в структуре молекулы которого расположены неупорядоченно и могут быть в любом порядке и сочетании.
От характера распределения функциональных групп зависит реакционная способность полимерного носителя в реакции конъюгации, а также стабильность сополимера и получаемых на его основе конъюгатов.
Полученный разными способами сополимер с одними и теми же количественными характеристиками с идентичными активными группами (N-оксидные и карбоксильные группы) проявляет совершенно разную реакционную способность в реакциях конъюгации. Это объясняется тем, что карбоксильные группы могут быть малодоступны по стерическим причинам и/или не быть активированы при наличии рядом находящихся N-оксидных групп. Использование полимерного носителя с малореакционноспособными карбоксильными группами приводит к существенному снижению выходов и степени конъюгации, ухудшает молекулярно-массовое распределение получаемых конъюгатов. До настоящего изобретения гетероциклический N-оксидный полимерный носитель не имел нужного количества реакционноспособных групп (карбоксильных или гидразидных), что не позволяло получать гарантированно высокую степень конъюгации с ферментом гиалуронидазы карбодиимидным или азидным методом конъюгации. Разработанные в настоящем изобретении способы производства позволяют получать препараты гиалуронидазы со степенью конъюгации не менее 90% даже в промышленных масштабах.
Наличие больших участков молекулы сополимера, содержащих только N-оксидные группы, делает полимерную молекулу малостабильной. Изучение стабильности показало, что конъюгаты на основе таких полимерных молекул со временем подвержены деструкции. Скорость деструкции полимерного носителя с неравномерным распределением N-оксидных групп не постоянна, деструкция происходит гораздо быстрее в первые месяцы хранения. Напротив, полимерный носитель с равномерным распределением N-оксидных групп намного более стабилен, скорость деструкции меньше и постоянна. Стабильность конъюгата и равномерность распределения N-оксидных групп в полимерном носителе также зависит от условий способа получения сополимера для конъюгации (см. таблицу 1 и таблицу 2).
Предлагаемое изобретение, относящееся к способу производства конъюгатов гиалуранидазы, позволяет получать полимерный носитель не только с заданными количественными характеристиками (количество различных звеньев в полимере), но с необходимым распределением звеньев, что качественно меняет свойства как самого полимерного носителя, так и конъюгата с ферментом на его основе.
Изобретение делает возможным выпускать безопасный, высокоэффективный и стабильный лекарственный препарат, обладающий одновременно свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, представляющий собой конъюгат гиалуронидазы (терапевтического фермента, выделенного из семенников крупного рогатого скота) и водорастворимого сополимера общей формулы (I).
В случае азидного метода конъюгации алкилирование проводят алкиловым эфиром галогеналкановой кислоты, и стадии алкилирования и гидразинолиза совмещены. Конъюгацию с гиалуронидазой проводят азидным методом при температуре от 0 до 25°С
Очистка представляет собой трехкратную поэтапную отмывку очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа после завершения стадий окисления, алкилирования и гидразинолиза и конъюгации.
Для конъюгации используют водорастворимый сополимер общей формулы (I), содержащий в своей цепи гидразидные группы от 3-20%.
В случае карбодиимидного метода конъюгации поли-1,4-этиленпиперазин сначала алкилируют, а затем подвергают окислению в водной среде. При этом алкилирование проводят галогеналкановой кислотой.
Очистку при карбодиимидном методе осуществляют поэтапно путем отмывки очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа после завершения стадии получения сополимера и конъюгации.
Для конъюгации используют водорастворимые сополимеры N-оксида поли-1,4-этиленпиперазина общей формулы (I), содержащие в своей цепи до 25% карбоксильных групп, и используют любые водорастворимые карбодиимиды в количестве от 3 до 50% от взятого в реакции сополимера.
Объектом изобретения также является активная субстанция конъюгата, обладающая свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, полученная любым из предлагаемых способов для приготовления лекарственного средства в виде лекарственной формы, выбранной из суппозитория, мази, инъекций или косметических средств, в том числе лекарственных средств для ветеринарии.
Ниже приводится подробное описание предлагаемого способа с использованием азидного и карбодиимидного методов конъюгации производства Лонгидазы с конкретными свойствами, включая характеристики сополимера, подробно описанными в 10 примерах и представленными в таблице 1 и в таблице 3.
В условиях предлагаемой технологии получения полимерного носителя и конъюгатов гиалуронидазы, как было обнаружено, происходит необходимое распределение функциональных звеньев в структуре сополимера, при которых полимерный носитель и конъюгаты на его основе получаются устойчивыми в процессе длительного хранения. Указанный результат достигается тем, что осуществляют реакцию окисления полиэтиленпиперазина в диссоциирующих условиях путем добавления мочевины. При этом разрушаются нековалентные межмолекулярные связи полиэтиленпиперазина, в реакциях участвуют отдельные молекулы полимера, а не молекулы в составе мицеллы, и достигается необходимое равномерное распределение функциональных групп по цепи полимера, повышается ферментативная активность (на 30-65% таблица 1), степень конъюгации и выходы целевого продукта (на 15-20%, см. таблицу 1), а также стабильность конъюгата гиалуронидазы. Ферментативная активность препаратов «Лонгидаза» при хранении при температуре 2-8°С в течение 1 года падала на 4-6% для образцов, полученных с использованием мочевины и на 24-27% - без применения мочевины (таблица 1, пример 4 и пример 9).
Получение конъюгата осуществляют двумя способами:
способом производства конъюгата гиалуронидазы с использованием азидного метода конъюгации,
и способом производства конъюгата гиалуронидазы с использованием карбодиимидного метода конъюгации.
В качестве исходного сырья для всех способов производства используется поли-1,4-этиленпиперазин (ПЭП) с молекулярной массой от 20 до 60 кДа.
ПЭП получают в результате катионной полимеризации, которая является эффективным методом синтеза монодисперсных высокомолекулярных соединений с заранее заданной молекулярной массой и структурой.
1. Способ производства конъюгата с использованием азидного метода конъюгации
Способ производства состоит из основных этапов технологического процесса: окисления в присутствии мочевины, алкилирования, гидразинолиза, проведения конъюгации азидным методом.
Окисление поли-1,4-этиленпиперазина проводят в кислой среде пероксидом водорода в присутствии мочевины при температуре 45-55°С в течение 12-24 часов в реакторе с водяной рубашкой. Затем реакционную смесь разбавляют, фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,45 нм, проводят диафильтрацию на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 5 кДа, и фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,22 нм. Далее лиофильно высушивают, анализируют на соответствие требованиям НД и сдают на склад.
На втором этапе полученный N-оксид поли-1,4-этиленпиперазина алкилируют эфиром галогеноалкановой кислоты в водно-органическом растворе (смесь вода и N-метилформамид) при перемешивании в интервале температур 35-50°С в течение 4-6 часов и проводят гидразинолиз алкильного производного полиэтиленпиперазина обработкой гидразингидратом при температуре 2-8°С. Реакционную массу фильтруют на патронном фильтре, снабженном фильтрующим элементом с 0,45 нм, проводят очистку на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 10 кДа (количество гидразингидрата не более 0,001%), проводят стерилизующую фильтрацию на патронном фильтре и разливают во флаконы. Анализируют на соответствие требованиям НД и сдают на склад.
На последнем третьем этапе процесс конъюгации гиалуронидазы с гидразидным производным карбоксиметилсодержащего N-оксида полиэтиленпиперазина, содержащим в своей цепи более 3% гидразидных групп, проводят азидным методом путем обработки нитритом натрия при рН 0-1 и последующей конъюгации азидного производного с гиалуронидазой в течение 18-22 часов при комнатной температуре. Конъюгат гиалуронидазы фильтруют, очищают отмывкой на ультрафильтрационной установке (кассеты с нижним пределом отсекания частиц 5 кДа), концентрируют, стерилизуют фильтрацией и лиофильно высушивают или хранят в виде концентрата. Результаты анализов приведены в таблице 1 (примеры 1-3).
Предлагаемым способом производства, включающим этапы алкилирования, окисления, но без добавления мочевины, гидразинолиз, конъюгацию азидным методом и процедуру очистки, получают образец Лонгидазы. Результаты анализов последнего представлены в таблице 1 (пример 4). Сравнительные исследования показывают, что добавление мочевины увеличивает ферментативную активность, степень конъюгации и выход целевого продукта, а также стабильность конъюгата (таблица 1).
Полученный лиофилизат расфасовывают во флаконы и сдают на склад в виде активной субстанции конъюгата с активностью, которой обладает Лонгидаза®.
В дальнейшем полученную лекарственную субстанцию используют для получения инъекционной формы препарата в жидком или лиофилизованном виде. Для этого раствор разбавляют с таким расчетом, чтобы в 1 мл раствора ферментативная активность составила 3000 ME (терапевтическая доза) и анализируют по всем параметрам на соответствие требованиям НД на готовую лекарственную форму. После этого раствор можно лиофильно высушить (лиофилизованная форма препарата) или, не высушивая, укупоривают, этикетируют жидкую лекарственную форму и контролируют по всем параметрам на соответствие требованиям НД на готовую лекарственную форму.
Предлагаемый согласно настоящему изобретению карбодиимидный метод позволяет провести процесс без органических растворителей и вредных реагентов, улучшить качество и повысить стабильность конечного препарата - конъюгата гиалуронидазы с производными полиэтиленпиперазина.
2. Способ производства Лонгидазы с использованием карбодиимидного метода конъюгации
Последовательная технология производства состоит из основных этапов технологического процесса: алкилирования, окисления в присутствии мочевины, проведения конъюгации карбодиимидным методом.
Используют поли-1,4-этиленпиперазин с заданными свойствами (см. выше), который алкилируют бромуксусной кислотой в водной среде при температуре 40-95°С при весовом соотношении (85:15)-(70:30) соответственно. Смесь перемешивают при температуре 50-70°С в течение 3 часов, затем в реакционную массу добавляют мочевину, уксусную кислоту и пероксид водорода, после этого при непрерывном перемешивании оставляют на 18-22 часов. Далее проверяют полноту протекания реакции окисления при помощи аммиачного теста (аналогично примеру 1). Реакционную массу фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,45 нм, полимер очищают отмывкой на ультрафильтрационной установке с нижним пределом отсекания частиц 5 кДа до содержания пероксида водорода не более 0,001% (тест на перекись водорода). Раствор концентрируют до 10-15%, содержание карбоксильных групп в полимере должно быть не менее 6%. В реакционную среду при перемешивании вводят рассчитанное количество гиалуронидазы и доводят рН среды до значения 4,8.
Продолжая перемешивание, добавляют водорастворимый карбодиимид с таким расчетом, чтобы его количество составляло 25-50% от введенной гиалуронидазы (в пересчете на белок). Реакционную смесь выдерживают при температуре 0-25°С в течение 1-1,5 часов, после чего проводят контроль степени конъюгации, которая должна быть не ниже 95%. При положительном результате реакционную смесь отмывают очищенной водой, подщелачивают до значения рН 6,8-7,0 и фильтруют на дисковом фильтре, снабженном глубинным фильтром марки АР-15. После предварительной фильтрации реакционную смесь продолжают очищать отмывкой очищенной водой на Пелликон-кассете с таким расчетом, чтобы общее количество воды составляло бы не менее 200 л на 1 кг сухих веществ. Затем раствор субстанции с активностью Лонгидазы® концентрируют, стерильно фильтруют на патронном фильтре, снабженном фильтрующей мембраной с размером пор 0,22 нм и расфасовывают во флаконы в виде жидкой субстанции. Также можно полученный стерильный концентрат лиофильно высушить, получая при этом субстанцию с активностью, которой обладает препарат «Лонгидаза»® в сухом виде. Проводят контроль на соответствие требованиям НД и сдают на склад готовой продукции. Результаты анализов субстанции приведены в таблице 1 (примеры 6-8).
Предлагаемым способом производства, включающим этапы алкилирования, окисления, но без добавления мочевины, конъюгации карбодиимидным методом и процедуры очистки, получен образец Лонгидазы, результаты анализов которого представлены в таблице 1 (пример 9). Так же, как и в случае способа производства Лонгидазы с использованием азидного метода конъюгации, добавление мочевины увеличивает ферментативную активность, степень конъюгации и выход целевого продукта, а также стабильность конъюгата (таблица 1, таблица 2).
Стерильный раствор конъюгата гиалуронидазы используют по назначению. Полученную лекарственную субстанцию используют для приготовления инъекционных форм в жидком или лиофилизованном виде. Для этого раствор разбавляют с таким расчетом, чтобы в 1 мл раствора ферментативная активность составила 3000 ME (терапевтическая доза) и разливают во флаконы и лиофильно высушивают (лиофилизованная форма препарата) или, не высушивая, укупоривают, этикетируют жидкую лекарственную форму и контролируют по всем параметрам на соответствие требованиям НД на готовую лекарственную форму.
В процессе получения конъюгата гиалуронидазы с производными полиэтиленпиперазина используют ультрафильтрационную очистку на кассетах с отсечением 1-30 кДа для удаления технологических примесей. Отмывку проводят после завершения стадий алкилирования и окисления, а также в конце технологического процесса. Предложенный карбодиимидный способ конъюгации осуществляют исключительно в водной среде.
Таким образом, технический результат предлагаемого способа заключается в разработке новых подходов в технологии получения иммобилизованных соединений на полимерном носителе нового класса в виде водорастворимых производных ПЭП по азидному и карбодиимидному методам, позволяющих получать высокий выход целевого продукта и высокое качество конечного продукта. Достигается указанный технический результат благодаря тому, что сополимер получают химической модификацией из ПЭП в присутствии мочевины, что в процессе дальнейшей конъюгации способствует значительному повышению гиалуронидазной активности, степени конъюгации, выхода препарата с активностью Лонгидазы и ее стабильности при хранении. При этом технологический процесс с использованием карбодиимидного метода обеспечивает более высокую степень конъюгации и активность конечного продукта и процесс осуществляется исключительно в водном растворе.
Изобретательский уровень разработанных способов производства конъюгата гиалуронидазы с производными полиэтиленпиперазина подтверждается отсутствием в данном направлении деятельности технологических процессов непрерывного характера и тем, что получение N-оксида полиэтиленпиперазина проводилось с использованием мочевины. При промышленном применении карбодиимидного метода последний является более предпочтительным, чем азидный метод. Применение разработанных способов в производстве пролонгированных форм соединений различного назначения позволяет улучшить производство нового препарата с активностью, превышающей активность препарата «Лонгидаза»®.
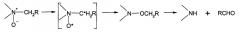
Изучение деструкции сополимеров N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния и 1,4-этиленпиперазина показало, что при температурах не выше 70°С в водной среде с рН не более 9 деструкция происходит исключительно по N-оксидным звеньям. Термическое разложение N-оксидов протекает посредством перегруппировки Мезенгеймера:
Сополимер, имеющий равномерное распределение различных звеньев, не может иметь большие участки, состоящие только из одного вида звеньев. Так, при содержании 50% и более N-оксидных звеньев и их равномерном распределении по полимерной цепочке, сополимер не должен иметь большие участки, состоящие только из незамещенных звеньев 1,4-этиленпиперазина (звенья 1). Основываясь на этом, был разработан метод качественной и количественной оценки равномерности распределения звеньев, содержащих N-оксидные группы по цепочке сополимера. Метод заключается в контролируемой деструкции сополимера с последующим физико-химическим анализом получаемых фрагментов. Было установлено, что при использовании в процессе окисления мочевины продукты деструкции не содержат низкомолекулярный полимер с содержанием одного вида звеньев:
где 1 = 3 и выше.
Наличие этого вещества в продуктах деструкции сополимера говорит о большой неравномерности распределения N-оксидных звеньев в исходном сополимере.
При анализе сополимера серии 111114 методом деструкции было выделено вещество
где 1 = от 4 до 6.
Проанализировав количество и качественный состав этого вещества, можно качественно и количественно судить о характере распределения N-оксидных групп в исследуемом сополимере. Однако разработанный метод измерения требует много времени (контролируемая деструкция сополимера по N-оксидным группам занимает 5 недель) и большого количества вещества для анализа. С учетом этого был разработан качественный метод быстрой оценки равномерности распределения звеньев.
В исследованиях разных образцов сополимеров методом ДСК (дифференциальной сканирующей калориметрии) было показано, что полимеры данного типа интенсивно разлагаются при температуре около 160°С с выделением тепла. При этом наблюдаются разные формы экзотермического пика разложения у образцов, полученных с применением мочевины и без. Так, были исследованы 2 образца полимерного носителя с одинаковыми количественными показателями - молекулярный вес, молекулярно-массовое распределение, количество карбоксильных и N-оксидных групп, полученных с применением мочевины на стадии окисления и без. При этом конъюгаты, полученные на одном полимерном носителе, были стабильными, на другом носителе нет.
Кривые ДСК сополимеров приведены на рис. 1 и 2.
На кривых ДСК (рис. 1 и 2) наблюдается значительное различие соотношения интенсивностей пиков в интервале 150-170°C. Полученные результаты указывают на связь структуры полимера (характер распределения звеньев) с его термической устойчивостью. Полученные результаты были подтверждены исследованиями других носителей и демонстрируют возможность различать образцы полимерных носителей с разной устойчивостью, обусловленной характером распределения функциональных групп в молекуле полимерного носителя.
Ниже приведены конкретные параметры, которые сведены в таблицу 1 и представлены в примерах 1-3 и 6-8. В таблице 1 также указаны результаты промышленных серий (пример 5 и пример 10). В примерах 4 и 9 приведены данные, подтверждающие преимущества способа производства в присутствии мочевины. Конкретные параметры сополимера представлены в таблице 3.
Пример 1
Способ производства конъюгата гиалуронидазы с производными полиэтиленпиперазина с использованием азидного метода конъюгации
Берут 200 г стружки поли-1,4-этиленпиперазина с молекулярной массой 50 кДа, предварительно измельченной и очищенной по методу четырехкратной отмывки очищенной водой. Стружку окисляют в смеси 50 мл уксусной кислоты, 140 мл 30%-ного раствора перекиси водорода в воде в присутствии 50 г мочевины. Количество воды добавляют таким образом, чтобы концентрация по ПЭПу была 15% мас., т.е. объем реакционной среды должен составлять 1,5 л. Реакционную смесь нагревают до 50°С и при непрерывном перемешивании выдерживают в течение 24 часов. Полноту окисления проверяют с помощью аммиачного теста. Аммиачный тест состоит в следующем, к 1 мл реакционной смеси добавляют 10 мл 25% раствора аммиака. Положительным результатом считается отсутствие мути в растворе после выдержки в течение 20 минут. При положительном результате реакционную смесь разбавляют, фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,45 нм, очищают и концентрируют на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 5 кДа, и фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,22 нм. Далее лиофильно высушивают и получают 204 г N-оксида поли-1,4-этиленпиперазина в виде лиофилизата, который анализируют на соответствие требованиям НД и сдают на склад.
Полученный N-оксид поли-1,4-этиленпиперазина растворяют в 1500 мл дистилированной воды и добавляют 6000 мл N-метилформамида. В полученный раствор добавляют 275 мл эфира бромалкановой кислоты и при перемешивании выдерживают при температуре 35-50°С в течение 4-6 часов. Затем реакционную массу охлаждают до 2-8°С и при перемешивании добавляют 250 мл гидразингидрата. Реакционную смесь разбавляют очищенной водой в 10 раз, фильтруют на патронном фильтре, снабженном фильтрующим элементом с 0,45 нм и очищают водой очищенной методом ультрафильтрации на Пиликон-кассетах (с нижним пределом отсекания частиц 10 кДа) до содержания следовых количеств гидразингидрата (не более 0,001%). Далее реакционную смесь концентрируют до 10-12% (по целевому веществу), стерильно фильтруют и разливают во флаконы. Получают 2200 мл раствора гидразидного производного N-оксида поли-1,4-этиленпиперазина, анализируют на соответствие требованиям НД (таблица 3, пример 1) и сдают на склад.
В полученный на предыдущей стадии раствор охлаждают до 2-6°С и при перемешивании и охлаждении добавляют соляную кислоту до рН 0-1. Затем при перемешивании и охлаждении порциями добавляют 360 г нитрита натрия и выдерживают реакционную массу 1,5 часа. После этого реакционную среду подщелачивают сухим поташом до рН 6,8-7 и, при температуре до 10°С, при перемешивании добавляют 10%-ный раствор, содержащий 65 г препарата гиалуронидазы (70% белка). Реакционную смесь продолжают перемешивать в течение 1,5 часа, затем отбирают пробу для контроля степени конъюгации. При положительном результате степени конъюгации (не ниже 70%) реакционную массу фильтруют на дисковом фильтре, снабженном глубинным фильтром марки АР-15, и отмывают 50 л очищенной воды на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 5 кДа. Раствор концентрируют, стерильно фильтруют и фасуют в стерильные флаконы (жидкая субстанция). Стерильный раствор также лиофильно высушивают и фасуют в стерильные флаконы (лиофилизованная субстанция). Получают 231 г, выход 86%. Результаты анализа полученной субстанции конъюгата представлены в таблице 1 (пример 1). Полученная субстанция используется для приготовления готового лекарственного средства с видом активности, идентичным активности известного препарата «Лонгидаза», в виде суппозитория вагинального и ректального 3000 МЕ.
Пример 2
Проводят аналогично Примеру 1, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 40 кДа и на стадии окисления используют 60 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 2. Получают 227 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 84%. Результаты анализа представлены в таблице 1, пример 2.
Полученная субстанция используется для приготовления крема и мазей для наружного применения, 1000 ME.
Пример 3
Проводят аналогично Примеру 1, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 55 кДа и на стадии окисления используют 80 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 3. Получают 235 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 87%. Результаты анализа представлены в таблице 1, пример 3.
Субстанция используется для приготовления инъекционной формы.
Пример 4
Проводят аналогично Примеру 1, с той разницей, что на стадии окисления не добавляют мочевину. Результаты контроля сополимера представлены в таблице 3, пример 4. Получают 215 г субстанции с активностью Лонгидазы®, в виде лиофилизата, выход 74%. Результаты анализа Лонгидазы® представлены в таблице 1, пример 4.
Субстанция с видом активности, идентичным активности известного препарата «Лонгидаза», используется для приготовления инъекционной формы.
Пример 5
Проводят аналогично Примеру 1, с той разницей, что используют измельченный и очищенный ПЭП в количестве 4000 г с молекулярной массой 45 кДа, а также тем, что на стадии окисления добавляют 2000 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 5. Получают 4700 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 87%. Результаты анализа представлены в таблице 1 (пример 5).
Дозируя требуемое количество полученной субстанции в суппозиторные, мазевые или кремовые основы, получают соответственно суппозитории, кремы, мази, содержащие активную субстанцию. Также субстанция используется для приготовления инъекционной формы.
Пример 6
Способ с использованием карбодиимидного метода конъюгации
Поли-1,4-этиленпиперазин 200 г с молекулярной массой 30 кДа добавляют в 1,2 л кипящего водного раствора, содержащего 58 г бромуксусной кислоты, и продолжают нагревать при 70°С в течение 3 часов при непрерывном перемешивании. Затем в реакционную массу добавляют 40 мл уксусной кислоты, 140 мл 30%-ного водного раствора пероксида водорода, 50 г мочевины и перемешивают при температуре 38-42°С в течение 18-20 часов. Далее проводят проверку на полноту степени окисления с помощью аммиачного теста (тест описан выше). При положительном результате реакционную смесь разбавляют до концентрации 1-2% и фильтруют на патронном фильтре, содержащем фильтрующий элемент с размерами пор 0,45 нм, очищают отмывкой очищенной водой на Пиликон-кассете с нижним пределом отсекания частиц 5 кДа. В процессе отмывания раствор подщелачивают до значения рН 11,0-11,5 с целью полной очистки от следов низкомолек