Способ персонифицированного назначения стандартного или комбинированного режимов поддержки лютеиновой фазы в программе эко с использованием молекулярно-генетических маркеров
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложен способ персонифицированного назначения стандартного или комбинированного режимов поддержки лютеиновой фазы (ЛФ) в программе ЭКО. Из образцов тканей пациентки с трубно-перитонеальным фактором бесплодия выделяют ДНК, определяют генотип по локусам LHCGR: 872 A>G(Asn291Ser) [rs12470652]; PGR: 38 T>C [rs484389] с применением ПЦР в режиме реального времени. В случае наличия генотипов риска 38 Т/С или 38 С/С для гена PGR или 872 T/C для гена LHCGR, то рекомендуют стандартный режим поддержки ЛФ - микронизированным прогестероном (Р). Если генотипы риска отсутствуют, то рекомендуют комбинированный режим поддержки ЛФ - микронизированным Р+а-ГнРГ. Предложенный способ повышает эффективность программ ЭКО у женщин с бесплодием. 1 ил., 1 табл., 2 пр.
Реферат
Поддержка лютеиновой фазы (ЛФ) стимулированного цикла - это интегральная часть программ вспомогательных репродуктивных технологий (ВРТ), во многом определяющая их результативность. В качестве одной из причин неудач программы экстракорпорального оплодотворения (ЭКО) предполагают потери на этапе имплантации эмбриона. Это связывают с тем, что методы ВРТ оказывают отрицательное влияние на раннее функционирование желтого тела, в связи с этим недостаточность ЛФ после стимуляции суперовуляции в протоколах с аналогами гонадотропин - рилизинг гормона (ГнРГ) является серьезной проблемой ВРТ. По данным литературы недостаточность ЛФ в программах ЭКО развивается в большинстве случаев как в протоколах с агонистами-гонадотропин-рилизинг гормона (а-ГнРГ), так и антагонистами - гонадотропин-рилизинг гормона (ант-ГнРГ) и обусловлена неблагоприятными эффектами стимуляции суперовуляции, подавлением секреции лютеинизирующего гормона (ЛГ) аналогами ГнРГ [1, 2, 3].
Таким образом, ожидаемый результат лечения методом ЭКО в значительной степени зависит от эффективности проводимой поддержки ЛФ. В настоящее время для восполнения недостаточности ЛФ используются различные режимы ее поддержки, включающие препараты прогестерона (Р), хорионического гонадотропина человека (ХГч), эстрадиола (Е2), однако сами препараты и их дозы назначаются врачами эмпирически [4, 5]. В последние годы появились работы, в которых было показано существенное повышение частоты имплантации, клинической беременности, развивающейся беременности и частоты родов живым плодом при добавлении к стандартному режиму поддержки ЛФ микронизированным Р препаратов а-ГнРГ (комбинированная поддержка ЛФ) [4, 6, 7, 8].
Несмотря на обнадеживающие результаты адъювантного применения препаратов а-ГнРГ для поддержки ЛФ в ряде публикаций, недостатками этих работ являются гетерогенность выборок, различные режимы поддержки ЛФ в группах сравнения, а также отсутствие ясности, для каких именно пациенток комбинированный режим поддержки ЛФ был бы наиболее эффективен, отсутствуют молекулярно-генетические предикторы назначения режимов поддержки ЛФ.
Как известно, на индивидуальную реакцию пациентки, использующей различные гормональные препараты, могут влиять сотни генов, но лишь небольшое количество ключевых одиночных нуклеотидных полиморфизмов (SNPs) могут прогнозировать эффективность применения данного препарата. В литературе широко изучаются полиморфизмы генов, которые участвуют в ответе яичников на стимуляцию суперовуляции и могут влиять на адекватность течения ЛФ в стимулированных циклах программ ЭКО [9].
Как следствие, последнее приобретает чрезвычайную актуальность в связи с высокой перспективностью для разработки персонифицированного подхода к ведению ЛФ в программах ВРТ.
В связи с чем было проведено исследование, целью которого явилось комплексная оценка молекулярно-генетических предикторов с целью предикции исходов программ ВРТ, что позволит индивидуально подобрать оптимальный режим поддержки ЛФ и тем самым увеличить эффективность программ ВРТ.
Способ персонифицированного назначения стандартного или комбинированного режимов поддержки лютеиновой фазы в программе ЭКО с использованием молекулярно-генетических маркеров, отличающийся тем, что выделяют ДНК из образцов тканей пациентки с трубно-перитонеальным фактором бесплодия, в качестве предпочитаемого источника ДНК рекомендуют периферическую кровь, определяют генотип по локусам LHCG R:872 A>G (Asn291Ser) [rs 12470652]; PGR: 38 T>C [rs484389] с применением ПЦР в режиме реального времени; если в генотипе пациентки присутствуют 1 или 2 генотипа риска, т.е. для гена PGR генотипы риска 38 Т/С и 38С/С, а для гена LHCGR - генотип риска 872Т/С, то рекомендуют стандартный режим поддержки ЛФ-микронизированным прогестероном, если генотипы риска отсутствуют, то рекомендуют комбинированный режим поддержки ЛФ - микронизированным Р+а-ГнРГ.
Материалы и методы
В исследование была включена 207 пациенток с трубно-перитонеальным фактором бесплодия, которые получали лечение в программе ЭКО.
Стимуляцию функции яичников проводили по фиксированному протоколу с ант-ГнРГ с использованием препаратов рекомбинантного ФСГ (рФСГ) со 2-3 дня менструального цикла. Введение гонадотропинов начинали при наличии условий для начала стимуляции суперовуляции по данным УЗИ: отсутствие кист яичников, толщина эндометрия не более 4 мм. Подбор стартовой дозы индуктора осуществляли исходя из параметров овариального резерва пациенток (возраст, уровень ФСГ, антимюллеровый гормон (АМГ), количество антральных фолликулов и ответ на предыдущую стимуляцию). Дозу индуктора корректировали в соответствии с ответом яичников на стимуляцию. С целью предотвращения паразитарного пика эндогенного ЛГ при достижении диаметра фолликулов 14-15 мм начиналось введение препарата ант-ГнРГ в дозе 0,25 мг/сут подкожно. В качестве триггера овуляции для финального созревания ооцитов назначали ХГч 10000 ME при визуализации трех и более фолликулов ≥17 мм в диаметре и толщине эндометрия 8-10 мм. ТВП яичников осуществляли через 35-36 часов после введения триггера овуляции. Преинкубация, оплодотворение ооцитов или ИКСИ, а также культивирование эмбрионов осуществлялось в средах для культивирования фирмы «ORIGIO» (Дания). Оценка качества полученных ооцитов по степени зрелости и эмбрионов осуществлялась на основании общепринятых критериев. Перенос 1-2 эмбрионов проводили на 3-5 сутки культивирования.
В зависимости от режима ведения ЛФ пациентки были рандомизированы на две группы: в 1-й группе (n=92) получали микронизированный Р-600 мг/день с 1-х суток после оплодотворения и трипторелин-0,1 мг и/к на 6-е сутки после оплодотворения, во 2 группе (n=115)-микронизированный Р-600 мг/день с 1-х суток после оплодотворения.
Анализ исходов программы ЭКО проводили с учетом наличия полиморфизмов LHR, PGR.
Определяют генотип по данным позициям с применением полимеразной цепной реакции (ПЦР) или аналогичного метода, позволяющего определить указанные генетические маркеры. ПЦР и определение температуры плавления олигонуклеотидных проб проводят при помощи детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). ДНК для генотипирования выделяют из образцов периферической крови взятой с ЭДТА (этилендиаминтетрауксусная кислота) в качестве антикоагулянта, объемом 0,5 мл, смешивают в микроцентрифужных пробирках (объемом 1,5 мл) типа Эппендорф с лизирующим раствором (0,5 мл), состоящим из 10 мМ Трис-HCl pH 7,5, 0,32 М сахарозы, 5 мМ MgCl, 1% Тритона Х-100 центрифугируют. Центрифугирование проводится в течение 1 мин при 10000 об/мин, супернатант удаляется, осадки клеточных ядер двукратно отмывают соответствующим буфером. В последующем протеолиз проводят в буферном растворе (50 мкл), содержащем 10 мМ Трис-HCl pH 8,3, 50 мМ KCl, 0,45% NP40, 045% Твина 20 и 250 мкг/мл протеиназы К, 2,5 мМ MgCl, в течение 20 минут при 37°C. Инактивация протеиназы К производится в течение 20 минут при температурном режиме 98°C. Концентрация ДНК определяется на ДНК-минифлуориметре (Hoefer, США) и составляет около 50-100 мкг/мл. Идентификацию однонуклеотидных полиморфизмов проводят с помощью модифицированного метода «примыкающих проб» (adjacent probes, kissing probes), с использованием оригинальных олигонуклеотидов [10; 11].
Определение полиморфизма генов сначала проводится ПЦР с праймерами, которые связываются с комплементарными последовательностями, и между циклами нагревания (для денатурации ДНК) и охлаждения (для обеспечения синтеза) синтезируются копии данной области гена [12]. Праймеры общие для обоих вариантов нуклеотидной последовательности, после чего температуру реакционной смеси для гибридизации матрицы с олигонуклеотидными пробами понижают. Для определения типа последовательности используют два варианта олигонуклеотидов. В первом случае олигонуклеотиды метят флуорофором, во втором - гасителем флуоресценции. Этот процесс протекает при помощи ферментов, способных соединять нуклеотидные основания и выдерживать необходимые для денатурации температурные режимы [12]. В качестве такого фермента используется Taq-полимераза, блокированная специфическими антителами, чтобы предотвратить неспецифический отжиг праймеров и повысить чувствительность тест-систем.
В режиме реального времени измеряют уровень флуоресценции в процессе температурной денатурации дуплексов олигонуклеотидов и полученных матриц. Генотип определяется путем анализа кривых плавления. В том случае, если анализируемый образец содержит только один тип нуклеотидной последовательности гена, т.е. гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, выше, чем для пробы, образующей несовершенный дуплекс.В том случае, если анализировался гетерозиготный образец, содержащий два типа нуклеотидной последовательности, каждый из вариантов проб может образовать совершенный дуплекс, поэтому температуры плавления одинаковы [12].
Результаты исследования
Проведена оценка клинико-анамнестических данных, гормональных параметров и параметров стимулированного цикла, раннего оогенезе и эмбриогенеза пациенток, включенных в работу, а также исследованы генетические маркеры, потенциально влияющих на исходы программ ЭКО в зависимости от режима поддержки ЛФ.
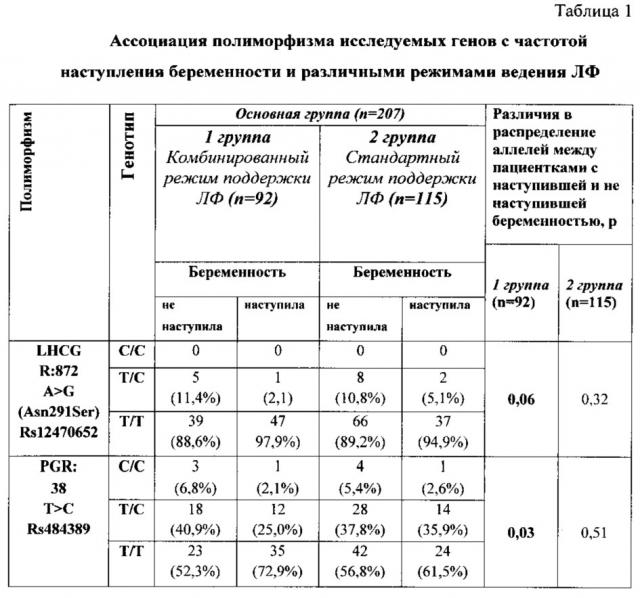
В ходе проведенного анализа выявлена статистически значимая ассоциация полиморфизмов PGR: 38 Т>С [rs484389], LHCG R:872 A>G (Asn291Ser) [rs 12470652] (см. таблицу 1) с частотой наступления беременности при различных режимах поддержки ЛФ.
Проведен многофакторный дискриминантный анализ распределения генотипов LHCGR: 872 A>G, PGR: 38 Т>С, а также их сочетаний. В результате дискриминантного анализа была получена прогностическая модель неудачи программы ВРТ при различных тактиках ведения ЛФ в зависимости от сочетаний генотипов риска (PGR 38С/С или PGR 38Т/С) и LHCGR: 872Т/С. В качестве предиктора неудачи использовалась переменная, принимающая значение 1 - если в генотипе пациентки присутствовал хотя бы один генотип риска по указанным маркерам, и 2 - если присутствовали оба генотипа риска. При отсутствии генетических маркеров неудачи ВРТ переменная принимала значение 0. Данная переменная продемонстрировала наилучшую предсказательную способность (Лямбда Уилкса 0,968, p=0,011, площадь под кривой при проведении ROC-анализа составила 0,59 (0,51-0,67), p=0,032). Таким образом, у пациенток, получавших комбинированную поддержку ЛФ, при отсутствии генотипов риска частота наступления беременности возрастала до 63% и была существенно выше по сравнению со стандартной поддержкой, а среди пациенток, получавших а-ГнРГ при значении переменной, равном 1 (т.е. при наличии хотя бы одного генотипа риска), вероятность наступления беременности составляла 39,3% и была сопоставима со стандартной поддержкой и 35,7% (фиг. 1).
Фиг.1 - Прогностическая модель эффективности программ ЭКО стандартном и комбинированном режиме поддержки лютеиновой фазы.
* p<0,05 по сравнению комбинированной поддержки ЛФ с группой со стандартной поддержкой ЛФ при отсутствии генотипа риска (критерий Фишера).
** p<0,05 по сравнению комбинированной поддержки ЛФ при наличии генотипа риска с комбинированной поддержкой при отсутствии генотипа риска (критерий Фишера).
Пример 1
Персонифицированное назначение стандартного или комбинированного режимов поддержки лютеиновой фазы в программе ЭКО у пациентки X 29 лет, обратившейся для проведения программы ЭКО и ПЭ по поводу трубно-перитонеального фактора бесплодия. Из анамнеза: беременностей 0, в 2013 г. проведена лапароскопия, двухсторонняя тубэктомия по поводу гидросальпинксов. Данная попытка ЭКО первая.
Результат генотипирования пациентки X:
LHCGR 872 A>G (Asn291Ser) [rs12470652] - Т/С
PGR: 38 T>C [rs484389]-C/C
Пациентка направлена в программу ЭКО, для поддержки ЛФ назначена стандартная поддержка ЛФ, в результате проведенной программы ЭКО наступила беременность.
Пример 2
Персонифицированное назначение стандартного или комбинированного режимов поддержки лютеиновой фазы в программе ЭКО у пациентки А 34 лет, обратившейся для проведения программы ЭКО и ПЭ по поводу трубно-перитонеального фактора бесплодия. Из анамнеза: беременностей 0, по данным гистеросальпингографии от 2012 г. - маточные трубы не проходимы, в 2014 программа ЭКО, беременность не наступила. Данная попытка ЭКО вторая.
Результат генотипирования пациентки X:
LHCGR 872 A>G (Asn291Ser) [rs12470652] - Т/Т
PGR: 38 T>C [rs484389]-T/T
Пациентка направлена в программу ЭКО, для поддержки ЛФ назначена комбинированная поддержка ЛФ, в результате проведенной программы ЭКО наступила беременность.
Список литературы
1. Beckers NG, Macklon NS, Eijkemans MJ, Ludwig M, Felberbaum RE, Diedrich K, Bustion S, Loumaye E, Fauser ВС. Nonsupplemented luteal phase characteristics after the administration of recombinant human chorionic gonadotropin, recombinant luteinizing hormone, or gonadotropin-releasing hormone (GnRH) agonist to induce final oocyte maturation in in vitro fertilization patients after ovarian stimulation with recombinant follicle-stimulating hormone and GnRH antagonist cotreatment. J Clin Endocrinol Metab. - 2003. - Vol. 88. - P. 4186-1192.
2. Kerin JF, Broom TJ, Ralph MM, Edmonds DK, Warnes GM, Jeffrey R, Crocker JM et al. Human luteal phase function following oocyte aspiration from the immediately preovular graafian follicle of spontaneous ovular cycles. Br J Obstet Gynaecol - 1981- Vol. 88. - P. 1021-1028.
3. Kolibianakis EM, Devroey P. The luteal phase after ovarian stimulation. Reprod Biomed Online - 2002a- Vol.5. - P.26-35.
4. Michelle van der Lindenl, Karen Buckingham, Cindy Farquhar, Jan AM Kremer, Mostafa Metwally. Editorial Group: Cochrane Menstrual Disorders and Subfertility Group Published Online: 5 OCT 2011 Assessed as up-to-date: 25 MAY 2011.
5. Ludwig M, Finas A, Katalinic A, Strik D, Kowalcek I, Schwartz P et al. Prospective, randomized study to evaluate the success rates using hCG, vaginal progesterone or a combination of both for luteal phase support. Acta Obstetricia et Gynecologica Scandinavica - 2001 - Vol. 80. - P. 574-82.
6. Tesarik J, Hazout A, Mendoza-Tesarik R, Mendoza N, Mendoza C. Beneficial effect of luteal-phase GnRH agonist administration on embryo implantation after ICSI in both GnRH agonist- and antagonist-treated ovarian stimulation cycles. Hum Reprod - 2006. - Vol. 21. - P. 2572-2579.
7. Zafardoust S, Jeddi-Tehrani M, Akhondi MM, Sadeghi MR, Kamali K, Mokhtar S, et al. Effect of Administration of Single Dose GnRH Agonist in Luteal Phase on Outcome of ICSI-ET Cycles in Women with Previous History of IVF/ICSI Failure: A Randomized.
8. Razieh DF, Maryam AR, Nasim T: Beneficial effect of luteal-phase gonadotropin-releasing hormone agonist administration on implantation rate after intracytoplasmic sperm injection. Taiwan J Obstet Gynecol - 2009- Vol. 48. - P. 245-248.
9. Cramer DW, Hornstein MD, McShane P, Douglas Powers R, Lescault PJ, VitonisAF, De VivoI. Human progesterone receptor polymorphisms and implantation failure during in vitro fertilization American Journal of Obstetrics and Gynecology. - 2003 - Vol. 189. - №4. - P. 1085-1092.
10. Кофиади И.А., Ребриков Д.В. Методы детекции однонуклеотидных полиморфизмов: аллель-специфичная ПЦР и гибридизация с олигонуклеотидной пробой // Генетика 2006 - Т. 42 (1) С. 22-32.
11. Lyon Е. Mutation detection using fluorescent hybridization probes and melting curve analysis // Expert Rev Mol Diagn. - 2001. - Vol. 1. - №1. - P. 92-101.
12. Элдер К., Дэйл Б. Экстракорпоральное оплодотворение / М.: МЕДпресс-информ, 2008. - 276 с.
Способ персонифицированного назначения стандартного или комбинированного режимов поддержки лютеиновой фазы в программе ЭКО с использованием молекулярно-генетических маркеров, отличающийся тем, что выделяют ДНК из образцов тканей пациентки с трубно-перитонеальным фактором бесплодия, в качестве предпочитаемого источника ДНК рекомендуют периферическую кровь, определяют генотип по локусам LHCGR: 872 A>G(Asn291Ser) [rs12470652]; PGR: 38 T>C [rs484389] с применением ПЦР в режиме реального времени; если в генотипе пациентки присутствуют 1 или 2 генотипа риска, т.е. для гена PGR генотипы риска 38 Т/С и 38 С/С, а для гена LHCGR - генотип риска 872 T/C, то рекомендуют стандартный режим поддержки ЛФ - микронизированным прогестероном, если генотипы риска отсутствуют, то рекомендуют комбинированный режим поддержки ЛФ - микронизированным Р+а-ГнРГ.