Способ получения амфифильных блок-сополимеров n,n-диметиламиноэтилметакрилата для доставки нуклеиновых кислот в живые клетки
Иллюстрации
Показать всеГруппа изобретений относится к области химии высокомолекулярных соединений и медицины, а именно к вариантам способа получения псевдоживой радикальной полимеризации амфифильных блок-сополимеров для трансфекции эукариотических клеток, включающих катионный блок – поли(N,N-диметиламиноэтилметакрилат) и гидрофобный блок – поли(олигопропиленгликольакрилат). Согласно первому варианту способ включает приготовление раствора динитрила азоизомасляной кислоты (ДАК) и агента обратимой передачи цепи, выбираемого из дитиобензоата циан-изопентановой кислоты и S,S'-бис-(метил-2-изобутират)тритиокарбоната, в N,N-диметиламиноэтилметакрилате, дегазирование раствора, проведение полимеризации с получением полимерного агента обратимой передачи цепи, такого как поли(N,N-диметиламиноэтилметакрилат), содержащий дитиобензоатную или тритиокарбонатную группу, его растворение в смеси олигопропиленгликольакрилат/бензол и проведение полимеризации с последующим выделением, очисткой и высушиванием полученного блок-сополимера. Согласно второму варианту способ включает приготовление раствора ДАК и агента обратимой передачи цепи в смеси олигопропиленгликольакрилат/бензол, дегазирование раствора, проведение полимеризации с получением полимерного агента обратимой передачи цепи, такого как поли(олигопропиленгликольакрилат), содержащий дитиобензоатную или тритиокарбонатную группу, его растворение и ДАК в смеси N,N-диметиламиноэтилметакрилат/бензол, проведение полимеризации с последующим выделением, очисткой и высушиванием полученного блок-сополимера. Группа изобретений обеспечивает высокую трансфекционную активность. 2 н. и 1 з.п. ф-лы, 3 пр., 6 ил.
Реферат
Изобретение относится к области химии высокомолекулярных соединений, молекулярной биологии и медицины и может быть использовано для генной терапиинаследственных, онкологическихи инфекционных заболеваний. Использование этого изобретения возможно для лечения вирусных заболеваний, для которых разработаны вирусоспецифические антисмысловые олигонуклеотиды, рибозимы, ДНКзимы или миРНК, способные эффективно подавлять репродукцию вирусов. Изобретение может быть также использовано для доставки нуклеиновых кислот в эукариотические клетки invitro для получения трансгенных эукариотических линий.
Уровень техники
Нуклеиновые кислоты, кодирующие различные гены, антисмысловыеолигонуклеотиды, рибозимы, аптамеры и малые интерферирующие РНК могли бы быть идеальными по избирательности действия лекарственными веществами. Однако нуклеиновые кислоты практически не проникают в живые клетки вследствие высокой плотности отрицательного заряда, одноименного по отношению к заряду клеточной мембраны. Поэтому создание носителей, способных обратимо связывать нуклеиновые кислоты, доносить их до клеточной мембраны и высвобождать в цитозоле или ядре, могло бы существенно расширить арсенал лекарственных средств для борьбы с различными заболеваниями как инфекционной, так и метаболической этиологии.
В последние два десятилетия генной терапии, как методу лечения вирусных инфекций уделяется существенное внимание. Усилия исследователей в данный момент фокусируются на создании эффективного трансфецирующего агента для генной терапии, который компактизует и защитит генетический материал от нуклеаз сыворотки крови и будет способствовать его проникновению в клетки-мишени [1].
Невирусные носители, такие как катионные липиды, дендримеры и пептиды, все способны компактизовать и связывать нуклеиновые кислоты (НК), способствуя их проникновению в клетки. Однако, в отличие от вирусных аналогов, у которых развиты способы преодолевать клеточные барьеры и механизмы иммунного ответа в организме, невирусные носители НК показывают гораздо меньшую транфецирующую способность, так как они задерживаются многочисленными вне- и внутриклеточными защитными барьерами. Однако биосовместимость и возможность синтеза этих соединений делают их очень привлекательными для использования в генной терапии. В результате, в течение последних десяти лет, многочисленные исследования были посвящены получению катионных соединений, которые могут образовывать комплексы с НК и преодолевать клеточные барьеры [1-2].
Первым барьером, который необходимо преодолеть полиплексу на пути до клетки-мишени, является кровь и внеклеточная среда. Именно поэтому необходимо подобрать такие физико-химические параметры комплекса, чтобы увеличить его стабильность, избежать неспецифических взаимодействий и возможности иммунного ответа. Во-первых, в составе полиплекса ДНК должна быть защищена от действия внеклеточных нуклеаз. Во-вторых, отрицательно заряженные белки сыворотки крови (альбумин, фибриноген, иммуноглобулины и др.), а также белки внеклеточного матрикса (коллагены) способны адсорбироваться на поверхности заряженных полиплексов, что ведет за собой изменение поверхностного заряда полиплексов, приводит к увеличению размера комплексов и к их агрегации.
Следующим этапом доставки генетического материала в клетки-мишени является их взаимодействие с плазматической мембраной и поглощение клеткой. Связывание полиплексов с клетками происходит в результате электростатического взаимодействия с отрицательно заряженной (за счет отрицательно заряженных поверхностных мембранных белков - протеогликанов) плазматической мембраной. В большинстве случаев такие полиплексы поглощаются путем неспецифического эндоцитоза. Для эффективного проникновения через плазматическую мембрану клетки оптимальным значением размера комплекса ДНК-поликатион является 70-90 нм.
Одним из самых важных этапов транспортного пути полиплексов является их выход из эндосом. Эндосомы представляют собой везикулы с белково-липидной мембраной, функция которых состоит в транспорте белков в определенные части клетки. За счет работы протонных насосов в них понижается рН (рН 6.5). Дальнейший транспорт может идти либо по пути рециркуляции с выбросом поглощенных молекул во внемембранное пространство, либо по литическому пути, когда происходит дальнейшее закисление среды в поздних эндосомах, и макромолекулы поступают в лизосомы. В лизосомах содержимое закисляется до рН 5, и поглощенные молекулы деградируют под действием гидролитических ферментов, которые активны при низком рН. Продукты деградации удаляются из клетки путем экзоцитоза или переносятся в цитоплазму, где используются как строительный материал [3].
Выйдя из лизосом, полиплексы оказываются в цитозоле, после чего комплекс диссоциирует на свободный поликатион и ДНК. Считается, что это происходит за счет конкуренции за катионные группы между фосфатными группами ДНК и низкомолекулярньгми соединениями и анионами цитоплазмы. В некоторых случаях диссоциация комплекса происходит, по-видимому, в ядре. Главным барьером на пути плазмидной ДНК в клеточное ядро служит двойная ядерная оболочка. Через ядерный поровой комплекс путем пассивной диффузии могут проходить только маленькие молекулы (<40 кД, ~10 нм). Так как освободившаяся после диссоциации комплекса свободная плазмидная ДНК не имеет сигнала ядерной локализации, то в ядро будет проходить очень незначительная часть плазмидной ДНК (не более 0,1-0,001%). Кроме того, установлено, что около 50% инъецированной ДНК деградирует в цитозоле уже через 1-2 часа после введения. В опухолевых клетках эта проблема решается за счет активной пролиферации: ДНК без труда проникает в ядра дочерних клеток во время митотического цикла, когда ядерная мембрана растворяется.
При доставке в клетку малых интерферирующих РНК проблема ядерного транспорта вообще не стоит, т.к. явление РНК-интерференции происходит в цитозоле. Однако в данном случае особенно важно, чтобы олигонуклеотид освободился от полимера-носителя и имел возможность связаться с белками RISC.
Таким образом, для обеспечения эффективной доставки ДНК в клетки, поликатионы должны обратимо взаимодействовать с ДНК, образуя стабильные положительно заряженные комплексы малого размера при физиологических значениях рН и ионной силы. Эти комплексы должны быть устойчивы к присутствию макромолекулярных компонентов биологических жидкостей и, наконец, молекулы ДНК, включенные в комплекс, должны быть защищены от биодеструкции.
В настоящее время запатентован целый ряд подходов, основанных на использовании поликатионов для доставки ДНК в эукариотические клетки. Так, один из первых патентов, касающихся использования поликатионов для трансфекции живых клеток принадлежит фирме Rhone-PoulencRore. В нем предлагается использовать полизтиленимин (ПЭИ) с молекулярной массой до 50 кДа для трансфекции эукариотических клеток [4]. Приблизительно в то же время было также предложено использовать для доставки ДНК полиэтиленимин, модифицированный углеводородными радикалами [5, 6].
Высокая трансфекционная автивность ПЭИ в значительной мере обусловлена тем, что данный полимер является слабым полиоснованием, и при рН 7, т.е. в среде окружающей клетку, протонирован лишь на 10-30%. При попадании в эндосомы и лизосомы, рН в которых составляет около 5-5.5, этот полимер протонируется, что приводит к повышению эндосомального рН. Это активирует эндосомальную Н+-АТФазу, которая начинает накачивать протоны во внутреннюю среду эндосом. В итоге это может приводить к осмотическому набуханию и лизису эндосомальной мембраны с выходом комплекса полимера и ДНК в цитозоль [7].
Далее конструкции с участием ПЭИ были усовершенствованы. В частности, было предложено использовать этот же полимер с привитыми цепями полиэтиленгликоля, несущими на противоположном конце олигопептид ТАТ (пептидная последовательность оболочечного белка вируса иммунодефицита человека 1 типа), причем такой полимер эффективен для доставки генетического материала в легкие [8]. Полиэтиленимин также может усиливать трансфекцию в композиции с белками вызывающими компактизацию ДНК, например, с гистонами [9]. Позже было предложено использовать ПЭИ на стадии формирования комплекса с ДНК при пониженных значениях рН (3.5-4.5), что способствует более эффективной компактизации нуклеиновой кислоты [10]. Также было предложено использовать биодеградируемые аналоги ПЭИ, содержащие дисульфидные связи, подверженные расщеплению в восстановительных условиях, в том числе в живой клетке [11]. ПЭИ модифицированный остатками ароматических аминокислот было предложено использовать для доставки малых интерферирующих РНК [12].
Существует целый ряд патентов, в которых в качестве поликатионной основы для трансфекции клеток используется поли-L-лизин (ПЛ). Этот полимер, а также целый ряд карбоцепных полимеров с первичными аминогруппами (полиаллиламин, поли(аминоэтилметакрилат и др.) были предложены для компактизации ДНК [13]. Хотя сам по себе этот полипептид неэффективен для доставки ДНК, он может служить удобной платформой для создания модульных конструкций, содержащий пептидные последовательности, способствующие проникновению нуклеиновой кислоты в клетку (например, имидазольные группы) [14], а также рецептор-узнающие молекулы (углеводы, способные связываться с мембранными лектинами, гормоны, RGD-пептиды, и т.д.) [15].
Существует также целый ряд способов доставки нуклеиновых кислот в клетки, основанных на использовании природного полисахарида хитозана и его производных. Так, было показано, что фракционирование частично деполимеризованных препаратов хитозана по молекулярным массам с выделением фракции, содержащей около 18 звеньев (разброс от 15 до 21 звена)приводит к трехкратному повышению эффективности трансфекции [16]. Модификация хитозанаимидазолуксусной кислотой с помощью N-этил-N'-изопропилкарбодиимида приводит к повышению его трансфецирующей активности почти на 2 порядка [17].
Наиболее близким к патентуемому способу является метод доставки ДНК в клетки с помощью катионных полимерных частиц, состоящих из полиакрилатов, полиметакрилатов, в том числе поли(N,N-диметиламиноэтилметакрилата), полиалкилцианоакрилатов, предпочтительно, полибутилцианоакрилатов, полиариламидов, полилактатов, полигликолятов, полиортоэфиров, желатины, полисахаридов, альбумина, полистирола, поливиниловых эфиров, полиакролеина, полиглутарового альдегида и его производных, их сополимеров и смесей [18]. Полимерный носитель, заявленный в данном патенте, представляет собой твердые частицы полибутилцианоакрилата, покрытые катионными полимерами и ПАВ Tween 80 для стабилизации частиц в водном растворе.
Носитель для доставки ДНК, патентуемый в настоящей заявке, представляет собой блок-сополимер с узким молекулярно-массовым распределением. Данное соединение содержит гидрофобный и гидрофильный блоки, т.е. имеет амфифильное строение. В водном растворе этот блок-сополимер образует мицеллы, размер которых сильно зависит от температуры раствора.
Другим аналогом предлагаемого подхода является серия патентов на получение липополиаминов, в которых предлагается использовать для доставки ДНК полиэтиленимин, модифицированный гидрофобными радикалами [6, 19]. Показано, что такая модификация увеличивает трансфекционную активность полиамина, однако при этом заметно увеличивается его цитотоксичность.
В настоящем изобретении поставлена задача создания поликатионного носителя, способного дестабилизировать эндосомальные мембраны не только за счет эффекта протонной губки, но и за счет структуры его гидрофобного блока. Для этого были синтезированы носителиполикатионной природы, имеющие блочное строение, и содержащие в своем катионном блоке слабый полиамин поли(N,N-диметиламиноэтилметакрилат) (ПДМАЭМА), а в гидрофобном поли(олигопропиленгликольакрилат) (ПОПГА). Для синтеза блок-сополимеров была использована радикальная полимеризация в условиях обратимой передачи цепи (ОПЦ-полимеризация), обеспечивающая узкое молекулярно-массовое распределение.
Признаками, отличающими настоящее изобретение от аналогов являются:
- катионный носитель для трансфекции имеет блочное строение;
- катионный блок представляет собой слабый полиамин, содержащий вторичные или третичные аминогруппы;
- гидрофобный блок представляет собой полимер или олигомер разветвленного или щеточного строения, содержащий гидрофобные полиалкиленоксиды или другие гибкоцепныеполимеры, характеризующиеся нижней критической температурой растворения (НКТР);
- блок-сополимер имеет узкое молекулярно-массовое распределение;
- блок-сополимер способен образовывать мицеллы в водном растворе;
- мицеллообразование блок-сополимера зависит от температуры;
- блок-сополимер взаимодействует с нуклеиновыми кислотами в водно-солевом буферном растворе, вызывая их компактизацию;
- структура и размер комплексов блок-сополимеров с нуклеиновыми кислотами зависят от температуры;
- трансфекционная активность носителей превышает активность полиэтиленимина (25 кДа) и сопоставима с активностью коммерческого препарата Lipofectamine 2000 (Invitrogen, США).
Раскрытие изобретения
Сущность изобретения состоит в том, что способ получения амфифильных блок-сополимеров для трансфекцииэукариотических клеток, предусматривает использование псевдоживых методов радикальной полимеризации, причем в структуре всех синтезируемых блок-сополимеров присутствует катионный блок слабогополиамина-поли(N,N-диметиламиноэтилметакрилата) и гидрофобный блок, представляющий собой полимер или олигомер разветвленного или щеточного строения - поли(олигопропиленгликольакрилат), включающий на первом этапе получение полимерного агента обратимой передачи цепи на основе N,N-диметиламиноэтилметакрилата путем приготовления раствора, содержащего 0.01-0.001 моль/л динитрилаазоизомасляной кислоты и 0.1-0.01 моль/л раствора дитиобензоатного (дитиобензоат циан-изопентановой кислоты) или тритиокарбонатного(S,S'-бис-(метил-2-изобутират)тритиокарбонат) агента обратимой передачи цепи в N,N-диметиламиноэтилметакрилате, присоединении его к вакуумной установке и тщательном удалении следов кислорода, запаивании полученного дегазированного раствора в ампулу и нагревании при 80°C в течение 24-48 часов, в результате чего образуется полимер N,N-диметиламиноэтилметакрилата, содержащий тритиокарбонатную или дитиобензоатную группу, на втором этапе полученный полимер (0.1-0.01 моль/л) и динитрилазоизомасляной кислоты (0.01-0.001 моль/л) растворяется в смеси олигопропиленгликольакрилат/бензол (3:7) и проводится полимеризация при 80°C в течение 24-48 час, полученный блок-сополимер выделяется из раствора упариванием свободного мономера и очищается методом диализа против дистиллированной воды с последующим лиофильным высушиванием в вакууме.
Предпочтительно, в качестве полимерных агентов обратимой передачи цепи используются полимерыполи(олигопропиленгликольакрилата), содержащие дитиобензоатную или тритиокарбонатную группу, которые получены с использованием двух типов агентов обратимой передачи цепи - дитиобензоата циан-изопентановой кислоты и S,S'-бис-(метил-2-изобутират)тритиокарбоната.
В частных случаях реализации способа синтезируемые блок-сополимеры взаимодействуют с нуклеиновыми кислотами в водно-солевом буферном растворе, вызывая их значительную компактизацию, и обладают в культурах эукариотических клеток высокой трансфекционной активностью в комплексе с различными типами нуклеиновых кислот, в том числе плазмидной ДНК и малыми интерферирующими РНК.
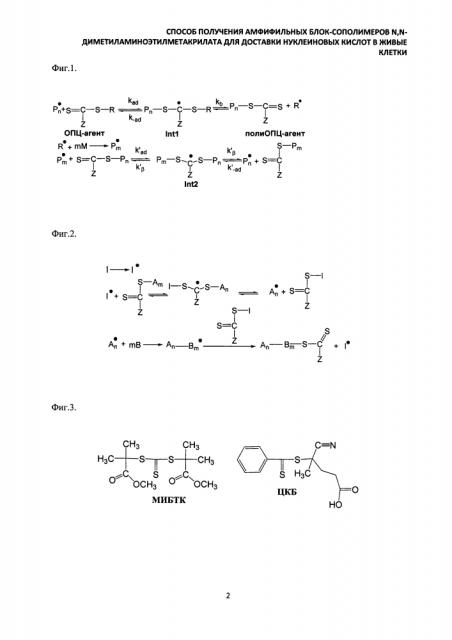
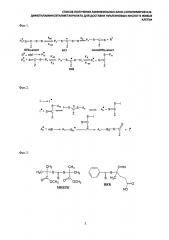
Заявляемый способ получения (синтеза) катионных блок-сополимеров поли(N,N-диметиламиноэтилметакрилата) (ПДМАЭМА) и поли(олигопропиленгликольакрилата) ПОПГА основан на явлении радикальной полимеризации в условиях обратимой передачи цепи[20]. Данный подход основан на том, что тиокарбонильные соединения ZC(=S)SR (ОПЦ-агенты) обратимо реагируют с радикалом роста, образуя интермедиаты Int1 и Int2, способные расщепляться по радикальному механизму; в ходе этих реакций в системе регенерируются макрорадикалы или , способные участвовать в реакции роста цепи вплоть до следующего акта взаимодействия с ОПЦ-агентом (фиг. 1), вследствие чего радикальная полимеризация приобретает черты живых анионных процессов [21, 22, 23].
Данный подход к синтезу полимеров имеет два существенных достоинства с точки зрения полимерного дизайна вообще и создания полимерных носителей для биологически активных соединений в частности.
Во-первых, при его использовании молекулярная масса полимера линейно растет по мере расходования мономера в реакционной смеси, т.е. с ростом конверсии. При этом полученный полимер, как правило, имеет более узкое молекулярно-массовое распределение, чем полимер, полученный методом классической радикальной полимеризации.
Во-вторых, данный подход открывает широкие перспективы получения блок-сополимеров с контролируемой последовательностью и длиной блоков. Дело в том, что большинство макромолекул, образовавшихся в условиях ОПЦ-полимеризации, содержат группы ОПЦ-агента. Поэтому если такой полимер ZC(=S)SAn очистить от неизрасходованного мономера и ввести в реакцию с другим мономером В в присутствии инициатора, то блок Bm будет расти именно на цепи An, как показано на фиг. 2.
В аспекте биомедицинских приложений полимеров, полученных с помощью ОПЦ-полимеризации, актуальным является вопрос о токсичности ОПЦ-агента, входящего в состав полимера. Этот вопрос исследовался в литературе, и полученные результаты показывают, что уровень токсичности полимеров, полученных методом ОПЦ-полимеризации, сильно зависит от типа клеток и используемого ОПЦ-агента [24, 25]. Так, клетки макрофагальной линии Raw264.7 более чувствительны к полимерам, полученным с помощью ОПЦ-полимеризации, чем фибробластоидная линия NIH3T3 или клетки яичников китайского хомячка СНО. [Ошибка! Неизвестный аргумент ключа., Ошибка! Неизвестный аргумент ключа.].
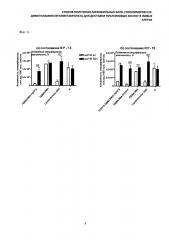
В качестве реагента обратимой передачи цепи в данном изобретении использовали полимеры ПДМАЭМА и ПОПГА, которые были получены с использованием двух типов агентов обратимой передачи цепи - S,S'-бис-(метил-2-изобутират)тритиокарбоната (МИБТК) и дитиобензоата циан-изопентановой кислоты (ЦКБ) (фиг. 3).
В качестве агентов обратимой передачи цепи в данном изобретении использовали S,S'-бис-(метил-2-изобутират)тритиокарбонат (МИБТК) и дитиобензоат циан-изопентановой кислоты (ЦКБ).
МИБТК является симметричным тритиокарбонатным ОПЦ-агентом и содержит две одинаковые лабильные C-S связи, что обеспечивает рост полимерной цепи в два конца, давая возможность достаточно легко получать триблок-сополимеры типа ABA. При этом тритиокарбонатная гpyппa-S-C(=S)-S- остается в центре полимерной цепи (фиг. 4а).
Дитиобензоатный ОПЦ-агент (ЦИБ) содержит только одну лабильную C-S-связь, поэтому в его присутствии остаток ОПЦ-агента Ph-С(=S)S-, обеспечивающий реализацию псевдоживого механизма, находится на конце цепи. В этом случае добавление второго мономера к полимерному ОПЦ-агенту приводит к получению диблок-сополимера типа АВ, содержащего дитиобензоатную группу на конце цепи (фиг. 4б).
Эффективный контроль ОПЦ-полимеризации возможен только в том случае, если равновесие в реакции образования интермедиата 1 (фиг. 2) сдвинуто вправо. В этом случае при фрагментации интермедиата образуется макромолекула, содержащая дитиоэфирную группу и способная выполнять функции полимерного ОПЦ-агента. Естественно, что соотношение констант скорости прямой и обратной реакции образования интермедиата 1, kad/k-ad, зависит от природы ОПЦ-агента и мономера.
Блок-сополимеры на основе ДМАЭМА и ОПГА, полученные с помощью ОПЦ-полимеризации имеют индекс полидисперсности 1.2-1.9, предпочтительно - 1.5. При этом степень полимеризации ПДМАЭМА варьирует от 100 до 300, предпочтительно, около 200. Степень полимеризации блока ПОПГА может изменяться от 20 до 100, предпочтительно составляет 40-80, при этом в мономере ПОПГА степень полимеризации пропиленгликоля должна варьироваться от 5 до 10 звеньев, предпочтительно - должна составлять 7 звеньев.
Блок-сополимеры ПДМАЭМА и ПОПГА имеют амфифильную природу, поэтому они склонны к агрегации в водном растворе с образованием мицелл. При физиологических условиях критическая концентрация мицеллообразования блок-сополимеров варьируется в диапазоне от 1 до 10 мкг/мл, предпочтительно составляет 2.5 мкг/мл, что на порядок меньше ККМ большинства полимерных ПАВ.
Структура и стабильность мицелл зависят от концентрации низкомолекулярного электролита, рН и температуры раствора, причем с ростом температуры средний гидродинамический радиус мицелл увеличивается от 15 до 300 нм. Повышение ионной силы выше 0.15 М или рН выше 8.5 приводит к уменьшению размеров мицелл.
Полученные блок-сополимеры взаимодействуют с ДНК в водном растворе с образованием комплексов, средний гидродинамический радиус которых составляет 100-150 нм, что более чем на порядок меньше гидродинамического радиуса свободной молекулы нуклеиновой кислоты. Тем не менее, размер комплексов сильно зависит от температуры, при которой они готовятся, причем наименьшие по размеру комплексы (около 70 нм) образуются при смешивании растворов нуклеиновой кислоты и блок-сополимера нагретых до температуры +37°C. Комплексы несколько большего, но сходного по порядку величины, размера (около 100 нм) образуются при +4°C. Категорически не рекомендуется готовить комплексы при комнатной температуре, поскольку в этих условиях образуются чрезвычайно полидисперсные частицы комплексов со средним гидродинамическим радиусом превышающим 300 нм, что может быть больше толщины мелких кровеносных капилляров, а значит использование таких комплексов invivo может приводить к эмболизации.
Блок-сополимеры ПДМАЭМА и ПОПГА проявляют существенно меньшую цитотоксичность, чем гомополимеры ПДМАЭМА и ПЭИ, использованные в изобретении в качестве аналога. Наибольшая нетоксичная концентрация (ННК) блок-сополимеров для клеток рака яичников китайского хомяка СНО варьировалась в интервале от 20 до 50 мкг/мл в зависимости от состава, в то время как ННК гомополимера ПДМАЭМА составляет 12 мкг/мл, а ПЭИ - 4 мкг/мл. Таким образом, блок-сополимеры ПДМАЭМА и ПОПГА проявляют заметно меньшую цитотоксичность, чем ранее использовавшиеся аналоги.
Полученные блок-сополимеры проявляют высокую способность трансфецировать эукариотические клетки плазмидной ДНК. При этом наибольшую эффективность трансфекцииплазмидной ДНК демонстрируют комплексы плазмидной ДНК с триблок-сополимерами ПОПГА-блок-ПДМАЭМА-блок-ПОПГА при составе комплекса, соответсвтующем молярному соотношению амтногрупп полимера к фосфатным группам нуклеиновой кислоты, N:P=7.5, и с диблок-сополимерами ПДМАЭМА-блок-ПОПГА при соотношении N:P=15. Эффективность трансфекцииплазмидной ДНК с использованием ПОПГА-блок-ПДМАЭМА-блок-ПОПГА (при соотношении N:P=7.5) была в 3 раза выше, чем у коммерчески доступного препарата Lipofectamine 2000 и ПЭИ.
Эти же блок-сополимеры проявили высокую способность доставлять в клетки малые интерферирующие РНК. Для оценки эффективности подавления гена-мишени в изобретении использовали две различные системы. Во-первых, культуру клеток CHO-luc, стабильно трансфецированную геном светляковой люциферазы. Комплексы синтетическойми РНК, направленной к гену люциферазы, и триблок-сополимера ПОПГА-блок-ПДМАЭМА-блок-ПОПГА подавляют люциферазную активность на 89 и 93% при соотношении N:P=7.5 и 15, соответственно, что на 7 и 10% больше, чем у препарата сравнения Lipofectamine 2000. Диблок-сополимеры ПДМАЭМА-блок-ПОПГА проявляют наибольшую эффективность при соотношении N:P=15 и вызывают подавление люциферазной активности на 80-90%, что близко к эффекту, оказываемому Lipofectamine 2000.
Осуществление изобретения
Пример 1.
Синтез блок-сополимеров на основе реагентов обратимой передачи цепи поли(N,N-диметиламиноэтилметакрилат)-дитиобензоата или поли(N,N-диметиламиноэтилметакрилат)-тритиокарбоната.
Для синтеза полимерных агентов обратимой передачи цепи на основе N,N-диметиламиноэтилметакрилата готовили раствор динитрила азоизомасляной кислоты в концентрации от 0,01 до 0,001 моль/л в свежеперегнанном диметиламиноэтилметакрилате. К полученному раствору добавляли дитиобензоат циан-изопентановой кислоты или S,S'-бис-(метил-2-изобутират)тритиокарбонат до конечной концентрации от 0,1 до 0,01 моль/л. Реакционную смесь заливали в ампулу, подсоединяли ее к вакуумной установке и дегазировали путем повторения циклов замораживания-размораживания до остаточного давления 5×10-3 мм рт.ст., затем ампулу запаивали. Образец полимеризовали при 80°C в течение 24-48 ч. Полимер выделяли методом лиофильного высушивания из бензола на вакуумной установке. Образец охарактеризовывали методом гель-проникающей хроматографии. В результате, в зависимости от использованного ОПЦ-агента, получали поли(N,N-диметиламиноэтилметакрилат)-дитиобензоат (ПДМАЭМА-Б) или поли(N,N-диметиламиноэтилметакрилат)-тритиокарбонат (ПДМАЭМА-ТК).
Для синтеза диблок-сополимера ПДМАЭМА-блок-ПОПГА на основе монофункционального ОПЦ-агента дитиобензоата циан-изопентановой кислоты готовили раствор динитрила азоизомасляной кислоты (0,01-0,001 моль/л) в смеси олигопропиленгликольакрилат/бензол (3:7 по объему) и добавляли его к полимерному ОПЦ-агенту (ПДМАЭМА-Б, 0,1-0,01 моль/л). Полученную смесь заливали в ампулу и дегазировали на вакуумной установке, ампулу запаивали и помещали в термостат, разогретый до 80°C, на 24-48 ч. По окончании полимеризации ампулу вскрывали, содержимое растворяли в избытке бензола и далее отгоняли растворитель на роторном испарителе. Полученный сухой остаток растворяли в воде, диализовали и полимер выделяли методом лиофильной сушки из водного раствора на вакуумной установке. Блок-сополимер характеризовали методом гель-проникающей хроматографии.
Пример 2.
Синтез блок-сополимеров на основе полимерных агентов обратимой передачи цепи поли(олигопропиленгликольакрилат)-дитиобензоата (ПОПГА-Б) или поли(олигопропил енгликольакрилат)-тритиокарбоната (ПОПГ А-ТК).
Для синтеза реагентов обратимой передачи цепи на основе поли(олигопропиленгликольакрилата) готовили раствор динитрила азоизомасляной кислоты (0,01-0,001 моль/л) в смеси олигополипропиленгликольакрилат/бензол (1:1 по объему). К полученному раствору добавляли дитиобензоат циан-изопентановой кислоты или S,S'-бис-(метил-2-изобутират)тритиокарбонат до конечной концентрации 0,01-0,1 моль/л. Реакционную смесь заливали в ампулу, подсоединяли ее к вакуумной установке и дегазировали путем повторения циклов замораживания-размораживания до остаточного давления 5×10-3 мм рт.ст., затем ампулу запаивали. Образец полимеризовали при 80°C в течение 4-24 ч. Полимер выделяли методом лиофильного высушивания из бензола на вакуумной установке. Молекулярно-массовые характеристики образца определяли методом гель-проникающей хроматографии. В результате в зависимости от использованного ОПЦ-агента получали поли(олигопропиленгликольакрилат)-дитиобензоат (ПОПГА-Б) или поли(олигопропиленгликольакрилат)-тритиокарбонат (ПОПГА-ТК).
Для синтеза триблок-сополимера ПОПГА-блок-ПДМАЭМА-блок-ПОПГА готовили раствор ПОПГА-ТК (0,01-0,001 моль/л) и динитрила азоизомасляной кислоты (0,1-0,01 моль/л) в смеси диметиламиноэтилметакрилат/бензол (4:1 по объему). Полученную смесь заливали в ампулу и дегазировали на вакуумной остановке, ампулу запаивали и помещали в термостат, разогретый до 80°C на 4-24 ч. По окончании полимеризации ампулу вскрывали, содержимое растворяли в избытке бензола и далее отгоняли растворитель на роторе. Полученный сухой остаток растворяли в воде, диализовали и полимер выделяли методом лиофильной сушки из водного раствора на вакуумной установке. Блок-сополимер характеризовали методом гель-проникающей хроматографии. Аналогичным способом получали блок-сополимер с обращенной последовательностью блоков ПДМАЭМА-блок-ПОПГА-блок-ПДМАЭМА, используя ПДМАЭМА-ТК в качестве полимерного агента обратимой передачи цепи.
Пример 3.
Оценка трансфекционной активности комплексов амфифильных блок-сополимеров с плазмидной ДНК и малыми интерферирующими РНК (миРНК).
Для оценки трансфекционной активности комплексов амфифильных блок-сополимеров с плазмидной ДНК и миРНК использовали культуры клеток яичника китайского хомячка СНО и CHO-luc (клетки СНО, стабильно трансфецированные геном светляковой люциферазы), соответственно.
Культуру клеток СНО обрабатывали комплексами, содержащими плазмидную ДНК pCMVluc (Promega, США) и препараты синтезированных катионных амфифильных блок-сополимеров: ПОПГА-блок-ПДМАЭМА-блок-ПОПГА, ПДМАЭМА-блок-ПОПГА-блок-ПДМАЭМА, ПДМАЭМА-блок-ПОПГА, ПОПГА-блок-ПДМАЭМА, а также гомополимер ПДМАЭМА в различных соотношениях N:P=7,5 и 15. Эффективность трансфекции оценивали по активности люциферазы через 24 часа после обработки комплексами с помощью коммерческого набора реагентов Luciferase assay system (Promega, США) в планшетном анализаторе. В качестве препаратов сравнения использовали коммерческий трансфекционный агент Lipofectamine 2000 (Invitrogene, США) и разветвленный полиэтиленимин 25 кДа (ПЭИ) (Sigma, США). Также в эксперименты включали отрицательный контроль, который представлял собой препараты "голой" плазмидной ДНК или миРНК. Комплексы ДНК с сополимерами для трансфекции готовили в соотношениях N:P - 7,5 и 15. Наибольшую эффективность трансфекции плазмидной ДНК продемонстрировали сополимеры ДМАЭМА-ОПГА в соотношении N:P - 7,5, а также ПОПГА-блок-ПДМАЭМА и ПОПГА-блок-ПДМАЭМА-блок-ПОПГА в соотношении 15 (фиг. 5а, 5б), как по сравнению с другими синтезированными сополимерами, так и с исходными блоками для сополимеров.
В соотношении N:P - 15 эффективность трансфекции с использованием комплексов ПОПГА-блок-ПДМАЭМА-блок-ПОПГА и ПОПГА-блок-ПДМАЭМА была, соответственно, в 83 и 53 раза выше, чем в экспериментах с гомополимером ПДМАЭМА и не ниже эффективности препаратов сравнения (ПЭИ и Lipofectamine 2000). Эффективность трансфекции плазмидной ДНК с использованием ПДМАЭМА-блок-ПОПГА (при соотношении N:P - 7,5) была в 64 раза выше, чем у ПДМАЭМА и не уступала по эффективности препаратам сравнения. При увеличении соотношения N:P до 15 эффективность трансфекции препарата ПДМАЭМА-блок-ПОПГА снижалась (в 2,4 раза по сравнению с эффективностью при N:P=7,5). Это, вероятно, связано с увеличением токсического эффекта исследуемых сополимеров при увеличении их концентрации.
Комплексы для трансфекции миРНК готовили в соотношениях N:P=7,5 и 15. В данной серии экспериментов использовали культуру клеток CHO-luc, стабильно трансфецированную геном светляковой люциферазы. Комплексы для трансфекции готовили из синтетических миРНК, направленных к гену люциферазы, и амфифильных блок-сополимеров. Результаты, полученные в экспериментах с блок-сополимерами, представляли в виде люциферазной активности в клетках, обработанных комплексами на основе специфической (направленной к гену люциферазы) и неспецифической миРНК (направленной к Р-гену респираторно-синцитиального вируса). Результаты выражали в виде процента остаточной люциферазной активности в клетках, обработанных специфической миРНК по сравнению с неспецифической (фиг. 6а, 6б). Как и в экспериментах с плазмидной ДНК высокую эффективность трансфекции миРНК продемонстрировал препарат ПОПГА-блок-ПДМАЭМА-блок-ПОПГА, который подавлял люциферазную активность на 78% при соотношении N:P - 7,5. Блок-сополимеры ПДМАЭМА-блок-ПОПГА проявили одинаково высокую эффективность трансфекции при соотношении N:P - 7,5 и 15, и обеспечили подавление люциферазной активности на 89%. Это на 7% больше по сравнению с Lipofectamine 2000.
Таким образом, препараты амфифильных катионных сополимеров на основе ПДМАЭМА и ПОПГА проявили высокую трансфекционную активность как при трансфекции культуры клеток плазмидной ДНК, так и миРНК, сравнимую или даже превосходящую эффективность, достигнутую с использованием препаратов сравнения.
В соотношении N:P - 15 эффективность трансфекции с использованием комплексов ПОПГА-блок-ПДМАЭМА-блок-ПОПГА и ПОПГА-блок-ПДМАЭМА была, соответственно, в 83 и 53 раза выше, чем в экспериментах с гомополимером ПДМАЭМА и не ниже эффективности препаратов сравнения (ПЭИ и Lipofectamine 2000). Эффективность трансфекцииплазмидной ДНК с использованием ПДМАЭМА-блок-ПОПГА (при соотношении N:P - 7.5) была в 64 раза выше, чем у ПДМАЭМА и не уступала по эффективности препаратам сравнения. При увеличении соотношения N:P до 15 эффективность трансфекции препарата ПДМАЭМА-блок-ПОПГА снижалась (в 2.4 раза по сравнению с эффективностью при N:P=7.5). Это, вероятно, связано с увеличением токсичности исследуемых сополимеров.
Комплексы для трансфекциими РНК готовили в соотношениях N:P=7.5 и 15. В данной серии экспериментов использовали культуру клеток CHO-luc, стабильно трансфецированную геном светляковой люциферазы. Комплексы для трансфекции готовили из синтетических миРНК, направленных к гену люциферазы, и амфифильных блок-сополимеров. Результаты, полученные в экспериментах с блок-сополимерами, представляли в виде люциферазной активности в клетках, обработанных комплексами на основе специфической (направленной к гену люциферазы) и неспецифической миРНК (направленной к Р-гену респираторно-синцитиального вируса). Результаты выражали в виде процента остаточной люциферазной активности в клетках, обработанных специфической миРНК по сравнению с неспецифической (фиг.6а, 66). Как и в экспериментах с плазмидной ДНК высокую эффективность трансфекциими РНК продемонстрировал препарат ПОПГА-блок-ПДМАЭМА-блок-ПОПГА, который подавлял люциферазную активность на 78% при соотношении N:P - 7.5. Блок-сополимеры ПДМАЭМА-блок-ПОПГА проявили одинаково высокую эффективность трансфекции при соотношении N:P - 7.5 и 15, и обеспечили подавление люциферазной активности на 89%. Это на 7% больше по сравнению с Lipofectamine 2000.
Таким образом, препараты амфифильных катионных сополимеров на основе ПДМАЭМА и ПОПГА проявили высокую трансфекционную активность как при трансфекции культуры клеток плазмидной ДНК, так и миРНК, сравнимую или даже превосходящую эффективность, достигнутую с использованием препаратов сравнения.
Литература
1. Roth C.M., Sundaram S. Engineering synthetic vectors for improved DNA delivery: Insights from Intracellular Pathways. Annu. Rev. Biomed. Eng. v. 6, p. 397-426 (2004).
2. Mintzer M.A., Simanek E.E. Nonviral vectors for gene delivery. Chem. Rev. v. 109, p. 259-302 (2009).
3. Cho Y.W., Kim J.D., Park K.. Polycation gene delivery systems: escape from endosomes to cytosol. J Pharm Pharmacol, v. 55, p. 721-734 (2003).
4. Behr J.-P., Demeneix В., Lezoualch F., Mergny M., Scherman D., Boussif O. Nucleic acid containing composition, preparation and uses of same. Патент ЕС №06013240 (1997).
5. Jean-PaulBehr J.-P., Demeneix B., Scherman D., Schwartz B., Remy J.-S. Compositioncontainingnucleicacids, preparationanduses. ПатентФранции №94/00159 (1994). 6 Behr J.-P., Loeffler J.-P. Lipopolyamines, theirpreparationandtheiruse. Патент ЕС №056167458 (1995).
7. Boussif O., Lezoualc'h F., Zanta M.A., Mergny M.D., Scherman D., Demeneix В., Behr J.-P. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proc Natl Acad Sci USA. v. 92, N 16. p. 7297-301 (1995).
8. Kissel T, Kleemann E., Neu M., Gessler Т., Schmehl T. Non-viral vector system for the delivery of nucleic acid into the lung. Патент США №2007/38693.
9. Scherman D., Byk G., Schwartz B. Nucleic acid-containing composition, preparation and use thereof. Патент США №5,945,400 (1999).
10. Yamaguchi N., Fukumoto Y. Method of transfecting cells with nucleic acids using acidified polyethyleneimine. Японский патент №2009-174234. (2009).
11. Gxpfreich A., Breunig M., Lungwitz U., Blunk T. Cationic polymers for transporting nucleic acids in cells Патент США №2009/0215166 A1 (2009).
12. Adib A., Erbacher P., Stock F., Hafdi N. Means for delivery of nucleic acids active for gene silencing using synthetic polymers. Патент США №2010/0297756 A1 (2010).
13. Lynn D.M., Miller A.D. Charge-dynamic polymers and delivery of anionic compounds. Патент ЕС №07883720 (2004).
14. Midoux P., Monsigny M. Polymeric complexes for the transfection of nucleic acids, with residues causing the destabilization of cell membranes. Патент ЕС №06372499 (1999).
15. Midoux P., Erbacher P., Roche-Degremont A.-C., Monsigny M. Polylysine conjugates. Патент ЕС №055958974 (1994).
16. Artursson P., Christensen B.K., Koping-Hoggard M., Varnum K.M. Non-viral gene delivery system. Патент США №7,767,456 B2 (2010).
17. Roy K., Ghosu В., Kasturi S. Modified polysaccharide-based delivery of nucleic acids. Патент США №2010/0311654 Al (2010).
18. Sabei В., Walz C., Ringe K. Use of nanoparticles for the DNA administration to a target organ. Патент США №7,402,573 B2 (2008).
19. Ferguson D.Y., Kim S.W. Linear polyethylenimine-sterol conjugates for gene delivery. Патент EC №07863470 (2007).
20. Chiefari J., Chong Y.K., Ercole F., Krstina J., Jeffery J., Le T.P.T., Mayadunne R.T.A., Meijs G.F., Moad C.L., Moad G., Rizzardo E., Thang S.H. // Macromolecules. 1998. V. 31. №16. P. 5559-5562.
21. Зайцев С.Д., Семчиков Ю.Д., Черникова E.B. Контролируемая радикальная сополимеризация N-винилпирролидона и 1,1,1,3,3,3-гексафторизопроп