Пластиковый эндопротез для стентирования панкреатических протоков
Иллюстрации
Показать всеИзобретение относится к медицине. Стент изготавливают из термопластичного полимерного материала - полиэфирблокамида в виде изогнутых, имеющих боковые фиксаторы трубчатых отрезков с наружным диаметром от 1,0 до 4,0 мм и длиной от 30 до 180 мм, снабженных отверстиями для сбора и проведения панкреатического секрета при установке в поджелудочную железу. Стент для стентирования панкреатических протоков используют в течение продолжительного времени без закупорки внутренних просветов, 1 табл., 5 пр.
Реферат
Изобретение относится к медицине, а именно к абдоминальной хирургии, и может быть использовано при изготовлении пластиковых эндопротезов (стентов) - устройств для эндоскопического и открытого интраоперационного стентирования панкреатических протоков при хирургическом лечении хронического панкреатита.
Хронический панкреатит (далее - ХП) - воспалительно-дегенеративное заболевание, характеризующееся прогрессирующим разрастанием фиброзной ткани, приводящим к блокированию протоковой системы поджелудочной железы и соответственно к нарушению поступления панкреатического сока в двенадцатиперстную кишку и, как следствие этого процесса, к тяжелой экзо- и эндокринной недостаточности.
В последние годы наблюдается значительное увеличение количества больных ХП, осложненным нарушением проходимости панкреатических протоков, что требует пересмотра старых и разработки новых способов лечения.
Согласно обширным данным отечественной и зарубежной литературы (Котовский А.Е., Петрова Н.А., Глебов К.Т., Бекбауов С.А. Атлас рентгеноэндоскопических диагностических и лечебных вмешательств при заболеваниях желчных протоков и поджелудочной железы, Москва, ООО ИД «Роса», Типография «Новости», 2012. - 252 с. [1]; Котовский А.Е., Глебов К.Т., Петрова Н.А., Дюжева Т.Г. Эндоскопическое транскапиллярное стентирование желчных протоков пластиковыми эндопротезами, методическое пособие для ординаторов, Москва ООО «ЭКСПАНКО-медикал», 2012-40 с. [2]), а также данным патентных материалов (патенты США US 5320602, US 5876450; заявка США на изобретение US 2010/0049328; патент Канады CA 2661962; патент России RU 2364367; патент Украины UA 25857; Европейская заявка на изобретение EP 1980277) к наиболее эффективным методам лечения ХП в настоящий период относят проведение дренирующих операций, целью которых является восстановление пассажа панкреатического сока в просвет двенадцатиперстной кишки путем создания искусственного тоннеля в головке поджелудочной железы, функционирование которого поддерживается специальным эндопротезом - стентом.
Данный вид оперативного вмешательства, дающий возможность восстановить поступление панкреатического сока в двенадцатиперстную кишку, относительно прост в исполнении, избавляет пациента от болей и улучшает экзокринную функцию поджелудочной железы, не ухудшая эндокринную.
Указанная выше методика позволяет не только полностью ликвидировать панкреатическую гипертензию, улучшить результаты лечения больных, уменьшить количество послеоперационных осложнений и летальность, но и создать комфортные условия жизни больным.
На сегодняшний день существует два вида эндопротезов (стентов): пластиковые и самораскрывающиеся металлические (см. ссылку [1]).
Наиболее распространенными в мире являются стенты, изготовленные из пластика (см. ссылку [2]).
Как утверждается в проспекте фирмы COOK medical (www.cook medical.com) стр. 115-121 [3], безопасность и эффективность применения самораскрывающихся металлических стентов в сосудистой системе до конца не изучены. Этим, по-видимому, объясняется большое количество послеоперационных осложнений при использовании стентов из металлов.
Следует также подчеркнуть, что техника транспапиллярной установки металлического (нитинолового) самораскрывающегося стента в поджелудочной железе сложнее, чем пластикового протеза. Такая операция требует особой прецизионности, аккуратности и абсолютных показаний.
В клинической практике используются разнообразные конструкции пластиковых эндопротезов (стентов).
Выпускаемые фирменные пластиковые стенты имеют различные характеристики: наружный диаметр, длину, конфигурацию (прямую, изогнутую), наличие и отсутствие боковых отверстий и элементов фиксации.
Все эндопротезы являются рентгеноконтрастными трубками, что значительно облегчает их установку и динамичное наблюдение за ними.
В настоящее время для изготовления стентов используются известные полимерные материалы (пластики), биосовместимые с тканями организма, такие как политетрафторэтилен, полиэтилен, поливинилхлорид, полиуретан и другие, а также силикон (см. патенты: EP 1980277, US 6361567, US 5876450, заявку на патентование US 2010/0049328).
Причем из пластиковых стентов наибольшее предпочтение получили стенты из полиуретана.
Такое положение объясняется тем, что полиуретаны характеризуются относительно лучшей совместимостью с кровью по сравнению с другими полимерами.
Кроме того, высокие конструктивные свойства полиуретанов (прочность, твердость, сопротивление раздиру) позволяют придать стентам требуемую конфигурацию, повторяющую нормальную анатомию протока поджелудочной железы.
Между тем, несмотря на ряд очевидных преимуществ, имеющих место при использовании панкреатических стентов из пластиков, в том числе и из полиуретанов, существует требующая решения проблема, связанная с закупоркой просветов имплантируемых дренажей (трубок, стентов) в течение довольно короткого периода их нахождения в организме.
По отзывам врачей, производящих эндоскопическое стентирование поджелудочной железы у пациентов, страдающих хроническим панкреатитом, обтурация пластиковых стентов происходит через 2-3 месяца, что требует их частой замены (Weber A, Schneider J, Neu B et al. Endoscopic stent therapy for patients with chronic pancreatitis: results from a prospective follow-up study. Pancreas. 2007; 34: 287-294 [4]).
Как показали исследования, данное явление вызвано в первую очередь отложением на внутренней поверхности стентов способных к инфицированию белковых образований, вырабатываемых в процессе секреции клетками поджелудочной железы.
Закупорка стентов приводит к резкому ухудшению состояния больных и ставит под угрозу долгосрочный медицинский успех у врачей, а также жизнь пациентов.
Действия, которые могли бы противостоять росту белковых отложений на стенках имплантов, в том числе и панкреатических стентов, а также предотвращать появление сопутствующих им инфекций, описаны в ряде патентов.
Так, в патенте США US 6228393 предлагается, используя липосомы в качестве носителей различных лекарств, целенаправленно доставлять на поверхность имплантов биологически активные препараты, сдерживающие развитие инфицированной белковой биопленки.
Данный патент, однако, не представляет технического интереса, поскольку, как показывает практика, введенные согласно указанному способу активные вещества довольно быстро расходуются, и поверхность имплантов возвращается в свое исходное состояние с точки зрения ее восприимчивости к белковым отложениям.
Патент США US 6361567 описывает покрытие для медицинских имплантов, включая покрытие стентов, основанное на использовании ионов благородных металлов с антимикробными свойствами, таких как серебро, золото или их комбинации. По мнению авторов патента с помощью данного покрытия возможно затормозить инфицирование белковых отложений на поверхности стента и, соответственно, ингибировать микробную колонизацию.
Причем нанесение покрытия предполагается выполнять в вакуумной камере в несколько стадий. На первой стадии на поверхности имплантов (внутренней и внешней) осаждается углеродосодержащий слой, на который происходит напыление металлов. Напыление может производится многократно для достижения равномерного покрытия с требуемой антибактериальной активностью.
В этом же патенте США (US 6361567) представлен довольно обширный список изобретений, посвященных созданию на поверхности широкого круга полимерных имплантов антимикробных покрытий, основанных на применении ионов благородных металлов.
Вместе с тем, как утверждается в заявке США на изобретение US 2010/0049328, активность антимикробного покрытия, содержащего ионы благородных металлов, и в первую очередь серебра, полученного известными способами, недостаточна для длительного подавления роста инфицируемых белковых образований на поверхности имплантов.
В заявке US 2010/0049328, а также в Европейском патенте EP 1980277, предлагается для эффективного устранения бактериальной колонизации стентов обрабатывать их поверхность гликозоаминогликанами (линейными гетерополисахаридами), которые после имплантации модифицированных стентов могут под воздействием движущихся инфицированных белковых сред приобретать значительный отрицательный заряд, способствующий отталкиванию белковых отложений от поверхности стентов, отдаляя тем самым сроки закупорки стентов и соответственно увеличивая сроки их имплантации в поджелудочной железе.
Одновременно в представленных патентных материалах указывается, что связь гликозоаминогликанов с поверхностью стентов не является стойкой, а потому требуется создание промежуточного слоя, обеспечивающего долгосрочную стабильность покрытия.
Для создания промежуточного слоя авторы патентов предлагают использовать гепаринпроизводные адипиновой кислоты, а также бензофенон, полиэтиленимины и их производные. Кроме того, в данных материалах указывается на необходимость активации поверхности стентов перед нанесением промежуточного слоя обработкой растворами серной кислоты или перманганата калия.
Последнее техническое решение может считаться наиболее близким к заявленному способу.
Однако и оно имеет существенный недостаток, поскольку его воплощение, как и внедрение всех описанных выше способов ингибирования или подавления биологической колонизации имплантов, многостадийно, что создает препятствия для реализации процесса и существенно усложняет его осуществление, к тому же повышает его стоимость и соответственно стоимость изделий.
Кроме того, воздействие активирующих агентов может отрицательно сказаться на физико-механических свойствах стентов и сделать их непригодными для последующей имплантации.
Таким образом, решение задачи, направленной на создание сравнительно недорогих пластиковых стентов (эндопротезов), пригодных, без проведения сложной предварительной обработки, для стентирования панкреатических потоков в течение продолжительного времени (от полугода до года и более), требует учета целого ряда факторов и, прежде всего, широкого комплекса физико-химических и физико-механических свойств полимерного материала, используемого для изготовления стентов.
Как уже указывалось ранее в вышеприведенных патентных материалах (заявка США на изобретение US 2010/0049328, европейский патент EP 1980277), одним из таких факторов является способность к приобретению под воздействием движущихся биологических сред отрицательного электрического заряда на поверхности имплантированного стента.
О необходимости учета данного фактора говорят и другие источники, где приводятся материалы, связанные с изучением процессов, относящихся к биосовместимости имплантов. В частности, в книге «Полимеры медицинского назначения» под редакцией проф. Сэноо Манабу, Москва «Медицина» 1981, стр. 210-213 [5] указывается на проявление антитромбогенного эффекта, возникающего при контакте движущейся крови с отрицательно заряженной поверхностью полимерного материала. В книге отмечаются работы, иллюстрирующие корреляцию между величиной поверхностного отрицательного электрического заряда и тромбообразованием, и приводятся значения электрических зарядов, возникающих на поверхности омываемых кровью имплантов, изготовленных из разных полимеров (поливинилхлорида, полиуретана, полиэфира). Обращает на себя внимание, что среди названных полимеров наибольший отрицательный заряд наблюдается для полиэфиров (6,5 мВ).
Однако полиэфиры по своим медико-техническим характеристикам непригодны для изготовления имплантируемых гибких трубчатых изделий типа стентов. Вместе с тем, выявленная способность полиэфирных имплантов к электризации также учитывалась при решении поставленной выше задачи.
Так, необходимое решение было найдено при использовании для изготовления стентов (эндопротезов), позволяющих проводить стентирование панкреатических протоков, термопластичного блоксополимера - полиэфирблокамида с определенным соотношением блоков полиэфира (политетраметиленоксида) и полиамида (найлона 12).
Как оказалось, поверхность этих стентов во время пребывания их в организме способна ингибировать закупорку внутренних просветов. При этом комплекс физико-механических, физико-химических и медико-биологических характеристик стентов сохраняется на уровне изделий, изготовленных из известных полиуретанов, и даже превосходит их.
Общая структурная формула предлагаемого полиэфирблокамида может быть изображена в следующем виде:
,
где блок РА соответствует полиамиду - найлону 12 с элементарным звеном:
H-[-НN(CH2)11-CO-]-OH,
а блок PE соответствует полиэфиру - политетраметиленоксиду с элементарным звеном:
Н-O-[-СН2-СН2-СН2-СН2-O-]-OH.
Отвечающие данной структурной формуле наиболее известные полиэфирблокамиды, имеющие разное соотношение полиамидных и полиэфирных блоков, описаны в статье Jignesh P. Shuth, Jiannong Xu, Garth L. Wilkes. Solid state structure - property behavior of semicrystalline poly (ether-block-amide) Pebax thermoplastic elastomers - Polymer 44 (2003) 743-756 [6].
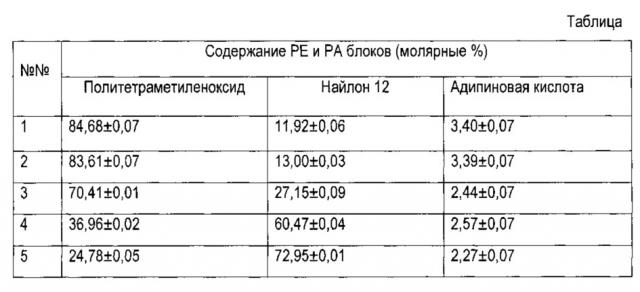
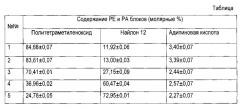
Предоставленные в статье соотношения блоков даны в виде таблицы
Всесторонние исследования представленных выше образцов полиэфирблокамидов, изучение их поведения при различных деформациях, картин гестерезиса, сжатия, специфики поверхности, стойкости к истиранию, температурных переходов, био- и хемостойкости позволили определить, что для изготовления имплантируемых медицинских изделий, в том числе и панкреатических стентов, наиболее пригоден полиэфирблокамид (№4), содержащий 36,96±0,02 мол. % блоков политетраметиленоксида и 60,47±0,04 мол. % блоков найлона 12, коммерческое название.
Попытки изготовить и испытать стенты из других перечисленных видов полиэфирблокамида положительных результатов не принесли. Изготовленные стенты при введении в поджелудочную железу либо сильно перегибались, либо переламывались, становясь непроходимыми для панкреатического секрета.
Техническим результатом, получаемым при использовании изобретения, является обеспечение функционирования стентов (эндопротезов) во время пребывания их в организме в течение продолжительного времени (не менее полугода) без закупорки внутренних просветов стента.
Ниже представлены примеры, иллюстрирующие результаты стентирования поджелудочной железы заявленными стентами.
Из описанного выше полиэфирблокамида были изготовлены стенты диаметром 9 Fr, длиной от 70 до 110 мм. Стенты из этого материала были установлены при эндоскопической замене у ряда больных, страдающих хроническим панкреатитом, калькулезом поджелудочной железы, панкреатической гипертензией на почве хронического стенозирующего папиллита, также было успешным эндоскопическое стентирование Вирсунгова протока после ЭРХПГ, ЭПСТ и вирсунготомии.
Кроме того, заявленный стент использовался при проведении операции - протезирующей вирсунгопластики. Протезирующая вирсунгопластика заключается в том, что в головке поджелудочной железы создают искусственный ход в зоне облитерации протоковой системы, соединяющий сохранившуюся часть главного панкреатического протока и просвет двенадцатиперстной кишки, и устанавливают стент, проводя его через главный панкреатический проток и созданный искусственный ход.
Впервые протезирующая вирсунгопластика с установкой стента из полиэфирблокамида был проведена больному А. с тяжелой формой непрерывно рецидивирующего обострения хронического индуративного панкреатита.
Пример 1. Больной А., 63-х лет, находился на стационарном лечении в хирургическом отделении с 13.02.2014 с диагнозом: острый панкреатит с осложнениями. Несмотря на проводимую консервативную терапию состояние прогрессивно ухудшалось. Сохранялся болевой синдром, нарастало истощение, появилась гипертермия. У больного полностью исчез аппетит, изменился психический статус. Индекс массы тела - 15,2 соответствовал крайнему истощению. Процессы метаболического распада достигли почти необратимого уровня. Больному выполнена протезирующая вирсунгопластика. В главном панкреатическом протоке установлен стент из полиэфирблокамида диаметром 9 Fr, длиной 90 мм.
Общее состояние больного стало постепенно улучшаться, появился аппетит. дальнейшем питался нормально, за два месяца после операции прибавил в весе 14 кг.
Через 10 месяцев после операции выполнена эндоскопическая замена стента. При осмотре извлеченного стента наблюдались лишь небольшие налипания на стенках, просвет оставался проходимым.
Пример 2. У больной Г., 69-ти лет, имелась картина хронического калькулезного панкреатита с расширением главного панкреатического протока. Больная страдала панкреатогенным сахарным диабетом, наблюдались сильные боли. Проведено эндоскопическое стентирование Вирсунгова протока. Установлен стент из полиэфирблокамида диаметром 10 Fr, длиной 100 мм.
Контрольный осмотр через 6 месяцев: болей нет, уровень глюкозы снижен по сравнению с дооперационным. По показаниям УЗИ - Вирсунгов проток не расширен. По данным дуоденоскопии - стент функционирует. Через 10 месяцев после операции стент удален.
При осмотре стента и микроскопии его срезов выяснилось, что полной абтурации стента еще не произошло. Необходимости в замене стента у данной больной не было.
Пример 3. У больного Ш., 33-х лет, обнаружена картина хронического панкреатита в фазе обострения, наблюдались псевдокиста поджелудочной железы в области тела, сообщающаяся с Вирсунговым протоком, выраженная панкреатическая гипертензия, лимфоаденопатия забрюшинного пространства, сильные боли. Выполнена протезирующая вирсунгопластика. Через проделанный ход в Вирсунговом протоке установлен специально изготовленный для этого больного заявленный стент из полиэфирблокамида длиной 110 мм и диаметром от 9 до 15 Fr.
Послеоперационный период протекал гладко. Проводилась стандартная терапия. Уровень амилазы нормализовался на 4-е сутки после операции. Через 8 месяцев проведено контрольное обследование. Болей не было. Больной чувствовал себя хорошо, прибавка в весе составила 25 кг. Поскольку у этого больного функционирующий панкреатический стент выступил в просвет двенадцатиперстной кишки на 2,5 см и начал травмировать слизистую противоположной стенки, выполнена замена стента. Извлеченный стент проходим, стенки его отверстий чистые.
Пример 4. Больной Т., 64-х лет, 22.09.2014 г. оперирован по поводу хронического индуративного калькулезного панкреатита, осложненного панкреатической и билиарной гипертензией. Была выполнена протезирующая вирсунгопластика, установлен стент из полиэфирблокамида диаметром 9 Fr, длиной 100 мм. При контрольном осмотре через год больной оценивал свое состояние как хорошее. Болей нет, дефицита массы тела нет, выполнена плановая замена панкреатического стента. При панкреатографии панкреатический проток не расширен. Извлеченный стент проходим, отверстия его чистые.
Пример 5. Больной Р., 49-ти лет. Контрольный осмотр через 5 месяцев после протезирующей вирсунгопластики. При дуоденоскопии наблюдали, что установленный стент из полиэфирблокамида функционирует, чист, без налипаний.
Приведенные примеры подтверждают, что заявленный стент после установки пациентам функционирует более полугода без закупорки его внутренних просветов.
Стент для стентирования панкреатических протоков, сформированный из термопластичного полимерного материала в виде изогнутых, имеющих боковые фиксаторы трубчатых отрезков с наружным диаметром от 1,0 до 4,0 мм и длиной от 30 до 180 мм, снабженных отверстиями для сбора и проведения панкреатического секрета при установке в поджелудочную железу, отличающийся тем, что стент выполнен из термопластичного полиэфирблокамида, содержащего полиэфирные блоки на основе политетраметиленоксида и полиамидные блоки на основе найлона 12, при этом содержание полиэфирных блоков на основе политетраметиленоксида составляет 36,96±0,02 мол.%, а содержание полиамидных блоков на основе найлона 12 составляет 60,47±0,04 мол.%.