Устройство привода насоса перфузионного контура для восстановления кровообращения и оксигенации крови
Иллюстрации
Показать всеИзобретение к медицинской технике. Устройство привода насоса перфузионного контура включает блок привода насоса, блок контроля параметров перфузии, блок контроля насыщения перфузата кислородом, блок контроля объемного расхода перфузата, блок звуковой и световой индикации и блок дистанционного управления, связанные с центральным микроконтроллером, выполненным с возможностью контроля блока питания. Блок привода насоса включает микроконтроллер привода насоса, связанный через силовые ключи и электродвигатель с магнитной муфтой, соединяющей вал электродвигателя с насосом, включенным в перфузионный контур. Блок контроля параметров перфузии включает первый и второй фильтры, на входы которых поступают напряжения от датчиков давления и температуры перфузата соответственно, аналого-цифровой преобразователь, связанный с выходами фильтров и со входом микроконтроллера параметров перфузии, связанного с центральным микроконтроллером. Блок контроля насыщения перфузата кислородом включает трансимпедансный усилитель, выполненный с возможностью подключения датчика насыщения кислородом и связанный через аналого-цифровой преобразователь с микроконтроллером блока контроля насыщения перфузата кислородом, один выход которого имеет возможность подключения через цифроаналоговый преобразователь к светодиодам датчика насыщения перфузата кислородом, а другой связан с центральным микроконтроллером. Блок контроля объемного расхода перфузата включает время-цифровой преобразователь, выходами генератора измерительных сигналов и входами измерителя времени подключенный к пьезоэлементам. Выход измерителя времени подключен к микроконтроллеру вычисления объемного расхода перфузата. Блок дистанционного управления выполнен с возможностью формирования и подачи управляющих команд на включение и остановку насоса, запись параметров перфузии и настройку датчиков. Блок звуковой и световой индикации подключен к центральному микроконтроллеру. Изобретение обеспечивает надежное и длительное дистанционное поддержание условий перфузии жизнеспособных донорских органов внутри тела донора. 2 з.п. ф-лы, 4 ил.
Реферат
Область изобретения
Изобретение относится к медицине, в частности к медицинской технике, а именно к устройствам, предназначенным для восстановления, экстренной поддержки кровообращения и оксигенации крови в условиях реанимации, кардиохирургии, медицины катастроф при острой кардио, кардиореспираторной недостаточности, создающей угрозу жизни или значительный вред здоровью больного, а также для проведения экстракорпоральной перфузии с целью восстановления и поддержания жизнеспособности донорских органов после остановки естественного кровообращения для осуществления последующей трансплантации.
Уровень техники
Десятки и даже сотни тысяч людей для сохранения жизни нуждаются в пересадке донорских органов. При этом проблемой является сохранение жизнеспособности и функций любых типов донорских органов. Актуальным является также поддержание или замена транспортной функции левого желудочка сердца у больных с тяжелыми формами сердечной недостаточности, функций легкого при легочной и/или сердечно-легочной недостаточности.
В настоящее время наиболее распространенной является холодовая консервация донорских органов при температуре от 4 до 8°С с последующим хранением донорского органа в специальном контейнере. Трансплантация таких органов зачастую сопровождается отторжением, снижением срока службы трансплантатов. Холодовая консервация пострадавших от недостатка кислорода органов на сегодняшний день является нерациональной, особенно на фоне все более широкого использования трансплантатов от доноров.
Органы от всех типов доноров восприимчивы к тепловой ишемии, которая вызвана прекращением или снижением кровотока и может привести к существенной потере функций органа. Перед удалением органа из тела донора необходимо подтверждение необратимого повреждения головного мозга после остановки сердца. В связи с этим средний период тепловой ишемии составляет приблизительно 10-40 минут и более, что приводит к существенной потере функций органа, что имеет место в случае поддержания (экстренного) жизнедеятельности органов при острой сердечной, сердечно-легочной недостаточности. Прекращение/ снижение кровотока есть следствие сердечной недостаточности. Сердечно-легочная недостаточность осложнена низкой оксигенацией крови, что приводит к кислородному голоданию или кислородной ишемии различной тяжести.
Известны устройства для перфузии изолированных органов с сохранением постоянства массы и других параметров перфузии (авторские свидетельства SU 1464324, SU 1687262, SU 479466, патенты RU 2489855, RU 2441608, опубликованные патентные заявки US 2013331762, US 2012302995, US 2002032405).
Недостатками этих устройств являются повреждение эндотелия за счет эндотелиально-лейкоцитарного взаимодействия, отсутствие контроля проходимости микроциркуляторного русла (контроля параметров перфузии), что может привести к повреждению структуры органа за счет избыточного перфузионного давления, большое время бесперфузионного периода, что приводит к дополнительному повреждению структурных единиц органов.
В последнее время используется экстракорпоральная нормотермическая перфузия донорских органов до осуществления эксплантации, органов пациента при сердечной и сердечно-легочной недостаточности. Эффективность такого подхода состоит практически в полном восстановлении и поддержке функциональной пригодности органов пациентов, доноров. Для поддержки жизнедеятельности больных с сердечной и сердечно-легочной недостаточностью используются аппараты вспомогательного кровообращения, аппарат искусственной вентиляции легких, аппарат искусственного кровообращения, аппарат экстракорпоральной оксигенации легких и др. Это дорогое, сложное в эксплуатации стационарное оборудование, которое позволяет до, во время или после операции проводить протезирование сердца (функций), легких или одновременно сердца и легких. Это оборудование, как правило, используется в отделениях шоковой терапии, реанимации, кардиохирургии и нейрохирургии.
Наиболее близким является устройство, раскрытое в RU 2570391. В этом решении перфузия органа осуществляется внутри тела донора, при этом контролируются параметры перфузата, в перфузионной магистрали установлены лейкоцитарный фильтр, оксигенатор, насос, блок управления и энергопитания насоса, датчики давления снабжены обратной связью. В известном устройстве фактически моделируются близкие к физиологическим условия: возобновляется кровообращение органа с доставкой кислорода, осуществляется управление объемом перфузата. Устройство также может использоваться для поддержания жизнедеятельности пациентов при указанной выше недостаточности.
Однако в известных решениях при управлении скоростью и объемом перфузии не учитываются реальные температурные условия и насыщенность перфузата кислородом. Отсутствует режим экстренного снижения перфузии в случае выхода параметров за допустимые предельные значения. Отсутствует возможность дистанционного управления процессом.
Таким образом, имеется потребность усовершенствования устройства для экстракорпоральной перфузии органов внутри тела как после остановки естественного кровообращения, так и для поддержания их жизнедеятельности с целью гарантированного восстановления и поддержания функционирования в течение возможно более длительного времени, исключения повреждения эндотелия, сокращения времени бесперфузионного периода, снижения и в идеальном случае исключения вероятности отторжения органа после пересадки. Имеется потребность в создании удобного режима управления и контроля параметров процесса поддержания жизнеспособности как донорских органов, так и органов пациентов с острой сердечной, легочной, сердечно-легочной недостаточностью.
Раскрытие изобретения
Изобретение направлено на решение задачи длительного поддержания жизнеспособности и функциональных свойств донорских органов, предназначенных как для имплантации нуждающимся в них пациентам, так и экстренной поддержки жизнедеятельности пациентов с острой сердечной, сердечно-легочной недостаточностью.
Технический результат заключается в обеспечении надежного длительного дистанционного поддержания условий перфузии жизнеспособных донорских органов внутри тела донора, так и органов пациентов с острой сердечной, сердечно-легочной патологией.
Технический результат заключается в обеспечении надежного длительного дистанционного поддержания условий перфузии жизнеспособных донорских органов внутри тела донора и экстренной реанимации пациентов с острой сердечно-легочной патологией.
Дополнительный технический результат заключается в дистанционном оповещении обслуживающего персонала о возникновении аварийных, нештатных и опасных ситуаций, сокращении времени подготовки и ввода в эксплуатацию устройства, повышении оперативности реагирования персонала на экстренные сигналы, повышении удобства и безопасности обслуживания пациентов. Это обеспечивает повышение качества и эффективности обслуживания пациента.
Технический результат достигается благодаря тому, что устройство привода насоса перфузионного контура, включающее блок привода насоса, блок контроля параметров перфузии, блок контроля насыщения перфузата кислородом, блок контроля объемного расхода перфузата, блок звуковой и световой индикации и блок дистанционного управления, связанные с центральным микроконтроллером, выполненным с возможностью контроля блока питания, при этом
блок привода насоса включает связанный с центральным микроконтроллером микроконтроллер привода насоса, связанный через силовые ключи и электродвигатель, выход с датчиков которого подключен к микроконтроллеру привода насоса, с магнитной муфтой, соединяющей вал электродвигателя с насосом, включенным в перфузионный контур,
блок контроля параметров перфузии включает первый и второй фильтры, на входы которых поступают напряжения от датчиков давления и температуры перфузата соответственно, аналого-цифровой преобразователь, связанный с выходами фильтров и со входом микроконтроллера параметров перфузии, связанного с центральным микроконтроллером,
блок контроля насыщения перфузата кислородом включает трансимпедансный усилитель, выполненный с возможностью подключения датчика насыщения кислородом и связанный через аналого-цифровой преобразователь с микроконтроллером блока контроля насыщения перфузата кислородом, один выход которого имеет возможность подключения через цифроаналоговый преобразователь к светодиодам датчика насыщения перфузата кислородом, а другой связан с центральным микроконтроллером,
блок контроля объемного расхода перфузата включает время-цифровой преобразователь, выходами генератора измерительных сигналов и входами измерителя времени подключенный к пьезоэлементам, при этом выход измерителя времени подключен к микроконтроллеру вычисления объемного расхода перфузата, подключенного двусторонней связью к центральному микроконтроллеру и входу генератора измерительных сигналов,
блок дистанционного управления выполнен с возможностью формирования и подачи управляющих команд на включение и остановку насоса, запись параметров перфузии и настройку датчиков, а
блок звуковой и световой индикации подключен к центральному микроконтроллеру с возможностью подачи звукового и светового сигналов при выходе значений параметров перфузии за пределы допустимых и в случае остановки насоса.
Блок питания содержит зарядное устройство, подключенное к аккумуляторной батарее, связанной с блоком управления питанием от аккумуляторной батареи и управляющим предохранителем, через силовые ключи, управляемые блоком управления питанием от аккумуляторной батареи, связанным с блоком выбора источника питания, выход которого подключен к центральному микропроцессору.
Блок дистанционного управления включает центральный микроконтроллер пульта дистанционного управления, связанный с сенсорной панелью, экраном, оперативным запоминающим устройством, блоком звуковой индикации, устройством флэш-памяти, а по каналу радиосвязи - с центральным микроконтроллером устройства привода насоса.
Краткое описание чертежей
Сущность изобретения и возможность достижения технического результата будут более понятны из последующего описания со ссылками на позиции чертежей, где на:
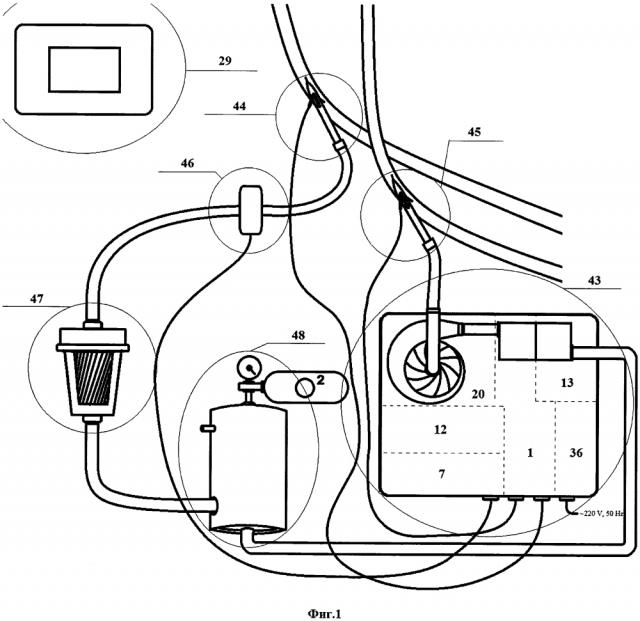
фиг. 1 приведена схема контура перфузии,
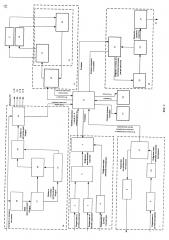
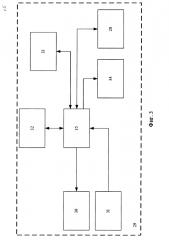
фиг. 2 изображена структурная схема устройства привода насоса перфузионного контура для восстановления кровообращения и оксигенации крови,
фиг. 3 приведена схема блока дистанционного управления,
Фиг. 4 приведена схема блока питания (пример выполнения).
На чертежах использованы следующие обозначения и сокращения:
1 - блок контроля параметров перфузии
2 - фильтр
3 - аналого-цифровой преобразователь (АЦП)
4 - микроконтроллер параметров перфузии
5 - фильтр
6 - аналого-цифровой преобразователь
7 - блок контроля насыщения перфузата кислородом
8 - цифроаналоговый преобразователь (ЦАП)
9 - трансимпедансный усилитель
10 - аналого-цифровой преобразователь
11 - микроконтроллер блока контроля насыщения перфузата кислородом
12 - центральный микроконтроллер
13 - блок контроля объемного расхода перфузата
14 – время-цифровой преобразователь
15 - генератор измерительных сигналов
16 - измеритель времени
17, 18 - пьезоэлементы
19 - микроконтроллер вычисления объемного расхода перфузата
20 - блок привода насоса
21 - микроконтроллер привода насоса
22 - силовые ключи
23 - электродвигатель
24 - магнитная муфта
25 - насос
26 - перфузионный контур
27 - блок звуковой и световой индикации
28 - канал радиосвязи
29 - блок дистанционного управления (пульт)
30 - экран
31 - сенсорная панель управления
32 - оперативное запоминающее устройство
33 - флэш-память
34 - блок звуковой индикации
35 - центральный микроконтроллер блока дистанционного управления
36 - блок питания
37 - аккумуляторная батарея
38 - зарядное устройство
39 - управляемый предохранитель
40 - силовые ключи
41 - блок управления питанием аккумуляторной батареи
42 - блок выбора источника питания
43 - привод насоса
44 - датчик давления, установленный на входе в артериальную канюлю и подключенный к блоку контроля параметров перфузии привода насоса
45 - датчик давления, установленный на выходе из венозной канюли и подключенный к блоку контроля параметров перфузии привода насоса
46 - датчик оксигенации, подключенный к блоку контроля насыщения перфузата кислородом
47 - лейкоцитарный фильтр
48 - оксигенатор
Структурная схема устройства привода насоса контура перфузии для восстановления кровообращения и оксигенации крови (далее - устройство привода насоса) представлена на фиг. 2. Устройство привода насоса включает блок 20 привода насоса, блок 1 контроля параметров перфузии, блок 7 контроля насыщения перфузата кислородом, блок 13 контроля объемного расхода перфузата, блок 27 звуковой и световой индикации, канал связи 28 и блок 29 дистанционного управления (выполненный в виде пульта), связанные с центральным микроконтроллером 12 (выполнен на базе микросхемы STM32F405RG).
Блок 1 контроля параметров перфузии включает фильтры 2, 5, на вход которых поступают напряжения с выходов инвазивных датчиков давления соответственно. Через АЦП 3 (AD7190) фильтры 2, 5 связаны с микроконтроллером 4 (С8051 F340) параметров перфузии, связанным с центральным микроконтроллером 12. Блок 1 также включает АЦП 6, на вход которого поступает напряжение от инвазивного датчика температуры.
Блок 7 контроля насыщения перфузата кислородом включает трансимпедансный усилитель 9, на вход которого поступает напряжение от датчика насыщения перфузата кислородом, связанный через АЦП 10 (AFE 4400) с микроконтроллером 11 (STM32F030) блока насыщения перфузата кислородом, который связан с ЦАП 8 цепи контроля датчика насыщения перфузата кислородом (цепь контроля светодиодов), на выходе которого формируется сигнал контроля датчика насыщения перфузата кислородом. Другой выход микроконтроллера 11 связан с центральным процессором 12.
Блок 13 контроля объемного расхода перфузата включает время-цифровой преобразователь 14 (TDC-GP22), выходами генератора 15 измерительных сигналов и входами измерителя 16 времени подключенный к пьезоэлементам 17 и 18 и выходом связанный с микроконтроллером 19 вычисления расхода, подключенного к центральному процессору 12, выходом через микроконтроллер 19 связанному с генератором измерительных сигналов.
Блок привода насоса 20 включает связанный с центральным процессором 12 микроконтроллер 21 (ATMega32M1) привода насоса, через силовые ключи 22 связанный с электродвигателем 23 (FL42), на котором установлены подключенные к микропроцессору 21 привода насоса датчики Холла, и магнитной муфтой 24, связывающей вал электродвигателя 23 с насосом 25, включенным в контур перфузии 26.
Блок 27 звуковой и световой индикации подключен к центральному микроконтроллеру 12 с возможностью подачи звукового и светового сигналов при выходе значений параметров перфузии за пределы допустимых и в случае аварийной остановки насоса 25.
Блок 29 (фиг. 3) дистанционного управления включает сенсорную панель 31 управления, экран дисплея 30 и оперативное запоминающее устройство 32 через центральный микроконтроллер 35 (AT32UC3A3256) блока дистанционного управления 29, канал радиосвязи 28 связан с центральным процессором 12 и выполнен с возможностью подачи команд на включение и остановку насоса 25 контура перфузии 26 (фиг. 1), подачи команд на запись параметров перфузии и настройку датчиков и подачи управляющих команд. Блок 34 звуковой и световой индикации подключен к центральному микроконтроллеру 35 с возможностью подачи звукового сигнал f при выходе значений параметров перфузии за пределы допустимых и в случае аварийной остановки насоса 25.
Устройство привода насоса перфузионного контура 26 включается после подключения трубопроводов перфузионного контура к системе кровообращения (фиг. 1). Кнопкой, размещенной на блоке 20 привода насоса, на устройство привода насоса подается питание и включается центральный процессор 12. В энергопитании системы привода насоса реализованы встроенные аккумуляторы, позволяющие обеспечить использование системы в отсутствие источников электрического питания и осуществлять транспортировку из отделения реанимации в операционную донора/пациента.
В приводе насоса реализовано несколько измерительных каналов: 2 канала измерения инвазивного давления, канал измерения температуры, насыщения кислородом и объемного расхода перфузата.
Измерение инвазивного давления производится с использованием тензорезистивных датчиков давления мостового типа, подключаемых к блоку 1 контроля параметров перфузии посредством разъемов (на фиг. 2 не показаны). Аналоговые сигналы с датчиков фильтруются в блоках 2 и 5, а затем оцифровываются в АЦП 3. Численные значения напряжения, соответствующие давлениям соответственно, передаются в микроконтроллер 4 блока контроля параметров перфузата и подвергаются цифровой обработке (преобразование напряжения в значения давление, фильтрация артефактов, определение выхода измеренного давления за пределы допустимых значений).
Измерение температуры осуществляется подключением к блоку 1 датчика температуры через разъем с последующим преобразованием его сигнала в АЦП 6. Измеренное значение температуры передается в микроконтроллер 4 блока контроля параметров перфузии.
Измерение насыщения крови кислородом производится фотометрическим методом. Фотометрический датчик SpO2 подключается к блоку 7 контроля содержания кислорода через разъем. В датчик попеременно подается сигнал на включение красного и инфракрасного светодиодов. Получаемый с фотоприемника датчика аналоговый сигнал усиливается трансимпедансным усилителем 9 и преобразуется в АЦП 10 в цифровое значение. Затем в микроконтроллере 11 блока контроля насыщения перфузата кислородом производится расчет параметров насыщения крови кислородом. В зависимости от условий, в которых производится измерение, необходимо изменять уровень сигнала, подаваемого на фотометрический датчик (светодиоды) блоком ЦАП 8 в цепи контроля светодиодов, который управляется микроконтроллером 11.
Вращение рабочего колеса насоса осуществляется от электродвигателя 23 через магнитную муфту 24, которая по сигналу с микропроцессора 21 производит сцепление вала электродвигателя 23 с валом рабочего колеса насоса 25. Муфта закреплена на валу двигателя. Вращение ротора двигателя приводит к вращению магнитной муфты, создается вращающееся магнитное поле, которое вращает рабочее колесо насоса.
Управление скоростью вращения ротора двигателя осуществляется микроконтроллером 21 через силовые ключи 22, коммутирующие обмотки двигателя. Регулирование или поддержание скорости вращения вала двигателя 23 осуществляется за счет обработки микропроцессором 21 сигналов обратной связи с двигателя (с датчиков Холла - датчиков положения), установленных в двигателе 23. Три датчики установлены производителем внутри корпуса двигателя с интервалом 120 градусов. Значение необходимой (заданной) скорости вращения рабочего колеса насоса с учетом значений температуры, давления и расхода поступает в микроконтроллер 21 с центрального микропроцессора 12 устройства привода насоса.
Измерение объемного расхода перфузата (далее - расхода) как основного показателя производительности насоса 25 (фиг. 1) осуществляется ультразвуковым методом. Датчик расхода имеет два ультразвуковых пьезоэлемента 17 и 18, определенным образом зафиксированных друг относительно друга.
Одна из магистралей контура перфузии расположена между двумя пьезоэлементами 17, 18. При этом импульсы от одного пьезоэлемента распространяются по течению потока перфузата, от другого - против потока. Микроконтроллер 19 вычисления расхода подает команды на генерацию измерительных импульсов через генератор 15 на один из пьезоэлементов 17 или 18. После этого блок 16 измеряет время между моментом подачи сигнала на один пьезоэлемент 17 и моментом приема на втором 18 и передает результат в микроконтроллер 19. Генератор 19 измерительных импульсов и измеритель 16 времени реализованы в микросхеме время-цифрового преобразования 18 (TDC, timetodigitalconverter). По измеренному времени в микроконтроллере 19 производится расчет расхода. Полученное значение расхода передается в центральный процессор 12, откуда в микроконтроллер 19 поступают команды на установку нулевого значения.
Отображение состояния системы, оповещение пользователя сигналами тревоги реализуется в блоке звуковой и световой индикации 27, по каналу радиосвязи 28 (СС2500) эти тревожные сигналы дублируются на экране дисплея пульта дистанционного управления.
Передача информации об измерениях давления, температуры, расхода и насыщения крови кислородом, собранной центральным процессором 12, в устройстве привода насоса осуществляется через канал радиосвязи 28 для возможности работы устройства привода насоса в условиях «шума» операционной двунаправленной связи. По каналу связи 28 поступают управляющие команды с пульта 29 (блок дистанционного управления).
Блок 29 дистанционного управления предназначен прежде всего для управления устройством привода насоса и отображения пользовательской информации.
Информация о состоянии системы и измеренных физиологических параметрах выводится через пользовательский интерфейс на экран дисплея 30 пульта. Задание режимов работы устройства привода насоса, пуск и остановка насоса 25, настройка датчиков также осуществляется через пользовательский интерфейс путем считывания действий пользователя с сенсорной панели 31. Сигналы сенсорной панели 31 передаются в центральный процессор 12. Для корректной работы экрана в части хранения изображений пользовательского интерфейса реализован блок оперативной памяти 32. При работе с устройством привода насоса имеется также возможность непрерывной записи параметров перфузии во Flash-память 33. Оповещение пользователя об аварийных режимах и сигналы тревоги выдаются пользователю центральным микроконтроллером 35 через блок звуковой индикации 34 пульта 29. В зависимости от выбранного режима работы (заданная скорость вращения рабочего колеса насоса/обеспечение заданного напора на насосе/обеспечение заданного расхода/обеспечение насосом расхода или напора) центральный микроконтроллер 12 через канал связи 28 (блок помехозащищенной радиосвязи) посылает управляющие команды в блок 25 привода насоса, где отрабатывается заданный режим. Также через канал связи 28 (оснащен блоками помехозащищенной радиосвязи) центральный микроконтроллер 12 принимает актуальное состояние привода насоса.
Перфузионный контур представляет собой комплект одноразового использования. Конкретный состав комплекта и способ подключения к организму человека определяется медицинским персоналом и зависит от целей использования устройства привода насоса. В минимальной комплектации перфузионный контур включает оксигенатор, лейкофильтр, соединительные магистрали и насос.
Питание привода насоса осуществляется от встроенной аккумуляторной батареи или от сети (от сетевого адаптера 220 В, 50 Гц). Контроль процесса заряда/разряда аккумуляторной батареи, балансировка ячеек, управление внутренними режимами, аварийная защита от превышения тока и напряжения в приводе насоса обеспечивает система управления питанием. Состояние системы управления питанием контролируется центральным микроконтроллером. Информация об исправном состоянии блока питания, значении и состоянии заряда аккумулятора отображается в блоке звуковой и световой индикации, управляемым центральным микроконтроллером. Активация звуковой индикации происходит в случае заряда встроенной аккумуляторной батареи близкого к нулю или перехода устройства в аварийный режим.
Пример. В клинической практике перфузионная система с усовершенствованным приводом насоса применялась на доноре с внезапной необратимой остановкой кровообращения. Смерть от остановки сердечной деятельности констатирована до извещения донорской службы о наличии потенциального донора, изъятие начато после прибытия судебно-медицинского эксперта, что определило критические сроки первичной тепловой ишемии. Донор женщина в возрасте 48 лет, причина смерти - массивный CAK, время первичной тепловой ишемии составило 50, доза вазопрессорной поддержки 6 мкг/кг/мин, донор имеет исходный уровень азотемии и диуреза в пределах нормы. Экстракорпоральная нормотермическая перфузия абдоминальных донорских органов с использованием аксиального насоса и удалением лейкоцитов проведена модифицированной аутологичной кровью доноров в течение 140 и 142 минут. Начальная скорость перфузии составила 1 л/мин, в течение 15 мин достигала 5 л/мин, уровень подачи кислорода установлен постоянным - 350 мл/мин. Уровень лейкоцитов в перфузионном контуре снизился до 0,78×109/л исходного. Уровень гемоглобина и гематокрита составлял 37,2-0,32 г/л.
При использовании системы привода насоса на экране дистанционного блока управления (пульта) отображались данные с датчиков давления, температуры и насыщения перфузата кислородом.
При снижении расхода перфузата и выходе его значения за нижний допустимый предел подан тревожный звуковой сигнал. Скорость вращения насоса и рабочего колеса насоса увеличена до заданной.
В ходе перфузии отмечено уменьшение показателей давления, что свидетельствовало о снижении возврата по венозной канюле и позволило своевременно выполнить дополнительное введение объема раствора, предназначенного для защиты органов, тем самым предотвратить снижение перфузионного давления на артериальной канюле и оценить степень отека (проходимость) микрососудистого русла. В состав системы входит датчик давления на входе в артериальную магистраль и датчик давления, установленный на выходе из венозной магистрали. Для сокращения времени сборки устройства на период до 15 минут использовалась упрощенная система экстракорпоральных перфузионных трубок (исключающая использование венозного резервуара) для соединения компонентов устройства.
Реципиентами почек стали 2 пациента, находящиеся на заместительной почечной терапии программным гемодиализом. Средний возраст пациентов 46 лет. Схемы иммуносупрессии включали 3 компонента - ингибиторы кальциневрина, препараты микофеноловой кислоты и глюкокортикоиды в стандартных дозах. Срок наблюдения результатов пересадок почек от доноров составил 1 год. Среднее значение креатинина сыворотки крови к первому году после трансплантации, составляющее 84±13,1 мкмоль/л, соответствует удовлетворительной функции почечных трансплантатов.
Система привода насоса экстракорпоральной перфузии органов (донора, пациента) обеспечивает:
восстановление и поддержание жизнеспособности донорских органов после остановки естественного кровообращения для их последующей трансплантации,
восстанавливает проходимость микроциркуляторного русла трансплантата и устраняет повреждения эндотелия за счет эндотелиально-лейкоцитарного взаимодействия,
осуществляет контроль проходимости микроциркуляторного русла,
сокращает время бесперфузионного периода,
осуществляет контроль объема и других параметров перфузата,
подает тревожные сигналы при выходе параметров перфузата за границы допустимых значений и в случае аварийных ситуаций,
обеспечивает дистанционное управление работой насоса.
Промышленная применимость
Все блоки, устройства и составляющие элементы системы привода насоса реализованы на базе известных и широко используемых в медицинской технике изделий и материалов. Устройство может быть использовано в работе центров органного донорства, отделениях реанимации и интенсивной терапии, отделениях сердечно-сосудистой терапии, отделениях онкологии. Перспективным представляется использование при транспортировке донора для проведения дополнительных исследований (коронарографии, ангиографии (в т.ч. церебральной), CKT), в научно-исследовательских целях.
1. Устройство привода насоса перфузионного контура, включающее блок привода насоса, блок контроля параметров перфузии, блок контроля насыщения перфузата кислородом, блок контроля объемного расхода перфузата, блок звуковой и световой индикации и блок дистанционного управления, связанные с центральным микроконтроллером, выполненным с возможностью контроля блока питания, при этом
блок привода насоса включает связанный с центральным микроконтроллером микроконтроллер привода насоса, связанный через силовые ключи и электродвигатель, выход с датчиков которого подключен к микроконтроллеру привода насоса, с магнитной муфтой, соединяющей вал электродвигателя с насосом, включенным в перфузионный контур,
блок контроля параметров перфузии включает первый и второй фильтры, на входы которых поступают напряжения от датчиков давления и температуры перфузата соответственно, аналого-цифровой преобразователь, связанный с выходами фильтров и со входом микроконтроллера параметров перфузии, связанного с центральным микроконтроллером,
блок контроля насыщения перфузата кислородом включает трансимпедансный усилитель, выполненный с возможностью подключения датчика насыщения кислородом и связанный через аналого-цифровой преобразователь с микроконтроллером блока контроля насыщения перфузата кислородом, один выход которого имеет возможность подключения через цифроаналоговый преобразователь к светодиодам датчика насыщения перфузата кислородом, а другой связан с центральным микроконтроллером,
блок контроля объемного расхода перфузата включает время-цифровой преобразователь, выходами генератора измерительных сигналов и входами измерителя времени подключенный к пьезоэлементам, при этом выход измерителя времени подключен к микроконтроллеру вычисления объемного расхода перфузата, подключенного двусторонней связью к центральному микроконтроллеру и входу генератора измерительных сигналов,
блок дистанционного управления выполнен с возможностью формирования и подачи управляющих команд на включение и остановку насоса, запись параметров перфузии и настройку датчиков, а блок звуковой и световой индикации подключен к центральному микроконтроллеру с возможностью подачи звукового и светового сигналов при выходе значений параметров перфузии за пределы допустимых и в случае остановки насоса.
2. Устройство по п. 1, отличающееся тем, что включает блок питания, содержащий зарядное устройство, подключенное к аккумуляторной батарее, связанной с блоком управления питанием от аккумуляторной батареи и управляющим предохранителем, через силовые ключи, управляемые блоком управления питанием от аккумуляторной батареи, связанным с блоком выбора источника питания, выход которого подключен к центральному микропроцессору.
3. Устройство по п. 1 или 2, отличающееся тем, что блок дистанционного управления включает центральный микроконтроллер пульта дистанционного управления, связанный с сенсорной панелью, экраном, оперативным запоминающим устройством, блоком звуковой индикации, устройством флэш-памяти, а по каналу радиосвязи - с центральным микроконтроллером устройства привода насоса.