Способ диагностики повреждения миокарда во время стентирования коронарных артерий у больных стабильной ишемической болезнью сердца
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиологии. Определяют величину глобальной деформации левого желудочка сердца в продольном направлении до стентирования и в первые 7 дней после выполнения стентирования коронарных артерий. При снижении величины глобальной деформации левого желудочка сердца в продольном направлении на 1% и более и увеличении времени до пиковой скорости верхушечного вращения левого желудочка сердца в систолу до 189 мс и более диагностируют субклиническое повреждение миокарда. Способ позволяет диагностировать субклиническое повреждение миокарда на ранних стадиях после проведения операции стентирования коронарных артерий до появления жалоб пациента, электрокардиографических изменений, появления или усугубления нарушений локальной сократимости ЛЖ сердца, что обеспечивает возможность своевременной коррекции назначенной терапии. 4 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к медицине, а именно к кардиологии, и может быть использовано для диагностики субклинического повреждения миокарда во время стентирования коронарных артерий у больных стабильной ишемической болезнью сердца при отсутствии у пациента жалоб кардиального характера и появления изменений на электрокардиограмме и нарушений локальной сократимости по общепринятой эхокардиограмме.
Известен способ диагностики повреждения миокарда после стентирования коронарной артерии, основанный на появлении депрессии или подъема сегмента ST на электрокардиограмме, ухудшении перфузии сердечной мышцы при сцинтиграфии миокарда и появлении новых нарушений локальной сократимости при эхокардиографии [1].
Недостатком способа повреждения миокарда у больных стабильной ишемической болезнью сердца является использование сцинтиграфии миокарда, общепринятой эхокардиографии и регистрации электрокардиограммы. Совокупность этих инструментальных методов исследования не позволяет диагностировать субклиническое повреждение миокарда вследствие их низкой специфичности.
Известен способ оценки уровней кардиоспецифичных ферментов, таких как Тропонина I, МВ-фракции креатинфосфокиназы в качестве «золотого стандарта» диагностики некроза миокарда [1, 2].
Недостатками данного способа являются его высокая стоимость, инвазивность, необходимость повторных исследований в течение суток для анализа их динамики.
В проанализированной патентной и научно-медицинской литературе адекватного прототипа не обнаружено.
Задачей изобретения является создание простого и высоко специфичного способа диагностики повреждения миокарда во время стентирования коронарных артерий у больных стабильной ишемической болезнью сердца.
Поставленная задача решается путем оценки величины глобальной деформации левого желудочка сердца в продольном направлении. Оценку проводят до стентирования и первые 7 дней после выполнения операции стентирования коронарных артерий. При снижении величины глобальной информации (ЛЖ) в продольном направлении на 1% и более и удлинении времени до пиковой скорости верхушечного вращения левого желудочка в систолу (189 мс и более) диагностируют субклиническое повреждение миокарда. Для осуществления предлагаемого способа используют ультразвуковую технологию «След пятна» (Speckle Tracking Imaging). При этом отсутствуют жалобы у пациента, отсутствуют новые нарушения локальной сократимости при общепринятой эхокардиографии и изменения на электрокардиограмме. Это было подтверждено путем оценки уровней Тропонина I с использованием иммунохемилюминесцентного метода (ACCESS). Пороговое значение уровня Тропонина I для острого коронарного синдрома составляло 0,5 нг/мл и выше. Повышение уровня Тропонина I через 24 ч (с 0,039±0,044 нг/мл; Ме=0,02 нг/мл до 0,419±0,049 нг/мл; Ме=0,14 нг/мл; р=0,01), не превышающее порогового значения для острого коронарного синдрома, наблюдалось у больных, имевших после стентирования коронарной артерии снижение глобальной деформации левого желудочка в продольном направлении на 1% и более и удлинение времени до пиковой скорости верхушечной ротации в систолу более 189 мс. Уровни Тропонина I после стентирования не повышались у тех больных стабильной ишемической болезнью сердца, у которых глобальная деформация левого желудочка в продольном направлении не изменялась или повышалась, а время до пиковой скорости верхушечного вращения не изменялось либо уменьшалось.
Техническим результатом предлагаемого изобретения является возможность осуществления достоверной диагностики субклинического повреждения миокарда, обусловленного стентированием коронарной артерии при отсутствии жалоб пациента, электрокардиографических изменений, появления или усугубления нарушений локальной сократимости во время общепринятой эхокардиографии.
Существенные признаки изобретения проявили в предлагаемой совокупности новые свойства, не вытекающие из уровня техники в данной области и не очевидные для специалиста. Идентичной совокупности признаков не обнаружено в патентной и научно-медицинской литературе. Предлагаемый в качестве изобретения способ может быть использован в практическом здравоохранении для улучшения качества диагностики повреждения миокарда у больных стабильной ишемической болезнью сердца, что позволяет своевременно корректировать лечебную тактику.
Исходя из вышеизложенного следует считать предлагаемое изобретение соответствующим условиям патентоспособности «новизна», «изобретательский уровень» и «промышленная применимость».
Изобретение будет понятно из следующего описания и приложенных к нему фигур.
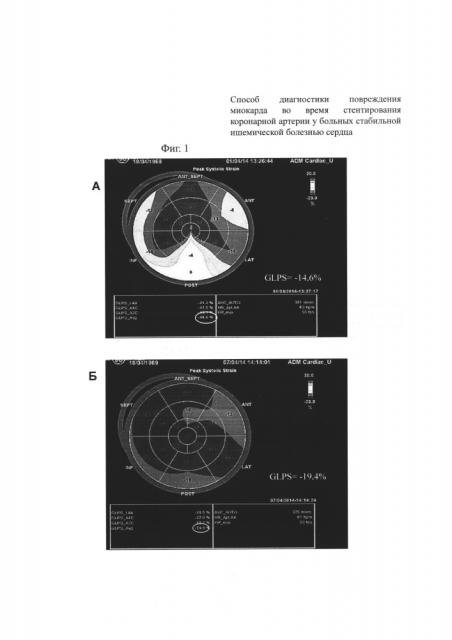
На фиг. 1 приведена технология Speckle Tracking Imaging. Изображена схема «Бычий глаз». Оценка глобальной деформации левого желудочка (GLS Avg) А - до стентирования коронарной артерии, Б - после стентирования коронарной артерии. Как видно из данной фигуры, значения (GLS Avg) после стентирования коронарной артерии увеличились с - 14,6% до - 19,4%.
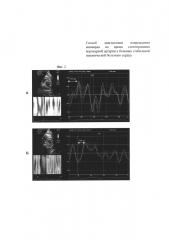
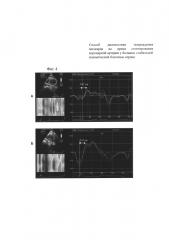
На фиг. 2 приведена технология Speckle Tracking Imaging. Эхокардиограммы из парастернальной позиции по короткой оси ЛЖ на уровне верхушки ЛЖ. Кривая скорости верхушечного вращения левого желудочка до (А) и после (Б) стентирования коронарной артерии. Время до пиковой скорости верхушечного вращения левого желудочка уменьшилось с 159 мс (А) до 108 мс (Б)
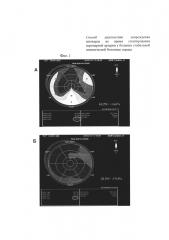
На фиг. 3 приведена технология Speckle Tracking Imaging. Изображена схема «Бычий глаз». Оценка глобальной деформации левого желудочка (GLS Avg) до (А) и после (Б) стентирования правой коронарной артерии. Значения глобальной деформации левого желудочка в продольном направлении (GLS Avg) уменьшились с - 18,2% (А) до - 13,6% (Б).
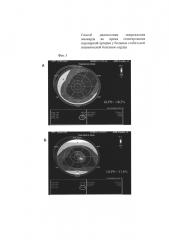
На фиг. 4 приведена технология Speckle Tracking Imaging. Эхокардиограммы из парастернальной позиции по короткой оси ЛЖ на уровне верхушки ЛЖ. Кривая скорости верхушечного вращения левого желудочка до (А) и после (Б) стентирования коронарной артерии. Время до пиковой скорости верхушечного вращения левого желудочка увеличилось с 162 мс (А) до 235 мс (Б).
Способ осуществляют следующим образом.
Больному первоначально проводят общепринятую эхокардиографию на ультразвуковой системе экспертного уровня, в частности, нами была выполнена на Vivid Е9 (GE, Healthcare) с использованием матричного секторного датчика M5S (1,5-4,6MHz). Получают двухмерные изображения левого желудочка из парастернального доступа по короткой оси на уровне верхушечных сегментов и из апикальной позиции на уровне 2-, 4 камер и по длинной оси левого желудочка при частоте кадров (Frame Rate) не менее 36. Двухмерные серошкальные изображения левого желудочка автоматически «замораживаются» в конце систолы. Используя технологию «след пятна» (Speckle Tracking Imaging) и опцию Automated Functional Imaging («AFI»), устанавливаются маркеры на базальных сегментах на уровне фиброзного кольца митрального клапана и на эндокардиальную поверхность верхушки левого желудочка. Происходит автоматическое оконтурирование границ эндокарда, если есть необходимость, то в ручную проводится корректировка границ эндокарда, эпикарда стенок ЛЖ и толщины межжелудочковой перегородки для получения оптимального оконтуривания стенок ЛЖ. Расчет глобальной деформации ЛЖ в продольном направлении производится в автоматическом режиме после получения ее значений на уровне 4 и 2 камер и подлинной оси левого желудочка. Суммарное значение глобальной деформации левого желудочка в продольном направлении (GLSavg), деленное на три, и есть то значение, по которому определяется его динамика после стентирования. Глобальная деформация левого желудочка в продольном направлении (GLSavg) в норме составляет - 18% и выше (в абсолютных значениях). Глобальная деформация левого желудочка в продольном направлении снижена при ее значениях менее - 18%.
Затем проводят оконтурирование границ эндокарда двухмерного изображения левого желудочка из парастернальной позиции по короткой оси на уровне верхушечных сегментов. При необходимости проводят корректировку границ эндокарда, эпикарда и толщины межжелудочковой перегородки, и в автоматическом режиме получаем кривые ротации от сегментов и ротации верхушки левого желудочка. Затем автоматически производится расчет скорости верхушечного вращения левого желудочка, и линия, проведенная от зубца QRS электрокардиограммы до пиковой скорости верхушечного вращения в систолу, показывает время до пика верхушечного вращения левого желудочка в систолу.
Исследование проводят до и в первые семь дней после стентирования коронарной артерии. Исследования выполнены на клиническом материале, включающем 50 больных с верифицированной ишемической болезнью сердца в возрасте от 37 до 64 лет.
В таблице 1 показана динамика глобальной деформации ЛЖ в продольном направлении и времени до пиковой скорости верхушечного вращения левого желудочка до и после стентирования коронарной артерии. Как видно из данной таблицы, улучшение глобальной деформации левого желудочка в продольном направлении после стентирования коронарной артерии сопровождается уменьшением времени до пиковой скорости верхушечного вращения, а при ухудшении глобальной деформации ЛЖ в продольном направлении наблюдалось увеличение времени до пиковой скорости верхушечного вращения левого желудочка.
В таблице 2 приводятся уровни Тропонина I до, через 6 и 24 часа после стентирования коронарной артерии. Как видно из таблицы 2, при положительной динамике глобальной деформации ЛЖ в продольном направлении уровни Тропонина I через 6 и 24 ч значимо не изменились. При отрицательной динамике глобальной деформации ЛЖ в продольном направлении уровни Тропонина I через 24 ч значимо увеличились.
Пример 1. Больной П. 1945 года рождения с диагнозом: основным: ИБС. Стенокардия напряжения, функциональный класс III. Атеросклероз коронарных артерий (передняя нисходящая коронарная артерия: в устье и проксимальной трети сегмента 30%; огибающая артерия в проксимальном сегменте 75%; правая коронарная артерия в проксимальном сегменте 25%). Постинфарктный кардиосклероз (2001 г., 2014 г.). Н I, ФК II по NYHA. Исходя из данных коронарной ангиографии пациенту показано стентирование огибающей коронарной артерии. Выполнена операция (3.03.2015 г.): баллонная дилатация и стентирование стеноза огибающей артерии стентом с лекарственным покрытием «Калипсо» 3,0×15 мм без остаточного стеноза.
На электрокардиограмме до и в течение семи дней отрицательной динамики не зарегистрировано (то есть, не было появления отрицательных зубцов Т, депрессии сегмента ST в каком-либо отведении, нарушений ритма сердца). По данным общепринятой эхокардиографии до проведения стентирования огибающей коронарной артерии был зарегистрирован гипокинез задней стенки ЛЖ, верхушечного сегмента МЖП. Индекс нарушения локальной сократимости составил 1,31 усл. ед. При использовании технологии Speckle Tracking Imaging оценена глобальная деформация левого желудочка в продольном направлении, которая до стентирования огибающей коронарной артерии составила - 14,6% (фигура 1.А), и время до пиковой скорости верхушечной ротации - 159 мс. Уровень Тропонина I до операции 0,02 нг/мл в пределах нормы (Референтные значения 0,00-0,04 нг/мл).
Через 6 часов после стентирования огибающей коронарной артерии уровень Тропонин I 0,03 нг/мл (0,00-0,04 нг/ммоль), а через 24 часа после стентирования уровень Тропонина I составил 0,04 нг/мл. Общепринятая эхокардиография выполнена на вторые сутки. Новых нарушений локальной сократимости не выявлено, регистрировался гипокинез задней стенки ЛЖ, верхушечного сегмента МЖП, который был обнаружен и до стентирования коронарной артерии (то есть без отрицательной динамики). Индекс нарушения локальной сократимости составил 1,31 усл. ед. (то есть без отрицательной динамики). При использовании технологии Speckle Tracking Imaging установлено повышение глобальной деформации левого желудочка в продольном направлении до - 19,4% (фигура 1.Б) с уменьшением времени до пиковой скорости верхушечного вращения левого желудочка в систолу (фигура 2.Б) до 108 мс.
Таким образом, данный клинический пример показывает отсутствие повреждения миокарда при стентировании коронарной артерии.
Пример 2. Пациент И., 1948 года рождения с диагнозом основным: ИБС, стенокардия напряжения, функциональный класс III. Атеросклероз коронарных артерий (стеноз правой коронарной артерии в проксимальной трети 75%; стеноз первой диагональной артерии в средней трети 25%). ХСН I, ФК II по NYHA. Исходя из данных коронарной ангиографии пациенту показано стентирование стеноза правой коронарной артерии. Выполнена операция: баллонная дилатация и стентирование стеноза правой коронарной артерии стентом с лекарственным покрытием Xience 3,0×28 мм без остаточного стеноза. На электрокардиограмме до и в течение семи дней отрицательной динамики не зарегистрировано (то есть не было появления отрицательных зубцов Т, депрессии сегмента ST в каком-либо отведении, нарушений ритма сердца). По данным общепринятой эхокардиографии до проведения стентирования правой коронарной артерии был зарегистрирован гипокинез базального и среднего сегментов нижней стенки левого желудочка, базального сегмента МЖП. Индекс нарушения локальной сократимости составил 1,12 усл. ед. При использовании технологии Speckle Tracking Imaging оценена глобальная деформация левого желудочка в продольном направлении, которая до стентирования правой коронарной артерии составила - 18,2% (фигура 3.А), и время до пиковой скорости верхушечной ротации - 162 мс (фигура 4.А). Уровень Тропонина I до операции 0,04 нг/мл в пределах нормы (Референтные значения 0,00-0,04 нг/мл).
Через 6 часов после стентирования правой коронарной артерии уровень Тропонина I составил 0,06 нг/мл (0,00-0,04 нг/ммоль), а через 24 часа после стентирования уровень Тропонина I составил 0,44 нг/мл.
Повышение уровня Тропонина I через 24 часа сопровождалось отсутствием появления приступов стенокардии. На электрокардиограмме не было зарегистрировано появления нарушения ритма сердца, депрессии сегмента ST, отрицательных зубцов Т.
Общепринятая эхокардиография выполнена на вторые сутки после стентирования правой коронарной артерии. Новых нарушений локальной сократимости не было обнаружено. Индекс нарушения локальной сократимости составил 1,12 усл. ед. (то есть без отрицательной динамики).
При использовании технологии Speckle Tracking Imaging установлено ухудшение глобальной деформации левого желудочка. Глобальная деформация левого желудочка в продольном направлении составила - 13,6% (фигура 3.Б). Увеличилось время до пиковой скорости верхушечного вращения левого желудочка в систолу до 235 мс (фигура 4.Б).
Таким образом, данный клинический пример показывает, что у пациента после стентирования правой коронарной артерии клиническое состояние оставалось без изменений, отрицательной динамики на электрокардиограмме не было зарегистрировано. По общепринятой эхокардиограмме не было зарегистрировано появления новых нарушений локальной сократимости. Однако у пациента выявлено увеличение уровня Тропонина I через 24 часа, ухудшение глобальной деформации левого желудочка в продольном направлении и удлинение времени до пиковой скорости верхушечного вращения левого желудочка. Это свидетельствует о повреждении миокарда при стентировании правой коронарной артерии.
Применение предлагаемого способа позволяет диагностировать субклиническое повреждение миокарда на ранних стадиях после проведения операции стентирования коронарных артерий до появления жалоб пациента, электрокардиографических изменений, появления или усугубления нарушений локальной сократимости левого желудочка, что обеспечивает возможность своевременной коррекции назначенной терапии.
Литература
1. Третье универсальное определение инфаркта миокарда. Российский кардиологический журнал 2013; 2(100). Приложение 1.
2. Herrmann J. Peri-procedural myocardial injury: 2005 update. European heart Journal 2005; 26: 2493-2519.
Способ диагностики повреждения миокарда во время стентирования коронарных артерий у больных стабильной ишемической болезнью сердца, характеризующийся тем, что оценивают величину глобальной деформации левого желудочка сердца в продольном направлении до стентирования и в первые 7 дней после выполнения стентирования коронарных артерий и при снижении величины глобальной деформации левого желудочка сердца в продольном направлении на 1% и более и увеличении времени до пиковой скорости верхушечного вращения левого желудочка сердца в систолу до 189 мс и более диагностируют субклиническое повреждение миокарда.