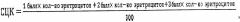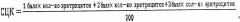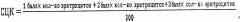Способ количественной цитохимической оценки хромаффинной реакции эритроцитов крыс при общем охлаждении организма
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к количественной гистохимической оценке адаптации организма к воздействию низкой температуры окружающей среды. Для этого устанавливают холодовую анестезию у экспериментального животного путем количественной цитохимической оценки хромаффинной реакции эритроцитов крыс при общем охлаждении организма. Способ включает охлаждение крыс, забор у них крови из легочной вены после ее флеботомии в воротах левого легкого. Изготавливают мазок крови на предметном стекле, окрашивают сначала 5% спиртовым раствором ализарина красного С, затем 5% раствором бихроматом калия. Под микроскопом подсчитывают количество различно окрашенных эритроцитов в группе от 300 клеток. После этого рассчитывают средний цитохимический коэффициент СЦК по формуле:
в которой 1 балл - эритроциты не окрашены; 2 балла - гранулярная окраска периферии эритроцита, центральная часть клетки не окрашена; 3 балла - эритроциты целиком гранулярно окрашены. И при СЦК менее 2,4 устанавливают эффективную холодовую анестезию. Способ обеспечивает объективизацию оценки холодовой анестезии у животного, что позволяет проводить вивисекцию без использования наркосодержащих фармакологических средств. 1 пр., 1 табл.
Реферат
Изобретение относиться к медицине, а именно к количественной гистохимической оценке адаптации организма к воздействию низкой температуры окружающей среды.
Известно, что ионы кальция участвуют в медиации процессов нейрогуморальной регуляции при экспериментальной гипотермии и анестезии холодом. Поэтому оценка снижения содержания в клетках организма концентрации катионов кальция и кальций-связывающих белков является одним из специфических и уже классических критериев развития экспериментальной гипотермии у ряда животных (крысы) /1. К.П. Иванов, Н.К. Арокина, И.Л. Потехина. Стимуляция физиологических функций у крыс при глубокой гипотермии без отогревания с помощью введения в желудочки мозга ЭДТА // Российский физиологический журнал. - 2005. - Т. 91, №3. - С. 286-292; 2. Г.С. Федоров, Н.К. Арокина. Развитие гипотермии у крыс при повышении [Ca2+] в крови // Российский физиологический журнал. - 2007. - Т. 93, №10. - С. 1171-1180/.
Гистохимическое окрашивание органов с помощью ализарина красного C (ETON-alizarin) является методом выявления кальция в клетках и тканях /3. Victor G. Springer and G. David Johnson Use and Advantages of Ethanol Solution of Alizarin Red S Dye for Staining Bone in Fishes // Copeia, Vol. 2000, № 1, pp. 300-301)/.
Гистохимическая окраска легочных клеток ализарином красным C подтверждает специфичность выявления катионов кальция и натрия в легких с помощью гистохимической реакции с антимонатом /3. Патент RU (11) 2013145543, Целуйко С.С., Зиновьев С.В., Решодько Д.П., Попов С.В. Способ дополнительного электронноплотного контрастирования нуклеиновых кислот в ядре и цитоплазме при гистохимическом выявлении катионов натрия в ультраструктурах клеток и тканей/.
Известно, что хромаффинная реакция - это гистохимический способ выявления биогенных аминов в клетках, который осуществляется при окрашивании бихроматом калия /4. Г. Гайер Электронная гистохимия. - М. Мир. 1974. - 488 с./.
Известен также способ цитологического окрашивания ализарином красным С мазков периферической крови у крыс. В известном способе продукт цитохимической реакции обнаруживается в лейкоцитах и эритроцитах. В случае дополнительного окрашивания мазков периферической крови в растворе бихромата калия (K2Cr2O7), этот метод является одним из подходов к оценке хромаффинной реакции в эритроцитах. /5. Зиновьев С.В. Гистохимическая характеристика клеток периферической крови при коррекции дигидрокверцетином общего переохлаждения организма в течение 10 дней // Материалы V Съезда врачей-пульмонологов Сибири и Дальнего Востока / под общ. ред. чл.-корр. РАМН В.П. Колосова. Благовещенск, 2013. - 180-163. 192 с./.
Недостаток предложенного способа заключается в том, что в нем не описан количественный подход к оценке обнаруженной цитохимической реакции в эритроцитах крыс на мазках крови.
В отличие от известного способа /5/, заявленный способ осуществляется после флеботомии легочной вены левого легкого, после чего изготавливается мазок крови. Количественная цитохимическая оценка хромаффинной реакции в эритроцитах выявляется после окраски ализарином красным С.
Задача изобретения заключается в создании способа, позволяющего объективизировать особенности количественной цитохимической оценки хромаффинной реакции эритроцитов крови крыс во время холодовой пробы.
Существо способа заключается в том, что животное подвергается экспериментальному воздействию общего охлаждения организма, а после экспериментального воздействия изучается цитохимический профиль мазков крови, полученный во время флеботомии легочной вены левого легкого, окрашенных раствором ализарина красного С и затем раствором бихромата калия.
Способ осуществляется следующим образом.
Сразу (не более чем через 30 секунд) после вивисекции производиться вскрытие грудной клетки крыс. В операционной ране производится осмотр ворот левого легкого.
Из левой легочной вены крыс берут кровь, необходимую для цитохимического исследования. Это делается с помощью флеботомии-венесекции левой легочной вены. Для этого с помощью хирургического зажима пережимается просвет легочной вены. Левое легкое приподнимается и помещается на предметное стекло, которое вводят в грудную клетку. Затем скальпелем рассекается просвет левой легочной вены, который расположен ближе к воротам левого легкого. Капля крови, поступившая из вен легкого, наносится на предметное стекло, после чего изготавливается цитологический мазок.
Мазки крови на предметных и покровных стеклах высушиваются на воздухе.
Окрашивание мазков крови ализариновым красным С производится в 5% спиртовом растворе (96% р-р этанола) ализаринового красного С. Минуя этап фиксации, мазки крови помещают в стеклянный стаканчик, заполненный 5% спиртовым раствором ализаринового красного С. Окраска и фиксация мазков крови проводится при комнатной температуре на протяжении 5 минут (время определяется эмпирически).
После окрашивания мазки крови быстро (5-10 секунд) ополаскиваются в дистиллированной воде, затем быстро ополаскиваются в 5% р-ре бихромата калия (5-10 секунд), потом быстро, но тщательно промываются в дистиллированной воде (от 5 до 30 секунд), затем мазки крови сушатся на воздухе.
Контроль исследования.
1. После высушивания мазков, их необходимо на 5 минут поместить в пары аммиака, (после чего краситель становится ярко-красным). Затем производится микроскопирование мазков крови.
2. В качестве контроля используется фиксация мазков в парах формалина, которая производится перед окрашиванием. Нами установлено, что формалин блокирует хромаффинную реакцию в эритроцитах, которая отмечается при окрашивании ализарином красным С и бихроматом мазков периферической крови.
3. Установлено, что добавление 3% р-ра динатриевой соли этилендиаминтетрауксусной кислоты (C10H14N2Na2O8) в кровь во время изготовления мазка на предметном стекле, так же блокирует окрашивание ализарином красным С и бихроматом мазков периферической крови.
После окрашивания, под иммерсионным объективом ×100, производится микроскопия окрашенного мазка крови крыс. Оценка цитохимической реакции происходит по балам:
1 балл - эритроциты не окрашены;
2 балла - выявляется гранулярная окраска периферии (тора) эритроцита, центральная часть клетки не окрашена;
3 балла - эритроциты целиком гранулярно окрашены.
Подсчет цитохимической реакции ведется на 300 клетках. Во время исследования подсчитывается количество эритроцитарных клеток с различной выраженностью реакции. После чего по формуле рассчитывают средний цитохимический коэффициент - СЦК:
Пример использования.
Объектом исследования являлись белые крысы (Вистар) - самцы, в возрасте 4 месяца, весом 300-350 грамм.
Были созданы 5 групп экспериментальных животных.
1 гр. - интактные животные находились в помещении при температуре +25°C и 30% влажности воздуха.
Остальные группы животных подвергали экспериментальному воздействию холодом при - 15°C, в течение 3 часов в климатокамере Fentron (Германия), а именно: 2 гр. подвергалась экспериментальному воздействию 1 день; 3 гр. подвергалась экспериментальному воздействию 5 дней; 5 гр. подвергалась экспериментальному воздействию 10 дней. В каждой группе было по 10 животных.
Вивисекция животных осуществлялась путем цервикальной дислокации. Сразу (не более чем через 30 секунд) после вивисекции, производилось вскрытие грудной клетки крыс. Во время эксперимента производился осмотр ворот левого легкого. При исследовании ворот левого легкого крыс отмечается, что при общем охлаждении крыс развивается гиперемия легочных вен. В результате чего в воротах левого легкого обнаруживается полнокровие каудальной и краниальной легочных вен, которые после слияния с общей левой легочной веной впадают в левое предсердие. Критерием гиперемии являлось то, что краниальная легочная вена набухала и становилась доступной наблюдению без вооруженного глаза в воротах левого легкого. После этого делалась флеботомия (венесекция) левой легочной вены. Для этого с помощью зажима нейрохирургического типа «Москит» пережимался просвет легочной вены. Легкое приподымалось и укладывалось на предметное стекло, которое вводят в грудную клетку. Затем скальпелем рассекался просвет левой легочной вены, который расположен ближе к воротам левого легкого. Капля крови, поступившая из вен легкого, наносилась на предметное стекло, после чего изготавливался цитологический мазок. Затем производилось цитохимическое окрашивание мазков крови изложенным в изобретении способом.
Результаты цитохимического исследования мазков периферической крови крыс, которые отражают механизм экспериментального воздействия на организм, отражены в таблице 1.
Полученные данные говорят о том, что в ходе эксперимента развивается компенсированная гипотермия организма, и анестезия холодом у крыс. Это позволяет проводить вивисекцию и цитохимическое исследование крыс без использования нарко-препаратов.
Способ позволяет провести математический расчет СЦК хромаффинной реакции эритроцитов. При значении СЦК менее 2,4 прогнозируется кальций зависимый адренергический механизм медиации процессов нейрогуморальной регуляции ответа организма, во время формирования анестезии холодом при экспериментальной гипотермии.
Это указывает на позитивное решение способов вивисекции экспериментальных животных анестезией холодом.
Поэтому техническим результатом изобретения является то, что он подтверждает эффективность анестезии животных холодом, что позволяет проводить вивисекцию экспериментальных животных путем цервикальной дислокации без использования дорогостоящих наркосодержащих фармакологических средств.
Способ установления холодовой анестезии у экспериментального животного путем количественной цитохимической оценки хромаффинной реакции эритроцитов крыс при общем охлаждении организма, включающий охлаждение крыс, забор у них крови из легочной вены после ее флеботомии в воротах левого легкого, изготовление мазка крови на предметном стекле, его окрашивание сначала 5% спиртовым раствором ализарина красного С, затем 5% раствором бихроматом калия, исследование окрашенного мазка под микроскопом с подсчетом количества различно окрашенных эритроцитов в группе от 300 клеток, после чего по формуле рассчитывают средний цитохимический коэффициент СЦК:
где
1 балл - эритроциты не окрашены;
2 балла - гранулярная окраска периферии эритроцита, центральная часть клетки не окрашена;
3 балла - эритроциты целиком гранулярно окрашены,
и при СЦК менее 2,4 устанавливают холодовую анестезию у животного, позволяющую проводить вивисекцию без использования наркосодержащих фармакологических средств.