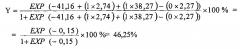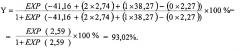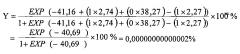Способ прегравидарного прогнозирования риска формирования септальных форм врожденных пороков сердца у плода
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неонатологии и детской кардиологии, и касается предгравидарного прогнозирования риска формирования септальных форм врожденных пороков сердца у плода. Способ включает молекулярно-генетическое тестирование семейной пары, планирующей беременность на догестационном этапе, с выявлением женского аллеля HLA-DRB1*03, HLA-DRB1*12 и мужского генотипа HLA-DRB1*01,04. Вероятный прогноз развития врожденного порока рассчитывают по формуле
,
где Y - вероятность риска формирования септальных форм врожденного порока сердца в последующих поколениях (%); X1 - женский аллель HLA-DRB1*03, при этом X1 принимает значение равное 0 при отсутствии аллеля в генотипе, X1=1 при наличии аллеля HLA-DRB1*03 в гетерозиготе и X1=2 при наличии аллеля HLA-DRB1*03 в гомозиготе; X2 - мужской генотип HLA-DRB1*01,04, X2=0 при отсутствии данного генотипа, X2=1 при наличии генотипа HLA-DRB1*01,04; X3 - женский аллель HLA-DRB1*12, соответственно X3=0 при отсутствии аллеля в генотипе, X3=1 при наличии аллеля HLA-DRB1*12 в гетерозиготе и X3=2 при наличии аллеля HLA-DRB1*12 в гомозиготе. Изобретение обеспечивает повышение эффективности и достоверности прогнозирования развития септальных форм врожденных пороков сердца у плода в последующей беременности. 3 пр., 1 табл.
Реферат
Изобретение относится к области медицины, а именно к неонатологии и детской кардиологии, и может быть использовано для скринингового обследования женщин, планирующих беременность, для выявления риска развития септальных пороков сердца на этапе предгравидарной подготовки.
Врожденные пороки сердца (ВПС) - наиболее распространенный тип врожденных дефектов и основная неинфекционная причина младенческой смертности [1]. Эпидемиологические исследования в Российской Федерации показали, что частота ВПС увеличивается из года в год. При этом основными предикторами формирования врожденных пороков до недавнего времени считали внешние факторы окружающей среды, воздействующие на плод во время внутриутробного развития, воздействие химических тератогенов, перенесенные во время беременности вирусные инфекции, а также наличие хронических заболеваний у матери.
Основная масса от всех ВПС приходится на пороки межжелудочковой и межпредсердной перегородок сердца - септальные формы ВПС (СФВПС). Поражения перегородок сердца разнообразны по анатомическому строению и характеру гемодинамических нарушений, а значит имеются особенности этиологии и патогенеза отдельных СФВПС. Поэтому поиск индивидуальных генетических маркеров для каждой формы ВПС является актуальной и значимой проблемой.
Известен способ прогнозирования развития септальных врожденных пороков сердца в последующих поколениях, включающий анализ медико-биологических, социально-гигиенических и внешних средовых факторов риска (Сафиуллина А.Р., Яковлева Л.В. Анализ факторов риска развития врожденных септальных пороков сердца // Современные проблемы науки и образования. - 2012. - №4; Найдено в интернет: http://www.science-education.ru/ru/article/view?id=6678). Способ основан на опросе родителей по таблице с соответствующими диагностическими коэффициентами, при этом вероятный прогноз делают на основании суммарного значения коэффициентов. В случае, если сумма коэффициентов равна +13 и более, риск рождения ребенка с септальным пороком ВПС составляет 95%.
Недостатком данного способа является отсутствие статистически подтвержденной чувствительности, специфичности и прогностической значимости модели, что снижает достоверность известного способа.
Известен способ предгравидарного прогнозирования риска формирования септальных врожденных пороков сердца у плода (Удостоверение №22 БРИЗ ГОУ ВПО «СамГМУ Росздрава» от 20.04.09 на рац. предложение. Модель расчета риска формирования врожденного порока развития плода (ВПР) / Абрамова О.А.), при котором в догестационном периоде проводится оценка демографических, социально-гигиенических, профессиональных и медицинских факторов, присущих обследуемой семейной паре. На основе многофакторного анализа показано, что для СФВПС рисковыми факторами являются длительность проживания матери в неблагоприятном экологическом районе, возраст старше 40 лет, наличие большого количества беременностей в анамнезе, наличие хронических заболеваний у матери. Полученная модель прогнозирования обеспечивает чувствительность решающего правила прогноза 51%, специфичность 59%, а прогностическая ценность 36%.
Основной недостаток данного способа - его низкая прогностическая ценность, которая не превышает 40%.
На сегодняшний день все больше исследований доказывает повышенный риск повторных сердечных пороков развития при последующих беременностях, что подтверждает генетическое детерминирование данной патологии [2].
Известен способ генотипирования семейных пар для прогнозирования риска формирования СФВПС у их детей (Швецов Я.Д. Полиморфизм генов сигнального каскада арилгидрокарбонового рецептора и его вклад в формирование врожденных дефектов межпредсердной и межжелудочковой перегородки сердца: диссертация на соискание ученой степени канд. мед. наук: 03.02.07 / Швецов Ярослав Дмитриевич; Курский гос. мед. ун-т. - Курск, 2014. - 131 с.). На основе логистической регрессии показано, что сочетание полиморфизмов G189C гена ARNT и P187S гена NQO1 является наиболее значимым для риска формирования ВПС.
Основным недостатком предложенной модели является расчет значимых генотипов по распределению аллелей и генотипов полиморфных вариантов генов у детей, но не у их родителей.
Известен способ прогнозирования дефекта межжелудочковой перегородки, основанный на исследовании иммуногенетического статуса новорожденного, и при наличии в сыворотке его крови антигенов А25, В27 или Cw5 или их сочетания прогнозируют дефект межжелудочковой перегородки (Пат. РФ 2201596. Способ прогнозирования дефекта межжелудочковой перегородки / Джумагазиев А.А., Безрукова Д.А. и пр.; заявитель и правообладатель Муниципальное учреждение здравоохранения «Детская городская консультативно-территориальная поликлиника (RU). №2001117198/14. Заявл. 25.06.01. Опубл. 27.03.03).
Недостатком известного способа является то, что он позволяет прогнозировать развитие врожденного септального порока у новорожденного и не предназначен для определения вероятности развития патологии на этапе предгравидарной подготовки.
Из литературных источников известны исследования, доказывающие роль иммунных взаимодействий в системе «мать - эмбрион/плод» в формировании иммунной защиты против ксенобиотиков с тератогенным эффектом [3], поэтому изучение генов главного комплекса гистосовместимости человека (HLA) поможет выявить эффективные предикторы вероятного развития врожденных пороков, поскольку продукты этих генов появляются на клетках эмбриона на ранних сроках беременности [4].
В локусе HLA, расположенном на коротком плече 6 хромосомы, в положении 21.3, выделяют три класса антигенов: I класс детерминирует классические антигены, определяющие совместимость тканей (в этом же классе находятся и эмбриональные HLA, экспрессирующиеся исключительно на клетках зародыша, эмбриона и в трофобласте); II класс (HLA-DR, HLA-DQ) содержит гены иммунного ответа (Ir-гены), продукты которых участвуют в презентации антигенов иммунорегуляторным Т-лимфоцитам; III класс включает гены цитокинов и комплемента [5].
Известен способ прогнозирования структурно-функциональных нарушений в сердце на основании исследования комплекса HLA (Гладких Н.Н. Прогнозирование структурно-функциональных особенностей сердца на основе HLA-фенотипа у пациентов с первичным пролапсом митрального клапана /Н.Н. Гладких, А.В. Ягода/ // Кубанский научный медицинский вестник. - 2009. - №6. - С. 35-37). Так Н.Н. Гладких и А.В. Ягода изучили распределения аллелей HLA I класса у пациентов с пролапсом митрального клапана. Надо отметить, что первичный пролапс митрального клапана является врожденной патологией сердца, и тем самым в данной работе показана значимость HLA в формировании врожденной микроаномалии сердца. Авторы показали положительную ассоциативную связь между носительством HLA-A25, В8, В27, В35, Cw3 и Cw5 и первичным пролапсом митрального клапана.
Основным недостатком предложенного метода является то, что прогнозирование первичного пролапса митрального клапана проходит по уже унаследованным аллелям HLA.
HLA является компактным генетическим локусом, уровень кроссинговера в нем не высок и это определяет неравновесное сцепление аллелей I, II и III классов. Таким образом, совместимость супругов по классическим и эмбриональным HLA, приводящая к репродуктивным потерям, может быть определена и по HLA-DRB1* [6]. Типирование HLA-DRB1*, относящегося ко II классу локуса HLA, эффективно еще и с той позиции, что полиморфизм в этом гене определяет антигенный полиморфизм молекулы [7]. Более того, принимая во внимание концепцию о генах иммунного ответа, находящихся в этом сублокусе, обсуждается вопрос о значимости каждого аллеля и генотипа HLA-DRB1* в формировании различной иммунопатологии [8]. Термин «функциональные аллели и генотипы» введен для научного направления «HLA и болезни», в целом, для его звена «HLA и репродукция», в частности [9]. Соответственно, типирование женщин и мужчин по гену HLA-DRB1* дает представление о рамках потенциальных возможностей материнской иммунной системы ограничить тератогенное влияние ксенобиотика на зародыш/эмбрион/плод, а наследуемые от отца HLA-DRB1* указывают на силу иммунного воспаления у плода.
Наиболее близким к заявляемому является способ прогнозирования риска развития дефекта межжелудочковой перегородки у детей русской популяции (Безрукова Д.А. Клинико-прогностическое значение факторов риска развития врожденных пороков сердца у детей: автореф. … канд. мед. наук.: 14.00.09 / Безрукова Дина Анваровна; Астраханская гос. мед. академия. - Астрахань, 2002. - 22 с.). В работе выявлено, что предрасположенность к развитию ДМЖП у детей русской популяции по совокупности критериев ассоциативной связи и прогностической значимости связывалась с повышенной частотой антигенов HLA-А25, В27 и Cw2.
Однако известный способ также не позволяет прогнозировать вероятный риск формирования СФВПС у семейной пары на этапе подготовки к будущей беременности.
Таким образом, применяемые на сегодняшний день методы вероятного прогнозирования развития врожденных аномалий/пороков и хромосомных болезней плода позволяют лишь выделить группу беременных с повышенным риском рождения детей с этой патологией. Разработка эффективного метода прогнозирования риска формирования ВПС до наступления беременности является перспективной для современной медицины.
Техническим результатом предложенного изобретения является повышение эффективности и достоверности прогнозирования развития септальных форм ВПС у плода в последующей беременности за счет анализа генотипов HLA-DRB1* родителей и расчета вероятности риска с использованием формулы логистической регрессии.
Предложенный способ основан на результатах обследования (n=184) семейных пар, имеющих детей с СФВПС, при этом выявлены следующие пороки: дефект межжелудочковой перегородки - 44,72%, дефект предсердной перегородки - 33,98%, тетрада Фалло - 16,51%, комбинирование ДМЖП с атрезией клапанов легочной артерии - 3,88% и с аномалией Эбштейна - 2,91%. В качестве контрольной группы были обследованы (n=49) семьи, имеющие здоровых детей.
На первом этапе все семейные пары были подвергнуты анкетированию, которое включало социальные аспекты жизненного уклада (образование, вредные привычки, профессиональные вредности, этажность проживания во время беременности т.д.), наличие хронических болезней различных органов и систем, наследственная отягощенность (в том числе ВПС), акушерско-гинекологический анамнез, а также особенности течения настоящей беременности, перинатального и раннего постнатального периодов.
Молекулярно-генетическое типирование генов HLA-DRB1* осуществляли у всех обследованных путем выделения ДНК из лейкоцитов периферической крови по инструкциям коммерческих наборов НПФ «ДНК-технологии» (Россия, г. Москва).
Из 137 социально-медицинских и генетических возможных предикторов риска формирования СФВПС при помощи факторного анализа отобраны 12 показателей, которые имели наиболее тесную связь с латентыми (скрытыми) факторами, ассоциированными на 66,8% с бинарной переменной.
Далее была выполнена логистическая регрессия по 12 отобранным в факторном анализе показателям. Результаты логистической регрессии показали, что нелинейная зависимость бинарной переменной (есть или нет СФВПС) была получена только для генетических маркеров. Это указывает на не значимое влияние социальных и медицинских родительских факторов, на риск формирования септального порока сердца в последующей беременности. На основе логистической регрессии была получена формула для расчета вероятности риска формирования СФВПС в последующих поколениях.
где Y - вероятность риска формирования СФВПС в последующих поколениях (%);
X1 - женский аллель HLA-DRB1*03, при этом X1 принимает значение равное 0 при отсутствии аллеля в генотипе, X1=1 при наличии аллеля HLA-DRB1*03 в гетерозиготе и X1=2 при наличии аллеля HLA-DRB1*03 в гомозиготе;
X2 - мужской генотип HLA-DRB1*01,04, X2=0 при отсутствии данного генотипа, Х2=1 при наличии генотипа HLA-DRB1*01,04;
X3 - женский аллель HLA-DRB1*12, соответственно X3=0 при отсутствии аллеля в генотипе, X3=1 при наличии аллеля HLA-DRB1*12 в гетерозиготе и X3=2 при наличии аллеля HLA-DRB1*12 в гомозиготе.
Надо отметить, что в настоящее время в гене HLA-DRB1* описаны для клинического типирования следующие аллели (01, 02 (субаллели 15, 16), 03 (субаллели 17, 18), 04, 05 (субаллели 11, 12), 06 (субаллели 13, 14), 07, 08, 09, 10), которые можно определить с помощью коммерческих тест-систем (ООО «ДНК-технологии», Москва, Россия). При типировании индивидуума определяются два аллеля из перечисленного списка, аллели могут быть в гомозиготе, например генотип HLA-DRB1*01,01, или в гетерозиготе, например генотип HLA-DRB1*08,10. Логистическая регрессия показала значимость отдельных аллелей, которые могут встречаться в гомозиготе HLA-DRB1*03,03 и HLA-DRB1*12,12, в гетерозиготе HLA-DRB1*03,x и HLA-DRB1*12,x: (x - любой другой аллель), или отсутствовать в генотипе HLA-DRB1*x,y, HLA-DRB1*x,x, HLA-DRB1*y,y (x и y - любые другие аллели), а также одного значимого генотипа HLA-DRB1*01,04, который либо присутствует, либо отсутствует у индивидуума.
Значимость вклада всех трех генетических предикторов была высокая (p<0,001).
Как видно из формулы, наибольший вклад в детерминирование риска формирования септальных врожденных пороков сердца приходится на мужской генотип HLA-DRB1*01,04. Известно, что аллель HLA-DRB1*04 имеет высокие антигенные характеристики и может детерминировать срыв физиологической толерантности и иммунной защиты в системе «мать - зародыш/эмбрион» [10].
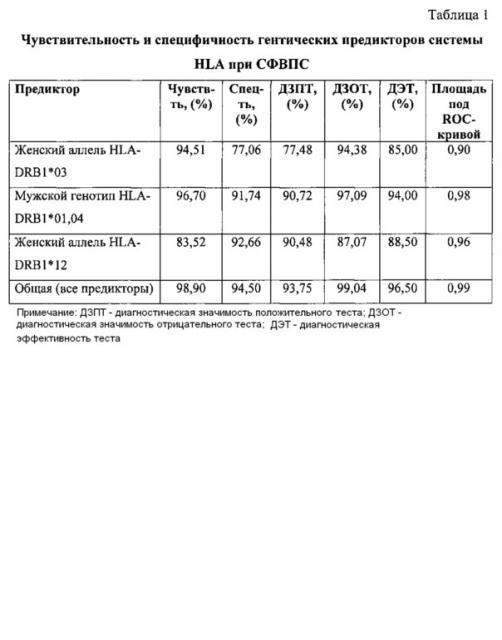
Для выявленных в логистической регрессии предикторов СФВПС была высчитана чувствительность и специфичность как для отдельных предикторов, так и для уравнения определения риска формирования СФВПС в целом (таблица 1).
Как видно из таблицы диагностическая эффективность предложенного способа в целом составляет 96,5%.
Способ осуществляют следующим образом. Семейной паре, где женщина планирует беременность, проводят генетическое типирование гена тканевой совместимости (HLA-DRB1*) с целью поиска маркерных аллелей и генотипов: женского потенциирующего аллеля HLA-DRB1*03; мужского потенциирующего генотипа HLA-DRB1*01,04 и/или женского протективного аллеля HLA-DRB1*12 и на основании полученной формулы рассчитывается степень риска формирования СФВПС на догестационном этапе.
Предлагаемый способ нетрудоемкий, выполняется по хорошо известной методике проведения полимеразно-цепной реакции ДНК, выделенной из лейкоцитов периферической крови супругов.
Апробация предложенного способа проведена на базе ООО «Современные медицинские технологии» г.Кемерово на 11 семейных парах, планирующих беременность. У 3 семейных пар по формуле была рассчитана высокая степень риска (в пределах 46-93%) рождения ребенка с СФВПС. Учет результатов родов всех наблюдаемых семейных пар показал, что в выделенной группе риска по рождению детей с септальными ВПС таких детей родилось двое, что составило 66,7%, а в группе с отрицательным результатом скрининга таких детей не было (0%). Эти данные указывают на эффективность проведения предгравидарного скрининга патентуемой формулой для выявления группы риска по формированию СФВПС.
Ниже приведены примеры реализации предложенного способа.
Пример 1. Семейная пара. Женщина Н-на Л., 21 года обратилась в ООО «Современные медицинские технологии» г. Кемерово с целью планирования беременности. При объективном обследовании выставлен диагноз - здорова. Мужчина (супруг) М-м Л., 22 лет жалоб не предъявляет, при объективном обследовании выставлен диагноз - здоров. Было проведено типирование гена HLA-DRB1* супругов (женщины и мужчины).
Выявлен генотип женщины - HLA-DRB1*03,04 и мужчины HLA-DRB1*01,04. Значимыми в данном случае являются женский аллель HLA-DRB1*03, находящийся в гетерозиготе (1 балл), и мужской генотип HLA-DRB1*01,04 (1 балл).
На основании полученных результатов провели расчет риска формирования СФВПС в последующем поколении по предложенной формуле
где X1=1, наличие женского аллеля HLA-DRB1*03 в гетерозиготе, X2=1, наличие генотипа мужского генотипа HLA-DRB1*01,04, X3=0, отсутствие в генотипе женского аллеля HLA-DRB1*12.
Это высокая степень риска и эта пара была предупреждена о риске СФВПС. При внутриутробном ультразвуковом скрининге дефект межжелудочковой перегородки не визуализировался. Экстрагенитальной патологии у матери во время беременности не зафиксировано, наследственность не отягощена, влияние тератогенных факторов не установлено, социально-бытовые условия благоприятные.
После рождения ребенка было проведено его обследование и выявлен дефект межжелудочковой перегородки в ее мышечной части размером 0,1×0,2 см.
Пример 2. Семейная пара. Женщина К-на С., 22 лет обратилась в ООО «Современные медицинские технологии» г. Кемерово с целью планирования беременности. После объективного обследования выставлен диагноз - здорова.
Мужчина (супруг) П-р С., 22 лет жалоб не предъявляет, при объективном обследовании выставлен диагноз - здоров. При типировании гена HLA-DRB1* супругов (женщины и мужчины) выявлен генотип женщины HLA-DRB1*17,18 и мужчины HLA-DRB1*01,04. Генотип HLA-DRB1*17,18 (HLA-DRB1*17 и HLA-DRB1*18 являются субаллелями HLA-DRB1*03) можно описать как HLA-DRB1*03,03, то есть гомозиготный по HLA-DRB1*03 генотип (2 балла), генотип супруга HLA-DRB1*01,04 выставляется 1 балл.
Расчетный показатель риска формирования СФВПС по формуле равен 93,02%.
Семейная пара была предупреждена о высокой степени риска рождения ребенка с СФВПС. При проведении внутриутробного ультразвукового скрининга выявлен сложный врожденный порок сердца, предположительно Тетрада Фалло. Родители отказались от прерывания беременности. После рождения диагноз Тетрада Фалло был подтвержден и ребенок взят на оперативное лечение.
Пример 3. Семейная пара. Женщина О-га П., 24 лет обратилась в ООО «Современные медицинские технологии» г. Кемерово с целью планирования беременности. После объективного обследования выставлен диагноз - здорова.
Мужчина (супруг) Н-й П., 26 лет жалоб не предъявляет, при объективном обследовании выставлен диагноз - здоров. Было проведено типирование гена HLA-DRB1* супругов (женщины и мужчины). По результатам молекулярно-генетического тестирования генотип женщины HLA-DRB1*12,18 и мужчины HLA-DRB1*01,08. Генотип женщины HLA-DRB1*12,18 можно описать как HLA-DRB1*03,12. В данном случае X1=1, X2=0, X3=1.
На основании полученных результатов провели расчет риска формирования СФВПС в последующем поколении по формуле
Получена очень низкая степень риска рождения ребенка с СФВПС. При проведении внутриутробного ультразвукового скрининга ВПС не выявлен. После рождения и объективного обследования ВПС также не был выявлен.
Представленные примеры показывают эффективность проведения догестационного скрининга патентуемой формулой для выявления группы риска по формированию СФВПС.
Литература
1. Методические рекомендациями «Социально-гигиенический мониторинг. Анализ медико-демографических и социально-экономических показателей на региональном уровне» (утв. приказом Роспотребнадзора от 20.09.2010 №341).
2. Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирургия-2014. Болезни и врожденные аномалии системы кровообращения. / Л.А. Бокерия, Р.Г. Гудкова. - М.: НЦССХ им. А.Н. Бакулева, 2015. - 226 с.
3. Сотникова Н.Ю. Иммунные аспекты беременности // Russian journal of immunology. - 2005. - V. 9(2). - С. 15-16; Иммунологическая загадка беременности / Под редакцией Н.Ю. Сотниковой // Иваново: Издательство МИК. - 2005. - 276 с.
4. Говалло В.И. Иммунология репродукции / М.: Медицина, 1987. - 304 с.
5. Структура генов и антигенов главного комплекса гистосовместимости человека I и II класса / Ю.Н. Наумов, В.И. Коненков, Л.П. Алексеев // Иммунология. - 1994. - 2. - С. 4-8; Галактионов В. Г. Иммунология. / В. Г. Галактионов. – М.: Академия, 2004. - 343 с.
6. The possible role of classical human leukocyte antigens in recurrent miscarriage / O.B. Christiansen // Am. J. Reprod. Immunol. - 1999. - V. 42(2). - P. 110-5.
7. Bodmer W.F. The HLA system: structure and function / J Clin Pathol. - 1997. - Sep; 40(9). - Р. 948-958.
8. Болдырева M.H., Алексеев Л.П. HLA и естественный отбор. Гипотеза «преимущества функциональной гетерозиготности». Иммунология, 2006, Т. 27, №3, с. 172-176.
9. Болдырева М.Н. Исследование роли HLA-DRB1-генов при невынашивании беременности неясного генеза. / М.Н. Болдырева, P.M. Хаитов, О.Б. Барцева и др. // Иммунология. - 2004. - №1. - С. 4-8.
10. Kilpatrick D.C., Liston W.A. Influence of histocompatibility antigens in recurrent spontaneous abortion and its relevance to leukocyte immunotherapy. Hum. Reprod. 1993, v. 8(10), 1645-1649.
Способ предгравидарного прогнозирования риска формирования септальных форм врожденных пороков сердца у плода, включающий молеклярно-генетическое тестирование и выявление аллелей и генотипа HLA-DRB1*, отличающийся тем, что генетическое типирование HLA-DRB1* выполняют у семейной пары, планирующей беременность на догестационном этапе, при этом прогностическими критериями считают наличие женского аллеля HLA-DRB1*03, HLA-DRB1*12 и мужского генотипа HLA-DRB1*01,04, а вероятный прогноз рассчитывают по формуле
где Y - вероятность риска формирования септальных форм врожденного порока сердца в последующих поколениях (%);
X1 - женский аллель HLA-DRB1*03, при этом X1 принимает значение равное 0 при отсутствии аллеля в генотипе, X1=1 при наличии аллель HLA-DRB1*03 в гетерозиготе и Х1=2 при наличии аллеля HLA-DRB1*03 в гомозиготе;
Х2 - мужской генотип HLA-DRB1*01,04, Х2=0 при отсутствии данного генотипа, Х2=1 при наличии генотипа HLA-DRB1*01,04;
Х3 - женский аллель HLA-DRB1*12, соответственно Х3=0 при отсутствии аллеля в генотипе, Х3=1 при наличии аллеля HLA-DRB1*12 в гетерозиготе и Х3=2 при наличии аллеля HLA-DRB1*12 в гомозиготе.