Применение arry-520 для лечения рака у пациентов с низким уровнем акг
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения рака у пациентов с низкой концентрацией человеческого α 1-кислотного гликопротеина (АКГ). Способы по изобретению включают получение биологического образца от пациента, определение концентрации АКГ и введение ARRY-520 пациенту с низкой концентрацией АКГ. Использование изобретений позволяет повысить эффективность лечения за счет лучшего ответа на введение ARRY-520 при низкой АКГ. 5 н. и 52 з.п. ф-лы, 6 табл., 10 ил., 10 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к ARRY-520 и лечению больных раком с низким уровнем [АКГ].
Уровень техники
(S)-2-(3-аминопропил)-5-(2,5-дифторфенил)-N-метокси-N-метил-2-фенил-1,3,4-тиадиазол-3(2H)-карбоксамид, известный также как «ARRY-520», имеет следующую формулу:
и является ингибитором белка веретена кинезина («БВК») (см. US 7449486, US 2010/0099697 и WO 2010/045624, содержание которых включено в настоящее описание в полной мере посредством ссылки). Ингибирование БВК приводит к задержке митоза пролиферирующих клеток и последующей их гибели. ARRY-520 продемонстрировал клиническую активность у пациентов с рецидивирующей и рефрактерной множественной миеломой («ММ»). Фармакокинетика («ФК») ARRY-520 варьирует среди пациентов, несмотря на внутривенное введение («ВВ»).
Связывание сывороточного белка с препаратами может изменить их активность и ФК, и, возможно, повлиять на клиническую активность. Человеческий сывороточный альбумин («ЧСА») и человеческий α 1-кислотный гликопротеин («АКГ») являются наиболее распространенными белками плазмы со средними физиологическими концентрациями около 40 г/л и 0,6-1,2 г/л соответственно. АКГ является сывороточным белком острой фазы, который продуцируется печенью в ответ на воспаление и инфекцию. Несмотря на то, что имеются данные о внепеченочной экспрессии, АКГ продуцируется преимущественно в печени. Уровень АКГ иногда повышается в крови больных раком, включая множественную миелому. Уровень АКГ в плазме может варьировать в зависимости от физиологических, патологических и генетических факторов. Изменения уровня АКГ в плазме могут непосредственно влиять на концентрации несвязанного препарата, и, таким образом, изменять ФК препарата и его фармакодинамику («ФД»). Высокая концентрация АКГ связана с ослаблением ответа и выживаемости без прогрессирования («ВБП») для лекарственных препаратов, которые прочно связываются с АКГ (Bruno, Rene, et al. "α-1-Acid Glycoprotein As an Independent Predictor for Treatment Effects and a Prognostic Factor of Survival in Patients with Non-small Cell Lung Cancer Treated with Docetaxel." Clin. CancerRes. Vol. 9 (2003): pp 1077-1082). На момент установления диагноза, концентрация АКГ у пациентов с множественной миеломой составляла от 0,4 до 4,1 г/л, причем 24% из них имели высокую концентрацию АКГ (Felliniemi Tarja-Terttu, et al. "Immunoreactive Interleukin-6 and Acute Phase Proteins as Prognostic Factors in Multiple Myeloma." Blood. Vol. 85, No. 3 (February 1, 1995): pp. 765-771). См. также, Brown, Karin D., et al. "An Effective Screening Approach to Assess the Impact of α-1 Acid Glycoprotein Binding on the Fraction Unbound of a Drug." 17th North American Regional International Society for the Study of Xenobiotics Meeting, Atlanta, Georgia, October 18, 2011, Abstract #25022, www.arraybiophama.com/_documents/Publication/PubAttachment479.pdf.
Раскрытие изобретения
Неожиданно было обнаружено, что пациенты, которые получали ARRY-520, демонстрировали лучший ответ, если у них была низкая [АКГ] перед введением ARRY-520.
В одном аспекте настоящее изобретение относится к применению ARRY-520 для лечения рака у пациентов с низкой [АКГ].
В другом аспекте предлагается применение ARRY-520 для лечения рака у пациента, включающее в себя (а) анализ биологического образца, полученного от пациента, на [АКГ], (b) определение того, имеет ли образец низкую [АКГ], и (с) введение терапевтически эффективного количества ARRY-520 пациенту с низкой [АКГ].
В другом аспекте предлагается применение ARRY-520 для лечения рака у пациента, включающее в себя (а) получение биологического образца от пациента, (b) анализ [АКГ] в биологическом образце, (с) определение того, имеет ли образец низкую [АКГ], и (d) введение терапевтически эффективного количества ARRY-520 пациенту с низкой [АКГ].
В другом аспекте предлагается способ лечения рака у больного раком, определенного как имеющий низкую [АКГ], включающий этап лечения пациента ARRY-520, в том числе: (а) определение пациента как имеющего низкую [АКГ] путем анализа биологического образца, полученного от пациента, и (b) введение терапевтически эффективной дозы ARRY-520 пациенту с низкой [АКГ].
В другом аспекте предлагается способ лечения рака у больного раком, определенного как имеющий низкую [АКГ], включающий этап лечения пациентов ARRY-520, в том числе: (а) получение биологического образца от пациента, (b) определение пациента как имеющего низкую [АКГ] путем анализа биологического образца, полученного от пациента, и (с) введение ARRY-520 пациенту с низкой [АКГ].
В другом аспекте предлагается способ выявления пациента, с большей вероятностью поддающегося лечению ARRY-520, включающий в себя получение и анализ биологического образца от пациента для определения [АКГ], при котором низкая [АКГ] указывает на большую вероятность ответа пациента на лечение ARRY-520.
В другом аспекте предлагается способ выявления пациента, с большей вероятностью поддающегося лечению ARRY-520, включающий получение биологического образца от пациента, анализ образца для определения [АКГ] и определение большей вероятности ответа пациента на лечение ARRY-520, при котором низкая [АКГ] указывает на большую вероятность ответа пациента на лечение ARRY-520.
В другом аспекте предлагается способ повышения вероятности ответа у больного раком, включающий: (а) определение пациента как имеющего низкую [АКГ] путем анализа биологического образца, полученного от пациента; и (b) введение ARRY-520 пациенту, имеющему предиктор повышенной вероятности ответа.
В другом аспекте предлагается способ повышения вероятности ответа у больного раком, включающий: (а) получение биологического образца от пациента; (b) анализ образца для измерения [АКГ]; (с) определение того, имеет ли образец низкую [АКГ]; (d) классификацию пациента как имеющего большую вероятность ответа, если пациент имеет низкую [АКГ]; и (е) введение ARRY-520 пациенту, с большей вероятностью поддающемуся лечению.
В другом аспекте предлагается способ прогнозирования повышенной вероятности терапевтического ответа пациента на способ лечения рака с применением ARRY-520, включающий: (а) измерение [АКГ] в биологическом образце, полученном от пациента; (b) определение того, имеет ли образец низкую [АКГ]; (с) классификацию пациента как имеющего большую вероятность ответа, если пациент имеет низкую [АКГ]; и (d) введение ARRY-520 пациенту, с большей вероятностью поддающемуся лечению.
В другом аспекте предлагается способ прогнозирования повышенной вероятности терапевтического ответа пациента на способ лечения рака с применением ARRY-520, включающий: (а) получение биологического образца от пациента; (b) измерение уровня [АКГ] в биологическом образце, полученном от пациента; (с) определение того, имеет ли образец низкую [АКГ]; (d) классификацию пациента как имеющего большую вероятность ответа, если пациент имеет низкую [АКГ]; и (е) введение ARRY-520 пациенту, с большей вероятностью поддающемуся лечению
В другом аспекте предлагается способ определения повышенной вероятности чувствительности больного раком к лечению ARRY-520, включающий: (а) измерение уровня [АКГ] в биологическом образце, полученном от пациента; и (b) классификацию пациента как имеющего большую вероятность чувствительности к лечению ARRY-520, если биологический образец имеет низкую [АКГ].
В другом аспекте предлагается способ определения повышенной вероятности чувствительности больного раком к лечению с применением ARRY-520, включающий: (а) получение биологического образца от пациента; (b) измерение уровня [АКГ] в биологическом образце; и (с) классификацию пациента как имеющего большую вероятность чувствительности к лечению ARRY-520, если биологический образец имеет низкую [АКГ].
В другом аспекте предлагается способ применения ARRY-520 для лечения пациента, у которого диагностирован уровень [АКГ] ниже, чем около 1,1 г/л, включающий введение одной или более стандартных доз ARRY-520.
В другом аспекте предлагается способ применения ARRY-520 для лечения пациента, у которого диагностирован уровень [АКГ] ниже, чем около 1,1 г/л, включающий введение одной или более стандартных доз ARRY-520 указанному пациенту в количестве, эффективном для достижения уровня несвязанного ARRY-520, не меньшего, чем IC50, рассчитанная по результатам тестирования in vitro.
В другом аспекте предлагается способ лечения рака у пациента с низким уровнем [АКГ], включающий введение пациенту эффективного количества ARRY-520.
В другом аспекте предлагается способ лечения рака у млекопитающего с низким уровнем [АКГ], включающий введение терапевтически эффективного количества ARRY-520 млекопитающему.
В другом аспекте предлагается способ лечения заболевания или нарушения, модулированного КВБ, включающий введение млекопитающему с низким уровнем [АКГ], нуждающемуся в таком лечении, эффективного количества ARRY-520.
В другом аспекте предлагается применение ARRY-520 в производстве лекарственного средства, предназначенного для лечения рака у пациента с низким уровнем [АКГ].
В другом, аспекте предлагается фармацевтическая композиция для лечения больного раком и низким уровнем [АКГ], включающий ARRY-520.
В другом аспекте предлагается фармацевтическая композиция для лечения больного раком и низким уровнем [АКГ], включающий ARRY-520 и фармацевтически приемлемый носитель или наполнитель.
Краткое описание фигур
На фигуре 1 представлен клеточный анализ.
На фигуре 2 представлена имитационная модель популяционной ФК («попФК»).
На фигуре 3 представлена имитационная модель популяционной ФК («попФК»).
На фигуре 4 представлен анализ клинических испытаний на людях.
На фигуре 5 представлен анализ клинических испытаний на людях.
На фигуре 6 представлена вариабельность анализа.
На фигуре 7 представлена линейная регрессия при сравнении двух анализов.
На фигуре 8 представлена линейная регрессия при сравнении двух анализов.
На фигуре 9 представлена линейная регрессия при сравнении двух анализов.
На фигуре 10 представлена линейная регрессия при сравнении двух анализов.
Осуществление изобретения
Далее будут подробно рассмотрены некоторые варианты реализации изобретения. Следует понимать, что изобретение не ограничивается описанными ниже вариантами его реализации. Напротив, изобретение направлено на охват всех вариантов, модификаций и эквивалентов, которые могут быть включены в объем настоящего изобретения, как определено формулой изобретения. Специалисту в данной области техники будут понятны многие способы и вещества, аналогичные или эквивалентные описанным в данном документе, которые могут быть использованы в практике настоящего изобретения. Настоящее изобретение никоим образом не ограничивается описанными способами и материалами. В случае, если одна или более позиций используемой литературы и подобных материалов отличается или противоречит настоящей заявке, включающей, но не ограничивающейся определенными условиями, сроком использования, описанными методами и т.п., настоящая заявка имеет преимущество.
Определения
Способы настоящего изобретения включают: способы лечения, предупреждения и/или сдерживания развития различных типов рака, а также заболеваний и нарушений, связанных с, или характеризующихся, неблагоприятным ангиогенезом. Если не указано иное, в настоящем документе термин «лечение» или «лечить» относится к введению соединения, заявленного в изобретении, или другого дополнительного активного вещества после появления симптомов конкретного заболевания или нарушения. Термины «лечить» или «лечение» относятся также к лечебным или паллиативным процедурам. Значимые или желаемые клинические результаты включают, но не ограничиваются ослаблением симптомов, уменьшением степени заболевания, стабилизацией (т.е. отсутствием ухудшения) заболевания, задержкой или замедлением прогрессирования заболевания, улучшением или временным облегчением болезненного состояния и ремиссией (частичной или полной), как явными, так и неявными. «Лечение» может также означать повышение выживаемости по сравнению с ожидаемой выживаемостью пациента, который не получает лечения. Пациенты, нуждающиеся в лечении, включают тех, кто уже имеет или склонен иметь соответствующие состояния или нарушения. Если не указано иное, термин «предотвращение» в настоящем документе относится к введению лекарственного средства до появления симптомов, особенно пациентам, имеющим риск рака и других заболеваний и нарушений, связанных с, или характеризующихся, неблагоприятным ангиогенезом. Термин «предупреждение» распространяется на уменьшение симптомов конкретного заболевания или нарушения. Пациенты с семейной историей рака, а также заболеваний и нарушений, связанных с, или характеризующихся, неблагоприятным ангиогенезом, являются предпочтительными кандидатами для профилактических схем. Если не указано иное, термин «Сдерживание развития» в настоящем документе относится к предотвращению рецидива конкретного заболевания или нарушения у пациента, страдающего от него, и/или увеличению длительности ремиссии.
Термин «около» в настоящем документе означает приблизительно, примерно, ориентировочно. Когда термин «около» используют в сочетании с диапазоном числовых значений, он изменяет этот диапазон, расширяя границы выше и ниже указанных числовых значений. В целом, термин «около» используется в настоящем документе для изменения числового значения выше и ниже указанного значения в пределах 20%.
Термины «рак» и «раковый» относятся к физиологическому состоянию у млекопитающих, которое обычно характеризуется аномальным или неконтролируемым ростом клеток. «Опухоль» включает одну или более раковых клеток. Примеры рака включают, но не ограничиваются карциномой, лимфомой, бластомой, саркомой и лейкозом или лимфоидными злокачественными новообразованиями. Более конкретные примеры таких видов рака включают в себя плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких («НМРЛ»), аденокарциному легких и плоскоклеточный рак легкого, рак брюшины, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или карциному матки, карциному слюнных желез, рак почки, или ренальный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, рак кожи, включая меланому, а также рак головы и шеи.
Признак «фармацевтически приемлемый» означает, что вещество или композиция совместимы химически и/или токсикологически с другими ингредиентами, содержащимися в препарате, и/или с млекопитающим, подлежащим лечению ими.
Признак «фармацевтически приемлемая соль» в настоящем документе относится к фармацевтически приемлемым органическим или неорганическим солям соединения, описанного в настоящем документе.
Признак «терапевтически эффективное количество» или «эффективное количество» означают количество соединения, описанного в настоящем документе, которого, при введении млекопитающему, нуждающемуся в таком лечении, достаточно для (i) лечения или профилактики конкретного заболевания, состояния или нарушения, (ii) уменьшения, облегчения или устранения одного или более симптомов конкретного заболевания, состояния или нарушения или (iii) предотвращения или задержки появления одного или более симптомов конкретного заболевания, состояния или нарушения, описанных в настоящем документе. Количество соединения, которое будет терапевтически эффективным, может изменяться в зависимости от таких факторов, как конкретное соединение, состояние болезни и ее тяжесть, индивидуальные особенности млекопитающего (например, вес), нуждающегося в лечении, но тем не менее может быть определено по стандартной методике специалистом в данной области техники.
Термин «млекопитающее» означает теплокровное животное, которое имеет риск развития описанного в настоящем документе заболевания, и включает, но не ограничивается морскими свинками, собаками, кошками, крысами, мышами, хомяками и приматами, включая человека.
Пациенты с низкой [АКГ]
В анализах in vitro ARRY-520 демонстрирует низкое микромолярное сродство с АКГ, но не с другими сывороточными белками, такими как альбумин (пример 1). Выявлено, что лечение пациентов с низким уровнем [АКГ] при помощи ARRY-520 является эффективным.
Термин «[АКГ]» означает концентрацию АКГ, измеренную в биологическом образце, полученном от пациента, перед введением ARRY-520. Термин «низкая [АКГ]» означает [АКГ] менее, чем около 1,1 г/л. Как показано в примере 7, уровень 1,1 г/л измеряли в плазме крови с помощью анализа R&D Systems Quantikine®. Как показано в примере 8, существуют различия в анализе, составляющие по меньшей мере 8,6%. В определенном варианте реализации изобретения термин «около 1,1 г/л» означает 1,1 г/л±20%. В другом варианте реализации изобретения термин «около 1,1 г/л» означает 1,1 г/л±10%. В другом варианте реализации изобретения термин «около 1,1 г/л» означает 1,1 г/л±8,6%. В другом варианте реализации изобретения низкая [АКГ] означает [АКГ] менее, чем около 1,1 г/л в плазме крови, как это определено в анализе R&D Systems Quantikine® (как описано в примере 7).
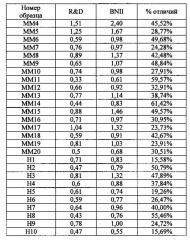
Следует понимать, что для измерения [АКГ] могут быть использованы различные виды анализа. Другие анализы могут давать несколько отличающиеся результаты. Если используются другие анализы, то они должны коррелировать с 1,1 г/л измерением в анализе R&D Systems Quantikine®, используемом в примере 7. Научные и статистические методы, известные в данной области техники, используются для корреляции двух анализов. Примеры корреляций (перекрестных сравнений) показаны в примере 10. Другие анализы могут включать в себя, в частности, иммунотурбидиметрические анализы Randox Imola, Randox Daytona, Siemens Advia и иммуннонефелометрический анализ Siemens BNII.
В некоторых вариантах реализации изобретения биологическим образцом для измерения [АКГ] является кровь. Забор крови (получение биологического образца) у пациента является хорошо известной манипуляцией в данной области техники. В еще одном варианте реализации изобретения биологическим образцом для измерения [АКГ] является плазма. В другом варианте биологическим образцом для измерения [АКГ] является сыворотка. При тестировании была выявлена хорошая корреляция (>0,9) между [АКГ] в сыворотке и плазме в анализах R&D Systems Quantikine®, Siemens Advia, Siemens BNII и Randox Imola (все анализы были проведены согласно протоколам изготовителя, если в примерах не указано иное).
ARRY-520, как правило, вводят внутривенно. ARRY-520 обычно предоставляется в виде лиофилизованного порошка, содержащегося во флаконе из прозрачного стекла типа 1 для использования ВВ. Для получения раствора порошок вначале растворяют в стерильной воде для инъекций, затем разводят физиологическим раствором перед ВВ введением.
Было выявлено, что основной дозолимитирующей токсичностью («ДЛТ») ARRY-520 является нейтропения. В связи с этим, с целью профилактики может применяться гранулоцитарный колониестимулирующий фактор («Г-КСФ»).
ARRY-520, как правило, вводят в 1-й и 2-й дни 14-дневного цикла (1-й и 2-й дни, 1 раз в 2 недели). ARRY-520, как правило, вводят в дозе 2,5 мг/м2/цикл (1,25 мг/м2/день) без Г-КСФ и 3,0 мг/м2/цикл (1,5 мг/м2/день) в сочетании с профилактическим Г-КСФ. Тем не менее ARRY-520 можно также вводить в 1-й день 14-дневного цикла (1-й день; 1 раз в 2 недели) или в 1-й и 15-й дни 28-дневного цикла (1-й и 15-й дни; 1 раз в 4 недели).
Было обнаружено, что введение ARRY-520 пациенту, имеющему низкую [АКГ], повышает вероятность ответа на ARRY-520.
В связи с этим в одном варианте реализации изобретения предлагается применение ARRY-520 для лечения рака у пациента с низкой [АКГ].
Некоторые варианты реализации изобретения предлагают применение ARRY-520 для лечения рака у пациента, включающее в себя (а) анализ биологического образца, полученного от пациента, на [АКГ], (b) определение того, имеет ли образец низкую [АКГ], и (с) введение терапевтически эффективного количества ARRY-520 пациенту, если он имеет низкую [АКГ].
Другой вариант реализации изобретения предлагает применение ARRY-520 для лечения рака у пациента, включающий в себя (а) получение биологического образца от пациента; (b) анализ биологического образца на [АКГ], (с) определение того, имеет ли образец низкую [АКГ], и (г) введение терапевтически эффективного количества ARRY-520 пациенту, если он имеет низкую [АКГ].
Некоторые варианты реализации изобретения предлагают способ лечения рака у больного раком, определенного как имеющий низкую [АКГ], включающий этап лечения пациента с ARRY-520, предлагает: (а) определение пациента как имеющего низкую [АКГ] путем анализа биологического образца, полученного от пациента, и (b) введение ARRY-520 пациенту, имеющему низкую [АКГ].
Другой вариант реализации изобретения предлагает способ лечения рака у больного раком, определенного как имеющий низкую [АКГ], включающий этап лечения пациента ARRY-520, предлагает: (а) получение биологического образца от пациента; (b) определение пациента как имеющий низкую [АКГ] путем анализа биологического образца, полученного от пациента, и (с) введение ARRY-520 пациенту, имеющему низкую [АКГ]..
Некоторые варианты реализации изобретения предлагают способ выявления пациента, с большей вероятностью поддающегося лечению ARRY-520, включающий получение биологического образца от пациента и анализ образца для определения [АКГ], при котором низкая [АКГ] указывает на большую вероятность ответа пациента на лечение с применением ARRY-520.
Другой вариант предлагает способ выявления пациента, с большей вероятностью поддающегося лечению ARRY-520, включающий получение биологического образца от пациента, анализ образца на [АКГ] и определение большей вероятности ответа пациента на лечение с применением ARRY-520, при котором низкая [АКГ] указывает на большую вероятность ответа пациента на лечение с применением ARRY-520.
Некоторые варианты реализации изобретения предлагают способ повышения вероятности ответа у больного раком, включающий: (а) определение пациента как имеющего низкую [АКГ] путем анализа биологического образца, полученного от пациента; и (b) введение ARRY-520 пациенту, классифицированному как имеющий повышенную вероятность ответа.
Другой вариант реализации изобретения предлагает способ повышения вероятности ответа у больного раком, включающий в себя: (а) получение биологического образца от пациента; (b) анализ образца для измерения [АКГ]; (с) определение того, имеет ли образец низкую [АКГ]; (d) классификацию пациента, как имеющего повышенную вероятность ответа, если пациент имеет низкую [АКГ]; и (е) введение ARRY-520 пациенту, классифицированному как имеющий повышенную вероятность ответа.
Некоторые варианты реализации изобретения предлагают способ прогнозирования повышенной вероятности терапевтического ответа пациента на способ лечения рака с применением ARRY-520. Способ включает: (а) измерение [АКГ] в биологическом образце, полученном от пациента; (b) определение того, имеет ли образец низкую [АКГ], (с) классификацию пациента, как имеющего повышенную вероятность терапевтического ответа на способ лечения рака, если образец имеет низкую [АКГ], и (d) введение ARRY-520 пациенту, классифицированному как имеющий повышенную вероятность ответа.
Еще один вариант реализации изобретения предлагает прогнозирования повышенной вероятности терапевтического ответа пациента на способ лечения рака с применением ARRY-520.. Способ включает: (а) получение биологического образца от пациента; (b) измерение [АКГ] в образце, полученном от пациента; (с) определение того, имеет ли образец низкую [АКГ], (d) классификацию пациента, как имеющего повышенную вероятность терапевтического ответа на описанный способ лечения рака, если образец имеет низкую [АКГ], и (е) введение ARRY-520 пациенту, классифицированному как имеющий повышенную вероятность ответа.
Некоторые варианты реализации изобретения предлагают способ прогнозирования повышенной вероятности чувствительности к лечению больного раком с применением ARRY-520, включающий: (а) анализ биологического образца, полученного от пациента, на [АКГ]; и (b) определение пациента как имеющего повышенную вероятность чувствительности к лечению ARRY-520 при низкой [АКГ] в биологическом образце.
Некоторые варианты реализации изобретения предлагают способ прогнозирования повышенной вероятности чувствительности к лечению больного раком с применением ARRY-520, включающий: (а) получение биологического образца от пациента; (b) измерение [АКГ] в биологическом образце; и (с) идентификацию пациента как имеющего более высокую вероятность чувствительности к лечению ARRY-520 при низкой [АКГ] в биологическом образце.
Некоторые варианты реализации изобретения предлагают способ применения ARRY-520 для лечения пациента, который был диагностирован с уровнем [АКГ] менее, чем около 1,1 г/л, включающий введение одной или более стандартных доз ARRY-520.
Некоторые варианты реализации изобретения предлагают способ применения ARRY-520 для лечения пациента, который был диагностирован с уровнем [АКГ] менее, чем около 1,1 г/л, включающий введение одной или более стандартных доз ARRY-520 указанному пациенту в количестве, эффективном для достижения уровня несвязанного ARRY-520, не меньшего, чем IC50, рассчитанная по результатам тестирования in vitro. В дополнительном варианте реализации изобретения IC50, рассчитанная по результатам тестирования in vitro, составляет около 0,2 нг/мл. В дополнительном варианте реализации изобретения IC50, рассчитанная по результатам тестирования in vitro, составляет 0,2 нг/мл.
Некоторые варианты реализации изобретения предлагают способ лечения рака у пациента, имеющего низкую [АКГ], включающий введение пациенту эффективного количества ARRY-520.
Некоторые варианты реализации изобретения предлагают способ лечения рака у млекопитающего, имеющего низкую [АКГ], включающий введение терапевтически эффективного количества ARRY-520 млекопитающему.
Некоторые варианты реализации изобретения предлагают способ лечения заболевания или нарушения, модулированного БВК, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества ARRY-520, если млекопитающее имеет низкую [АКГ].
Другой вариант реализации изобретения предлагает применение ARRY-520 в производстве лекарственного средства, предназначенного для лечения рака у пациента, имеющего низкий уровень АКГ.
Один из вариантов реализации изобретения предлагает фармацевтическую композицию, содержащую ARRY-520, для лечения больного раком, имеющего низкую [АКГ]. Еще один вариант предлагает фармацевтическую композицию, содержащую ARRY-520 вместе с фармацевтически приемлемым носителем или наполнителем для лечения больного раком, имеющего низкую [АКГ]. В некоторых вариантах реализации изобретения фармацевтически приемлемый наполнитель представляет собой манитол.
Также предлагаются способы лечения заболевания или состояния путем введения ARRY-520. В одном из вариантов реализации изобретения пациент - человек с низкой [АКГ] - получает лечение ARRY-520 в комплексе с фармацевтически приемлемым носителем, адъювантом или наполнителем в количестве, достоверно ингибирующем активность БВК.
В другом варианте реализации изобретения предлагается способ лечения или профилактики рака у млекопитающего, нуждающегося в таком лечении, включающий введение указанному млекопитающему терапевтически эффективного количества ARRY-520.
В некоторых вариантах реализации изобретения рак выбирается среди рака молочной железы, рака яичника, рака шейки матки, рака предстательной железы, рака семенников, рака мочеполовой системы, рака пищевода, рака гортани, глиобластомы, нейробластомы, рака желудка, рака кожи, кератоакантомы, рака легких, плоскоклеточного рака, крупноклеточной карциномы, немелкоклеточного рака легкого, мелкоклеточного рака, аденокарциномы легкого, рака костного мозга, рака толстой кишки, аденомы, рака поджелудочной железы, аденокарциномы, рака щитовидной железы, фолликулярной карциномы, недифференцированной карциномы, папиллярной карциномы, семиномы, меланомы, саркомы, карциномы мочевого пузыря, рака печени и желчных протоков, рака почки, миелоидных нарушений, лимфоидных нарушений, рака ворсистых клеток, рака ротовой полости и глотки (орального рака), рака губ, рака языка, рака рта, рака глотки, рака тонкого кишечника, рака ободочной и прямой кишки, рака толстой кишки, рака прямой кишки, рака мозга и центральной нервной системы, болезни Ходжкина и лейкоза.
В некоторых вариантах реализации изобретения рак представляет собой гемобластоз. В некоторых вариантах реализации изобретения рак выбирается среди лимфомы, лейкоза и множественной миеломы. В некоторых вариантах реализации изобретения рак выбирается среди лейкоза и множественной миеломы. В некоторых вариантах реализации изобретения рак выбирается среди острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах реализации изобретения предлагается назначение препарата при множественной миеломе. В некоторых вариантах предлагается назначение препарата при остром миелоидном лейкозе.
В некоторых вариантах реализации изобретения рак представляет собой солидную опухоль. В других вариантах реализации изобретения рак выбирается среди рака кожи, рака молочной железы, рака головного мозга, цервикальной карциномы и рака яичка. В других вариантах реализации изобретения рак выбирается среди рака молочной железы, колоректального рака, немелкоклеточного рака легкого, рака поджелудочной железы, рака мочевого пузыря, рака слюнных желез (аденокистозного), рака пищевода, мезотелиомы и смешанного мелкоклеточного рака легкого/немелкоклеточного рака легкого.
Комбинированная терапия
Соединения, стереоизомеры и фармацевтически приемлемые соли, описанные в настоящем документе, могут применяться для лечения отдельно или в сочетании с другими терапевтическими агентами. Соединения, описанные в настоящем документе, могут применяться в комбинации с одним или более дополнительных препаратов, например, анти-гиперпролиферативным (или противораковым) агентом, который воздействует на другой целевой белок. Второе соединение с комбинированной фармацевтической формулой или режимом дозирования чаще имеет взаимодополняющую активность по отношению к соединению, описанному в этом документе, таким образом, что составные части второго соединения не оказывают отрицательного воздействия друг на друга. Такие молекулы присутствуют в надлежащей комбинации в количествах, которые эффективны для использования по назначению. Соединения могут вводиться вместе в единой фармацевтической композиции или по отдельности. Введение по отдельности может происходить одновременно или последовательно в любом порядке. Временные интервалы при последовательном введении могут быть краткими или длительными.
В некоторых вариантах реализации изобретения G-CSF вводят в комбинации с ARRY-520.
В некоторых вариантах реализации изобретения дексаметазон вводят в комбинации с ARRY-520. В некоторых вариантах реализации изобретения G-CSF вводят в комбинации с ARRY-520 и дексаметазоном.
В некоторых вариантах реализации изобретения бортезомиб вводят в комбинации с ARRY-520. В некоторых вариантах реализации изобретения G-CSF вводят в комбинации с ARRY-520 и бортезомибом.
В некоторых вариантах реализации изобретения карфилзомиб вводят в комбинации с ARRY-520. В некоторых вариантах реализации изобретения G-CSF вводят в комбинации с ARRY-520 и карфилзомибом.
В некоторых вариантах реализации изобретения помалидомид вводят в комбинации с ARRY-520. В некоторых вариантах осуществления G-CSF вводят в комбинации с ARRY-520 и помалидомидом.
Примеры
Следующие примеры приведены в ознакомительных целях. Следует понимать, что они не ограничивают изобретение и предназначены только для предложения способа практического применения изобретения.
В описанных ниже примерах, если не указано иное, все температурные значения приведены в градусах Цельсия. Реактивы были приобретены у коммерческих поставщиков и использовались без дополнительной очистки, если не указано иное.
Пример 1
Методология связывания ARRY-520 TRANSIL®
Методология связывания TRANSIL® (www.admecell.com) - Анализ буферов: фосфатно-солевой буфер («ФСБ»), рН 7,4 (Gibco 10010) и диметилсульфоксид («ДМСО»). Планшеты: заказ от ADMEcell (Аламеда, Калифорния). AGP - сплошной планшет: ТВР-0211-0096; AGP - полосковый планшет: ТВР-0211-1196; HSA - сплошной планшет: ТВР-0210-0096; HSA - полосковый планшет: ТВР-0210-1196. Стоп-раствор: 100% ацетонитрил с добавлениями внутреннего стандарта (конечная концентрация - 0,4 мкмоль).
Разведение лекарственного средства: Разведение образцов лекарственного средства для достижения конечной концентрации лекарственного средства 2 мкмоль (1% ДМСО) (используется 360 мкл конечного разбавленного лекарственного средства на тестирование белка, m.e. 720 мкл на АКГ и ЧСА). Вносили лекарственное средство в маточного раствора (10 ммоль) в ДМСО. Разводили маточный раствор (10 ммоль) до 200 мкм (0,2 ммоль) (путем добавления 4 мкл маточного раствора (10 ммоль) в 196 мкл ДМСО). Разводили 200 мкм маточного раствора до 20 мкм (путем добавления 100 мкл 200 мкм раствора ДМСО в 900 мкл ФСБ, рН 7,4).
Размораживали аналитический набор при комнатной температуре (приблизительно 3 часа) или в холодильнике при 4°C в течение ночи. Планшеты помещали в инкубатор, СО2 (5%) на 30 минут перед добавлением соединения. Предварительно разбавляли соединения (10-кратная концентрация для анализа) (см. Разведение лекарственного средства выше). Разведенный лекарственный раствор нагревали на водяной бане при 37°C перед дозированием соединения. Внимание! Тщательно проводите предварительное разведение для любого осадка и обеспечивайте достаточную растворимость буфера и стабильность вашего тестового образца. Раствор тестового образца (45 мкл) добавляли в пробирки/лунки готового набора и инкубировали в течение 2 минут. Смешивали десять раз, ресуспендируя крупинки. Ресуспендировали приблизительно половину общего объема флакона (общий объем 450 мкл). Орбитальные шейкеры не использовали. Флаконы помещали в поворотно-откидную центрифугу на 10 минут при 750 г. 100 мкл осторожно переносили в 96-луночный планшет. Ацетонитрил (50 мкл) добавляли в лабеталол в качестве внутреннего стандарта (конечная концентрация 0,4 мкмоль). Планшеты герметизировали для анализа. Концентрацию надосадочной жидкости количественно оценивали с помощью жидкостной хроматография с масс-спектрометрией (ЖХ/МС) (API4000). Смотрите также: Brown, KarinD. supra. Результат в таблице 1 оценивался с помощью программного обеспечения ACD/pKaDB. Расчеты:
Пример 2
Трехдневный анализ выживаемости клеток (NCIH929 ММ)
Анализ пролиферации клеток синего титра: эффект АКГ на цитотоксическую активность ARRY-520 в ММ линиях.
Реактивы: RPMI-8226, Н929, RPMI1640 среда, 10% ФСБ, GlutaMAX
Набор: Анализ жизнеспособности клеток синего титра, PromegaCorp. (Медисон Висконсин), № G 8081 по каталогу
Состав:
Маточный раствор (10 ммоль) ARRY-520 в ДМСО.
250 мг АКГ из человеческой плазмы закуплено у Sigma-AldrichCo. LLC (St. Louis, МО) № G 9885 по каталогу.
Добавляли 6,2 мл ФСБ→40 мг/мл маточный раствор.
Хранили при 4°C.
Процедура:
Разведение ARRY-520 в 96-луночном планшете с V-образным дном:
Помещали 10 мкл ДМСО в лунки В2-В11.
Добавляли 10 мкл 100 мкмоль ARRY-520 в лунку В2 и перемешивали пипетированием вверх-вниз.
С новым наконечником пипетки, переносили 10 мкл из лунки В2 в лунку B3 и перемешивали пипетированием вверх-вниз.
Повторяли процедуру до В10, затем отбраковывали 10 мкл из В10.
Лунка B11 являлась контрольной лункой ДМСО.
Лунки В2-В10 теперь имеют 10 мкл 1:2 кратных серийных разведений ARRY-520 (50 мкмоль к 200 нмоль).
Добавляли 190 мкл среды роста в каждую лунку (1:20 разведение, 5% ДМСО)
Планшет накрывали крышкой и перемещали в сторону.
Готовили растворы АКГ:
30 мг/мл: 150 мкл 40 мг/мл +50 мкл ФСБ
20 мг/мл: 100 мкл 40 мг/мл +100 мкл ФСБ
10 мг/мл: 100 мкл 40 мг/мл +300 мкл ФСБ
5 мг/мл: 100 мкл 10 мг/мл +100 мкл ФСБ
Подсчитывали клетки ММ.
Помещали 1,2×106 клеток в 8 мл питательной среды и осторожно перемешивали для создания клеточной суспензии (143 клеток/мкл).
Добавляли 10 мкл (1/10 объема) разведенного соединения (см. выше) к двум 96-луночным планшетам для тканевых культур (с черными стенками и прозрачным дном) (Sigma-Aldrich, № CLS 3904 по каталогу), как показано ниже. Убеждались, что на дне каждого планшета содержится 10 мкл вещества.
Размещали 10 мкл разведения ARRY-520 из лунок В2-В11 планше