Способ детекции специфического вещества в молоке
Иллюстрации
Показать всеГруппа изобретений относится к ветеринарии и касается иммунохроматографического способа детекции специфического вещества, содержащегося в молоке, который включает этап обработки молока литическим ферментом или поверхностно-активным веществом; этап приведения в контакт молока с тест-полоской, содержащей первую часть, содержащую меченое первое антитело, вторую часть, располагаемую ниже первой части, на которой иммобилизовано второе антитело, и третью часть, располагаемую выше первой части или второй части и содержащую пустоты, обеспечивающие удаление шариков молочного жира; этап протекания молока через третью часть для удаления части шариков молочного жира из молока; и этап протекания молока во вторую часть или последующую расположенную ниже часть с получением детектируемого сигнала метки во второй части или последующей расположенной ниже части. Группа изобретений также касается иммунохроматографического устройства для детекции специфического вещества, содержащегося в молоке; набора для детекции специфического вещества, содержащегося в молоке. Группа изобретений обеспечивает возможность производить определение специфического вещества на молочных фермах без необходимости использования дополнительного устройства, удаляющего шарики молочного жира. 3 н. и 11 з.п. ф-лы, 7 пр., 7 ил., 8 табл.
Реферат
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к иммунохроматографическому способу и иммунохроматографическому устройству для детекции вещества в молоке с использованием взаимодействия антиген-антитело.
Предшествующий уровень техники
[0002] Молоко домашнего скота, характерными примерами которого являются корова, овца и коза, не является стерильным и может быть загрязнено определенными микроорганизмами вследствие заболеваний или факторов окружающей среды. В частности, известно, что животные с заболеванием, вызываемым инфекцией микроорганизмом, как правило, выделяют много микроорганизмов в молоко. Характерные заболевания домашнего скота, вызываемые инфекцией микроорганизмом, включают мастит.
[0003] Мастит представляет собой воспаление системы млечных сосудов или ткани молочной железы и вызывается преимущественно инвазией, эцезисом и размножением микроорганизмов в вымени. Несмотря на то, что многие виды животных заражаются маститом, считают, что главным образом касательно мастита коров у молочных коров от 15 до 40% всех молочных коров заражены маститом, и, таким образом, он является одним из чрезвычайно важных заболеваний для владельцев молочных ферм. Если молочная корова заражается маститом, ингибируется не только функция синтеза молока, что приводит к уменьшению количества выделенного молока или даже прекращению лактации соответственно, а также к значительным экономическим потерям, таким как стоимость медицинского лечения, и на владельцев молочных ферм налагаются штрафные санкции, касающиеся стоимости молока. Кроме того, также увеличивается количество работы владельцев молочных ферм, т.к., например, доение сосков, инфицированных маститом, необходимо проводить отдельно для предотвращения инфекции.
[0004] Мастит вызывает инфекция различными микроорганизмами, но антибиотики, для которых продемонстрирована эффективность против мастита, могут различаться в зависимости от типа вызывающего заболевание микроорганизма, и определенные типы микроорганизмов обладают различными характеристиками, например, по отношению к передаче другим соскам или индивидуумам, или отличается и постинфекционная обработка. Таким образом, крайне важно быстро и подходящим способом идентифицировать вызывающий заболевание микроорганизм, присутствующий в молоке.
[0005] В качестве способов идентификации микроорганизма, вызывающего инфекционное заболевание, существуют известный способ идентификации на основе культивирования, способ идентификации на основе генов и способ идентификации на основе взаимодействия антиген-антитело. Хотя в настоящее время основная направление способа идентификации микроорганизма, вызывающего мастит домашнего скота, сводится к способу идентификации на основе культивирования, его проведение является затруднительным, и, кроме того, для него существует проблема, заключающаяся в необходимости нескольких суток для получения результатов. Также был опубликован способ идентификации на основе детекции конкретного гена способом амплификации гена (способом ПЦР) (непатентный документ 1). Несмотря на то, что этим способом можно получать результаты приблизительно за одни сутки, для него все еще существует проблема необходимости специальных приборов и манипуляций. В последние годы был разработан прибор для детекции Staphylococcus aureus, который представляет собой один из микроорганизмов, вызывающих мастит, или Escherichia coli поверхностно плазмонным резонансом (SPR) на основе взаимодействия антиген-антитело (непатентный документ 2). Для этого прибора получают антитело против антигена, специфического для каждой бактерии, и это антитело фиксируют на чипе SPR и используют. Хотя этот способ обеспечивает быструю детекцию специфического вызывающего заболевание микроорганизма, для него необходим специальный прибор, и, таким образом, проведение измерении этим способом на практических мазках молока и т.д. вызывает затруднение.
[0006] Широко используются простые устройства измерения, которые обеспечивают быстрое и удобное измерение биообразцов, таких как кровь и моча, дома или в клинике с использованием иммунохроматографии (иммунохроматографического устройства) (например, см. патентный документ 1). В способе, проводимом в таких устройствах, используют тест-полоску, содержащую индикаторную бумагу, содержащую первое антитело, специфическое к целевому веществу измерения (антиген) и меченное окрашенными частицами, такими как коллоидное золото, и пористую мембрану, на которой иммобилизовано второе антитело для захвата целевого вещества измерения, где индикаторная бумага и пористая мембрана соединены вместе. Если тестируемый образец, содержащий целевое вещество измерения, капают на полоску, то целевое вещество измерения связывается с антителом, меченным окрашенными частицами, и/или антителом, иммобилизованным на пористой мембране, что приводит к визуально отличимой линии или т.п. на мембране. Таким образом, подтверждая наличие или отсутствие такой линии или т.п., можно детектировать наличие или отсутствие вещества, подлежащего измерению.
[0007] Хотя в патентном документе 1 указано, что указанный выше способ кроме крови (цельной крови), можно применять к плазме, сыворотке, моче, слюне, мокроте, поту и т.д., в нем не указано применение указанного выше способа к молоку домашнего скота, и в нем также абсолютно не указаны и не обозначены трудности, возникающие в момент такого применения. Кроме того, несмотря на то, что способы применения иммунохроматографического способа к биообразцам, таким как кровь (цельная кровь), в качестве тестируемого образца также описаны в патентных документах 2-4, в этих патентных документах также не указано и не обозначено применение иммунохроматографического способа к молоку домашнего скота.
[0008] Для простого устройства измерения, которое обеспечивает быстрое и удобное измерение, для молока домашнего скота в качестве тестируемого образца иммунохроматографическим способом на практических мазках молока в патентном документе 5 предложен способ применения иммунохроматографического способа для молока в качестве тестируемого образца с целью проверки на микроорганизмы, вызывающие мастит домашнего скота. В этом патентном документе указано, что шарики молочного жира и казеин, содержащиеся в молоке, ингибируют детекцию иммунохроматографическим способом, и предпочтительно их предварительно удалять перед проведением теста. Хотя в этом патентном документе описан способ удаления шариков молочного жира и казеина отстаиванием молока, снятием слоя сливок и проведением обработки поверхностно-активным веществом, в не указано удаление шариков молочного жира с использованием фильтра.
[0009] Кроме того, хотя в патентных документах 2-4 не указаны техники удаления загрязнителей с использованием физического фильтра или мембраны, обладающей химической аффинностью, для применения в иммунохроматографическом способе, способы, описанные в этих ссылках, представляют собой способы, в которых применяют иммунохроматографический способ к биообразцам, таким как цельная кровь, как описано выше, и они не являются способами, в которых его применяют к молоку домашнего скота. В патентных документах 1-4 также не указаны и не обозначены трудности, возникающие в момент применения иммунохроматографического способа к молоку домашнего скота, и совершенно не указаны какие-либо средства решения этих трудностей.
Ссылки на известный уровень техники
Патентные документы
[0010] Патентный документ 1: нерассмотренная патентная публикация Японии (KOKAI) № 1-244370.
Патентный документ 2: нерассмотренная патентная публикация Японии (KOHYO) № 2003-512624.
Патентный документ 3: нерассмотренная патентная публикация Японии (KOHYO) № 11-505327.
Патентный документ 4: нерассмотренная патентная публикация Японии (KOKAI) № 2002-214236.
Патентный документ 5: международная патентная публикация WO02/075310.
Непатентные документы
[0011] Непатентный документ 1: J. Dairy. Sci., 84:74-83.
Непатентный документ 2: JRA Advanced Livestock Management System Utilization Report (Heisei 18 to 20 fiscal years), pp.58-65.
Сущность изобретения
Цель изобретения
[0012] Целью настоящего изобретения является предоставление иммунохроматографического способа и иммунохроматографического устройства для детекции вещества в молоке домашнего скота с использованием взаимодействия антиген-антитело.
Средства достижения цели
[0013] Автор настоящего изобретения анализировал идентификацию микроорганизмов, вызывающих мастит, на основании взаимодействия антиген-антитело с использованием иммунохроматографического устройства. Однако когда автор настоящего изобретения анализировал возможность фактической детекции микроорганизма иммунохроматографическим способом с использованием молока в качестве образца, было выявлено, что взаимодействие антиген-антитело не может проходить на тест-полоске иммунохроматографического устройства. Автор настоящего изобретения исследовал причину неровного прохождения взаимодействия антиген-антитело на тест-полоске, и в результате пришел к выводу, что причина указанного выше явления может заключаться в забивании тест-полоски, связанной с пористой мембраной в иммунохроматографическом устройстве, большим числом шариков молочного жира, содержащегося в молоке, что приводит к недостаточному потоку проявляющего раствора. В иммунохроматографических устройствах, как правило, используют тест-полоску с диаметром пор от нескольких десятков до нескольких сотен нм для переноса проявляющим раствором и для получения подходящей скорости взаимодействия антиген-антитело. Молоко непосредственно после дойки содержит большое количество шариков молочного жира с диаметром приблизительно от 1 до десяти и нескольких микрометров (хотя в поставляемом на рынке молоке диаметр частиц шариков молочного жира или т.п. получают равным 1 мкм или меньше посредством гомогенизирующей обработки шариков молочного жира в свежем молоке, молоко, не подвергнутое гомогенизирующей обработке, содержит шарики молочного жира с размерами частиц в широком диапазоне), и считалось, что распределение размера частиц шариков молочного жира является значительно шире, чем распределение размера эритроцитов, и, таким образом, они вызывают забивание мембраны, что делает измерение затруднительным.
[0014] Автор настоящего изобретения проводил различные исследования для достижения указанной выше цели и в результате выявил, что измерение специфического вещества, содержащегося в молоке, иммунохроматографическим способом можно было обеспечивать посредством улавливания части шариков молочного жира, содержащегося в молоке, обработкой с разделением по размеру на верхней стороне тест-полоски, используемой в иммунохроматографическом способе, и осуществил настоящее изобретение.
Таким образом, настоящее изобретение является таким, как указано ниже.
[0015] [1] Иммунохроматографический способ детекции специфического вещества в молоке, который включает:
(1) этап приведения в контакт молока с тест-полоской, содержащей первую часть, содержащую меченое первое антитело, направленное на специфическое вещество, или содержащей специфическое вещество, которое является меченым, вторую часть, расположенную ниже первой части, на которой иммобилизовано второе антитело, направленное на специфическое вещество, и третью часть, расположенную выше первой части или второй части и содержащую пустоты, обеспечивающие удаление шариков молочного жира, содержащегося в молоке, в третьей части или последующей расположенной выше части, и
(2) этап протекания молока до второй части или последующей расположенной ниже части для обеспечения детектируемого сигнала метки во второй части или последующей расположенной ниже части.
[0016] [2] Способ по [1], где иммунохроматографический способ представляет собой способ типа бокового потока.
[3] Способ по [1] или [2], где меченое первое антитело, направленное на специфическое вещество, находится в первой части.
[4] Способ по любому из [1]-[3], где специфическое вещество представляет собой компонент бактерии или вещество, секретируемое бактерией.
[5] Способ по любому из [1]-[4], где по меньшей мере одно или оба из первого антитела и второго антитела представляют собой моноклональные антитела.
[0017] [6] Способ по [5], где первое антитело и второе антитело представляют собой моноклональные антитела.
[0018] [7] Способ по любому из [1]-[6], где размер удерживаемых частиц пустот третьей части составляет от 1 до 3,5 мкм.
[8] Способ по любому из [1]-[7], где третья часть состоит из двух или более видов элементов, содержащих пустоты, которые могут удалять шарики молочного жира различных размеров частиц.
[9] Способ по [8], где третья часть состоит из первого элемента, расположенного ниже, и второго элемента, расположенного выше, и размер удерживаемых частиц второго элемента больше, чем размер удерживаемых частиц первого элемента.
[10] Способ по [9], где размер удерживаемых частиц первого элемента составляет от 1,0 до 2,0 мкм, и размер удерживаемых частиц второго элемента составляет от 3,0 до 3,5 мкм.
[0019] [11] Способ по любому из [1]-[10], который включает этап протекание молока, подвергнутого обработке литическим ферментом, во второй части или последующей расположенной ниже части.
[12] Способ по [11], где литический фермент представляет собой аутолизин.
[13] Способ по [11], где стафилококк, содержащийся в молоке, детектируют с использованием лизостафина в качестве литического фермента.
[14] Способ диагностики, является ли микроорганизм, вызывающий мастит домашнего скота, стафилококком или не является им, который включает: этап получения молока, содержащего вызывающий заболевание микроорганизм, от домашнего скота, страдающего маститом, этап перемешивания литического фермента в молоке, таким образом, чтобы специфическое вещество, существующее в клетках вызывающего заболевание микроорганизма, высвобождалось из клеток, и этап определения наличия или отсутствия специфического вещества или измерения имеющегося в наличии количества специфического вещества иммунологическим способом с использованием антитела, направленного на специфическое вещество, в качестве антигена.
[15] Способ по [14], где диагностику, является ли вызывающий заболевание микроорганизм стафилококком или не является, проводят с использованием лизостафина в качестве литического фермента.
[16] Иммунохроматографическое устройство для детекции специфического вещества, содержащегося в молоке, которое содержит тест-полоску, содержащую первую часть, содержащую меченое первое антитело, направленное на специфическое вещество, или содержащую специфическое вещество, которое является меченым, вторую часть, которая располагается ниже первой части, на котором иммобилизовано второе антитело, направленное на специфическое вещество, и третью часть, располагающуюся выше первой части или второй части, и содержащую пустоты, обеспечивающие удаление шариков молочного жира, содержащегося в молоке.
[17] Иммунохроматографическое устройство по [16], где первая часть или вторая часть содержит литический фермент или поверхностно-активное вещество.
[18] Набор для детекции, состоящий из добавочного раствора, содержащий литический фермент или поверхностно-активное вещество, и иммунохроматографического устройства по [16].
Эффект изобретения
[0020] По настоящему изобретению наличие или отсутствие специфического вещества в молоке можно быстро и подходящим способом детектировать на месте. В частности, когда желательно диагностировать мастит у коровы, если используют визуально распознаваемую метку, детекции можно проводить на молочных фермах без использования какого-либо прибора и т.д., и обработка для удаления слоя сливок также не является необходимой. Таким образом, можно быстро идентифицировать вызывающий заболевание микроорганизм до дальнейшего ухудшения состояния заболевания и на ранней стадии можно определять правильные лечебные тактики, такие как выбор подходящих антибиотиков, и меры для профилактики распространения инфекции.
Краткое описание чертежей
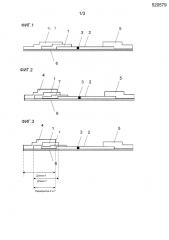
[0021] [Фиг. 1] на фиг. 1 представлен схематический разрез тест-полоски иммунохроматографического устройства, используемого в примере 1, которая содержит 1 элемент, пропитанный меченым антителом, (первая часть), 2 мембранный носитель для хроматографического проявления (вторая часть), 3 часть для захвата, 4 элемент для добавления образца, 5 элемент для абсорбции, 6 субстрат и 7 элемент для удаления шариков жира (третья часть).
[Фиг. 2] на фиг. 2 представлен схематический разрез другого примера тест-полоски иммунохроматографического устройства.
[Фиг. 3] на фиг. 3 представлен схематический разрез дополнительного другого примера тест-полоски иммунохроматографического устройства.
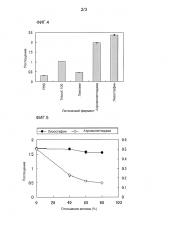
[Фиг. 4] на фиг. 4 представлена эффект, чувствительность детекции, в результате применения аутолизина.
[Фиг. 5] на фиг. 5 представлены результаты измерения Staphylococcus aureus, добавляемого в коровье молоко, на основе ELISA с использованием ахромопептидазы и лизостафина.
[Фиг. 6] на фиг. 6 представлен схематический разрез тест-полоски иммунохроматографического устройства, используемой в примере 6, которая содержит 1 элемент, пропитанный меченым антителом, (первая часть), 2 мембранный носитель для хроматографического проявления (вторая часть), 3 часть для захвата, 4 элемент для добавления образца, 6 элемент для абсорбции и 6 субстрат.
[Фиг. 7] на фиг. 7 представлены результаты детекции Staphylococcus aureus, содержащегося в молоке, иммунохроматографическим способом с использованием лизостафина в качестве литического фермента.
Способы осуществления изобретения
[0022] Далее настоящее изобретение будет более подробно описано.
Иммунохроматографическое устройство по настоящему изобретению представляет собой устройство для детекции специфического вещества, содержащегося в молоке, иммунохроматографическим способом, которое содержит тест-полоску, содержащую первую часть, содержащую меченое первое антитело, направленное на специфическое вещество, или специфическое вещество, которое является меченым, вторую часть, располагающуюся после первой части, на которой иммобилизовано второе антитело, направленное на специфическое вещество, и третью часть, располагающуюся выше первой части или второй части и содержащую пустоты, обеспечивающие удаление шариков молочного жира в молоке. Конкретные примеры структуры тест-полоски включают примеры тест-полосок, схематические разрезы которых представлены на фиг. 1, 2 и 3. На фиг. 1 элемент 4 для добавления образца и элемент 7 для удаления шариков жира (третья часть) совместно располагаются выше элемента 1, пропитанного меченым антителом, (первой части). На фиг. 2, элемент 7 для удаления шариков жира (третья часть) располагается ниже элемента 1, пропитанного меченым антителом, (первой части) и выше мембранного носителя 2 для хроматографического проявления (второй части). На фиг. 3 элемент 7 для удаления шариков жира (третья часть) располагается ниже элемента 4 для добавления образца и выше элемента 1, пропитанного меченым антителом, (первой части).
[0023] Иммунохроматографическое устройство можно получать известным способом с использованием коммерческих материалов.
[0024] Материал, используемый для первой части, конкретно не ограничен при условии, что выбирают материал, обеспечивающий иммунохроматографию, но предпочтительные примеры включают волокнистую матрицу производного целлюлозы и т.д., фильтровальную бумагу, стекловолокно, ткань, хлопок и т.д.
[0025] Материал, используемый для второй части, конкретно не ограничен при условии, что выбирают материал, обеспечивающий иммунохроматографию, но предпочтительные примеры включают нитрат целлюлозы, смешанный сложный эфир нитрата целлюлозы, поливинилиденфторид, нейлон и т.д.
[0026] Материал, используемый для третьей части, предпочтительно содержит пустоты, которые обеспечивают удаление шариков молочного жира, содержащегося в молоке, и имеют диаметр приблизительно от 1 до десяти и нескольких микрометров. Третья часть должна располагаться выше указанной выше второй части, состоящий из пористой мембраны с диаметром пор от нескольких десятков до нескольких сотен нм, и предпочтительно располагается выше указанной выше первой части, т.е. в положении, при котором образец раствора сначала контактирует с ней и проходит через тест-полоску.
[0027] Поры третьей части могут иметь размер, который обеспечивает удаление шариков молочного жира, и размер удерживаемых частиц предпочтительно составляет от 0,1 до 10 мкм, более предпочтительно от 1 до 3,5 мкм. Материал является конкретно не ограниченным при условии, что выбирают материал, содержащий пустоты с размером удерживаемых частиц в указанном выше диапазоне, но предпочтительные примеры включают матрицу волокон, таких как производное целлюлозы, фильтровальная бумага, стекловолокно, ткань, хлопок и т.д. Размер удерживаемых частиц означает такой размер частиц шариков молочного жира, что шарики молочного жира с размером частиц не меньше размера удерживаемых частиц не могут проходить через пустоты и удерживаются третьей частью, и по существу соответствует среднему размеру пор пустот третьей части, и 50% или более, предпочтительно 60% или более, более предпочтительно 70% или более, еще более предпочтительно 80% или более, особенно предпочтительно 90% или более, наиболее предпочтительно 98% или более, шариков молочного жира с размером частиц не меньше, чем размер удерживаемых частиц не могут проходить через пустоты и удерживаются третьей частью. Отношение шариков молочного жира, которые необходимо удерживать, можно измерять способом, хорошо известным специалистам в данной области. Например, описано, что размер удерживаемых частиц GF/B, предоставляемого GE Healthcare Bioscience, составляет 1,0 мкм в их каталоге (удержание частиц), и такой размер частиц, как указано выше, можно подтверждать способом, хорошо известным специалистам в данной области.
[0028] Указанная выше третья часть может состоять из одного типа материала с конкретным размером удерживаемых частиц или может состоять из слоистого пластика, содержащего материалы с различными размерами удерживаемых частиц и склеенными вместе, таким образом, чтобы размер удерживаемых частиц постепенно становился меньше для повышения эффективности отделения шариков молочного жира. Такая третья часть, как указано выше, состоящая из двух или более типов элементов, которые могут удалять шарики молочного жира различных размеров частиц, представляет собой предпочтительный вариант осуществления настоящего изобретения, и в более предпочтительном варианте осуществления настоящего изобретения третья часть состоит из первого элемента, расположенного ниже, и второго элемента, расположенным выше, и размер удерживаемых частиц второго элемента является больше, чем размер удерживаемых частиц первого элемента. Когда третья часть состоит из двух типов элементов, предпочтительно, чтобы размер удерживаемых частиц первого элемента, расположенного ниже, составлял от 1,0 до 2,0 мкм, и размер удерживаемых частиц второго элемента, расположенного выше, составлял от 3,0 до 3,5 мкм. Для детекции с высокой чувствительностью специфического вещества в молоке, содержащем шарики молочного жира в высокой концентрации и с широким диапазоном распределения размера частиц, предпочтительно такое молоко, неразбавленное после дойки, предпочтительно, чтобы третья часть состояла из комбинации элемента с небольшим размером удерживаемых частиц и элемента с большим размером удерживаемых частиц.
[0029] Указанная выше первая часть содержит меченое первое антитело, направленное на специфическое вещество, или меченое специфическое вещество. Если первая часть содержит меченое первое антитело, направленное на специфическое вещество, специфическое вещество можно детектировать способом сэндвич-анализа. Кроме того, если первая часть содержат меченое специфическое вещество, специфическое вещество можно детектировать конкурентным способом. Вследствие того, что способ сэндвич-анализа обладает высокой чувствительностью детекции и в качестве положительного результата дает линию, указывающую на детекцию антитела, он является более предпочтительным для настоящего изобретения, и, таким образом, предпочтительно первая часть содержит меченое первое антитело, направленное на специфическое вещество.
[0030] Когда первая часть выполнена с возможностью содержания меченого первого антитела, направленного на специфическое вещество, два типа антител, первое антитело, направленное на специфическое вещество, и второе антитело, направленное на специфическое вещество. Для обеспечения возможности детекции специфического вещества способом сэндвич-анализа, указанное выше первое антитело и второе антитело представляют собой антитела, которые могут одновременно связываться со специфическим веществом, и предпочтительно, чтобы эпитоп специфического вещества, подлежащий распознаванию указанным выше первым антителом, отличался от эпитопа специфического вещества, подлежащего распознаванию указанным выше вторым антителом.
[0031] В настоящем изобретении для получения детектируемого сигнала первое антитело или специфическое вещество, содержащееся в первой части, метят. Примеры метки, используемой для настоящего изобретения, включают окрашенную частицу, фермент, радиоактивный изотоп и т.д., и предпочтительно использовать окрашенную частицу, которую можно визуально детектировать без какого-либо специального оборудования. Примеры окрашенной частицы включают металлические микрочастицы, такие как микрочастицы золота и платины, неметаллические частицы, латексные частицы и т.д., но не ограничены ими. Окрашенная частица может иметь любой размер при условии, что окрашенная частица имеет такой размер, что она может быть перемещена в нижнюю часть внутри пустот тест-полоски, но предпочтительно размер диаметра составляет от 1 нм до 10 мкм, более предпочтительно от 5 нм до 1 мкм, еще более предпочтительно от 10 до 100 нм.
[0032] Специфическое вещество, измеряемое настоящим изобретением, может представлять собой любое вещество при условии, что оно представляет собой вещество, которое можно измерять иммунохроматографическим способом, но предпочтительно оно представляет собой компонент бактерии или вещество, которое секретирует бактерия. Более предпочтительно специфическое вещество представляет собой рибосомный белок L7/L12 бактерии. Для рибосомного белка L7/L12 можно получать высокую чувствительность детекции, т.к. он присутствует в клетках в большом числе копий. Кроме того, как продемонстрировано в примерах, указанных ниже, антитело, с использованием которого можно отличать конкретную бактерию как причину маститу, от других бактерий на уровне вида или рода, можно фактически получать известным способом. Тип бактерии не является конкретно ограниченным, и он может представлять собой грамположительную бактерию или грамотрицательную бактерию. Примеры включают, например, грамположительные бактерии, такие как стафилококки (бактерии, принадлежащие к роду Staphylococcus), предпочтительно Staphylococcus aureus и т.д., Escherichia coli, бактерии, принадлежащие к роду Klebsiella и т.д., но не ограничены ими.
[0033] Указанное выше антитело можно получать способом, описанным в международной патентной публикации WO00/06603. Когда бактериальный рибосомный белок L7/L12 является антигеном, антитело можно получать с использованием полноразмерного белка или неполного пептида бактериального рибосомного белка L7/L12 в качестве антигена, но предпочтительно получать с использованием в качестве антигена полноразмерного белка. Антисыворотку, содержащую антитело (поликлональное антитело), которое распознает рибосомный белок L7/L12, можно получать инокуляцией такого неполного пептида или полноразмерного белка, как указано выше, в его обычном виде или сшитым с белком-носителем, животному совместно с адъювантом при необходимости и сбором сыворотки у животного. Кроме того, из антисыворотки также можно выделять антитело и использовать. Примеры животного, используемого для инокуляции, включают овцу, лошадь, козу, кролика, мышь, крысу и т.д., и особенно предпочтительными для получения поликлональных антител являются овца, кролик и т.д. Кроме того, более предпочтительно использовать в качестве антитела моноклональное антитело, получаемое известным способом, в котором получают гибридомную клетку, и в таком случае в качество животного предпочтительной является мышь. Если моноклональное антитело, которое взаимодействует с рибосомным белком L7/L12 конкретной бактерии, которая вызывает мастит, но не взаимодействует с рибосомным белком L7/L12 бактерии, которая вызывает мастит, отличной от указанной выше конкретной бактерии, находят скринингом, моноклональное антитело само по себе можно использовать для диагностики, страдает ли животное инфекцией бактерией или не страдает.
[0034] Антитело, которое распознает вещество, отличное от рибосомного белка L7/L12, в качестве антигена, также можно использовать при условии, что антитело представляет собой моноклональное антитело, которое взаимодействует с компонентом конкретной бактерии, которая вызывает мастит, или веществом, секретируемым такой бактерией, но не взаимодействует с компонентом бактерии, которая вызывает мастит, отличной от указанной выше бактерии, или веществом, секретируемым такой бактерией.
[0035] Кроме того, в качестве моноклонального антитела предпочтительно использовать моноклональное антитело, взаимодействие антиген-антитело которого не ингибируется какими-либо загрязнителями, отличными от специфического вещества, содержащегося в молоке. Например, молоко содержит большое количество белков, таких как казеин, и они могут ингибировать взаимодействие специфического вещества и моноклонального антитела. В качестве моноклонального антитела, направленного на специфическое вещество, получаемого общепринятым способом можно предпочтительно выбирать и использовать, например, моноклональное антитело, взаимодействие антиген-антитело которого не ингибируется казеином или т.п., или моноклональное антитело, на взаимодействие антиген-антитело которого незначительно влияет казеин, или т.п. Такое моноклональное антитело можно легко получать путем получения моноклональных антител, которые специфически взаимодействуют с антигеном, общепринятым способом, а затем выбирать моноклональное антитело, взаимодействие антиген-антитело которого по существу не ингибируется загрязнителем, таким как казеин, анализируя, ингибируются или не ингибируется взаимодействие антиген-антитело в присутствии загрязнителя.
[0036] В настоящем изобретении в качестве иммунохроматографического устройства можно использовать описанную выше тест-полоску как она есть, или тест-полоску можно хранить в футляре, составляющем иммунохроматографическое устройство. В первом случае, если в качестве образца используют большой объем молока, иммунохроматографическое устройство предпочтительно использовать путем непосредственного погружения одного конца тест-полоски в образец, содержащийся в контейнере. В последнем случае, если объем молока в качестве образца, является небольшим, иммунохроматографическое устройство предпочтительно использовать путем измерения предопределенного объема образца пипеткой или т.п. и помещением капли образца на тест-полоску. В последнем случае, футляр может иметь любую форму при условии, что можно хранить тест-полоску. Футляр может быть выполнен из любого материала, и предпочтительные примеры включают полипропилен, поликарбонат и т.д.
[0037] Иммунохроматографическое устройство по настоящему изобретению также можно предоставлять в виде набора, содержащего контейнер, такой как микропробирка, и добавочный раствор, например, добавочный раствор, содержащий литический фермент или поверхностно-активное вещество для лизиса бактерии с выделением рибосомного белка L7/L12 в раствор.
[0038] Иммунохроматографический способ по настоящему изобретению представляет собой иммунохроматографический способ детекции специфического вещества, содержащегося в молоке, который включает:
(1) этап приведения в контакт молока с тест-полоской, содержащей первую часть, содержащую меченое первое антитело, направленное на специфическое вещество, или содержащей специфическое вещество, которое является меченым, вторую часть, располагаемую ниже первой части, на которой иммобилизовано второе антитело, направленное на специфическое вещество, и третью часть, располагаемую выше первой части и второй части и содержащую пустоты, обеспечивающие удаление шариков молочного жира, содержащегося в молоке, в третьей части или последующей расположенной выше части, и
(2) этап прохождения молока во вторую часть или дополнительную расположенную ниже часть с получением детектируемого сигнала метки во второй части или дополнительной расположенной ниже части.
[0039] Молоко приводят в контакт с указанной выше третьей частью или элементом для добавления образца, располагающимся в еще более высоком положении, само по себе или в виде смешанного раствора, содержащего добавочный раствор. Когда указанное выше специфическое вещество представляет собой вещество, присутствующее в клетках бактерии, бактерию можно лизировать непосредственным добавлением ингредиента поверхностно-активного вещества в молоко или указанного выше добавочного раствора, или обеспечивая удерживание ингредиента поверхностно-активного вещества в части, располагаемой выше указанной выше второй части, предпочтительно части, располагаемой выше указанной выше первой части (касательно лизирующий обработки клетки поверхностно-активным веществом см. нерассмотренную патентную публикацию Японии (KOKAI) № 61-111464). Эти техники можно соответствующим образом комбинировать. В качестве другого компонента добавочного раствора можно использовать подходящий буфер (например, MOPSO и т.д.), хотя компонент не является конкретно ограниченным при условии, что выбирают компонент, который не ингибирует взаимодействие антиген-антитело.
[0040] В качестве другого варианта осуществления путем непосредственного добавления литического фермента в молоко или его добавления в добавочный раствор, или иммобилизации литического фермента выше указанной выше второй части, предпочтительно выше указанной выше первой части, молоко, подвергаемое обработке литическим ферментом, при которой специфическое вещество, содержащееся в клетках, выходит из клеток, можно доставлять во вторую часть или последующую расположенную ниже часть, и таким образом, специфическое вещество, присутствующее в клетках бактерии, можно детектировать на высоком уровне чувствительности. Эти техники можно соответствующим образом комбинировать. В предпочтительном варианте осуществления литический фермент можно непосредственно добавлять в молоко, или он может содержаться в указанном выше добавочном растворе, и в особенно предпочтительном варианте осуществления указанный выше добавочный раствор, содержащий литический фермент, можно добавлять в молоко.
[0041] Тип литического фермента конкретно не ограничен, и также можно использовать два или более типов произвольно выбранных литических ферментов в комбинации. Вследствие того, что часто встречаются инфекции Escherichia coli, бактерий, принадлежащих роду Klebsiella, и Staphylococcus aureus, в качестве бактерий, являющихся этиологическим фактором мастита, также предпочтительно использовать один или несколько типов литических ферментов, которые могут проявлять бактериолитическое действие в отношении этих микроорганизмов в комбинации. Например, можно использовать один или два или более типа литических ферментов, выбранных из лизоцима, лизостафина, пепсина, глюкозидазы, галактозидазы, ахромопептидазы, β-N-ацетилглюкозаминидазы и т.д. Например, был предложен способ использования лизоцима и литического средства для клеточной мембраны в качестве литического фермента (нерассмотренная патентная публикация Японии (KOKAI) № 63-167799).
[0042] В качестве лизирующего фермента многие из аутолизинов обладают высоким литическим эффектом, и такие аутолизины