Амиды акриловой и метакриловой кислот с n-алкилпиперазино-пиперидинами и способ их получения
Иллюстрации
Показать всеИзобретение относится к новым амидам акриловой и метакриловой кислот с N-алкилпиперазинопиперидинами формулы (I)
,
где R1=Н или СН3; R2 представляет собой линейную или разветвленную С1-С4 алкильную группу, и способу их получения. Соединения формулы I, содержащие легко полимеризуемую (мет)акрилоильную группу и две ионогенные группы, могут использоваться в качестве мономеров для получения полиэлектролитов, обладающих повышенной обменной емкостью. 2 н. и 6 з.п. ф-лы, 1 табл., 20 пр.
Реферат
Изобретение относится к органической химии и химии высокомолекулярных соединений, конкретно к новым N-алкилпиперазинопиперидиламидам акриловой и метакриловой кислот общей формулы I
,
где
R1 представляет собой Н или СН3;
R2 представляет собой линейную или разветвленную С1-С4 алкильную группу, и к способу их получения.
Заявляемые соединения наиболее успешно могут быть использованы в химической промышленности в качестве мономеров для получения полиэлектролитов.
Полиэлектролитами называются полимеры, макромолекулы которых содержат ионогенные группы. В зависимости от их природы полиэлектролиты могут быть кислотами, основаниями, солями, амфолитами. Полиэлектролиты широко используются как ионообменные смолы, поверхностно-активные вещества, структурообразователи и загустители [Dobrynin А. V., Rubinstein М. Theory of polyelectrolytes in solutions and at surfaces. Prog. Polym. Sci., 2005, Vol. 30, pp. 1049-1118; Химический энциклопедический словарь / Под ред. И.Л. Кнунянца. М.: Советская энциклопедия, 1983].
В качестве исходных соединений для получения полиэлектролитов используют мономеры, содержащие соответствующие ионогенные группы. Заявляемые соединения содержат две основные ионогенные группы, в качестве которых выступают третичные аминогруппы, и получаемые из них полиэлектролиты могут обладать повышенной обменной емкостью.
Заявляемые соединения, представляющие собой 4-(N-алкилпиперазино)пиперидиламиды акриловой и метакриловой кислот, их свойства и способы получения в литературе не описаны.
Известен близкий по структуре к соединениям формулы I акриламид 1-1-(4-метилпиперазин-1-ил)проп-2-ен-1-он (CAS Number: 50658-92-9) [Fong D.W. Dimethyl sulfate quarternary ammonium salt of 1-acryloyl-4-methylpiperazine. US 4659828 A, 1987].
Соединение 1 коммерчески доступно (Suzhou Rovathin Foreign Trade Co., Ltd., China, Order Number: W18791) и может быть использовано в качестве мономера для синтеза полиэлектролитов [Balasubramanian S., Dharani М. Piperazinium polyelectrolytes useful as flocculants for industrial wastewater treatment. IN pat. Appl. №2012CH00585 А]. Однако оно содержит только одну третичную аминогруппу, и, следовательно, полученные из него полиэлектролиты мало отличаются по обменной емкости от других полиэлектролитов, содержащих только одну ионогенную группу на одно звено цепи.
Известен еще один структурный аналог заявляемых соединений - 1-[4-(пиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-он (2) (CAS Number: 1276110-71-4).
Способ получения соединения 2 не описан, оно упомянуто как возможный ингибитор PI3-киназы [Niu D., Petter R.C., Singh J., Kluge A.F., Mazdiyasni H., Zhu Z., Qiao L., Kuntz К. PI3 kinase inhibitors and uses thereof. WO 2011031896 А2]. Других данных о применении соединения 2, например в качестве мономера для синтеза полимеров, в литературе не имеется. Соединение 2 содержит вторичную аминогруппу наряду с третичной аминогруппой. Наличие вторичной аминогруппы, способной легко вступать в характерные для аминов реакции, затрудняет использование соединения 2 в качестве мономера для синтеза полиэлектролитов.
Соединения формулы I представляют собой амиды акриловой и метакриловой кислот с 4-(N-алкилпиперазино)пиперидинами.
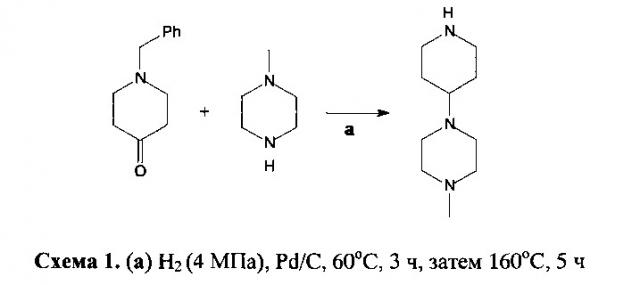
Известен способ получения 4-(N-метилпиперазино)пиперидина восстановительным аминированием N-бензил-4-пиперидона 1-метил пиперазином с последующим дебензилированием (схема 1) [Nakamura R., Ito М. Method for producing piperidine compound. JP pat. Appl. №2008050307 A]:
В качестве восстанавливающего и деблокирующего агента используют водород в присутствии палладиевого катализатора. Недостатками способа являются необходимость использования высокого давления и повышенных температур, применение специального оборудования и дорогого катализатора.
Известны способы получения N-замещенных амидов акриловой и метакриловой кислот, в которых используют реакции аминов с хлорангидридом или ангидридом соответствующей кислоты либо с соответствующей кислотой под действием конденсирующих агентов [Elles J. Some polyacrylamides. Chimie Moderne, 1959, Vol. 4, No. 26, pp. 53-57; Nogami H., Anzai R. Method for manufacture of N-substituted (meth)acrylamide. JP pat. Appl. №2010248097; Davydova N.K., Sinitsyna O.V., Yaminsky I.V., Kalinina E.V., Zinoviev K.E. Synthesis and Study of New Copolymers Capable of Forming Molecular Complexes with DNA. Macromolecular Symposia, 2012, Vol. 321/322, No. 1, pp. 84-89].
Задачей настоящего изобретения является создание новых соединений, содержащих несколько ионогенных групп и легко полимеризуемую группу, которые могут использоваться в качестве мономеров для синтеза полиэлектролитов повышенной обменной емкости, и разработка способа их получения.
Поставленная задача решается соединениями общей формулы I,
,
где
R1 представляет собой Н или СН3;
R2 представляет собой линейную или разветвленную С1-С4 алкильную группу, которые применимы в качестве мономеров для синтеза полиэлектролитов, и способом получения соединений формулы I, включающим: (а) восстановительное аминирование трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты N-алкилпиперазином под действием триацетоксиборгидрида натрия; (b) удаление трет-бутоксикарбонильной (Boc) защитной группы полученного трет-бутилового эфира 4-(N-алкилпиперазино)пиперидин-1-карбоновой кислоты в кислой среде и (с) ацилирование образовавшего 4-(N-алкилпиперазино)пиперидина с получением целевого продукта формулы I, причем ацилирование 4-(N-алкилпиперазино)пиперидина на стадии (с) осуществляют либо акриловой или метакриловой кислотой в присутствии конденсирующего агента и основания, либо хлорангидридом акриловой или метакриловой кислоты в присутствии основания, либо ангидридом акриловой или метакриловой кислоты в присутствии основания.
Указанным способом был получен ряд соединений формулы I (примеры 1-18). Заявляемые соединения формулы I содержат легко полимеризуемую (мет)акрилоильную группу и две ионогенные группы. Показано, что они могут использоваться в качестве мономеров для получения полиэлектролитов (примеры 19, 20).
Важнейшей количественной характеристикой полиэлектролитов является обменная емкость, которая в первую очередь определяется числом ионогенных групп, приходящихся на единицу массы полиэлектролита.
Заявляемые соединения представляют собой N-алкилпиперазинопиперидиламиды акриловой и метакриловой кислот, которые содержат две третичные аминогруппы, являющиеся ионогенными. Это позволяет получать из соединений формулы I полиэлектролиты с повышенным содержанием ионогенных групп, приходящихся как на звено полимера, так и на единицу его массы, по сравнению с полиэлектролитами, получаемыми из аналога формулы 1.
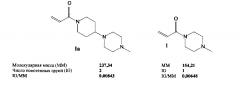
Например, расчетное содержание ионогенных групп, приходящихся на единицу массы, в 1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-оне (Ia) в 1,3 раза больше, чем в 1-(4-метилпиперазин-1-ил)проп-2-ен-1-оне (1).
Возможность получения полиэлектролитов с повышенной обменной емкостью, содержащих две ионогенные группы на одно звено полимера, является существенным преимуществом новых мономеров формулы I, которое связано с наличием двух третичных аминогрупп в их составе.
Соединения формулы I получают заявляемым способом в мягких условиях из коммерчески доступных реагентов.
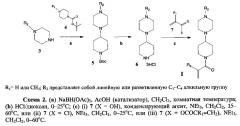
Общая схема получения соединений формулы I заявляемым способом приводится ниже (схема 2). Используемый далее термин «комнатная температура» обозначает температуру 15-25°С.
В заявляемом способе для получения 4-(N-алкилпиперазино)пиперидинов 6 по реакции восстановительного аминирования (стадия а) в качестве восстановителя используют триацетоксиборгидрид натрия в присутствии каталитических количеств уксусной кислоты [Abdel-Magid A.F., Carson K.G., Harris B.D., Maryanoff C.A., Shah R.D. Reductive Animation of Aldehydes and Ketones with Sodium Triacetoxyborohydride. Studies on Direct and Indirect Reductive Animation Procedures. J. Org. Chem., 1996, Vol. 61, pp. 3849-3862]. В качестве карбонильного субстрата используют коммерчески доступный трет-бутиловый эфир 4-оксопиперидин-1-карбоновой кислоты (N-трет-бутоксикарбонил-4-пиперидон) с легко удаляемой защитной Вос-группой. Для снятия защитной Вос-группы (стадия b), осуществляемого в кислой среде в апротонном растворителе, можно использовать раствор хлористого водорода в диоксане или раствор трифторуксусной кислоты в хлористом метилене.
Предлагаемый способ получения заявляемых соединений формулы I заключается в том, что
(a) N-алкилпиперазин 3 подвергают взаимодействию с трет-бутиловым эфиром 4-оксопиперидин-1-карбоновой кислоты (4) в присутствии триацетоксиборгидрида натрия и каталитических количеств уксусной кислоты в хлористом метилене при комнатной температуре и получают трет-бутиловый эфир 4-(N-алкилпиперазино)пиперидин-1-карбоновой кислоты 5;
(b) удаляют защитную трет-бутоксикарбонильную группу соединения 5 в кислой среде в апротонном растворителе, например обработкой раствором хлористого водорода в диоксане, при температуре 0-25°С;
(c) из образовавшегося 4-(N-алкилпиперазино)пиперидина 6 получают целевые амиды формулы I либо
- конденсацией соединения 6 с акриловой или метакриловой кислотой в присутствии конденсирующего агента, например тетрафторбората O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) или его гексафторфосфата (HBTU), и основания, например триэтиламина, при температуре 15-60°С, либо
- взаимодействием соединения 6 с хлорангидридом акриловой или метакриловой кислоты в присутствии основания, например триэтиламина, при температуре 0-25°С, либо
- взаимодействием соединения 6 с ангидридом акриловой или метакриловой кислоты в присутствии основания, например триэтиламина, при температуре 0-60°С.
Таким образом, предлагаемый способ получения заявляемых амидов достаточно прост в исполнении и основан на использовании доступных реагентов.
Техническим результатом изобретения являются новые 4-(N-алкилпиперазино)пиперидиламиды акриловой и метакриловой кислот, содержащие две ионогенные группы, которые применимы в качестве мономеров для синтеза полиэлектролитов, обладающих повышенной обменной емкостью, и способ их получения.
Заявляемое изобретение иллюстрируется примерами 1-20, приведенными ниже.
Необходимые для проведения реакций 1-Boc-4-пиперидон (Alfa Aesar), N-алкилпиперазины, хлористый метилен (Panreac), персульфат аммония (Merck), триэтиламин (Aldrich), конденсирующие агенты TBTU и HBTU, N,N,N',N'-тетраметилэтилендиамин (Sigma), диоксан (Aldrich), тетрагидрофуран (Aldrich), насыщенный раствор HCl в диоксане, триацетоксиборгидрид натрия (Alfa Aesar), акриловая (Fluka) и метакриловая (Acros) кислоты, а также хлорангидриды и ангидриды этих кислот являются коммерчески доступными веществами. Кроме хлористого метилена, можно использовать и другие апротонные растворители.
Спектры ЯМР-1Н были зарегистрированы на спектрометрах Avance-300 и Avance-600 фирмы Bruker с использованием тетраметилсилана в качестве внешнего стандарта.
Пример 1
Получение 1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-она (Ia)
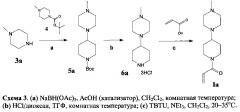
1-[4-(4-Метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-он (Ia) получают заявляемым способом в соответствии со схемой 3.
(а) К раствору 13,2 г (50 ммоль) N-метилпиперазина (3а) в 250 мл хлористого метилена добавляют 10 г (50 ммоль) 1-Boc-4-пиперидона (4) и перемешивают 1 ч при комнатной температуре. Затем добавляют 18,83 г (70 ммоль) триацетоксиборгидрида натрия и 200 мкл уксусной кислоты, перемешивают 3 ч при комнатной температуре и оставляют на ночь. После завершения реакции смесь разбавляют 200 мл хлористого метилена и промывают 200 мл 40%-ного водного раствора карбоната натрия. Органическую фракцию отделяют и упаривают в вакууме трет-Бутиловый эфир 4-(N-метилпиперазино)пиперидин-1-карбоновой кислоты (5а) выделяют методом колоночной хроматографии на силикагеле в градиентной системе хлористый метилен/этанол (10:1-5:1) с выходом 4,93 г (34,8%). Спектр ЯМР-1Н (ДМСО-d6), δ, м.д.: 1,26 (CCH2, 2Н, м); 1,77 (CCH2, 2Н, м); 1,42 [С(CH3)3, 9Н, с]; 2,18 (NCH3, 3Н, с); 2,35-2,50 (NCH2, 8Н, широкий сигнал); 2,72 (O=CNCH2, цис к С=O, 2Н, м); 3,30 (CCH, 1Н, под сигналом H2O от ДМСО-d6); 3,98 (O=CNCH2, транс к С=O, 2Н, д).
(b) К раствору 13,0 г (45,8 ммоль) трет-бутилового эфира 4-(N-метилпиперазино)пиперидин-1-карбоновой кислоты (5а) в 150 мл безводного тетрагидрофурана добавляют 90 мл 14%-ного насыщенного раствора HCl в диоксане, перемешивают при комнатной температуре 30 мин и оставляют на ночь. Выпавший осадок тригидрохлорида 4-(N-метилпиперазино)пиперидина (6а) отфильтровывают, промывают тетрагидрофураном (100 мл) и гексаном (3×100 мл). Выход 13,12 г (97,8%).
(c) К суспензии 4,10 г (14 ммоль) тригидрохлорида 4-(N-метилпиперазино)пиперидина (6а) в 250 мл хлористого метилена добавляют 17,28 мл (120 ммоль) триэтиламина и перемешивают при комнатной температуре до полного растворения осадка. К полученному раствору добавляют 1,08 г (15 ммоль) акриловой кислоты и небольшими порциями 6,74 г (21 ммоль) тетрафторбората 0-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU). Реакционную смесь перемешивают 1 ч при температуре не выше 35°С, оставляют на ночь, затем промывают насыщенным раствором Na2CO3 (250 мл). Отделяют органическую фракцию и упаривают в вакууме. 1-[4-(4-Метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-он (Ia) выделяют методом колоночной хроматографии на силикагеле в системе хлористый метилен/этанол (10:1) в присутствии аммиака. Выход 1,53 г (46%). Спектр ЯМР-1Н (ДМСО-d6), δ, м.д.: 1,27 (CCH2, 2Н, м); 1,81 (CCH2, 2Н, м); 2,23 (NCH3, 3Н, с); 2,35-2,50 (NCH2, 8Н, широкий сигнал); 2,66 (O=CNCH2, цис к С=O, 2Н, м); 4,09 (0=CNCH2, транс к С=O, 1Н, д); 4,44 (O=CNCH2, транс к С=O, 1H, д); 3,06 (ССН, 1Н, м); 5,68 (CH2=СН, Jцис=10,95 Гц, Jгем=2,4 Гц, 1Н, дд); 6,11 (CH2=СН, Jтранс=15,5 Гц, Jгем=2,4 Гц, 1Н, дд); 6,83 (СН2=CH, Jтранс=15,5 Гц, Jцис=10,95 Гц, 1H, дд).
Пример 2
Получение 1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-она (Ia)
Стадии а и b осуществляют так же, как описано в примере 1.
(с) К суспензии 0,293 г (1,0 ммоль) полученного на стадии (b) тригидрохлорида 4-(N-метилпиперазино)пиперидина (6а) в 25 мл безводного хлористого метилена добавляют 1,44 мл (10,0 ммоль) триэтиламина. Перемешивают при комнатной температуре до полного растворения осадка, охлаждают до 0-5°С и добавляют при интенсивном перемешивании небольшими порциями раствор 0,091 г (1,0 ммоль) хлорангидрида акриловой кислоты в 5 мл безводного хлористого метилена. Реакционную смесь перемешивают 30 мин, промывают насыщенным водным раствором Na2CO3 (30 мл), а затем водой (30 мл). Отделяют органическую фракцию и упаривают в вакууме. Целевой продукт Ia выделяют методом колоночной хроматографии на силикагеле, элюент - хлористый метилен/этанол/аммиак (10:1:0,1), с выходом 0,093 г (39%). Спектр ЯМР-1Н Ia в ДМСО-d6 аналогичен спектру ЯМР-1Н, приведенному в примере 1.
Пример 3
Получение 1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-она (Ia)
Стадии а и b осуществляют так же, как описано в примере 1.
(с) К суспензии 0,293 г (1,0 ммоль) тригидрохлорида 4-(N-метилпиперазино)пиперидина (6а) в 25 мл безводного хлористого метилена добавляют 1,44 мл (10,0 ммоль) триэтиламина. Перемешивают при комнатной температуре до полного растворения осадка, добавляют небольшими порциями 0,26 г (1,0 ммоль) ангидрида акриловой кислоты при интенсивном перемешивании. Реакционную смесь перемешивают 1 ч при 40°С, промывают насыщенным водным раствором Na2CO3 (25 мл), а затем водой (25 мл). Отделяют органическую фракцию и упаривают в вакууме. Целевой продукт Ia выделяют методом колоночной хроматографии на силикагеле, элюент - хлористый метилен/этанол/аммиак (10:1:0,1), с выходом 0,097 г (41%). Спектр ЯМР-1Н Ia в ДМСО-d6 аналогичен спектру ЯМР-1Н, приведенному в примере 1.
Получение других соединений формулы I (Ib-Ip) заявляемым способом (примеры 4-18) осуществляют аналогично примерам 1-3. Некоторые характеристики заявляемых соединений Ib-Ip приведены в таблице.
Пример 19
Получение поли{1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-она} (IIa)
1-[4-(4-Метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-он (Ia, 119 мг, 0,5 ммоль) растворяют в 5 мл воды. Полученный раствор 1 дегазируют в вакууме водоструйного насоса в течение 30 мин, затем через раствор 1 пропускают аргон в течение 15 мин. К раствору персульфата аммония (2,9 мг, 0,0125 ммоль) в 2 мл воды добавляют N,N,N',N'-тетраметилэтилендиамин (2 мкл, 0,05 ммоль). Полученный раствор 2 дегазируют в вакууме водоструйного насоса в течение 10 мин, затем пропускают аргон в течение 5 мин. Раствор 2 добавляют к раствору 1. Реакционную массу перемешивают 2 ч при 37°С и 12 ч при комнатной температуре. Проводят диализ против дистиллированной воды в течение 4 дней. Полимерный раствор лиофилизуют, получают поли{1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-он} (IIa). Выход 68 мг (57%). Спектр ЯМР-1Н (D2O), δ, м.д: 1,14; 1,94 (-СН2- полимерной цепи, широкий сигнал); 2,15 (ССН2, -СН- полимерной цепи, широкий сигнал); 2,23 (NCH3, широкий сигнал); 2,30-2,80 (NCH2, широкий сигнал); 3,0 (ССН, широкий сигнал); 3,90; 4,40 (O=CNCH2, широкий сигнал).
Структурный фрагмент гомополимера Па показан ниже.
Пример 20
Получение сополимера 1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-она с акриламидом (IIb)
Акриламид (56,9 мг, 0,8 ммоль) и 1-[4-(4-метилпиперазин-1-ил)пиперидин-1-ил]проп-2-ен-1-он (Ia, 47,4 мг, 0,2 ммоль) растворяют в 5 мл воды. Полученный раствор 1 дегазируют в вакууме водоструйного насоса в течение 30 мин, затем через раствор 1 пропускают аргон в течение 15 мин. К раствору персульфата аммония (5,8 мг, 0,025 ммоль) в 2 мл воды добавляют N,N,N',N'-тетраметилэтилендиамин (4 мкл, 0,1 ммоль). Полученный раствор 2 дегазируют в вакууме водоструйного насоса в течение 10 мин, затем пропускают аргон в течение 5 мин. Раствор 2 добавляют к раствору 1. Реакционную массу перемешивают 2 ч при 37°С и 12 ч при комнатной температуре. Проводят диализ против дистиллированной воды в течение 4 дней. Полимерный раствор лиофилизуют, получают сополимер IIb. Выход 24 мг. Спектр ЯМР-1Н (D2O), δ, м.д: 0,85-1,74 (-СН2- полимерной цепи m+n, широкий сигнал); 1,80-2,25 (ССН2, -СН-полимерной цепи, NCH3, широкий сигнал); 2,35; 2,56 (NCH2, широкий сигнал); 2,95 (ССН, широкий сигнал); 3,85; 4,35 (O=CNCH2, широкий сигнал).
Исходя из общей интенсивности сигналов в спектре, равной (3Н)m+(26Н)n, соотношение компонентов акриламида и Ia в сополимере составляет 0,87:0,13.
Структурные фрагменты сополимера IIb приведены ниже.
1. Соединения общей формулы I
,
где
R1 представляет собой H или CH3;
R2 представляет собой линейную или разветвленную C1-C4 алкильную группу.
2. Соединения по п. 1 в качестве мономеров для синтеза полиэлектролитов.
3. Способ получения соединений по п. 1, включающий (a) восстановительное аминирование трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты N-алкилпиперазином в присутствии триацетоксиборгидрида натрия; (b) удаление защитной Boc-группы полученного трет-бутилового эфира 4-(N-алкилпиперазино)пиперидин-1-карбоновой кислоты в кислой среде и (c) ацилирование 4-(N-алкилпиперазино)пиперидина с образованием целевого продукта формулы I.
4. Способ по п. 3, отличающийся тем, что ацилирование 4-(N-алкилпиперазино)пиперидина осуществляют акриловой или метакриловой кислотой в присутствии конденсирующего агента и основания.
5. Способ по п. 3, отличающийся тем, что ацилирование 4-(N-алкилпиперазино)пиперидина осуществляют хлорангидридом акриловой или метакриловой кислоты в присутствии основания.
6. Способ по п. 3, отличающийся тем, что ацилирование 4-(N-алкилпиперазино)пиперидина осуществляют ангидридом акриловой или метакриловой кислоты в присутствии основания.
7. Способ по п. 3, отличающийся тем, что восстановительное аминирование трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты N-алкилпиперазином проводят при комнатной температуре в хлористом метилене в присутствии каталитического количества уксусной кислоты.
8. Способ по п.3, отличающийся тем, что удаление защитной Boc-группы трет-бутилового эфира 4-(N-алкилпиперазино)пиперидин-1-карбоновой кислоты проводят раствором хлористого водорода в диоксане.