О-замещенные 3-пиридилкетоксимы, обладающие фунгицидной активностью
Иллюстрации
Показать всеИзобретение относится к O-замещенным 3-пиридилкетоксимам общей формулы I,
где R1 означает 4-бромфенил, 4-хлорфенил, 4-фторфенил или циклогексил, R2 означает гексил, циклогексил или бензил, обладающие фунгицидной активностью. Технический результат – расширение арсенала средств, обладающих фунгицидной активностью. 3 табл., 4 пр.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к O-замещенным 3-пиридилкетоксимам общей формулы I, где R1 означает 4-бромфенил, 4-хлорфенил, 4-фторфенил или циклогексил, R2 означает гексил, циклогексил или бензил, обладающие фунгицидной активностью.
Замещенные 3-пиридилкетоксимы общей формулы I могут найти применение для борьбы с вредоносными грибами в медицине, ветеринарии, сельском хозяйстве, приусадебном хозяйстве.
Известен пирифенокс (II), обладающий фунгицидной активностью [Пестициды и регуляторы роста растений / Н.Н. Мельников, К.В. Новожилов, С.Р. Белан. - М.: Химия, 1995. - 576 с.].
Наиболее близки по структуре к соединениям формулы I O-эфиры оксимов общей формулы III, где R1 означает C1-C6-алкил, C3-C6-циклоалкил, C1-C6-алкокси и др., m означает число от 1 до 4, R3 и R4 независимо друг от друга означают атом водорода, C1-C6-алкил и др., R5 означает атом водорода, и др., R6 означает атом водорода, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C1-C6-алкокси, атом галогена и др., n означает число от 1 до 4 [Пат. JP 6589967, 2001].
Однако соединения структур II и III имеют не всегда удовлетворительные физико-химические характеристики, узкий спектр действия и показывают фунгицидную активность только в отношении отдельных классов грибов. Кроме того, к фунгицидам у грибов часто развивается устойчивость.
Техническая задача, решаемая настоящим изобретением, состоит в расширении ассортимента фунгицидов для более эффективной борьбы с вредоносными грибами.
Поставленная задача решается получением O-замещенных 3-пиридилкетоксимов общей формулы I, обладающих фунгицидной активностью.
O-Замещенные 3-пиридилкетоксимы общей формулы I могут быть получены алкилированием 3-пиридилкетоксимов общей формулы IV, где R1 имеет те же значения, что и в формуле I, галогенидом общей формулы R2X, где R2 имеет те же значения, что и в формуле I, X означает атом галогена, например в присутствии гидрида натрия или в условиях межфазного катализа:
Аналогичные реакции описаны в литературе [E. Buehler. Alkylation of syn- and anti-benzaldoximes // Journ. Am. Chem. Soc., 1967, V. 32, pp. 261-265].
Соединения общей формулы IV могут быть получены известным способом взаимодействием пиридилкетонов общей формулы V, где R1 имеет те же значения, что и в формуле I, с гидроксиламином:
Аналогичные реакции описаны в литературе [F. Trusell, Н. Diehl. Phenyl-2-pyridilketoxime, a reagent in strong alkalies for iron // Journ. Analit. Chem., 1959, V. 31, No. 12, pp. 1978-1980].
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. К раствору 1,31 г (5 ммоль) 3-пиридил-4-бромфенилкетона в 5 мл этанола прибавляют 0,686 г (9,87 ммоль) гидрохлорида гидроксиламина, растворенного в 1 мл воды. Смесь нагревают на водяной бане в течение 1 ч, охлаждают до комнатной температуры, добавляют раствор 0,399 г (9,97 ммоль) гидроксида натрия в 1 мл воды. Через раствор пропускают углекислый газ, доведя его значение pH до примерно 7. Выпавший осадок отфильтровывают, нагревают с 5 мл этанола до кипения, прибавляют 5 мл тетрагидрофурана, охлаждают до комнатной температуры и вновь отфильтровывают. Органический экстракт упаривают досуха, остаток перекриталлизовывают из этанола. Получают 0,63 г (46,1%) 3-пиридил-4-бромфенилкетоксима. Тпл. 159-161°C.
Пример 2. К раствору 0,554 г (2 ммоль) 3-пиридил-4-бромфенилкетоксима и 2,889 г карбоната калия в 26 мл воды прибавляют раствор 0,3 г (2,375 ммоль) бензилхлорида и 0,23 г (0,1 ммоль) триэтилбензилхлорида в 4,2 мл бензола. Двухфазную систему интенсивно перемешивают при кипении в течение 4 ч. Смесь охлаждают до комнатной температуры, органический слой отделяют, растворитель отгоняют. Остаток разделяют на колонке с силикагелем 35/70, элюент толуол-ацетон 5:1. Получают 0,083 г (11,3%) O-бензилового эфира 3-пиридил-4-бромфенилкетоксима (масло).
Пример 3. К раствору 0,204 г (1,0 ммоль) 3-пиридилциклогексилкетоксима в 3,6 мл диметилформамида при охлаждении в бане со льдом и солью прибавляют 0,048 г (1,2 ммоль) 60%-ного гидрида натрия. Смесь пемешивают в течение 30 мин, добавляют 0,198 г (1,2 ммоль) 1-бромгексана 0,68 г (3,8 ммоль) и перемешивают в течение 2 ч при комнатной температуре, после чего реакционную массу выливают в ледяную воду. Органическую фазу экстрагируют диэтиловым эфиром, органический слой промывают водой, сушат над сульфатом натрия, растворитель отгоняют. Остаток разделяют на колонке с силикагелем 35/70, элюент толуол-ацетон 5:1. Получают 0,169 г (58,7%) O-гексилового эфира 3-пиридилциклогексилкетоксима (масло).
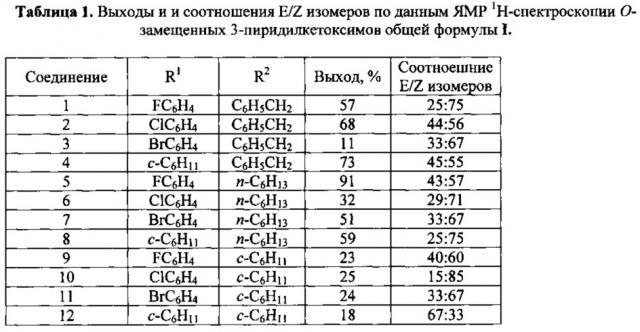
Выходы и соотношения E/Z-изомеров соединений формулы I приведены в табл. 1.
ЯМР 1H-спектры соединений I зарегистрированы на приборе Bruker AM300 в DMSO-d6 и приведены в табл. 2.
Пример 4. Испытания на фунгицидную активность соединений проводили in vitro на грибах Venturia inaequalis (V.i.), Rhizoctonia solani (R.S.), Fuzarium oxysporum (F.o.), Sclerotinia sclerotiorum (S.s.), Helminthosporium sativum (H.s.), Fuzarium moniliforme (F.m.) при концентрации активного компонента 30 мг/л. В качестве питательной среды использовали сахарозно-картофельный агар. Инокулированные среды выдерживали в термостате при 25°C в течение 3 сут. Активность соединений определяли как процент подавления роста мицелия гриба по отношению к контролю. В качестве эталона использовали коммерческий фунгицид триадимефон. Фунгицидная активность O-замещенных 3-пиридилкетоксимов общей формулы I приведена в табл. 3.
О-Замещенные 3-пиридилкетоксимы общей формулы I, где R1 означает 4-бромфенил, 4-хлорфенил, 4-фторфенил или циклогексил, R2 означает гексил, циклогексил или бензил, обладающие фунгицидной активностью.