Металл-саленовое комплексное соединение, локальный анестетик и антибластомное лекарственное средство
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к применению мази, получаемой путем смешения намагничивающегося металл-саленового комплексного соединения с основой в качестве антибластомного лекарственного средства. Масляная основа смешана с намагничивающим металл-саленовым комплексным соединением в количестве, эффективном для доставки, и где температура мази достигает по меньшей мере 39°С или более после наложения АС магнитного поля на мазь при условиях 400 кГц в течение 300 секунд и более. Осуществление изобретения позволяет получить металл-саленовое комплексное соединение, которое проявляет превосходную неинвазивность и может быть эффективно перенесено в пораженную область. 10 табл., 9 пр., 18 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к металл-саленовому комплексному соединению и к металл-саленовому комплексному соединению, которое является намагничивающимся и может быть использовано в составах мазей, локальному анестетику, содержащему металл-саленовое комплексное соединение, и антибластомному лекарственному средству, содержащему это металл-саленовое комплексное соединение.
Предпосылки создания изобретения
Обычно, когда лекарственное средство вводят в живой организм, оно проникает в пораженную область и оказывает свои фармакологические воздействия на эту пораженную область, таким образом оказывая свои терапевтические воздействия. С другой стороны, даже если лекарственное средство достигает ткани, другой, чем пораженная область (то есть, нормальная ткань), оно не должно быть терапевтическим. Следовательно, важным является то, каким образом направлять лекарственное средство к пораженной области.
Способ направления лекарственного средства к пораженной области называют доставкой лекарственного средства к участку действия, которая была недавно активно изучена и разработана. Эта доставка лекарственного средства к участку действия имеет, по меньшей мере, два преимущества. Одним преимуществом является то, что в ткани пораженной области может быть достигнута достаточно высокая концентрация лекарственного средства. Фармакологические воздействия не могут быть видны, если концентрация лекарственного средства в пораженной области не имеет постоянного значения или более. Достаточные терапевтические воздействия не могут быть ожидаемыми, если концентрация лекарственного средства является низкой. Вторым преимуществом является то, что лекарственное средство направляется только к ткани пораженной области и, следовательно, могут быть ингибированы побочные реакции в нормальной ткани.
Такая доставка лекарственного средства к участку действия является наиболее эффективной для лечения рака противоопухолевыми агентами. Наибольшее количество противоопухолевых агентов ингибирует клеточный рост раковых клеток, которые активно делятся, так что противоопухолевые агенты также ингибируют клеточный рост даже в случае нормальной ткани, в которой клетки активно делятся, такой, как костный мозг, корни волос или слизистая оболочка пищеварительного канала. Следовательно, пациенты с раковым заболеванием, которым вводят противоопухолевые агенты, страдают от побочных реакций, таких, как анемия, потеря волос и рвота. Так как такие побочные реакции оказывают тяжелые нагрузки на пациентов, доза должна быть ограничена, таким образом, вызывая проблему неспособности к достижению в достаточной степени фармакологических воздействий противоопухолевых агентов.
Алкильные антибластомные лекарственные средства среди таких противоопухолевых агентов (антибластомные лекарственные средства) представляют собой общий термин для противоопухолевых агентов, обладающих способностью комбинирования алкильной группы (-СН2-СН2-), например, с полинуклеотидным белком, и проявляют эффекты алкилирования ДНК и ингибирования репликации ДНК, вызывая гибель клетки. Эти эффекты действуют, невзирая на клеточные циклы, также оказывается действие на клетки G0-периода, имеет место сильное воздействие на клетки, которые активно растут, и имеется тенденция к повреждению, например, костного мозга, слизистой оболочки пищеварительного канала, половых клеток или корней волос.
Кроме того, антиметаболитные антибластомные лекарственные средства представляют собой соединения, имеющие структуры, подобные структурам нуклеиновых кислот или метаболитов в процессе синтеза белка, повреждают клетки, например, путем ингибирования синтеза нуклеиновых кислот и специфически воздействуют на клетки митотического периода.
Противоопухолевые антибиотики представляют собой химические вещества, продуцируемые микроорганизмами, оказывают воздействия, как например ингибирование синтеза ДНК и разрыв нити ДНК, и проявляют противоопухолевую активность.
Также, микроканальцевые ингибиторы обладают противоопухолевыми эффектами путем прямого воздействия на микроканальцы, которые играют важные роли для сохранения нормальных функций клеток, например, путем образования веретен во время деления клеток, локализации клеточных органелл и транспортировки веществ. Микроканальцевые ингибиторы воздействуют на клетки, которые активно делятся, и нервные клетки.
Кроме того, платиновые препараты ингибируют синтез ДНК путем образования нитей ДНК, межцепочечных связей или связей ДНК-белок. Цисплатин представляет собой типичное лекарственное средство, однако, он вызывает тяжелые нефропатии и требует замены большого количества жидкости.
Кроме того, парагормональные антибластомные лекарственные средства являются эффективными против гормонзависимых опухолей. Женские гормоны или антиандрогеновые лекарственные средства вводят в случае андрогензависимого рака простаты.
Молекулярнонаправленные лекарственные средства используют для направленного на молекулы лечения, которое соответствует молекулярным биологическим характерным особенностям, специфическим для соответственных злокачественных опухолей.
Кроме того, ингибиторы топоизомеразы представляют собой ферменты для временно генерируемых разрывов в ДНК и изменения числа сплетений ДНК-нитей. Ингибитор топоизомеразы I представляет собой фермент, который генерирует разрывы в одной нити кольцевой ДНК, позволяет проходить другой нити и затем замыкает разрывы, а ингибитор топоизомеразы II временно разрывает две нити кольцевой ДНК, позволяет другим двум нитям ДНК проходить между первыми двумя нитями и снова связывает разорванные нити.
Кроме того, неспецифические иммунопотенциаторы ингибируют увеличение раковых клеток путем активации иммунной системы.
Локальные анестетики также обладают преимуществом доставки лекарственного средства к месту действия. Локальные анестетики используют для лечения локальных зудов и болей, например, в случае слизистой оболочки или кожи, вызываемых геморроидальным заболеванием, стоматита, заболевания десен, полостей, удаления зубов или в случае операций. Лидокаин (название продукта: ксилокаин) известен как типичный локальный анестетик; однако, этот лидокаин является более быстро действующим, но обладает антиаритмическим действием. Кроме того, если лидокаин, который является анестетиком, инъецируют в цереброспинальную жидкость, когда осуществляют спинальную анестезию, лидокаин распространяется по цереброспинальной жидкости; и, по «сценарию» наихудшего случая, имеется опасение, что лидокаин может достигать цервикальной части спинного мозга и, таким образом, вызывает прекращение дыхательной функции и оказывает критические отрицательные воздействия.
Примером конкретного способа доставки лекарственного средства к участку действия является использование носителя. Этот способ представляет собой нагружение носителя, который имеет тенденцию концентрироваться в пораженной области, лекарственным средством и носитель переносит лекарственное средство к пораженной области. Подающим надежды кандидатом в носители является магнитное вещество и имеется предлагаемый способ присоединения носителя, который является магнитным веществом, к лекарственному средству и позволяет носителю аккумулироваться в пораженной области посредством магнитного поля (см., например, Патентную Литературу 1).
Однако, когда используют магнитное вещество в качестве носителя, является затруднительным введение магнитного вещества-носителя, так как молекулы носителя являются обычно гигантскими и имеются технические проблемы в отношении прочности связывания и аффинности между носителем и молекулами лекарственного средства; и, вследствие вышеуказанных причин, является затруднительным достижение практического применения магнитного вещества-носителя.
Поэтому вводят локальный анестетик, в котором боковые цепи, для достижения плотности положительного или отрицательного спин-заряда, связаны с основным скелетом органического соединения и который пригоден в целом до тех пор, пока локальный анестетик направлен посредством магнетизма за счет внешнего магнитного поля; и, если локальный анестетик применяют в случае человеческого организма или животного, он сохраняется в области, где магнитное поле наложено локально посредством магнитного поля вне тела, и на область оказываются лекарственные воздействия, которыми первоначально обладает локальный анестетик. В случае вышеуказанного способа используют железо-саленовый комплекс в качестве примера такого лекарственного средства (см. Патентную Литературу 2).
Кроме того, представлена обзорная статья в отношении органического магнитного вещества, которое образует магниты из высокополимерных материалов посредством синтеза «высокоспиновых молекул» с более параллельными спинами, чем обычные металл-магнитные вещества (например, см. Патентную Литературу 3).
Кроме того, также приводится способ, согласно которому содержащуюся в цисплатине платину заменяют другим элементом (например, см. Патентную литературу 4).
Перечень ссылок
Патентная литература
Патентная Литература 1: открытая выкладка заявки на патент Японии (Kokai), публикация № 2001-10978
Патентная Литература 2: Международная заявка WO-2008/001851
Непатентная Литература 1: Hiizu Iwamura, «Molecular Design Aimed at Organic Ferromagnetic Substances», февраль 1989, сс. 76-88
Непатентная Литература 2: Krsity Cochran и др., Structural Chemistry, 13 (2002), сс. 133-140
Краткое изложение сущности изобретения
Техническая проблема
Однако, разработка, например, лекарственных средств и систем доставки лекарственных средств к участку действия, способных эффективно переносить более превосходные инвазивные лекарственные средства к пораженной области, известна для лечений, которые относительно приводят к деформации у пациентов, как, например, в случае лечений раковых заболеваний языка, тканей посторбитальной части или т.п.
Настоящее изобретение задумано с точки зрения таких обстоятельств и целью настоящего изобретения является получение металл-саленового комплексного соединения, которое проявляет превосходные неинвазивности и может быть эффективно перенесено к пораженной области, локального анестетика, содержащего это металл-саленовое комплексное соединение, и антибластомного лекарственного средства, содержащего это металл-саленовое комплексное соединение.
Решение проблемы
Для достижения вышеуказанной цели, настоящее изобретение относится к металл-саленовому комплексному соединению, в котором часть атома металла в каждой из составных молекул металл-саленового комплекса или производного металл-саленового комплекса мультимеризована через воду, и которое смешивают с основой для получения мази.
Кроме того, относительно металл-саленового комплексного соединения согласно настоящему изобретению, составные молекулы, более предпочтительно, должны быть двумя молекулами и часть атома металла каждой из двух молекул, более предпочтительно, должна быть димеризована через воду.
Так как это металл-саленовое комплексное соединение может быть смешано с основой для получения мази, оно может быть введено в виде мази в пораженную область. Следовательно, металл-саленовое комплексное соединение проявляет превосходную неинвазивность и может быть эффективно перенесено к пораженной области.
Между прочим, «мазь» согласно настоящему изобретению включает, кроме того, например, мази, в которых используют маслянистые основы, крема, в которых используют эмульсионные основы, как описано в Фармакопее Японии. «Основа», используемая для получения мази, служит для прилипания к коже и приводит к оставлению на коже активных ингредиентов в течение длительного периода времени и основа, которая может быть легко нанесена, не обладает вызывающим раздражение эффектом на коже и не повреждает стабильность активных ингредиентов.
Кроме того, металл-саленовое комплексное соединение согласно настоящему изобретению может быть нанесено, например, на язык, десны и внутреннюю сторону щек путем смешения с основой, которая может быть использована в полости рта.
Примеры такой основы включают гидрофобные основы (маслянистые основы), гидрофильные основы (эмульсионные основы, водорастворимые основы, лиофобные основы), специальные композиции (как например линименты, пасты, пластыри, лосьоны и спреи), оральные мази и глазные мази; более конкретно, например, мазевые основы, как например вазелин (желтый вазелин, гидрофильный вазелин и белый вазелин), кеналог, жидкий парафин, полиэтоксилированное гидрогенизированное касторовое масло, макрогол и желатинируемый углеводород.
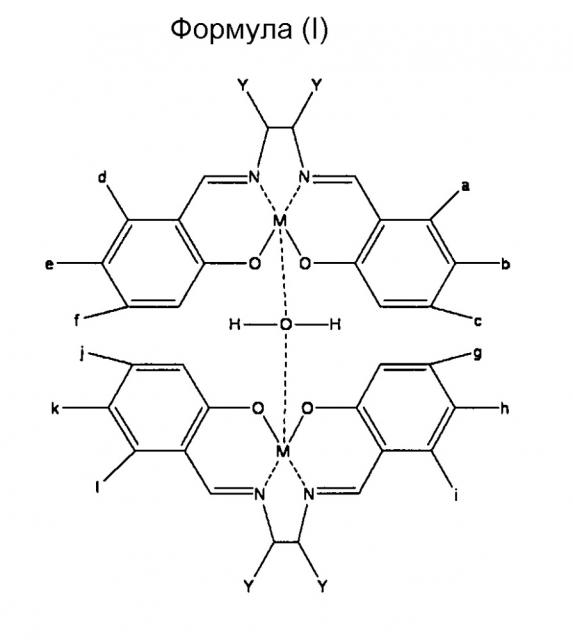
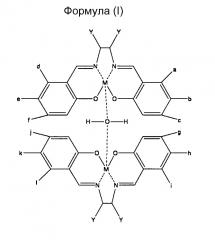
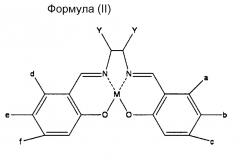
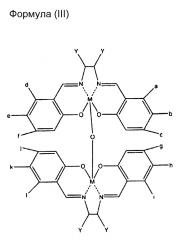
Предпочтительным воплощением настоящего изобретения является намагничивающийся металл-саленовый комплекс, представленный следующими химическими формулами (I), (II), (III), и его производные.
Однако, относительно всех формул (I), (II) и (III), М означает Fe (железо), Cr (хром), Mn (марганец), Со (кобальт), Ni (никель), Мо (молибден), Ru (рубидий), Rh (родий), Pd (палладий), W (вольфрам), Re (рений), Os (осмий), Ir (иридий), Pt (платина), Nd (ниобий), Sm (самарий), Eu (европий) или Gd (гадолиний), и каждый от а до f и Y означает водород (где М означает Fe, за исключением случая, где все от а до f и Y означают атомы водорода), или имеет любое значение из нижеперечисленного (1)-(7):
(1) -СО2Ме;
(2) -СО(ОСН2СН2)2ОСН3;
(где R2 представляет собой множество нуклеиновых кислот, которые комбинированы вместе и образованы из аденина, гуанина, тимина, цитозина или урацила);
(5) -NHCOH, -NH2, -NHR1 или -NR1R2;
(где R1 и R2 означают алкил или алкан с одинаковым числом атомов углерода или с числом атомов углерода от 1 до 6;
(6) -NHR3, -NHCOR3 или -R3;
(где R3 представляет собой замещающую связь как результат десорбции функциональной группы, такой как водород или гидроксильная группа); и
(7) атомы галогена, такие как хлор, бром или фтор.
Кроме того, перенос заряда от R3 предпочтительно должен быть менее чем 0,5 электронов (е).
Кроме того, R3 может быть одним любым из соединений, представленных следующими формулами (1)-(27).
(1) Ибупрофенпиконол, фенилпропионовая кислота, анальгетическое/противовоспалительное средство:
(2) Мефенаминовая кислота, антраниловая кислота, противовоспалительный анальгетик:
(3) Лекарственное средство для лечения гиперлипидемии:
(4) Антибактериальное средство:
(5) Фторохром (родамин):
(6) Гормон (эстроген):
(7) Гормон (эстроген):
(8) Таксол (паклитаксел):
(9) Аминокислота (глицин):
(10) Аминокислота (аланин):
(11) Аминокислота (аргинин):
(12) Аминокислота (аспарагин):
(13) Аминокислота (аспарагиновая кислота):
(14) Аминокислота (цистеин):
(15) Аминокислота (глутаминовая кислота):
(16) Аминокислота (гистидин):
(17) Аминокислота (изолейцин):
(18) Аминокислота (лейцин):
(19) Аминокислота (лизин):
(20) Аминокислота (метионин):
(21) Аминокислота (фенилаланин):
(22) Аминокислота (пролин):
(23) Аминокислота (серин):
(24) Аминокислота (треонин):
(25) Аминокислота (триптофан):
(26) Аминокислота (тирозин):
(27) Аминокислота (валин):
Кроме того, настоящее изобретение относится к локальному анестетику, включающему намагничивающееся металл-саленовое комплексное соединение, где R3 представляет собой заместитель, представленный любой из следующих формул (28)-(38), получаемый как результат десорбции водорода от соединения, которое имеет метильную группу и перенос заряда которого составляет менее чем 0,5 электронов (е).
(28) Общее название: лидокаин
(29) Общее название: этиламинобензойная кислота
(30) Общее название: оксибупрокаингидрохлорид
(31) Общее название: оксетазаин
(32) Общее название: дибукаин
(33) Общее название: этилпиперидиноацетиламинобензоат
(34) Общее название: прокаин
(35) Общее название: мепивакаин
(36) Общее название: п-бутиламинобензоилдиэтиламиноэтанол-гидрохлорид
(37) Общее название: бупивакаингидрохлорид
(38) Общее название: ропивакаингидрохлоридгидрат
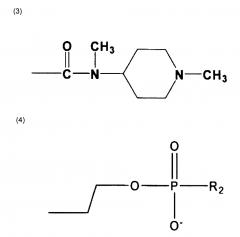
Кроме того, настоящее изобретение относится к антибластомному лекарственному средству, включающему намагничивающееся металл-саленовое комплексное соединение, где R3 представляет собой любое одно из соединений, представленных следующими формулами (39)-(103), которое комбинируется с основным скелетом соединения вышеприведенной формулы (I) через часть связывающей группы, получаемую как результат десорбции водорода (однако, в соединении (83), цианогруппа (-CN) представляет собой связывающую группу).
(39) Общее название: ифосфамид, алкильное антибластомное лекарственное средство
(40) Общее название: циклофосфамид, алкильное антибластомное лекарственное средство
(41) Общее название: дакарбазин, алкильное антибластомное лекарственное средство
(42) Общее название: бусульфан, алкильное антибластомное лекарственное средство
(43) Общее название: мелфалан, алкильное антибластомное лекарственное средство
(44) Общее название: ранимустин, алкильное антибластомное лекарственное средство
(45) Общее название: эстрамустиннатрийфосфат, алкильное антибластомное лекарственное средство
(46) Общее название: нимустингидрохлорид, алкильное антибластомное лекарственное средство
(47) Общее название: эноцитабин, антиметаболитное антибластомное лекарственное средство
(48) Общее название: капецитабин, антиметаболитное антибластомное лекарственное средство
(49) Общее название: кармофур, антиметаболитное антибластомное лекарственное средство
(50) Общее название: гимерацил, антиметаболитное антибластомное лекарственное средство
(51) Общее название: отерацилкалий, антиметаболитное антибластомное лекарственное средство
(52) Общее название: цитарабин, антиметаболитное антибластомное лекарственное средство
(53) Общее название: цитарабинокфосфат, антиметаболитное антибластомное лекарственное средство
(54) Общее название: тегафур, антиметаболитное антибластомное лекарственное средство
(55) Общее название: доксифлуридин, антиметаболитное антибластомное лекарственное средство
(56) Общее название: гидроксикарбамид, антиметаболитное антибластомное лекарственное средство
(57) Общее название: фторурацил, антиметаболитное антибластомное лекарственное средство
(58) Общее название: меркаптопурингидрат, антиметаболитное антибластомное лекарственное средство
(59) Общее название: флударабинфосфат, антиметаболитное антибластомное лекарственное средство
(60) Общее название: гемцитабингидрохлорид, антиметаболитное антибластомное лекарственное средство
(61) Общее название: актиномицин-D, противоопухолевый антибиотик
(62) Общее название: акларубицингидрохлорид, противоопухолевый антибиотик
(63) Общее название: идарубицингидрохлорид, противоопухолевый антибиотик
(64) Общее название: эпирубицингидрохлорид, противоопухолевый антибиотик
(65) Общее название: зиностатинстималамер, противоопухолевый антибиотик
R1 и R2 отличаются друг от друга и отвечают следующим формулам, соответственно, и то же самое относится к R’1 и R’2:
А1=Н или NH4
A2, A3=Н или NH4 или С4Н9
(А2 и А3 не означают С4Н9, в одно и то же время)
M+n: приблизительно в среднем 5,5
(66) Общее название: даунорубицингидрохлорид, противоопухолевый антибиотик
(67) Общее название: доксорубицингидрохлорид, противоопухолевый антибиотик
(68) Общее название: блеомицингидрохлорид, противоопухолевый антибиотик
(69) Общее название: пепломицинсульфат, противоопухолевый антибиотик
(70) Общее название: митомицин С, противоопухолевый антибиотик
(71) Общее название: амрубицингидрохлорид, противоопухолевый антибиотик
(72) Общее название: вибрамицингидрохлорид, противоопухолевый антибиотик
(73) Общее название: пирарубицингидрохлорид, противоопухолевый антибиотик
(74) Общее название: доцетакселгидрат, микроканальцевый ингибитор
(75) Общее название: винкристинсульфат, микроканальцевый ингибитор
(76) Общее название: винбластинсульфат, микроканальцевый ингибитор
(77) Общее название: винорелбинтартрат, микроканальцевый ингибитор
(78) Общее название: виндесинсульфат, микроканальцевый ингибитор
(79) Общее название: оксалиплатин, препарат на основе платины
(80) Общее название: карбоплатин, препарат на основе платины
(81) Общее название: цисплатин, препарат на основе платины
(82) Общее название: недаплатин, препарат на основе платины
(83) Общее название: анастрозол, парагормональное лекарственное средство
(84) Общее название: афема, парагормональное лекарственное средство
(85) Общее название: эксеместан, парагормональное лекарственное средство
(86) Общее название: тамоксифенцитрат, парагормональное лекарственное средство
(87) Общее название: торемифенцитрат, парагормональное лекарственное средство
(88) Общее название: бикалутамид, парагормональное лекарственное средство
(89) Общее название: флутамид, парагормональное лекарственное средство
(90) Общее название: мепитиостан, парагормональное лекарственное средство
(91) Общее название: эстрамустиннатрийфосфат, парагормональное лекарственное средство
(92) Общее название: медроксипрогестеронацетат, парагормональное лекарственное средство
(93) Общее название: тамибаротен, молекулярно направленное терапевтическое лекарственное средство
(94) Общее название: гефитиниб, молекулярно направленное терапевтическое лекарственное средство
(95) Общее название: третиноин, молекулярно направленное терапевтическое лекарственное средство
(96) Общее название: иматинибмезилат, молекулярно направленное терапевтическое лекарственное средство
(97) Общее название: этопозид, ингибитор топоизомеразы
(98) Общее название: собузоксан, ингибитор топоизомеразы
(99) Общее название: иринотекангидрохлорид, ингибитор топоизомеразы
(100) Общее название: ногитекангидрохлорид, ингибитор топоизомеразы
(101) Общее название: убенимекс, неспецифический иммуностимулятор
(102) Общее название: сизофиран, неспецифический иммуностимулятор
(103) Общее название: лентинан, неспецифический иммуностимулятор
Кроме того, настоящее изобретение относится к антибластомному лекарственному средству, включающему намагничивающееся металл-саленовое комплексное соединение, где R3 представляет собой любое одно из соединений, представленных следующими формулами (104)-(109).
(104) Наименование продукта: лейплин; и общее название: лейпрорелинацетат, противоопухолевый агент
(105) Наименование продукта: метотрексат; и общее название: метотрексат, противоопухолевый агент
(106) Наименование продукта: новантрон; и общее название: митоксантронгидрохлорид, противоопухолевый агент
(107) Наименование продукта: фотофрин; и общее название: порфимернатрий, противоопухолевый агент
(108) Наименование продукта: фотофрин; и общее название: порфимернатрий, противоопухолевый агент
(109) Наименование продукта: милотарг; и общее название: гемтузумабозогамицин, противоопухолевый агент
Полезные эффекты данного изобретения
В соответствии с настоящим изобретением, можно получать металл-саленовое комплексное соединение, которое проявляет превосходную неинвазивность и может быть эффективно перенесено в пораженную область, локальный анестетик, содержащий это металл-саленовое комплексное соединение, и антибластомное лекарственное средство, содержащее это металл-саленовое комплексное соединение.
Краткое описание чертежей
На фиг.1 представлен график, показывающий изменения по массе (TG) и результаты дифференциального термического анализа (ДТА), что касается металл-саленовых комплексных соединений согласно настоящему изобретению.
На фиг.2 представлена диаграмма, показывающая интегральную кривую металл-саленовых комплексных соединений согласно настоящему изобретению.
На фиг.3 представлена диаграмма, показывающая кривую магнитное поле-намагничивание Mn-саленового комплексного соединения.
На фиг.4 представлена диаграмма, показывающая кривую магнитное поле-намагничивание Cr-саленового комплексного соединения.
На фиг.5 представлена диаграмма, показывающая кривую магнитное поле-намагничивание Со-саленового комплексного соединения, при температуре 37°С (310 К).
На фиг.6 представлена кривая магнитное поле-намагничивание Fe-саленового комплексного соединения.
На фиг.7 представлен диаграммный рисунок состояния, где полюсовой магнит введен в контакт с прямоугольным флаконом.
На фиг.8 представлена типичная диаграмма, показывающая связь между расстоянием от магнита и количеством клеток (образцы) на единицу площади.
На фиг.9 представлен перспективный вид системы наведения.
На фиг.10 представлена типичная диаграмма, показывающая результаты измерения SNR клеток после помещения в систему наведения при использовании MRI.
На фиг.11 представлены фотоснимки, показывающие воздействия Fe-саленового комплексного соединения на рост меланомы у мыши.
На фиг.12 представлена типичная диаграмма, показывающая воздействия Fe-саленового комплексного соединения на меланомы.
На фиг.13 представлена диаграмма, показывающая результаты гистологического исследования Fe-саленового комплексного соединения.
На фиг.14 представлен график, показывающий зависимость между напряженностью магнитного поля Fe-саленового комплексного соединения и повышением температуры.
На фиг.15 представлен график, показывающий зависимость между временем и повышением температуры, когда магнитное поле АС наложено на мазь, в которой использован вазелин в качестве основы и смешан с Fe-саленовым комплексным соединением.
На фиг.16 представлен график, показывающий зависимость между временем и повышением температуры, когда магнитное поле АС наложено на мазь, в которой использован кеналог в качестве основы и смешан с Fe-саленовым комплексным соединением.
На фиг.17 представлен график, показывающий зависимость между временем и повышением температуры, когда магнитное поле АС наложено только на вазелин и только на кеналог.
На фиг.18 представлен график, показывающий зависимость между временем и повышением температуры, когда образец двухатомного Fe-саленового комплексного соединения, растворенный в агарозе, подвергают воздействию инфракрасного излучения в ближней области спектра.
Описание воплощений
Пример 1
Металл-саленовое комплексное соединение согласно настоящему изобретению получают следующим образом.
Смесь 4-нитрофенола (Соединение 1) (25 г, 0,18 моль), гексаметилентетрамина (25 г, 0,18 моль) и полифосфорной кислоты (200 мл) перемешивают в течение одного часа при температуре 100°С. Затем эту смесь вводят в 500 мл этилацетата и 1 л (литр) воды и перемешивают до полного растворения. Кроме того, когда 400 мл этилацетата добавляют к этому раствору, раствор разделяется на две фазы. Затем водную фазу удаляют из раствора, который разделен на две фазы; и остающееся соединение дважды промывают основным растворителем и сушат над безводным MgSO4 (сульфат магния). В результате, синтезируют 17 г Соединения 2 (выход 57%).
Соединение 2 (17 г, 0,10 моль), уксусный ангидрид (200 мл) и H2SO4 (минимальное количество) перемешивают в течение одного часа при комнатной температуре. Полученный раствор перемешивают в течение 0,5 часа в смеси воды со льдом (2 л) для осуществления гидролиза. Полученный раствор отфильтровывают и высушивают на воздухе, после чего получают порошкообразное вещество белого цвета. Это порошкообразное вещество перекристаллизуют, используя растворитель, содержащий этилацетат. В результате получают 24 г Соединения 3 (выход 76%) в виде кристаллов белого цвета.
Смесь углерода (2,4 г), содержащего 10% п