Препараты антител
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложен препарат антитела, содержащий IgG, IgA и, по меньшей мере, 5% антител IgM по массе от общего количества антител, обладающий специфической активностью активации комплемента, где в анализе in vitro препарат антитела по существу не образует С5а и/или по существу не образует С3а. Предложены применение препарата антитела для изготовления лекарственного средства для лечения иммунологического нарушения или бактериальной инфекции и способ лечения пациента, страдающего иммунологическим нарушением или бактериальной инфекцией. Предложенная группа изобретений обеспечивает эффективные средства и методы активации комплемента. 5 н. и 23 з.п. ф-лы, 3 ил., 13 табл., 11 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к препарату антитела (иммуноглобулина), содержащему IgM, обладающему специфической активностью активации комплемента, но низкой способностью к неспецифической активации комплемента. Настоящее изобретение также относится к применению препарата антитела в медицине.
Предпосылки создания изобретения
Композиции иммуноглобулинов, полученные из плазмы человека и пригодные для внутривенного введения, известны в данной области и в течение нескольких десятилетий играют важную роль в лечении широкого ряда заболеваний. Иммуноглобулины применяют, например, при лечении инфекций у человека, и их можно отнести к различным классам с различными биохимическими и физиологическими свойствами. Иммуноглобулин G участвует в защите против вирусных антигенов, в то время как IgM является преимущественно активным в иммунных ответах против бактерий и токсинов.
Растворы иммуноглобулинов содержат IgG, IgA и IgM в разных процентных соотношениях, где различные препараты имеют различные применения в лечении, например, препараты с более высоким процентным содержанием IgM применяют для профилактики или лечения бактериальных инфекций.
Растворы иммуноглобулинов обычно получают из фракций плазмы или сыворотки крови, например фракций Коэна. Затем эти фракции подвергают ряду стадий очистки для удаления загрязнений, таких как вирусы, денатурированные белки, протеазы и липиды.
Плазму человека для фракционирования собирают от тысяч доноров, и она может содержать патогенные вирусы, несмотря на тестирование источника плазмы. Таким образом, стадии способа инактивации или удаления вирусов являются необходимыми для получения безопасных продуктов для применения в медицине. В данной области известно несколько способов инактивации/удаления вирусов, например, химическая обработка, облучение УФС-светом или фильтрация через нанометровые фильтры, которые осуществляют для обеспечения полной вирусной безопасности.
Способность стадий способа удалять или инактивировать вирус подтверждают с использованием моделей способа получения в лабораторном масштабе, и для каждой стадии определяют степень удаления или инактивации. Увеличение степени инактивации/удаления добавляет фармацевтическому продукту дополнительную вирусную безопасность. Современные руководства регулирующих органов требуют, по меньшей мере, двух эффективных стадий для оболочечных и безоболочечных вирусов в производстве происходящих из плазмы лекарственных средств. Хотя несколько способов, таких как обработка растворителем/детергентом, обработка октановой кислотой, фильтрация через нанометровые фильтры и термическая обработка, являются эффективными для инактивации или удаления оболочечных вирусов, известно только немного способов для инактивации или удаления безоболочечных вирусов, например, парвовирусов. Эти безоболочечные вирусы по большей части являются очень мелкими, обычно проходя через нанометровые фильтры с размерами пор более 20 нм. Этот размер пор является слишком небольшим для молекул IgM, имеющих диаметр вплоть до 30 нм. Безоболочечные вирусы эффективно инактивируют химическими веществами, подобными β-пропиолактону, которые, однако, также приводят к модифицированному иммуноглобулину с нарушенными функциями. Другой эффективной обработкой является облучение УФС (EP 1842561, CAF-DCF). Однако известные обработки растворителем/детергентом, обработка октановой кислотой и слабая термическая обработка не оказывают существенного эффекта на безоболочечные вирусы.
Как указано выше, в дополнение к вирусам, которые потенциально присутствуют, также необходимым является удаление других загрязнений, подобных липидам, протеазам, агрегатам белка и денатурированным иммуноглобулинам. Удаление всех этих загрязнений является необходимым (1) чтобы обеспечить соответствие продукта инструкциям по биологической безопасности, относящимся к загрязнению вирусами, (2) чтобы продукт являлся переносимым пациентом после внутривенного введения, (3) чтобы дать возможность продукту оставаться стабильным во время долгосрочного хранения (любая остаточная протеолитическая активность может приводить к деградации продукта после долгосрочного хранения, например, 2 года), и (4) чтобы получить желаемую смесь соединений/фармацевтическую композицию.
В то же самое время, однако, является необходимым, чтобы стадии очистки для удаления загрязнений не затрагивали молекулы иммуноглобулинов, чтобы они, настолько, насколько возможно, сохраняли свою нормальную биологическую активность и сохранялись в растворе с высоким выходом. Этого равновесия трудно достичь, поскольку многие известные стадии очистки могут также оказывать негативное влияние на активность иммуноглобулинов, и в частности, на IgM; например, увеличенное время облучения УФС может снижать выход нативного и активного IgM, полученного в конечном растворе иммуноглобулина. Это не только приводит к снижению эффективности конечного раствора иммуноглобулина, но может также вызывать менее хорошую переносимость раствора in vivo.
Агрегаты и денатурированные иммуноглобулины, количество которых может увеличиваться из-за конкретных стадий очистки, особенно представляют потенциальный риск для пациентов, поскольку они обладают высокой способностью неспецифически активировать комплемент, приводя к тяжелым побочным эффектам у пациентов, которым вводят эти денатурированные иммуноглобулины. Неспецифическая активация комплемента относится к инициации каскада реакций комплемента в отсутствие специфических комплексов антитело-антиген. Неспецифической активации комплемента строго необходимо избегать, поскольку она может вызывать нежелательные побочные эффекты, такие как гипотензия, покраснение, головная боль, лихорадка, озноб, тошнота, рвота, мышечная боль, диспноэ и тахикардия. Специфическая активация комплемента, с другой стороны, является желательной и возникает только после связывания иммуноглобулинов с их специфическими антигенами.
Неспецифическую активацию комплемента измеряют как так называемую антикомплементарную активность (ACA) посредством стандартизированного теста, описанного в Европейской фармакопее.
Роль системы комплемента в иммунной защите от патогенов хорошо известна. Система комплемента состоит приблизительно из 20 белков, которые активируются последовательно. Для активации классического пути активации комплемента, как правило, необходим специфический комплекс антиген-антитело, в то время как альтернативный путь может быть активирован антигенами без присутствия антител. Как в классическом, так и в альтернативном пути активации комплемента образуется протеаза C3-конвертаза. C3-конвертаза расщепляет и активирует компонент C3, образуя C3a и C3b, и вызывая каскад дальнейших событий расщепления и активации до расщепления C5 конвертазы на C5a и C5b. C5b инициирует атакующий мембрану путь, что приводит в результате к атакующему мембрану комплексу, состоящему из C5b, C6, C7, C8 и полимерного C9. Это представляет собой цитолитический конечный продукт каскада комплемента, который формирует трансмембраный канал, вызывающий осмотический лизис клеток-мишеней, таких как бактерии.
Активация комплемента, кроме того, приводит к образованию анафилатоксинов, включая биологически активный белок C5a. Этот анафилатоксин является сильным хемотаксическим средством для иммунных и воспалительных клеток, индуцирует активацию клеток и вызывает высвобождение гистамина из тучных клеток. В ситуациях избыточной или неконтролируемой, и/или неспецифической активации комплемента сверхпродукция C5a может вызывать неблагоприятные эффекты у пациентов.
C5a представляет собой эффективный хемоаттрактант лейкоцитов, вызывая накопление лейкоцитов, особенно нейтрофильных гранулоцитов, в участках активации комплемента. C5a активирует лейкоциты и является сильным медиатором воспаления. В то время как эти функции являются преимущественными во время специфических реакций комплекса антитело-антиген, любого неспецифического образования C5a необходимо избегать из-за потенциальных побочных эффектов.
Неспецифическая активация комплемента является особенной проблемой для препаратов иммуноглобулинов IgM (т.е. препаратов, содержащих, по меньшей мере, 5% IgM), поскольку, в отличие от препаратов IgG, антитела IgM легко агрегируют в растворе. Препараты IgM трудно стабилизировать, особенно если они обогащены по сравнению с концентрациями в плазме и сохраняются в жидком растворе. Также известно, что IgM является сильным активатором комплемента; одна молекула, связанная с антигеном, может активировать комплемент. Это отличается от IgG, где две или более молекул IgG должны быть связаны с антигеном в тесной связи друг с другом для активации комплемента.
Кроме того, основными показаниями для лечения посредством содержащих IgM препаратов иммуноглобулинов являются бактериальные инфекции и сепсис. Поскольку эти пациенты уже страдают гипотензией, дополнительное нежелательное получение неспецифической активации комплемента и C5a может приводить к клиническому ухудшению состояния пациента. Соответственно, описано, что препараты IgM сложно получать для внутривенного введения.
Существует несколько способов, описанных в данной области, для получения содержащих IgM препаратов иммуноглобулинов из плазмы человека.
Начальную очистку растворов IgM человека проводят классическими способами фракционирования плазмы Коэна или их хорошо известными модификациями (например, Коэна/Онкли, Кистлера/Нитшманна). С использованием способа осаждения холодным этанолом фракцию IgM выделяют во фракции III или фракции I/III (также называемых B или B+I). Описаны способы очистки растворов белка, обогащенных IgM, начиная с фракции III или I/III. В EP0013901 описан способ очистки, начиная с фракции III, включающий стадии с использованием обработки октановой кислотой, β-пропиолактоном и стадию адсорбции с использованием анионообменной смолы. Этот способ используют для получения Pentaglobin® (пентаглобина®) - до настоящего времени единственного коммерчески доступного внутривенного продукта IgM. β-пропиолактон является хорошо известным химическим веществом, используемым на стадиях стерилизации для инактивации потенциально присутствующих вирусов. Поскольку β-пропиолактон является очень реакционноспособным веществом, вызывающим химическую модификацию белков, существует также существенная потеря противовирусной и антибактериальной активности иммуноглобулинов. С другой стороны, эта химическая модификация приводит к уменьшенной антикомплементарной активности по сравнению с активностью химически немодифицированного иммуноглобулина. В EP0352500 описано получение концентрата IgM для внутривенного введения с уменьшенной антикомплементарной активностью при использовании анионообменной хроматографии, β-пропиолактона, облучения УФС-светом и стадии инкубации при повышенной температуре (40°C-60°C). Препарат, полученный этим способом, являлся стабильным в жидком растворе в течение ограниченного времени из-за химической модификации. Концентрация IgM составляла более 50% общего содержания иммуноглобулинов.
Получение растворов белка, обогащенных IgM без химической модификации β-пропиолактоном, описано в EP0413187 (Biotest) и EP0413188 (Biotest). Эти способы включают подвергание подходящего раствора белка обработке октановой кислотой и анионообменной хроматографии, начиная с фракции Коэна III или II/III. В патенте EP0413187 (Biotest) обработку октановой кислотой проводят путем перемешивания в течение 15 мин для удаления липидов, присутствующих во фракции Коэна III.
Препарат согласно EP0413187 обладал низкой антикомплементарной активностью, от 0,6 до 0,8 CH50/мг белка, но нуждался в стабилизации и инактивации вируса посредством β-пропиолактона. Считается, что низкая антикомплементарная активность составляет ≤1 CH50/мг белка согласно монографии EP для иммуноглобулинов.
В EP0413188B1 (Biotest) описано получение обогащенного IgM препарата для внутривенного введения с использованием анионообменной хроматографии для снижения антикомплементарной активности. Кроме того, описана термическая обработка при pH 4-4,5 при 40-60°C, предпочтительно, от 50 до 54°C, для снижения антикомплементарной активности. Этот препарат необходимо было лиофилизировать для обеспечения стабильности препарата в течение нескольких месяцев. Не смогли показать долгосрочной стабильности в форме жидкого раствора.
В M.Wickerhauser et al. «Large Scale Preparation of Macroglobulin», Vox Sang 23, 119-125 (1972) показано, что препараты IgM, выделенные осаждением PEG, обладают высокой антикомплементарной активностью (ACA) в стандартной реакции связывания комплемента, и эту активность ACA уменьшали в 10 раз инкубацией препарата IgM при pH 4,0 при 37°C в течение 8 часов с последующим повторным доведением pH до нейтрального. Не показано, является ли это уменьшение в 10 раз достаточным для обеспечения переносимости при внутривенном введении. Авторы не оценивали потенциал специфической активации комплемента своего концентрата IgM и не оценивали безопасности на какой-либо модели на животных или человеке.
По другому способу описано применение мягкой термической обработки препаратов IgM при 40-62°C, предпочтительно, 45-55°C, при pH 4,0-5,0 (EP 0450412, Miles) для уменьшения неспецифической активации комплемента. В этой патентной заявке октановую кислоту добавляют к суспензии фракции Коэна III для удаления активатора прекалликреина и липопротеинов центрифугированием. Тем не менее, такая мягкая термическая обработка приводит к частичной потере антигенных детерминант IgM. Это может увеличивать риск образования неоантигенов, приводя к увеличенной иммуногенности для человека или потере активности.
Получение содержащего IgM раствора белка для внутривенного применения с использованием обработки протеазой (например, пепсином) после стадии осаждения октановой кислотой описано в EP0835880 (US 6136312, ZLB). Обработка протеазой приводит к частичной фрагментации молекулы иммуноглобулина, уменьшающей полную функциональную активность частей Fab и Fc. Таким образом, обработанные протеазой иммуноглобулины нельзя рассматривать как немодифицированные. Этот способ получения приводит также к приблизительно 5% фрагментов с молекулярной массой <100 кДа.
Описанные способы проведения обработки октановой кислотой (EP0413187 и EP0835880) обладают тем недостатком, что обработка октановой кислотой не является эффективной по отношению к удалению и инактивации безоболочечных вирусов, и не удаляет по существу всю протеолитическую активность. В EP 0345543 (Bayer, Miles) описан высококонцентрированный препарат IgM, по меньшей мере, с 33% IgM для терапевтического применения, где препарат является по существу свободным от титров изоагглютинина. В этой патентной заявке осаждение октановой кислотой проводят добавлением октановой кислоты, и изоагглютинины удаляют аффинной хроматографией на Synsorb. Конечный препарат необходимо лиофилизировать.
В целом, получение содержащего IgM препарата с низкой антикомплементарной активностью является возможным, если иммуноглобулины химически или ферментативно модифицируют и/или дополнительно очищают хроматографией и/или подвергают мягкой термической обработке. Однако эти способы обладают своими недостатками отсутствия удаления вируса/инактивации вируса (и, таким образом, вирусной безопасности), уменьшения количества молекул иммуноглобулинов в нативной форме и/или остаточной антикомплементарной активности. В связи с этим, еще существует необходимость предоставления улучшенных содержащих IgM препаратов иммуноглобулинов, пригодных для внутривенного введения человеку.
Краткое изложение сущности изобретения
В первом аспекте настоящее изобретение относится к препарату антител, пригодному для внутривенного введения человеку, содержащему IgG, IgA и, по меньшей мере, 5% антител IgM по массе от общего количества антител, где препарат получают из плазмы человека, причем препарат антитела обладает специфической активностью активации комплемента и где в анализе in vitro с сывороткой человека, пригодной для определения способности препарата антитела неспецифически активировать комплемент, препарат антитела по существу не образует C5a и/или по существу не образует C3a.
Авторы настоящего изобретения неожиданно обнаружили, что возможно получение препарата антитела IgM из сыворотки человека, который обладает специфической активностью активации комплемента и по существу не обладает неспецифической активностью комплемента. Этот продукт обладает преимуществами, поскольку он сохраняет эффективность продукта при уменьшении нежелательных побочных эффектов, таких как гипотензия, ассоциированных с неспецифической активацией комплемента после внутривенного введения.
Следующий аспект настоящего изобретения относится к способу получения препарата антитела по настоящему изобретению из плазмы человека, включающему стадии:
(a) получения из плазмы человека фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивания C7-C9 карбоновой кислоты с раствором и обработки смешанного раствора вибросмесителем для осаждения загрязняющих белков;
(c) отделения осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов;
(d) инкубации содержащей IgM композиции иммуноглобулинов от pH 3,5 до pH 4,5 для получения инкубированного раствора;
(e) облучения инкубированного раствора УФС для получения облученного УФС раствора; и
(f) фильтрации облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку.
Авторы настоящего изобретения неожиданно обнаружили, что использование вибросмесителя на стадии, когда раствор иммуноглобулина смешивают с карбоновой кислотой, обладает необычайными преимуществами. Эта стадия способа обеспечивает более эффективное удаление нежелательных белков (включая протеазы) и образует промежуточный продукт, лучше подходящий для стадий дальнейшей переработки, используемых для получения иммуноглобулинового лекарственного средства; промежуточный продукт дает возможность более эффективных стадий дальнейшей переработки. Соответственно, стадии дальнейшей переработки могут быть менее жесткими, помогая получать препарат антитела по настоящему изобретению, способный к специфической активации комплемента и по существу неспособный к неспецифической активации комплемента.
В частности, содержащую иммуноглобулин IgM композицию, полученную на стадии (c), можно комбинировать с дополнительными стадиями обработки, такими как обработка в слабокислых условиях и обработка облучением УФС, для получения содержащего IgM иммуноглобулинового продукта или препарата антитела, который является пригодным для внутривенного введения и который обладает следующими преимущественными свойствами: обладает низкой антикомплементарной активностью; сохраняет высокий уровень нативного и активного IgM; и обладает вирусной безопасностью и, таким образом, пригоден для внутривенного введения человеку. Уровень вирусной безопасности, достигаемый способами, описанными в настоящем описании, ранее не могли быть получены. Дополнительными преимуществами является низкая протеолитическая активность (и, таким образом, стабильность в ходе долгосрочного хранения) и отсутствие химических модификаций.
Кроме того, настоящее изобретение относится к препарату антитела для применения в медицине. В одном варианте осуществления препарат антитела предназначен для применения в лечении иммунологических нарушений и бактериальных инфекций.
Следующий аспект настоящего изобретения относится к способу лечения, включающему введение препарата антитела по настоящему изобретению пациенту.
Настоящее изобретение в настоящее время описано более подробно только посредством примера, со ссылкой на сопутствующие фигуры.
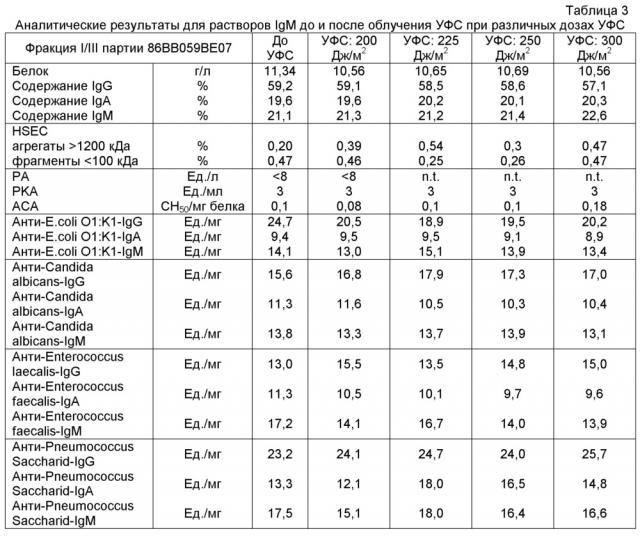
На фиг.1 представлен обзор стадий, которые можно использовать для получения препарата антитела, пригодного для внутривенного введения, согласно настоящему изобретению. На стадии обработки октановой кислотой с использованием устройства вибросмесителя большое значение придается обработке pH4 и обработке УФС. Исходный материал получают общепринятым способом осаждения плазмы человека холодным этанолом.
На фиг.2 представлен график, показывающий зависимые от времени средние концентрации C5a, обнаруженные в сыворотке человека после инкубации с препаратами IgM.
На фиг.3 представлен график, показывающий зависимые от времени средние концентрации C3a, обнаруженные в сыворотке человека после инкубации с препаратами IgM.
Подробное описание изобретения
Препарат антитела
Как описано выше, настоящее изобретение относится к препарату антитела, пригодному для внутривенного введения человеку, содержащему IgG, IgA и, по меньшей мере, 5% антител IgM по массе от общего количества антител, где препарат получен из плазмы человека, причем препарат антитела обладает специфической активностью активации комплемента, и где в анализе in vitro с сывороткой человека, пригодной для определения способности препарата антитела неспецифически активировать комплемент, препарат антитела по существу не образует C5a и/или по существу не образует C3a.
Препарат антитела по настоящему изобретению содержит белки плазмы человека, из которых, по меньшей мере, 90%, предпочтительно, по меньшей мере, 95% состоят из иммуноглобулинов (поликлональные антитела). В частности, препарат содержит иммуноглобулины IgG, IgA и IgM, где, по меньшей мере, 5% иммуноглобулинов представляют собой IgM. Количество иммуноглобулинов IgG, IgA и IgM можно определять посредством нефелометрии или посредством иммунопреципитации согласно Ph. Eur. 2.7.1.
Более предпочтительно, препарат антитела содержит, по меньшей мере, 10% IgM и наиболее предпочтительно, по меньшей мере, 15% IgM. Что касается IgG и IgA, предпочтительно, препарат антитела содержит более 5% IgA и/или более 40% IgG. Все проценты представляют собой процент от общего количества антител (например, г IgM/(г IgG+г IgA+г IgM)×100).
Способы определения того, что препарат антитела обладает специфической активностью активации комплемента (т.е. способностью активировать каскад реакций комплемента в присутствии антигена), посредством оценки функциональной активности Fc-фрагмента молекулы иммуноглобулина, известны в данной области. В частности, пригодный способ описан в способе Eur. Ph. согласно Европейскому руководству ICH S6 (CPMP/ICH/302/95) с использованием антигена краснухи. Дополнительные подробности относительно специфической активации комплемента представлены ниже в отношении биологической активности.
Препарат антитела по существу не вызывает неспецифической активации комплемента (т.е. активации каскада реакций комплемента иммуноглобулинами в отсутствие антигена) в анализах in vitro, пригодных для определения неспецифической активации комплемента в нормальной сыворотке человека (т.е. сыворотке от здоровых людей). В частности, анализ может определять количество C5a и/или C3a, образуемое в анализе в отсутствие антигена. Как указано выше, активация комплемента приводит к образованию C5a и C3a. Поскольку оба этих белка вовлечены в терминальный путь системы комплемента (больше чем в классический/лектиновый путь или альтернативный путь), они являются особенно пригодными для определения активации комплемента.
Препарат антитела по существу не образует C5a и/или по существу не образует C3a при использовании в подходящем анализе in vitro с сывороткой человека в отсутствие антигена. В предпочтительном варианте осуществления препарат антитела, доведенный до концентрации IgM 1,72 мг/мл, образует менее 200 нг/мл C5a после 60 минут анализа, и/или препарат антитела, доведенный до концентрации IgM 1,72 мг/мл, образует менее 6000 нг/мл C3a после 60 минут анализа.
Альтернативно или дополнительно, количество C5a и/или C3a, образуемое препаратом антитела в анализе, является таким же, как количество C5a и/или C3a, образуемое в таком же анализе отдельно сывороткой человека ±70%. Предпочтительно, это присутствует после 60 минут анализа.
Пригодные анализы известны в данной области. В предпочтительном варианте осуществления анализ включает стадии:
(a) добавления количества препарата антитела к 100 мкл сыворотки человека для получения реакционной смеси, содержащей 1,72 мг/мл IgM, и инкубации реакционной смеси в течение 60 минут при 37°C при постоянном перемешивании;
(b) получения набора разведений реакционной смеси, пригодного для ELISA;
(c) проведения сэндвич-ELISA для набора разведений реакционной смеси с использованием первичного и вторичного антитела против C5a или C3a и хромогенного вещества, где вторичное антитело конъюгировано с ферментом, и хромогенное вещество является субстратом фермента; и
(d) определения количества C5a или C3a в реакционной смеси на основании изменения окраски, полученного в результате контакта хромогенного вещества с ферментом, связанным с C5a или C3a через вторичное антитело.
В ELISA набор разведений приводят в контакт с лунками планшета для анализа, покрытыми первичным антителом. После инкубации лунки промывают для удаления разведенного образца, затем инкубируют с вторичным антителом и оно связывается со всеми C3a/C5a, связанными с первичным антителом в лунках, поскольку обладает эпитопом на C3a/C5a, другим, чем первичное антитело. После дополнительной промывки для удаления не связавшегося вторичного антитела проводят инкубацию с хромогеном, и он вступает в реакцию с ферментом, конъюгированным с вторичным антителом. Полученное изменение окраски можно измерить посредством определения с помощью фотометра оптической плотности, являющейся пропорциональной концентрации C5a/C3a, присутствующей в наборе разведений.
В частности, количество препарата антитела, добавленного на стадии (a), представляет собой количество, подходящее для создания концентрации 1,72 мг/мл IgM в реакционной смеси. Стадии (c) и (d) могут включать: (i) введение набора разведений реакционной смеси в лунки планшета для анализа, покрытые первичным антителом против C3a/C5a (т.е. «связывающим антителом»); (ii) инкубацию планшета, чтобы дать возможность связывания всего C3a/C5a с первичным антителом; (iii) промывку планшета для удаления любого материала в разведениях, не связанного с первичным антителом; (iv) введение вторичного антитела, связанного с ферментом (детектирующего антитела), которое также связывается с C3a/C5a; (v) инкубацию планшета, чтобы дать возможность всему вторичному антителу связаться с C3a/C5a; (vi) промывку планшета для удаления не связанного вторичного антитела; (vii) введение химического вещества, переводимого ферментом в цветовой сигнал; и (viii) измерение поглощения в лунках планшета для определения присутствия и количества C3a/C5a.
Сэндвич-ELISA проводят способами, известными в данной области, и/или с использованием коммерчески доступных наборов согласно инструкциям производителя. Пригодными и особенно предпочтительными коммерчески доступными наборами для твердофазного иммуноферментного анализа (ELISA) являются набор Quidel Micro Vue C5a Plus EIA; A025, и набор Quidel Micro Vue C3a Plus EIA; A032.
В следующем варианте осуществления настоящего изобретения препарат антитела содержит менее 2% агрегатов 1200 кДа или выше, предпочтительно, менее 1,5%. Это относится к % от содержания иммуноглобулинов. Количество агрегатов может быть определено высокоэффективной эксклюзионной хроматографией (HPSEC). Это можно осуществлять способами, известными в данной области.
Альтернативно или дополнительно, способность препарата антитела по существу не вызывать неспецифической активации комплемента может быть определена как антикомплементарная активность препарата, составляющая мене 1,0 CH50/мг белка, более предпочтительно, менее 0,75 CH50/мг белка. Анализ для определения антикомплементарной активности в этой шкале можно проводить способом, описанным в Европейской фармакопее (способ 2.6.17, Ph. Eur. 6. Edition, 2008). Дополнительные подробности этого анализа представлены в разделе анализы ниже.
В предпочтительном варианте осуществления препарат антитела получают из сыворотки человека в отсутствие стадии, включающей химическую или ферементативную модификацию антител, т.е. способ получения препарата антител из сыворотки человека не включает стадию контакта антител с реагентом, который может вызывать их ферментативную или химическую модификацию. В частности, способ не включает контакт антител с β-пропиолактоном, вызывающим химическую модификацию антител, или не включает контакт антител с пепсином, вызывающим ферментативное расщепление антител.
Альтернативно или дополнительно, препарат антитела получают из сыворотки человека в отсутствие стадии, включающей нагревание антител до температуры 40°C или более в течение 10 минут или более. В частности, известно, что стадии нагревания могут денатурировать иммуноглобулины и вызвать агрегацию иммуноглобулинов.
Более предпочтительно, препарат антитела получают способом, способным удалять более 3 log10, предпочтительно, более 4 log10, и наиболее предпочтительно, более 5 log10 безоболочечных вирусов, таким образом, придавая препарату антитела вирусную безопасность. Препарат антитела, таким образом, является более безопасным, чем препараты антител из предшествующего уровня техники, особенно в отношении активных безоболочечных вирусов, подобных, например, парвовирусам. Это приводит в результате к препарату антитела, который является по существу свободным от вирусов и, в частности, по существу свободным от безоболочечных вирусов. Кроме того, способом по настоящему изобретению можно достигать такого уровня удаления/инактивации вирусных частиц без существенного влияния на количество активного IgM или на антикомплементарную активность препарата антитела.
В частности, препарат антитела можно получать из плазмы человека способом, включающим стадии:
(a) получения из плазмы человека фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивания C7-C9 карбоновой кислоты с раствором и обработки смешанного раствора вибросмесителем для осаждения загрязняющих белков;
(c) отделения осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов;
(d) инкубации содержащей IgM композиции иммуноглобулинов от pH 3,5 до pH 4,5 для получения инкубированного раствора;
(e) облучения инкубированного раствора УФС для получения облученного УФС раствора; и
(f) фильтрации облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку.
Является предпочтительным, чтобы способ дополнительно включал подвергание инкубированного раствора, полученного на стадии (d), нанофильтрации перед облучением на стадии (e). Дополнительные подробности и предпочтительные аспекты способа получения описаны в разделе ниже.
В следующем предпочтительном варианте осуществления изобретения препарат антитела можно вводить яванским макакам при 115 мг IgM/кг массы тела/час в отсутствие 10% или большего снижения артериального давления от уровня, предшествующего обработке. Как указано выше, неспецифическая активация комплемента вызывает гипотензию, и таким образом, отсутствие значительного изменения артериального давления указывает, что по существу не возникает неспецифической активации комплемента у здоровых обезьян in vivo. Артериальное давление можно измерять посредством вставки катетера для измерения давления в нижний отдел брюшной аорты через правую бедренную артерию.
В предпочтительном варианте осуществления препарат антитела также содержит антитела против одного или более из Pneumococcus saccharide, Escherichia coli, Enterococcus faecalis, Candida albicans и Chlamydia.
В следующем предпочтительном варианте осуществления, по меньшей мере, 90% антител в препарате антитела являются биологически активными. Термин биологически активный означает, что антитела в препарате находятся в нативной форме и, в частности, способны к активации каскада реакций комплемента в результате специфического связывания с антигеном. Биологическую активность препарата антитела можно оценивать на основании анализов для определения титра/активности связывания антитела и целостности/функции Fc, известных в данной области. В частности, в анализе in vitro на основе антигена краснухи, пригодном для определения функции Fc, активность Fc-фрагмента антител препарата антитела является такой же, как активность эталонного биологического препарата ±10%, более предпочтительно ±5%.
Эталонные биологические препараты используют в международном сообществе медицины и здравоохранения, и они помогают обеспечивать сопоставимость медицинских продуктов. В таком качестве пригодные биологические эталонные препараты для анализа известны и доступны в данной области (например, биологический эталонный препарат иммуноглобулина (партия No. 3). В частности, анализ можно проводить согласно общепринятому тесту Fc-функции иммуноглобулинов Eur. Ph. 2.7.9 (современное издание апреля 2011), в котором используют биологический эталонный препарат иммуноглобулина (партия No. 3) в качестве контроля, против которого определяют % активности препарата антитела. Этот тест включает стадии (i) нагрузки обработанных дубильной кислотой эритроцитов группы O человека вирусом краснухи для получения покрытых антигеном клеток крови; (ii) инкубации некоторого количества препарата антитела с клетками крови; добавления комплемента морской свинки для начала инициированного комплементом лизиса клеток крови; (iii) измерения кинетики гемолиза посредством зависимых от времени изменений поглощения при 541 нм; (iv) оценки функции антител из препарата антитела с использованием максимального изменения поглощения за единицу времени.
Препарат антитела предпочтительно также обладает более низкой протеолитической активностью, чем препараты антител, описанные в предшествующем уровне. В частности, протеолитическая активность не поддается детекции в препарате при его хранении в интервале 2-8°C. Протеолитическую активность можно измерять стандартизованными способами тестирования, известными в данной области, такими как способы с использованием хромогенного субстрата, описанные в разделе анализы ниже и в примере 6.
Препарат антитела по настоящему изобретению может дополнительно содержать стабилизатор, такой как глицин.
Как и в случае препаратов, известных в данной области, препарат антитела по настоящему изобретению можно хранить при 5±3°C. Однако благодаря эффективной очистке способом по настоящему изобретению, стабильность препарата антитела является необычайно хорошей. Конечный продукт является стабильным в жидкой форме в течение, по меньшей мере, 3 месяцев, предпочтительно, по меньшей мере, 6 месяцев и наиболее предпочтительно, по меньшей мере, двух лет при 2-8°C, что означает, что отсутствует фрагментация или полимеризация IgM более 1,5%, измеренных в HPSEC, увеличение протеолитической активности, уменьшение активности антитела IgM против Escherichia coli и активности антитела IgM против Pneumococcus saccharide более 25% и увеличение антикомплементарной активности более 25%, остающейся ниже 1 CH50/мг белка. Кроме того, конечный продукт, полученный способом по настоящему изобретению, является стабильным в жидкой форме в течение, по меньшей мере, 3 месяцев, предпочтительно, по меньшей мере, 6 месяцев, и наиболее предпочтительно, по меньшей мере, одного года при комнатной температуре (от 23 до 27°C), как оценено по таким же критериям.
Способ получения препарата антитела
Как описано выше, настоящее изобретение относится к получению содержащего IgM препарата антитела из фракции плазмы, содержащей иммуноглобулины. В частности, настоящее изобретение относится к способу получения препарата антитела, описанного в настоящем описании, из плазмы человека, включающему стадии:
(a) получения из плазмы человека фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивания C7-C9 карбоновой кислоты с раствором и обработки смешанного раствора вибросмесителем для осаждения загрязняющих белков;
(c) отделения осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов;
(d) и