Способ экспресс-анализа генетического полиморфизма для выявления генетической предрасположенности к раку молочной железы
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии, микробиологии и медицине. Предложен способ экспресс-анализа генетического полиморфизма для выявления генетической предрасположенности к раку молочной железы (РМЖ). На микрочипе иммобилизуют олигонуклеотиды длиной 40 оснований, содержащие генетический маркер и не содержащие генетический маркер, представленные в табл. 1, по 3 повтора каждого олигонуклеотида, а также представленные в табл. 3 олигонуклеотиды из генов домашнего хозяйства человека в качестве позитивного контроля и из генов других организмов, не имеющих гомологии в человеческом геноме, в качестве негативного контроля. Выделяют нуклеиновые кислоты из образца крови, причем используют тотальную РНК или ДНК. Получают меченый зонд для гибридизации методом реакции обратной транскрипции с одновременным мечением флуоресцентной меткой для РНК, или мечением методом ник-трансляции для ДНК. Гибридизуют полученный зонд с иммобилизованными на микрочипе олигонуклеотидами. Отмывают не специфически связавшийся зонд в условиях, дискриминирующих мутантные генотипы. Сканируют микрочип и проводят оценку результатов. Изобретение позволяет повысить специфичность и достоверность проводимого анализа и с большей достоверностью оценить риски развития РМЖ. 3 табл., 1 ил.
Реферат
Изобретение относится к молекулярной биологии, микробиологии и медицине, в частности к способам выявления и идентификации известных полиморфизмов генов, ответственных за развитие различных заболеваний, с использованием дифференцирующего олигонуклеотидного биологического микрочипа (биочипа).
Точная диагностика в сочетании с детальным анализом типа наследования того или иного заболевания имеет определяющее значение для формирования групп риска, то есть отбора пациентов, у которых вероятность возникновения заболевания повышена.
В настоящее время известно несколько методов, используемых для скрининга на различные заболевания. Например, можно выделить следующие.
Известен способ диагностики генетической предрасположенности к инфаркту миокарда у мужчин (патент РФ на изобретение №2182175, МПК C12Q 1/68, опубл. 10.05.2002), включающий выявление генотипов геномного локуса, содержащего аллель гена, отличающийся тем, что у исследуемых пациентов проводят генотипирование полиморфизма V64I гена CCR2 и при выявлении генотипа геномного локуса 3q21, содержащего аллель гена хемокинового рецептора CCR2 с заменой G на А в 190-й позиции кодирующей части, приводящей к замене V на I в 64-й позиции аминокислотной последовательности белка CCR2 641, диагностируют генетическую предрасположенность к инфаркту миокарда у мужчин.
Недостатком известного способа является недостаточная специфичность экспресс-анализа, обусловленная тем, что данный способ оценивает всего лишь один фактор из множества влияющих на риск развития сердечно-сосудистых заболеваний и поэтому не может дать полной информации о пациенте.
Известен анализ и применение полиморфных форм PARI для оценки риска сердечно-сосудистых заболеваний (Заявка №2005136430, 2006.04.20), основанный на выявлении точечных мутаций в гене PARI. Изолированная полинуклеотидная последовательность гена PARI отличается тем, что в положении 3090 последовательности согласно NM_001992 имеется замена Т на С.
Недостаток данного способа в ограниченной информативности и невозможности предсказать риски развития различных патологий, сердечнососудистой системы, независимых от гена PARI.
Общий недостаток вышеперечисленных методов: их нецелесообразно применять для массового скрининга, т.к. они трудоемки и позволяют диагностировать только одно заболевание.
Наиболее близкими к предлагаемым являются способ экспресс-анализа генетического полиморфизма для определения фармакогенетического статуса человека и выявления генетической предрасположенности к онкологическим заболеваниям, биочип и набор олигонуклеотидов по патенту РФ на изобретение №2303634 (МПК C12N 15/11, опубл. 27.07.2007). Способ основан на проведении оригинального варианта мультиплексной полимеразной цепной реакции (ПЦР) в две стадии с последующей гибридизацией флуоресцентно меченного фрагмента ДНК на биологическом микрочипе, содержащем оригинальный набор дифференцирующих олигонуклеотидов, а также процедуры регистрации и интерпретации результатов.
Недостатком известного способа и биочипа является использование мультиплексной полимеразной цепной реакции (ПЦР). Проведение ПЦР достаточно трудоемко, на ее проведение требуется много времени, и поэтому не может охватывать большое количество патогенных мутаций, что снижает специфичность и достоверность проводимого анализа.
Задача, решаемая предлагаемым изобретением, заключается в повышении специфичности и достоверности экспресс анализа при упрощении его проведения. В основу изобретения положена также задача создания биочипа, обеспечивающего оптимальное функционирование иммобилизованных в нем биологических макромолекул для выявления патогенных мутаций в кодирующих регионах значимых для заболевания генов и мутаций вне кодирующих регионов, а также в межгенных промежутках как маркеров диагностируемого заболевания.
Поставленная задача решается тем, что в способе экспресс-анализа генетического полиморфизма для выявления генетической предрасположенности к диагностируемому заболеванию, включающем верификацию патогенных мутаций в клиническом образце НК путем дифференцированной гибридизации меченых зондов из НК пациента, предусматривающем следующие стадии:
- иммобилизация на микрочипе олигонуклеотидов;
- выделение нуклеиновых кислот из образца крови пациента;
- получение меченого зонда для гибридизации;
- гибридизация полученного меченого зонда с иммобилизованными на микрочипе олигонуклеотидами;
- отмывание не специфически связавшегося зонда в условиях, дискриминирующих мутантные генотипы;
- сканирование микрочипа и получение результатов;
- общая оценка результатов анализа;
согласно изобретению:
- на микрочипе иммобилизуют олигонуклеотиды длиной 25-60 оснований, содержащие и не содержащие генетический маркер (3 печатные точки для каждого олигонуклеотида), а также олигонуклеотиды из генов домашнего хозяйства человека и из генов других организмов, не имеющих гомологии в человеческом геноме;
- меченый зонд получают методом реакции обратной транскрипции с одновременным мечением флуоресцентной меткой для РНК или мечение методом ник-трансляции для ДНК, причем, используют тотальную РНК или ДНК из клеток клинического образца.
Иммобилизация на микрочипе олигонуклеотидов длиной 25-60 оснований повышает специфичность гибридизации и, как следствие, вероятность обнаружения патогенной мутации. В сочетании с 3 повторами каждого олигонуклеотида, позитивными и негативными контролями это повысит специфичность и достоверность проводимого экспресс-анализа.
Получение меченого зонда из тотальной РНК или ДНК клинического образца также повышает специфичность гибридизации и достоверность результатов. Кроме того, позволяет упростить проведение экспресс-анализа за счет исключения дополнительных операций.
Заявляемый способ позволяет получить более полную комплексную оценку генетических предрасположенностей пациента к диагностируемому заболеванию, и с большей достоверностью оценить риски развития этого заболевания.
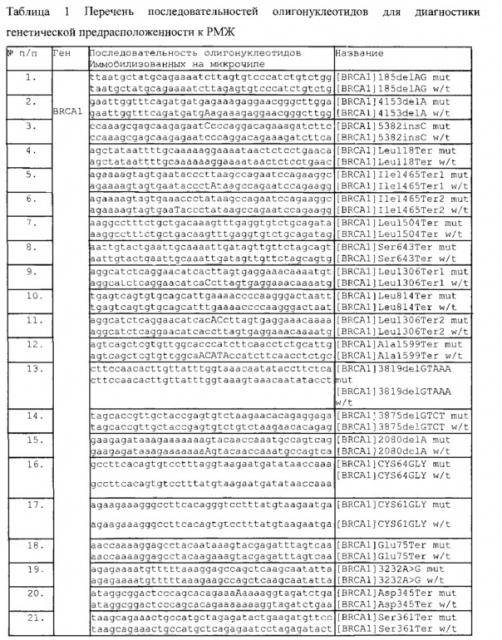
Последовательность олигонуклеотидов, содержащих генетический маркер, определяет какое именно заболевание будет диагностироваться. Так, для диагностики генетической предрасположенности к заболеванию раком молочной железы (РМЖ) целесообразно в качестве олигонуклеотидов, содержащих генетический маркер, использовать олигонуклеотиды с последовательностью, приведенной в табл. 1.
Предложенный набор генетических маркеров достаточно полно охватывает известные патогенные мутации, вызывающие предрасположенность к развитию РМЖ, а длина и последовательности олигонуклеотидов, содержащих патогенные мутации позволяет надежно дискриминировать мутантные аллели от аллелей дикого типа, даже если они отличаются всего лишь однонуклеотидной заменой.
Для диагностики предрасположенности к сколиозу целесообразно в качестве олигонуклеотидов, содержащих генетический маркер, использовать олигонуклеотиды с последовательностью, приведенной в табл. 2
Разработанный авторами набор генетических маркеров так же, как и набор маркеров для диагностики предрасположенности к РМЖ, обеспечивает высокую специфичность и достоверность экспресс-анализа.
При необходимости диагностики других заболеваний составляют последовательность олигонуклеотидов, включающую оптимальное число известных патогенных мутаций, характерных для каждого конкретного заболевания.
Поставленная задача решается тем, что в биочипе, представляющем собой подложку с набором иммобилизованных на ней олигонуклеотидов, согласно изобретению, подложка выполнена из прозрачного материала с покрытием, обеспечивающим прочное связывание олигонуклеотида с поверхностью подложки, набор иммобилизованных олигонуклеотидов включает последовательности длиной 25-60 оснований, содержащие и не содержащие генетический маркер (3 повтора каждого олигонуклеотида), а также олигонуклеотиды из генов домашнего хозяйства человека и из генов других организмов, не имеющих гомологии в человеческом геноме.
Для диагностики генетической предрасположенности к РМЖ на биочипе целесообразно иммобилизировать содержащие генетический маркер олигонуклеотиды в последовательности, приведенной в табл. 1.
Для диагностики генетической предрасположенности к сколиозу на биочипе целесообразно иммобилизировать содержащие генетический маркер олигонуклеотиды в последовательности, приведенной в табл. 2.
Иммобилизация на подложке олигонуклеотидов, содержащих и не содержащих генетический маркер, позволяет одновременно определять наличие патогенной мутации и ее статус без дополнительных операций, усложняющих проведение экспресс-анализа.
Наличие на биочипе олигонуклеотидов из генов домашнего хозяйства человека и из генов, не имеющих гомологии в человеческом геноме, обеспечивают контроль за правильностью проведения выделения нуклеиновых кислот из образца крови пациента, реакции обратной транскрипции, мечения, гибридизации, и отмывки микрочипа. Такой контроль также повышает специфичность и достоверность экспресс-анализа.
Для позитивного и негативного контролей целесообразно иммобилизовать на микрочипе олигонуклеотиды из генов домашнего хозяйства человека и из генов других организмов, не имеющих гомологии в человеческом геноме, в последовательности, приведенной в табл. 3.
Поставленная задача решается тем, что для диагностики предрасположенности к РМЖ используется набор олигонуклеотидов для идентификации патогенных мутаций с последовательностями, представленными в табл. 1.
Для диагностики предрасположенности к сколиозу используется набор олигонуклеотидов для идентификации генетических маркеров с последовательностями, представленными в табл. 2.
Последовательности не мутантных олигонуклеотидов в обоих случаях берут из стандартных последовательностей генов, опубликованных в базе данных http://www.ncbi.nlm.nih.gov.
Предлагаемое изобретение поясняется фигурой, на которой схематически изображен заявляемый биочип и таблицами, где в таблице 1 приведен перечень последовательностей олигонуклеотидов для диагностики генетической предрасположенности к РМЖ, в таблице 2 - перечень последовательностей олигонуклеотидов для диагностики генетической предрасположенности к сколиозу, в таблице 3 - перечень последовательностей олигонуклеотидов для позитивных и негативных контролей.
Предложенный биочип представляет собой подложку 1, выполненную из прозрачного материала с покрытием, обеспечивающим прочное связывание олигонуклеотида с поверхностью подложки. На подложке 1 иммобилизованы последовательности олигонуклеотидов длиной 25-60 оснований, не содержащие 2 и содержащие 3 генетический маркер (по 3 повтора каждого олигонуклеотида), а также олигонуклеотиды 4 из генов домашнего хозяйства человека и олигонуклеотиды 5 из генов других организмов, не имеющих гомологии в человеческом геноме.
Пример конкретной реализации заявляемого способа, биочипа и набора олигонуклеотидов для диагностики предрасположенности к РМЖ.
На подложке 1 из стекла размером 25×75×1 мм, покрытой материалом, обеспечивающим прочное сцепление олигонуклеотидов с поверхностью (SuperEpoxy 3 от Arrayit), иммобилизованы олигонуклеотиды 2 и 3, перечисленные в таблице 1, методом роботизированной печати на принтере микрочипов SpotBot® 2 от компании Arrayit.
В качестве позитивных и негативных контролей, подтверждающих правильность выполнения всех операций по процессингу микрочипа и повышающих надежность анализа, на микрочипе иммобилизованы олигонуклеотиды 4 и 5, перечисленные в таблице 3.
Из клинического образца, 5 мл, венозной крови методом центрифугирования выделена лейкоцитарная фракция, из которой при помощи набора RNeasy Protect Cell Mini Kit от QIAGEN, выделена тотальная РНК.
При помощи Набора SuperScript VILO от Invitrogen проведена реакция обратной транскрипции с одновременным мечением при добавлении в реакционную смесь Су5 CTP от Perkin Elmer.
После реакции получения кДНК и мечения, смесь меченых зондов очистили от не включившейся метки при помощи Fluorescent Probe Purification Kit, Single Column Format от Arrayit.
Меченый зонд смешали с буфером для гибридизации, поместили на напечатанный на подложке 1 микрочип под покровное стекло, и провели гибридизацию в герметичной гибридизационной камере при соответствующей температуре, обеспечивающей дискриминацию мутантных аллелей от аллелей дикого типа.
После гибридизации микрочипы были отмыты в серии буферов при условиях, обеспечивающих отмывку не специфически связавшихся зондов.
Отмытый микрочип был отсканирован на сканнере SureScan Microaaray Scanner от Agilent Technologies, и проанализирован при помощи программного обеспечения Agilent Microarray Control. При общем анализе все позитивные 4 контрольные точки на скане микрочипа светятся, а негативные 5 контрольные точки нет, из чего сделан вывод, что процедуры выделения РНК, получения кДНК, мечения, гибридизации и отмывки проведены правильно, и позитивным сигналам из точек печати мутантных аллелей маркеров можно доверять. Так как, олигонуклеотиды с мутантными 3 и нормальными 2 аллелями маркеров напечатаны друг под другом, то столбцы точек печати нормальных 2 аллелей должны светиться все и во всех трех повторах, за исключением случаев, когда носитель какой либо мутации является гомозиготой по этой мутации. В случае гетерозиготности носителя по какой либо мутации, будут светиться точки печати и мутантного 3, и нормального 2 вариантов. Один индивид может быть носителем нескольких мутаций в одном или разных генах, в гомозиготном или гетерозиготном состоянии, и эти факты дают основу для расчета рисков возникновения и развития рака молочной железы у носителя мутаций до проявления клинических симптомов заболевания.
Пример конкретной реализации заявляемого способа, биочипа и набора олигонуклеотидов для диагностики предрасположенности к сколиозу.
На подложке из стекла размером 25×75×1 мм, покрытой материалом, обеспечивающим прочное сцепление олигонуклеотидов с поверхностью (SuperEpoxy 3 от Arrayit), иммобилизованы олигонуклеотиды, перечисленные в таблице 2, методом роботизированной печати на принтере микрочипов SpotBot® 2 от компании Arrayit.
В качестве позитивных и негативных контролей, подтверждающих правильность выполнения всех операций по процессингу микрочипа и повышающих надежность анализа, на микрочипе иммобилизованы олигонуклеотиды, перечисленные в таблице 3.
Из клинического образца, 5 мл, венозной крови пациента с диагностированным идиопатическим сколиозом методом центрифугирования выделена лейкоцитарная фракция, из которой при помощи набора QIAamp DNA Mini Kit была выделена тотальная ДНК.
Выделенная ДНК была помечена методом ник-трансляции при помощи набора PromoFluor-550 Nick Translation Labeling Kit. Меченый зонд был очищен при помощи Fluorescent Probe Purification Kit от Arrayit.
Меченый зонд смешали с буфером для гибридизации, поместили на напечатанный на стеклянном носителе микрочип под покровное стекло, и провели гибридизацию в герметичной гибридизационной камере при соответствующей температуре, обеспечивающей дискриминацию мутантных аллелей от аллелей дикого типа.
После гибридизации микрочипы были отмыты в серии буферов при условиях, обеспечивающих отмывку не специфически связавшихся зондов.
Отмытый микрочип был отсканирован на сканнере SureScan Microaray Scanner от Agilent Technologies, и проанализирован при помощи программного обеспечения Agilent Microarray Control.
Если при общем анализе все позитивные контрольные точки на скане микрочипа светятся, а негативные контрольные точки нет, то сделан вывод, что процедуры выделения ДНК, мечения при помощи ник-трансляции (или другим способом), гибридизации и отмывки проведены правильно, и позитивным сигналам из точек печати мутантных аллелей маркеров можно доверять. Так как, олигонуклеотиды с мутантными и нормальными аллелями маркеров напечатаны друг под другом, то столбцы точек печати нормальных аллелей должны светиться все и во всех трех повторах, за исключением случаев, когда носитель какой либо мутации является гомозиготой по этой мутации. В случае гетерозиготности носителя по какой либо мутации, будут светиться точки печати и мутантного, и нормального вариантов. Один индивид может быть носителем нескольких мутаций в одном или разных генах, в гомозиготном или гетерозиготном состоянии, и эти факты дают основу для расчета рисков возникновения сколиоза у пациента еще до проявления клинических симптомов заболевания.
Способ экспресс-анализа генетического полиморфизма для выявления генетической предрасположенности к раку молочной железы, включающий верификацию патогенных мутаций в клиническом образце нуклеиновой кислоты (НК) путем дифференцированной гибридизации меченых зондов из НК пациента, предусматривающий следующие стадии:
- иммобилизация на микрочипе олигонуклеотидов;
- выделение нуклеиновых кислот из образца крови пациента;
- получение меченого зонда для гибридизации;
- гибридизация полученного меченого зонда с иммобилизованными на микрочипе олигонуклеотидами;
- отмывание не специфически связавшегося зонда в условиях, дискриминирующих мутантные генотипы;
- сканирование микрочипа и получение результатов;
- общая оценка результатов анализа;
отличающийся тем, что
- на микрочипе иммобилизуют олигонуклеотиды длиной 40 оснований, содержащие генетический маркер, представленные в табл. 1, и не содержащие генетический маркер, по 3 повтора каждого олигонуклеотида, а также представленные в табл. 3 олигонуклеотиды из генов домашнего хозяйства человека в качестве позитивного контроля и из генов других организмов, не имеющих гомологии в человеческом геноме, в качестве негативного контроля;
- меченый зонд получают методом реакции обратной транскрипции с одновременным мечением флуоресцентной меткой для РНК в качестве клинического образца, или мечением методом ник-трансляции для ДНК в качестве клинического образца, причем используют тотальную РНК или ДНК.