Штаммы lactobacillus brevis и lactobacillus rhamnosus с установленной последовательностью генома, синтезирующие глутатион и комплекс внутриклеточных антиоксидантов
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии и фармакологии и касается штаммов Lactobacillus brevis 47f, Lactobacillus rhamnosus 313, Lactobacillus rhamnosus 40f и Lactobacillus brevis 15f, способных синтезировать антиоксидант глутатион. Штаммы депонированы во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационными номерами ВКПМ В-12237, ВКПМ В-12236, ВКПМ В-12238 и ВКПМ В-12077 соответственно. Изобретение включает выделение, идентификацию, описание свойств и нуклеотидной последовательности генов. Штаммы могут быть использованы для получения препаратов сопровождения при химиотерапии онкологически больных с целью предотвращения и лечения лекарственной энтеропатии и сопутствующих заболеваний. Группа изобретений позволяет предотвратить тяжелые осложнения лекарственной энтеропатии. 4 н.п. ф-лы, 1 ил., 9 табл., 12 пр.
Реферат
Изобретение относится к фармакологии и медицине, в качестве нового пробиотика, в частности для сопровождения химио- и лучевой терапии онкологических заболеваний для предотвращения дисбактериоза и воспалительных процессов слизистых оболочек и кишечника.
Штаммы могут быть использованы в производстве функционального питания (йогурт) и для получения препаратов, используемых для профилактики и в комплексном лечении лекарственной энтеропатии. Противовоспалительные свойства штамма - продуцента антиоксидантов, требуются для предотвращения тяжелого осложнения лекарственной энтеропатии - мукозита кишечника.
Уровень техники
Огромную роль в жизнедеятельности организма человека играет микробном, совокупность населяющих его микроорганизмов (преимущественно бактерий). Наиболее сложным по общему числу микроорганизмов и числу составляющих его видов является микробном кишечника. Совокупность микроорганизмов, населяющих кишечник, выполняет многочисленные функции: участвует в переваривании пищи, подавляет патогенную микрофлору, проявляет антиканцерогенные и иммуномодулирующие свойства (Role of the normal gut microbiota. Jandhyala S.M., Talukdar R. et al. // World J Gastroenterol 2015 August 7; 21(29): 8787-8803; Gut microbiota and gastrointestinal health: current concepts and future directions. Aziz Q., Dore J. et al. // Neurogastroenterol Motil (2013) 25: 4-15; Pathways and functions of gut microbiota metabolism impacting host physiology. Krishnan S., Alden N., Lee K. // Current Opinion in Biotechnology 2015, 36. P: 137-145; The gut microbiota and host health: a new clinical frontier. Marchesi J.R., Adams D.H. et al. // Gut 2015; Sep. 2 P: 1-10).
Населяющие ЖКТ бактерии выделяют ряд биологически-активных веществ. Показано, что некоторые из пробиотических компонентов микрофлоры кишечника обладают антиоксидантными (Antioxidant properties of potentially probiotic bacteria: in vitro and in vivo activities. Amaretti A., M. di Nunzio et al., Appi Microbiol Biotechnol (2013) 97:809-817; Probiotics and Oxidative Stress T.Kullisaar. et al. University of Tartu, Bio-competence Centre of Healthy Dairy products LCC, Estonia, 2012), антимутагенными (DNA-protection and antioxidant properties of fermentates from Bacillusamyloliquefaciens B-1895 and Bacillus subtilis KATMIRA1933 / Prazdnova E.V., Chistyakov V.A. et al. // Article in Letters in Applied Microbiology, Sep. 2015; Antimutagenic and anticancer effects of lactic acid bacteria isolated from Tarhana through Ames test and phylogenetic analysis by 16S rDNA. Ahmadi M.A. et al. // Nutr Cancer. 2014; 66(8): 1406-13) и противоопухолевыми свойствами (Probiotics, the New Approach for Cancer Prevention and/or Potentialization of Anti-Cancer Treatment? Daniluk // J Clin Exp Oncol 2012, 1:2; A potential role of probiotics in colorectal cancer prevention: review of possible mechanisms of action. Chong ES // World J Microbiol Biotechnol 2014; 30(2):351-74; Inhibition of Fe-induced colon oxidative stress by lactobacilli in mice. Sun J. et al. // World J Microbiol Biotechnol. 2013 Feb; 29(2): 209-16. doi: 10.1007/s11274-012-1172-5. Epub 2012 Sep 19). Синтезируют и выделяют иммуномодуляторы (Федорова И.А., Даниленко В.Н. Иммуногенные свойства пробиотического компонента микробиоты желудочно-кишечного тракта человека // Усп. соврем, биол. 2014, Т. 134, №2, С. 99-110) и нейромедиаторы (Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Bravo et al. // Proc Natl Acad Sci USA, 2011; 108: 16050-5; Normal gut microbiota modulates brain development and behavior. Diaz et al. Proc Natl Acad Sci USA, 2011, 108: 3047-52).
Пробиотические микроорганизмы - представители нормальной микрофлоры желудочно-кишечного тракта человека и животных, обладающие антагонистической активностью по отношению к патогенной микрофлоре. Пробиотики оказывают благотворное влияние на функциональное состояние жк-тракта и здоровье человека, поддерживают здоровый баланс пищеварительной системы, стимулируют иммунитет, ферментируют клетчатку, участвуют в синтезе биологически активных веществ - витаминов, пептидов, незаменимых аминокислот; подавляют действие канцерогенов и препятствуют развитию аллергии. Синтезируют антибиотикоподобные вещества, препятствующие размножению гнилостных и гноеродных бактерий (например лизоцим и ацидофилин). Лактобактерии являются пробиотическими микроорганизмами и считаются безопасными (GRAS - generally regaded as safe), они широко используются в функциональных пищевых продуктах, биологически активных добавках, лекарственных средствах. Пробиотики, и лактобактерии в частности, все чаще используются в комбинированном лечении начальных стадий различных заболеваний (язвенного колита, синдрома воспаленного кишечника, аллергических заболеваний). Существует большой интерес к пробиотикам - естественным симбионтам человека, синтезирующим биологически активные вещества, в том числе антиоксиданты (Probiotics as potential antioxidants: A Systematic Review // V. Mishra et al. // Joumal of Agricultural and Food Chemistry. 03/2015; 63(14); Health benefits of probiotics: are mixtures more effective than single strains? Chapman C.M.; Gibson G.R.; Rowland I. // EurJ Nutr. 2011, 50,1-17; Antioxidative potential of lactobacilli isolated from the gut of Indian people. Achuthan AA. et al. // Mol. Biol. Rep. 2012, 39, 7887-97).
Преимуществами использования пробиотиков в качестве лекарственных средств является их относительная безвредность и физиологичность по сравнению с химическими препаратами и возможность подбора конкретного препарата - вплоть до индивидуальной терапии - для лечения одного и того же заболевания у разных пациентов.
В соответствии с современными представлениями, вещества, обладающие антиоксидантными свойствами (АОС), играют ключевую роль в поддержании общего здоровья человека, продления его жизни и молодости. Большая часть патологических процессов в организме связана с воздействием активных форм кислорода (АФК), образующихся в процессе жизнедеятельности клетки и свободнорадикального окисления (СРО) биомолекул - белков, липидов, нуклеиновых кислот.
Использование микроорганизмов, являющихся естественными симбионтами человека, в качестве источника антиоксидантов (АО), имеет ряд преимуществ перед другими способами повышения антиоксидантного статуса организма. В отличие от химических фарм. препаратов, применение Lactobacillus позволяет поддерживать постоянную продукцию АО в физиологических дозах непосредственно в кишечнике, исключая воздействие (желудочного сока и желчи) и возможную модификацию АО молекул. Такой подход особенно перспективен при лечении воспалительных заболеваний кишечника (неспецифический колит, мукозит и т.п.).
Существует большое количество препаратов, в основном БАДов, в состав которых входят лактобациллы. Такие препараты используют для коррекции и стабилизации кишечной микрофлоры при дисбактериозах различной этиологии, лечении урогенитальных инфекций, коррекции аллергических реакций. Около пятидесяти из них зарегистрированы в России как фармпрепараты [http://www.rlsnet.ru/baa_fg_id_367.htm].
Широкое использование пробиотиков в виде БАДов выявило ряд побочных эффектов. В силу этого, возросли требования к разрабатываемым пробиотическим препаратам, ужесточились требования как в Евросоюзе так и в России. Существенными являются: полногеномное секвенирование новых используемых штаммов и выявление активных компонентов (конкретных веществ) в используемых препаратах, установление механизмов действия, включая систему передачи сигнала к конечным биомишеням на уровне органов и молекулярном уровне и др. Выполнение данных требований позволяет более полно охарактеризовать пробиотик и позиционировать его для профилактики или лечения конкретных нозологии.
Выявление основного активного механизма его действия и отнесение исследуемого комплексного препарата (пробиотика) к одному из фармацевтических классов: иммуномодулятор; антибактериальный; противовирусный; нейродепрессант; и др.
Выбор типа препарата (препарат сопровождения при комплексной терапии, основной препарат и др.) и нозологической ниши.
Комплексность препаратов пробиотиков требует установления их молекулярной структуры (в том числе на уровне ДНК) и стандартизации по основным заявленным фармакологическим свойствам, продуктам и определяющим их генам.
Полногеномное секвенирование позволяет составить аннотацию геномов: на отсутствие генов, обусловливающих патогенность и лекарственную устойчивость, локализованную на мобильных генетических элементах; на наличие генов, участвующих в синтезе нейротрансмиттеров и их ингибиторов; генов, контролирующих продукцию потенциальных иммуномодуляторов (экзополисахаридов, пектинов и др.); генов, контролирующих продукцию антиоксидантов (глутатиона, витаминов Е, С, линолевой кислоты и др.); генов детоксикации ксенобиотиков; генов, контролирующих биосинтез бактериоцинов; генов гистаминов и других аллергенных факторов.
На основе полученных результатов отбираются штаммы, потенциально способные синтезировать антиоксиданты.
Далее, проводятся исследования отобранных штаммов на способность синтезировать антиоксидант.
Основным антиоксидантным веществом, обеспечивающим лечебный эффект предложенного пробиотика является глутатион. Штаммы L.brevis 15f, Lactobacillus rhamnosus 313 и Lactobacillus rhamnosus 40 синтезируют и выделяют в среду глутатион, обладающий высокой антиоксидантной активностью.
Глутатион (2-амино-5-{[2-[(карбоксиметил)амино]-1-(меркаптометил)-2-оксоэтил]амино}-5-оксопентаноевая кислота, glutathione, GSH) - значение глутатиона в клетке определяется его антиоксидантными свойствами.
Глутатион играет в клетке важную роль и участвует во многих процессах, таких как антиоксидантная защита клетки, иммуностимуляция и активирование клеточной детоксикации (Current status and emerging role of glutathione in food grade lactic acid bacteria. Pophaly S.D. et al. // Microb.l Cell Factories. 2012. P. 11:114).
Большинство биологических функций глутатиона связаны с его конверсией из восстановленной формы в окисленную и обратно при помощи ферментов глутатион редуктазы (gshR/gor) и глутатион пероксидазы (gpo) - двух основных ферментов, участвующих в метаболизме глутатиона. Каталитический перевод восстановленной формы глутатиона(GSH) в его окисленную форму(GSSG) и дальнейшая каталитическая регенерация его восстановленной формы, позволяет поддерживать уговень глутатиона на весьма высоком уровне (Glutathione and cellular redox control in epigenetic regulation. García-Giménez JL, Ibañez-Cabellos JS, Seco-Cervera M, Pallardo FV. // Free Radic Biol Med. 2014).
Фактически, глутатион поддерживает внутриклеточный гомеостаз, определяет редокс-статус внутриклеточной среды, защищая клетку от таких токсичных агентов, как свободные радикалы и активные формы кислорода. В случае низкой концентрации внутриклеточных антиоксидантов редокс-статус клетки понижается, происходит накопление реакционно-активных частиц. При накоплении окисленных молекул происходит "кислородный взрыв", сопровождающийся повреждением клеток. Окисленные молекулы действуют на молекулярный сенсор окислительного стресса -ядерный фактор каппа В (NFkB), вызывая уход клеток в апоптоз, что приводит к массовой гибели эпителиоцитов и воспалению слизистой оболочки.
Глутатион участвует в синтезе лейкотриенов, он также важен в качестве гидрофильной молекулы, которая присоединяется ферментами печени к гидрофобным токсическим веществам в процессе их биотрансформации с целью выведения из организма (в составе желчи). Как часть глиоксалазной ферментативной системы глутатион участвует в реакции детоксификации метилглиоксаля, токсического побочного продукта метаболизма. Глутатион является субстратом реакций конъюгирования и восстановления, катализируемых глутатион-5-трансферазой в цитозоле, микросомах и в митохондриях (The potential role of the antioxidant and detoxification properties of glutathione in autism spectrum disorders: a systematic review and meta-analysis. Main P.A. et al. // Nutr Metab (London). 2012 Apr 24; 9:35.).
Все клетки организма человека способны синтезировать глутатион, тем не менее в стрессовых для организма ситуациях, жизненно необходимо поддерживать его концентрацию на достаточно высоком уровне. Например, после рождения, мыши, у которых синтез глутатиона в печени генетически нарушен, живут не более одного месяца. Смерть вызвана повреждением митохондрий и недостаточностью печени («Hepatocyte-specific GCLC deletion leads to rapid onset of steatosis with mitochondrial injury and liver failure». Chen Y. et al. // Hepatology 2007, 45: 1118.).
Для лечения онкологических заболеваний используют ряд препаратов, обладающих эффективным противоопухолевым действием, но вызывающих целый ряд побочных эффектов, в т.ч. гематологическая токсичность, воспаление слизистой оболочки кишечника (мукозит или эпителиит) и общий дисбактериоз (5-Fluorouracil-induced changes of intestinal integrity biomarkers in BALB/c mice. Song M.K., Park M.Y., Sung M.K.J. // Cancer Prev. 2013. V. 18. P. 322-329). Последние два наиболее тяжелые и требуют специальных средств коррекции. Для решения данных задач в последние годы предложено использование нескольких штаммов Lactobacillus, обладающих антиоксидантным действием (Lactobacillus fermentum, a probiotic capable to release glutathione, prevent colonic inflammation in the TNBS model of rat colitis. L. Peran, D. Camuesco, M. Comalada et al. // Int J Colorectal Dis. 2006. V.21. P. 737-746; Bifidobacterium infantis has a beneficial effect on 5-fluorouracil -induced intestinal mucositis in rats. Yuan K.T., Yu H.L., Feng W.D. et al. // Benef. Microbes. 2014. V. 6. P. 1-6).
Противовоспалительные свойства штамма - продуцента антиоксидантов требуются для предотвращения тяжелого осложнения лекарственной энтеропатии - мукозита кишечника.
Есть отдельные зарубежные работы, предлагающие штаммы Lactobacillus, имеющих перспективы клинического применения (Complete Glutathione System in Probiotic Lactobacillus fermentum ME_31 Kullisaar Т., Songisepp E., Mikelsaar M. et al. //. Applied Biochemistry and Microbiology, 2010, Vol. 46, No. 5, pp. 481-486; In vitro and in vivo antioxidant activity of Bifidobacterium animalis 01 isolated from Centenarians. Shen Q.; Shang N.; Li P. // Curr. Microbiol. 2011, 62, 1097-1103).
Существует ряд патентов на пробиотические организмы с антиоксидантной активностью: Probiotic bacteria having antioxidant activity and use thereof, Mogna G.; Strozzi G.P.; Mogna L., US 20140065116 A1, 2014; Lactobacilli with Anti-Oxidant Action / Grompone G., Degivry M-C., Legrain-Raspaud S., Chambaud I., Bourdet-Sicard R. US 20130171117 A1, 2013; Human lactobacillus casei gr x 12 with antioxidant function and application thereof. Ruixia G. Dong. L, CN 103343107 (A), 2013; A Novel lactobacillus plantarum, composition with antibacterial and antioxidant activity comprising the same and use of thereof. Ki K.S., Kyung CH. W. // KR20120023480 (А) 2012; KR101197203 2012; Method of treatment using Lactobacillus fermentum ME-3. Kullisaar Т., Zilmer M. SG11201504787V (A), 2015). Описанные в них штаммы являются ближайшим аналогом изобретения.
Недавно установлено, что геном например, Bifidobacterium longum GT15, содержит 35 уникальных генов, характерных только для популяции жителей России (Zakharevich N.V. et al., 2015). Это дает основания считать, что разработка российских штаммов лактобацилл, адаптированных для российской популяции, с учетом происхождения штамма (т.е. выделенные из ЖКТ людей - жителей центрального региона России) и препаратов на их основе необходимы в России. Депонируемые штаммы отличаются от всех описанных ранее тем, что они: 1. выделены из ЖКТ именно жителей центрального региона России; 2. имеют отличную от других заявленных штаммов последовательность генома; 3. синтезируют глутатион в больших количествах - 1.5 г/л, определяемый с помощью стандартной валидированной методики.
Раскрытие изобретения
Целью данного изобретения является представление штаммов микроорганизмов в качестве нового пробиотика - продуцента антиоксидантов (в том числе глутатиона, как основного действующего вещества) для использования в фармацевтической и пищевой промышленности, а также в медицине в качестве препарата сопровождения химио- и лучевой терапии, а так же для профилактики и лечения воспалительных заболеваний кишечника.
Отбор штаммов.
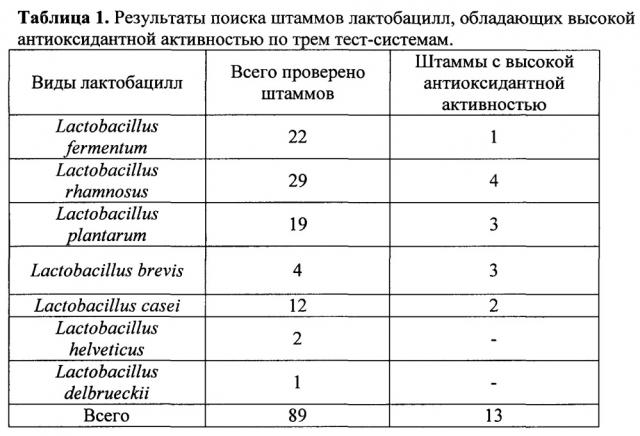
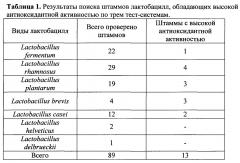
Задачей настоящего исследования является поиск и отбор штаммов лактобацилл, выделенных из организма людей - жителей центрального региона России, обладающих пробиотическими свойствами и способных синтезировать и выделять в среду глутатион и комплекс других антиоксидантов. Была проверена коллекция штаммов лактобацилл, состоящая из видов L.rhamnosus, L.fermentum, L.brevis, L.casei, L.plantarum, L.helveticus, L.delbrieckii, всего 89 штаммов, на наличие антиоксидантных свойств (Пример 1.). Штаммы выращивали в среде MRS в атмосфере CO2 при 37°С в течение 18-48 часов. Определяли наличие антиоксидантных свойств и, в частности, глутатиона при помощи биолюминесцентного и биохимического анализов.
Были отобраны четыре штамма, принадлежащие к этим видам, имеющие достаточно высокий уровень продукции антиоксидантов и характеризующиеся рядом пробиотических свойств - Lactobacillus brevis 47f, Lactobacillus rhamnosus 313 и Lactobacillus rhamnosus 40f и L.brevis 15f.
Штамм L.brevis 47f выделен из фекалий здоровой женщины в возрасте 38 лет, которая на момент обследования была клинически здорова, не имела в анамнезе инфекционных и соматических заболеваний желудочно-кишечного тракта и других систем органов, в 2010 г.
Штамм L.rhamnosus 313 выделен из слюны здоровой девушки в возрасте 19 лет, которая на момент обследования была клинически здорова, не имела в анамнезе инфекционных и соматических заболеваний желудочно-кишечного тракта и других систем органов, в 2013 г.
Штамм L.rhamnosus 40f выделен из фекалий здоровой девушки в возрасте 19 лет, которая на момент обследования была клинически здорова, не имела в анамнезе инфекционных и соматических заболеваний желудочно-кишечного тракта и других систем органов, в 2010 г.
Штамм L.brevis 15f выделен в 2010 г. в г. Твери из фекалий здоровой девушки в возрасте 19 лет, которая на момент обследования была клинически здорова, не имела в анамнезе инфекционных и соматических заболеваний желудочно-кишечного тракта и других систем органов.
Штаммы не являются генетически модифицированным и не содержат генов других организмов; перенесенных генов резистентности; генетических изменений, связанных с использованием генно-технических методик. Не являются зоопатогенными, не являются фитопатогенными, не представляют опасности по другим причинам.
Геномы штаммов были секвенированы и аннотированы в соответствии с требованиями Евросоюза по биобезопасности.
Штаммы охарактеризованы в соответствии с требованиями по биобезопасности, опубликованными в Фармакопейной статье «Пробиотики для медицинского применения» Министерства здравоохранения Российской Федерации (Государственный стандарт качества лекарственных средств).
Штаммы депонированы во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ), Геномы депонированы в международную базу GenBank (Пример 2)
Штамм L.brevis 47f депонирован в ВКПМ (г. Москва) 26.03.2015 г. В-12237; в GenBank WGS LBHR00000000;
Штамм L.rhamnosus 313 депонирован в ВКПМ (г. Москва) 26.03.2015 № В-12236; в GenBank WGS LFNB00000000;
Штамм L.rhamnosus 40i депонирован в ВКПМ (г. Москва) 26.03.2015 № В-12238; в GenBank WGS LFNA00000000.
Штамм L.brevis 15 f депонирован в ВКПМ (г. Москва) 10.10.2014 № В-12077; в GenBank WGS JXCD00000000
Определение видовой принадлежности патентуемых штаммов.
Определение видовой принадлежности штамма L.brevis 47f было проведено по нуклеотидной последовательности гена 16S РНК.
Для определения вида по гену 16S РНК использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT) (Lane, D. J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Штамм был идентифицирован как L.brevis. (Пример 3).
Определение видовой принадлежности штамма L.rhamnosus 313 было проведено по нуклеотидной последовательности гена 16S РНК; 2. НП межгенного района, предшествующего первому гену оперона FOF1 синтазы; 3. НП 8-ми генов «домашнего хозяйства» и 3-х систем токсин-антитоксин. Выделенный штамм лактобацилл по результатам анализа был идентифицирован как Lactobacillus rhamnosus (Пример 4).
Определение видовой принадлежности штамма L.rhamnosus 40f было проведено по нуклеотидной последовательности гена 16S РНК; 2. наличия и НП 5-ти систем токсин-антитоксин, специфичных для вида L.rhamnosus. Выделенный штамм лактобацилл по результатам анализа был идентифицирован как L.rhamnosus (Пример 5).
Определение видовой принадлежности штамма L.brevis 15f было проведено по нуклеотидной последовательности гена 16S РНК. Штамм был идентифицирован как L.brevis. (Пример 6).
Культурально-морфологические особенности штаммов:
Штамм Lactobacillus rhamnosus 40f представляет собой грам-положительные бесспоровые палочки короткие и длинные с закругленными концами, некоторые расположены в цепочку, 2-5 мкм. При культивировании на жидких средах в течение 22-24 ч происходит равномерное помутнение среды по всему ее объему с образованием осадка. При выращивании на поверхности агаризованных сред образуются колонии S-формы, выпуклые, гладкие, светло-желтого или белого цвета с ровными краями. Диаметр колонии 1-2 мм. Время культивирования 48 часов. Температура инкубации 37°С.
Штаммы L.brevis 47f, и L.rhamnosus 313 при культивировании на твердой среде MRS в течение 48 часов образуют колонии S-формы с диаметром 2 мм, выпуклые, гладкие, белого цвета с ровными краями. При культивировании в жидкой среде MRS в течение 18 и более часов происходит равномерное помутнение среды по всему ее объему, кроме зоны аэробиоза, с образованием осадка. При микроскопировании обнаруживаются одиночные грамположительные палочки правильной формы с округлыми концами, 2-5 мкм. По данным свойствам штаммы L.brevis 47f, и L.rhamnosus 313 неотличимы друг от друга.
Штамм L.brevis 15f грамположительные бесспоровые палочки короткие и длинные (2-5 мкм) с закругленными концами, некоторые расположены в цепочку. Выросшие колонии S-формы 1-2 мм, выпуклые, гладкие, светло-желтого или белого цвета с ровными краями. При культивировании в жидкой среде MRS в течение 22-24 ч происходит равномерное помутнение среды по всему ее объему, кроме зоны аэробиоза, с образованием осадка.
Способ, условия и состав сред для размножения штаммов.
Штаммы культивировали на жидкой и агаризованной средах MRS (Himedia) в течении 24-48 час. Состав среды MRS на 1 литр в граммах: протеозопептон - 10,0; мясной экстракт - 10,0; дрожжевой экстракт - 5,0; глюкоза - 20,0; полисорбат 80 - 1,0; цитрат аммония - 2,0; ацетат натрия - 5,0; сульфат магния - 0,1; сульфат марганца - 0,05; фосфат калия двузамещенный - 2,0. рН (при 25°С) 6,5. Культивирование осуществляли как в анаэробных условиях с использованием анаэростата и системы GasPak+, так и в аэробном режиме. Температура инкубации 37°С.
Активность (продуктивность) штаммов.
В MRS-бульоне продуктивность штаммов достигала 109 KОЕ/мл.
Антиоксидантная активность определялась биолюминесцентным методом на тест-системе с рекомбинантными штаммами E.coli, несущими lux-оперон (Lux-биосенсоры для детекции SOS-ответа, теплового шока и окислительного стресса. Котова В.Ю., Манухов И.В., Завильгельский Г.Б. // Биотехнология, 2009, №6, С. 16-25) (Пример 7).
Общий уровень поглощающей способности активных форм кислорода, таких как супероксид-анион, гидроксильный радикал и другие стабильные неорганические радикалы, определялся при помощи стандартной методики по скорости восстановления окрашенного метастабильного катион - радикала 2,2'-азинобис (3-этил-бензотиазолин-6-сульфоновой кислоты) (ABTS+•), образующегося в присутствии миоглобина и перекиси водорода (Antiradical and antioxidant activity of total anthocyanins from Perillapankinen is decne. Gulcin I. et al. // J. Ethnopharmacol. 2005, 101, 287-293) (Пример 8).
Для определения уровня глутатиона в культуральной жидкости штаммов, был проведен анализ при помощи набора реактивов НТ Glutathione Assay Kit (Trevigen, Catalog #7511-100-K). В основу метода положена реакция сульфгидрильных групп GSH с DTNB (5,5'-дитиобис-2-нитробензойной кислотой, реагент Эллмана) с образованием 5-тио-2-нитробензойной кислоты (TNB) желтого цвета и смешанного дисульфида GSTNB (Пример 9).
Антагонистическое действие на бактериальные и дрожжевые тест-культуры выявляли методом агаровых слоев (Блинкова, 2003) на бактериальных тест-штаммах: S.aureus ATCC 25923, B.subtilis 534, E.coli ATCC 25922, Sh.sonnei I фазы 941, P.aeruginosa ATCC 9027, Salmonella enterica typhimurium 415, C.albicans ATCC 885-653. (Пример 10)
Штаммы L. brevis 47f и L. rhamnosus 313 проявили высокую антагонистическую активность по отношению к S.aureus, B.subtilis, Sh.sonnei, P.aeruginosa; среднюю - по отношению к S.enterica.
Штамм L. rhamnosus 40f проявил высокую антагонистическую активность по отношению к B.subtilis, Sh.sonnei,; среднюю - по отношению к S.enterica, P.aeruginosa, S.aureus
Устойчивость (чувствительность) к антибиотикам.
Штамм L.brevis 47f устойчив к канамицину, амикацину, полимиксину В, ванкомицину, стрептомицинуя, линкомицину, ампициллину; чувствителен к рифампицину, хлорамфениколу, азитромицину, олеандомицину, эритромицину, тетрациклину, неомицину, гентамицину.
L.rhamnosus 313 устойчив к канамицину, неомицину, амикацину, полимиксину В, ванкомицину, стрептомицину; промежуточно устойчив к гентамицину; чувствителен к рифампицину, хлорамфениколу, азитромицину, олеандомицину, эритромицину, тетрациклину, линкомицину, ампициллину.
Штамм L.rhamnosus40f устойчив к канамицину, неомицину, амикацину, полимиксину В, ванкомицину; чувствителен к рифампицину, хлорамфениколу, азитромицину, олеандомицину, эритромицину, тетрациклину, линкомицину, ампициллину, стрептомицину, гентамицину.
У штаммов L.brevis 47f, L.rhamnosus 313 и L.rhamnosus 40f отсутствует ДНК-азная, РНК-азная и казеиназная активности.
Продукты, синтезируемые штаммами:
При выращивании в питательном бульоне MRS патентуемые штаммы синтезируют и секретируют в среду глутатион и комплекс антиоксидантов, обладающий высокой антиоксидантной и генопротекторной активностью.
Гены, кодирующие глутатион у патентуемых штаммов
У патентуемых штаммов было установлено наличие генов, кодирующих ферменты, ответственные за синтез, транспорт и восстановление окисленного глутатиона (γ-glutamylcystiene synthetase (GSHA), glutathione peroxidase (GPO), glutathione reductase (GSHR) и putative glutathione transport proteins (CydC и CydD)), отвечающие за пробиотические свойства штамма. (Пример 11).
Позиции генов метаболизма глутатиона, определенных у штаммов L.brevis 47f., L.rhamnosus 313, L.rhamnosus 40f и L.brevis 15fa соответситвующих геномах приведены в табл. 9. (Пример 12).
Таким образом, способность штаммов L.brevis 47f, L.rhamnosus 313, L.rhamnosus 40f и L.brevis 15f продуцировать глутатион, антагонистическая активность по отношению к патогенной и условно-патогенной микрофлоре, отсутствие протеазной и др. активностей делают возможным использование штаммов по отдельности и в составе различных смесей бактериальных штаммов при производстве функциональных продуктов питания и лекарственных средств в виде лиофилизированных препаратов, капсул, жидких культур и других аналогичных средств для сопровождения химио- и лучевой терапии онкологических заболеваний, для предотвращения дисбактериоза и воспалительных процессов кишечника. Штаммы отличны от всех описанных ранее штаммов L.brevis и L.rhamnosus, продуцирующих комплекс антиоксидантов в т.ч. глутатион, т.к. выделены из организма людей - жителей центрального региона Российской Федерации и имеют уникальную последовательность генов кодирующих глутатион, и
Примеры по характеристике получения и свойствам штамма L.brevis 47f, L.rhamnosus 313 и L.rhamnosus 40f по настоящему изобретению.
Пример 1
Проверка коллекшии штаммов, при помощи биолюминесцентного анализа на основе рекомбинантных штаммов Е.coli,
Пример 2
Базовые аннотации геномов штамма L.brevis 47f, L.rhamnosus 313 и L.rhamnosus 40f, депонированные в GenBank
Пример 3
Определение видовой принадлежности штамма Lactobacillus brevis 47f
1. Для определения вида по гену 16S РНК использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT) (Lane, D.J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1563 пн; определяли 500 пар нуклеотидов, с 46 по 595.
Результат однозначно свидетельствует о принадлежности штамма к виду L.brevis.
Пример 4
Определение видовой принадлежности штамма Lactobacillus rhamnosus 313.
1. Для определения вида по гену 16S РНК использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT) (Lane, D.J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1558 пн; определяли НП 1392 нуклеотидов, с 69 по 1460.
Данный метод не позволяет отнести штамм 313 однозначно к одному из 4-х видов (L.rhamnosus, L.zeae, L.casei, L.paracasei).
2. Помимо гена 16S рРНК мы используем в работе видоспецифические праймеры и НП межгенного района, предшествующего первому гену оперона F0F1 синтазы atpB (Полуэктова Е.У., Даниленко В.Н
Патент Ru 2508406 "Метод видовой идентификации лактобацилл L.casei/paracasei, L.fermentum, L.plantarum, L.rhamnosus". 2012 г.). Величина этого района у L.rhamnosus составляет 298 пн. Праймеры для выделения данного участка ДНК:
Нуклеотидная последовательность фрагмента:
Данная нуклеотидная последовательность имеет следующую идентичность с ДНК лактобацилл:
| С ДНК L.rhamnosus | 99-100% |
| С ДНК L.zeae | ≤83% |
| С ДНК L.casei | ≤83% |
| С ДНК L.paracasei | ≤80% |
Что свидетельствует о принадлежности штамма к виду L.rhamnosus.
3. Кроме того, проведено типирование штамма по НП 8-ми генов «домашнего хозяйства» [parB, recG, isoleu, recA, leu, ychF (GTP-depending NA-binding protein), strC, spaC] и 3-м системам токсин-антитоксин, специфичным для вида L.rhmnosus (RelE1Lrh, RelBE3Lrh, PemK1-A1Lrh - Klimina et al., 2013. Identification and characterization of toxin-antitoxin systems in strains of Lactobacillus rhamnosus, isolated from humans. Anaerobe. № P. 1-8).
Пример 5
Определение видовой принадлежности штамма Lactobacillus rhamnosus 40f.
1. Для определения вида по гену 16S РНК использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT) (Lane, D.J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1558 пн; определяли НП 800 нуклеотидов, с 44 по 843.
2. Кроме того, проведено типирование штамма по 5-ти системам токсин-антитоксин, специфичным для вида L.rhamnosus (RelE1Lrh, RelBE3Lrh, PemK1-A1Lrh, PemK2-A2Lrh, YefM-YoeBLrh - Klimina et al., 2013. Identification and characterization of toxin-antitoxin systems in strains of Lactobacillus rhamnosus, isolated from humans. Anaerobe. № P. 1-8).
Пример 6
Определение видовой принадлежности штамма L.brevis 15f
Использовали стандартные праймеры 27f (AGAGTTTGATCCTGGCTCAG) и 1492r (GGTTACCTTGTTACGACTT); (Lane, D.J. 1991. 16S/23S rRNA sequencing. In: Nucleic Acid Techniques in Bacterial Systematics, pp. 115-175. Edited by E. Stackebrandt & M. Goodfellow. Chichester: Wiley). Ген состоит из 1563 пн; определяли НП 500 пн (с 46 по 545).
Пример 7
Определение антиоксидантных свойств биолюминесцентным методом.
Для работы нами были использованы 3 биосенсора на основе штамма E.coli K12:
MG1655 (pSoxS-lux), MG1655(pKatG-lux) и MG1655 (pColD-lux), несущие рекомбинантную плазмиду с lux-опероном люминесцирующей бактерии Photorhabdus luminescens, слитым с промоторами генов супероксидисмутазы SoxS, катазазы KatG и колицина ColD. Штаммы E.coli, несущие lux-оперон, под воздействием индукторов окислительного стресса или ДНК-повреждающих веществ начинают активно продуцировать люциферин-люциферазный комплекс, что приводит к повышению уровня биолюминесценции.
Для индукции окислительного стресса в биосенсорах E.coli MG1655(pKat-lux) и MG1655(pSox-lux), соответственно, использовали перекись водорода и паракват, который вызывает формирование в клетке супероксид-анион-радикала. Для индукции SOS-ответа в биосенсоре E.coli MG1655(pColD-lux) был использован антибактериальный ДНК-повреждающий агент диоксидин. В качестве контроля служили растворитель (вода или раствор ДМСО). Интенсивность биолюминесценции измеряли на микропланшетном люминометре Beckman coulter DTX880 при комнатной температуре и через определенные интервалы времени.
Измерение уровня индуцированной люминесценции в присутствии образцов культуральных жидкостей (Iind/кж) проводили в сравнении с уровнем спонтанной люминесценции культуры (I0), индуцированной люминесценции (Iind) и индуцированной в присутствии стандартного антиоксиданта (Iind/AO).
Вычисления и обработку экспериментальных данных проводили по формулам:
и
Где IКЖ% и IAO% - относительная эффективность культуральной жидкости и антиоксиданта соответственно.
Пример 8
Определение антиоксидантных свойств: определение общего количества антиоксидантов в культуральной жидкости
Был проведен анализ при помощи набора Antioxidant Assay Kit (Sigma CS0790) для определения общего количества низкомолекулярных антиоксидантов. В основу метода положена реакция взаимодействия антиоксидантов с окрашенным метастабильным катион - радикалом 2,2'-азинобис (3-этил-бензотиазолин-6-сульфоновой кислоты) (ABTS+•).
Схему реакции можно представить следующим образом:
Где HX-Fe(III) - метмиоглобин, •X-[Fe(IV)=O] - феррилмиоглобин
Для получения ABTS+• в режиме on-line использована реакция жидкофазного окисления диаммонийной соли 2,2'-азинобис(3-этил-бензотиазолин-6-сульфоновой кислоты). В качестве окислителя выступает радикал феррил-миоглобина, формирующийся из миоглобина и перекиси водорода. Полученный радикал окисляет ABTS с получением катион-радикала ABTS+•. Полученный катион-радикал имеет в структуре хромоген, обеспечивающий его зеленую окраску.
Количество ABTS+• определяли по поглощению при 405 нм. В качестве стандарта или контрольного антиоксиданта использовать тролокс - водорастворимый аналог витамина Е.
Вычисление концентрации антиоксиданта относительно тролоксового стандарта (X, мМ) проводили по формуле:
Где Y(А405) - уровень абсорбции образца при 405 нм
Int - пересечение тролоксовой кривой с осью Y
Slope - наклон стандартной тролоксовой кривой;
Df - суммарное разведение исходного образца до добавления в реакционную смесь в лунке.
Пример 9
Определение антиоксидантных свойств: определение общего количества глутатиона в культуральной жидкости
Для определения уровня глутатиона в культуральной жидкости штаммов, был проведен анализ при помощи набора НТ Glutathione Assay Kit (Trevigen, Catalog # 7511-100-K). В основу метода положена реакция сульфгидрильных групп GSH с DTNB (5,5'-дитиобис-2-нитробензойной кислотой, реагент Эллмана) с образованием 5-тио-2-нитробензойной кислоты (TNB) желтого цвета и смешанного дисульфида GSTNB. Глутатионредуктаза уменьшает концентрацию окисленного глутатиона за счет его восстановления, а накопление смешанного дисульфида GSTNB мешает глутатионредуктазе рециркулировать глутатион и производить больше TNB. Скорость TNB производства прямо пропорционально этому процессу переработки, которые, в свою очередь прямо пропорционально концентрации глутатиона в образце (Рис. 1). Измерение оптической плотности раствора при 405 или 414 нм обеспечивает точную оценку глутатиона в образце.
Пример 10
Определение антагонистической активности штаммов.
Антагонистическую активность определяли при помощи модификации метода отсроченного антагонизма в агаре (Muriana Р.М., Klaenhammer Т.R. 1987. Conjugal transfer of plasmid-encoded determinants for bacteriocin production and immunity in Lactabacillus acidophilus 88. Appl. Environ. Microbiol. 53, 553-560). Для этого на поверхность плотной питательной среды MRS-агар бактериологической петлей бляшками с диаметром 15 мм засевали 24 часовые культуры лактобактерий и культивировали 24 часа при 37°С в анаэробных условиях. После культивирования круглым металлическим пробойником с диаметром 16 мм удаляли фрагмент агара с выросшими бактериями. Затем на подготовленные таким образом чашки наносили 5,5 мл расплавленной и остуженной до 50°С полужидкой (0,5% агара) среды Columbia agar, в которую предварительно вносили 0,1 мл суточной культуры индикаторного штамма. После 18-часовой инкубации при 37°С измеряли величину зон задержки роста от края удаленной бляшки до края роста индикаторных штаммов. Исследования по определению антагонистической активности по отношению к индикаторным штаммам микроорганизмов повторяли три раза. Из полученных данных вычисляли среднюю величину. Полученные результаты представлены в таблице 7.
Степень антагонизма определяли по следующим критериям:
10 мм и менее - низкая,
10-20 мм - средняя,
21 мм и более - высокая.
Р - резистентность.
Пример 11
Гены, кодирующие глутатион у патентуемых штаммов и их положение в геноме.
Пример 12
Нуклеотидная последовательность генов gpo и gshR/gor метаболизма глутатиона у штаммов L.brevis 47f, L.rhamnosus 40f, L.rhamnosus 313 и L.brevis 15f.
1. Штамм Lactobacillus brevis 47f ВКПМ № В-12237, способный к синтезу антиоксиданта глута