Способ лечения первичного мужского гипогонадизма в эксперименте
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к экспериментальной медицине и андрологии. Для лечения первичного мужского гипогонадизма в эксперименте проводят трансплантацию аллогенной ткани костного мозга лабораторному животному с первичным мужским гипогонадизмом, смоделированным на основании временной ишемии тестикул. Для моделирования осуществляют ишемическое воздействие с помощью наложения лигатуры в одностороннем порядке с одновременным удалением контралатерального тестикула путем открытой селективной перевязки семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока сроком на 3 суток. При этом лигатуру накладывают с силой деформирующего воздействия 3-4 Н. Трансплантацию аллогенной ткани костного мозга осуществляют путем инъекции под белочную оболочку тестикула клеточно-гелевого комплекса. Комплекс состоит из клеточной массы аллогенного костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум. Соотношение объема вносимой клеточной массы к объему гидрогеля Сферо®ГЕЛЬ составляет 1:1-1,5:1. Способ обеспечивает высокую эффективность лечения гипогонадизма на экспериментальной модели данной патологии при снижении побочных и искажающих чистоту эксперимента эффектов. 8 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной медицине и андрологии, и предназначено для лечения первичного мужского гипогонадизма в эксперименте.
Первичный мужской гипогонадизм - патологическое состояние, обусловленное уменьшением уровня андрогенов в организме или снижением чувствительности к ним. Первичный гипогонадизм вызван нарушением функции половых желез (Дедов И.И. и др. Эндокринология. М.: Гэотар-Медиа, 2007). Андрогены играют ключевую роль не только в поддержании репродуктивной и сексуальной функций мужского организма. Прослеживается взаимосвязь между снижением уровня андрогенов и деминерализацией костей, саркопенией, нарушением метаболизма жиров, депрессией, повышенной утомляемостью, угасанием когнитивных функций и пр. (Dohle GR et al. Guidelines on male hypogonadism, Arnhem (The Netherlands), Europian Assotiation of Urology, 2012). Имеются данные о том, что снижение уровня тестостерона и увеличение - 17β-эстрадиола коррелируют с повышенным риском сердечно-сосудистых заболеваний и сердечно-сосудистой смертности (Corona G. et al. Hypogonadism as a risk factor for cardiovascular mortality in men: a meta-analytic study. Eur J Endocrinol. 2011; 165(5):687-701).
На сегодняшний день основным методом лечения первичного мужского гипогонадизма остается заместительная терапия андрогенами, которая имеет ряд противопоказаний и побочных эффектов. Успешно устраняя некоторые симптомы андрогенодефицита, экзогенный тестостерон подавляет сперматогенез и лишь усугубляет такое значимое проявление гипогонадизма, как мужская инфертильность (Kliesch S. Testosterone and infertility. Urologe A 2010; 49(1):32-6). Согласно европейским рекомендациям в рамках лечения мужского бесплодия заместительная терапия тестостероном строго противопоказана (Jungwirth A., Guidelines on male infertility, Arnhem (The Netherlands), European Association of Urology; 2013).
Таким образом, существует потребность в поиске новых подходов к лечению первичного мужского гипогонадизма, нацеленных на восстановление собственного андроген-продуцирующего аппарата.
Так, из уровня техники известен, например, способ лечения первичного мужского гипогонадизма в эксперименте, заключающийся в ксенотрансплантации обогащенных клеточных культур плодов человека в пространство между капсулой и семенными канальцами тестикула экспериментальной модели с абдоминальным крипторхизмом (Охоботов Д. А. Влияние культур, обогащенных стволовыми клетками, на сперматогенез при экспериментальном двухстороннем крипторхизме. Автореф. дисс., М., 2008, с. 8-14). Способ позволяет добиться полноценного сперматогенеза у лабораторных животных с экспериментально смоделированным первичным гипогонадизмом по сравнению с контрольной группой, однако обладает рядом существенных недостатков. Так, в способе используют модель с экспериментальным двухсторонним крипторхизмом, для которой характерно частое самопроизвольное восстановление половой функции у животного; кроме того, получение обогащенных клеточных культур (стволовых и прогениторных клеток костного мозга, фетального яичка) от человеческих плодов 16 недель гестации, а также моноклональных кроличьих антител к суммарному антигену сперматозоидов человека для оценки выживаемости клеточных культур сопряжено с рядом трудностей как технического, так и этического характера.
Наиболее близким к предлагаемому способу является способ лечения первичного мужского гипогонадизма в эксперименте, заключающийся в трансплантации аллогенной ткани костного мозга лабораторному животному с первичным мужским гипогонадизмом, смоделированным на основании временной ишемии тестикул (Куликов А.В. и др. Новая модель и способ компенсации первичного мужского гипогонадизма. Материалы симпозиума «Новейшие методы клеточных технологий в медицине», 2-6 сентября 2014 г., Новосибирск, с. 30). Способ прост и доступен, однако также обладает рядом существенных недостатков. Так, в представленном источнике информации не раскрыто, какие именно манипуляции представляет собой создание временной ишемии тестикул, как и куда именно осуществляют аллотрансплантацию костного мозга, что существенно ограничивает применение данного способа на практике.
Таким образом, существует потребность в способе лечения первичного мужского гипогонадизма в эксперименте, лишенном всех вышеуказанных недостатков.
Техническим результатом настоящего изобретения является простота и доступность, высокая эффективность лечения гипогонадизма, основанная на точной и контролируемой экспериментальной модели данной патологии, практически лишенной побочных и искажающих чистоту эксперимента эффектов.
Этот технический результат достигается тем, что в предлагаемом способе лечения первичного мужского гипогонадизма в эксперименте, включающем трансплантацию аллогенной ткани костного мозга лабораторному животному с первичным мужским гипогонадизмом, смоделированным на основании временной ишемии тестикул, для эксперимента используют модель, которой осуществляют ишемическое воздействие с помощью наложения лигатуры в одностороннем порядке с одновременным удалением контралатерального тестикула путем открытой селективной перевязки семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока сроком на 3 суток, при этом накладывают лигатуру с силой деформирующего воздействия 3-4 Ньютон (Н), а трансплантацию аллогенной ткани костного мозга осуществляют путем инъекции под белочную оболочку тестикула клеточно-гелевого комплекса, состоящего из клеточной массы аллогенного костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум, причем соотношение объема вносимой клеточной массы к объему гидрогеля Сферо®ГЕЛЬ составляет 1:1-1,5:1.
Способ осуществляют следующим образом.
Исследование проводили на крысах-самцах Wistar (n=199), возраст два месяца (соответствует массе 200-220 г). Животные были поделены на три группы:
- со смоделированным гипогонадизмом и последующей трансплантацией клеточно-гелевого комплекса под белочную оболочку тестикул (группа Э, n=66),
- со смоделированным гипогонадизмом без последующей трансплантации клеток костного мозга, первая контрольная группа (ГГ, n=66)
- интактные животные, вторая контрольная группа (И, n=67).
Ишемическое воздействие на тестикулы осуществляли путем временного наложения лигатуры в одностороннем порядке. Лигатуру накладывали путем открытой селективной перевязки семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока. Лигатуру накладывали под контролем портативного динамометра таким образом, чтобы сила ее воздействия составила 3-4 Н. Данную манипуляцию проводили при помощи хирургической иглы и нити (Vicryl Plus, Johnson & Johnson). Концы нити, выведенные из-под лигируемых сосудов, однократно связывали между собой. Полученную петлю зацепляли за крючок динамометра и затягивали до достижения величины силы воздействия на шкале динамометра 3-4 Н, после чего фиксировали лигатуру вторым узлом.
Минимальный срок окклюзии, после которого не отмечалось восстановления массы и размеров семенников на отдаленных сроках после инициации гипогонадизма (два месяца и более) - трое суток.
Одномоментно с наложением лигатуры проводили удаление контралатерального тестикула.
Через 45 суток после инициации гипогонадизма экспериментальной группе трансплантировали клеточно-гелевый комплекс, состоящий из клеточной массы костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум, причем соотношение объема вносимой клеточной массы к объему гидрогеля Сферо®ГЕЛЬ составляет 1:1-1,5:1. Костный мозг извлекали из бедренных костей крыс-доноров, предварительно подвергнутых эвтаназии путем введения летальной дозы анестетика (Золетил 200 мг/на кг массы тела). Отобранный костно-мозговой пунктат смешивали с биодеградируемым гидрогелем Сферо®ГЕЛЬ медиум, насыщение гранул Сферо®ГЕЛЬ проводили неотцентрифугированной массой костного мозга в стерильных условиях в течение 30 минут. Все манипуляции проводили под общей анестезией экспериментальных животных. Экспериментальным путем нами были получены данные о наиболее эффективном соотношении объема клеточной массы костного мозга к объему гидрогеля Сферо®ГЕЛЬ - оно составляет 1:1-1,5:1. При меньших объемах костного мозга регенеративные процессы проходили медленнее, при больших - не происходило адекватной адгезии клеток костного мозга на гранулах Сферо®ГЕЛЬ и часть клеток погибала. Также экспериментально был выбран из всей линейки Сферо®ГЕЛЬ гидрогель Сферо®ГЕЛЬ медиум, плотность и свойства гранул которого оптимальны для клеточной адгезии.
Животных содержали в стандартных условиях вивария при температуре 21-23°C. Они получали сбалансированный гранулированный корм, свободный доступ к питьевой воде. Исследования проводили по протоколам, одобренным Комиссией по этике Института теоретической и экспериментальной биофизики РАН. Работа выполнена с соблюдением принципов Хельсинкской декларации о гуманном отношении к животным, принципов гуманности, изложенных в директиве Европейского сообщества (86/609/ЕС), в Приказе Минздрава СССР №755 от 12 августа 1977 г. «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных». Статистическую обработку данных проводили с помощью программ Statistica 6.0, Microsoft Office Excel 2010.
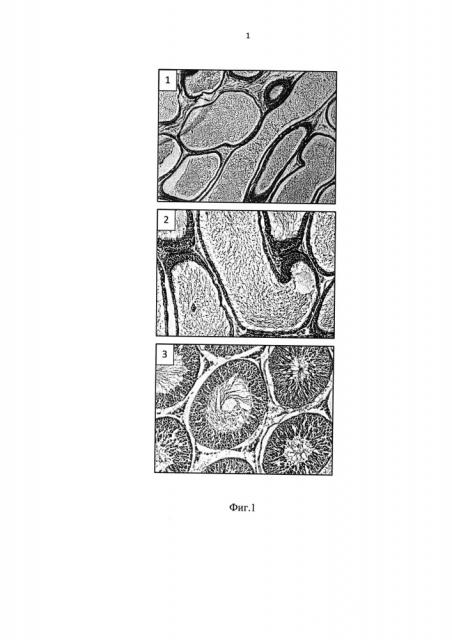
Проводили исследование и сравнительный анализ гистологических препаратов, полученных через пять недель (Фиг. 1) и через 7 недель (Фиг. 2) после инициации гипогонадизма (1 - группа И, 2 - группа Э, 3 - группа ГГ). Так, анализ показал, что гистологические и цитологические картины активного сперматогенеза очень схожи между собой в группах (1) и (2); соответственно в группе (3) картина пониженного сперматогенеза и отсутствие зрелых форм сперматозоидов.
Проводили измерение уровня общего тестостерона на иммуноферментном автоматическом анализаторе HTI BioChem Analette, измеряли массу тестикул непосредственно до трансплантации костного мозга, через 45 суток и через 8 месяцев (что соответствует возрасту исследуемых животных 3,5 месяца, 5 месяцев и 11,5 месяцев). Измерение общего тестостерона показало, что уровень этого гормона у всех экспериментальных животных на всех исследуемых сроках после инициации гипогонадизма резко снижен по сравнению с интактными животными (р<0,05) - (Фиг. 3 - график, представлена группа Э и контрольные группы, ГГ и И на сроке 8 мес после гипогонадизма). Проводили тест на фертильность, для чего к одному самцу через 45 суток после трансплантации клеток костного мозга подсаживали 5 половозрелых самок, оценивали количество оплодотворенных самок. Нами было показано, что у всех животных со смоделированным первичным гипогонадизмом исходный уровень общего тестостерона и масса семенников (Фиг. 4 - график, представлена группа Э и две контрольные группы, ГГ и И, на сроке 8 мес после инициации гипогонадизма) значимо меньше этого показателя у группы И, что подтверждает адекватность использования временной контролируемой окклюзии семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока для инициации гипогонадизма. Через 45 суток у группы Э уровень общего тестостерона был значимо выше (в 2,17 раз), чем у группы ГГ, что сопровождалось значимо большей массой семенников у группы Э - в 1,6-2,0 раз больше, чем у остальных групп. Уровень тестостерона и масса семенников через 45 суток после инъекций клеточно-гелевого комплекса в группе Э значимо не отличались от этих показателей в группе И того же возраста.
Через 8 месяцев после трансплантации клеток костного мозга уровень общего тестостерона и масса семенников в группе Э превосходила этот показатель группы с ГГ в 2,00 и 2,58 раз соответственно. Тест на фертильность показал восстановление репродуктивной функции самцов в группе Э. Исследуемые самцы из этой группы оплодотворяли всех подсаженных самок.
Средний уровень общего тестостерона в группе Э до трансплантации и группе ГГ составил 0,08 (+/-0,034) нг/мл, средняя масса семенников - 0,51 (+/-0,086) г (возраст исследуемых животных 3,5 месяца). Показатели в группе И, соответствующей по возрасту, - средний уровень общего тестостерона 1,70 (+/-0,98) нг/мл, средняя масса семенников - 1,947 (+/-0,1) г.
Через 1,5 месяца после трансплантации в группе Э (возраст исследуемых животных 5 месяцев) средний уровень общего тестостерона составил 2,39 (+/-1,06) нг/мл, средняя масса семенников - 0,9 (+/-0,44) г, тогда как у самцов в группах ГГ соответствующего возраста средний уровень общего тестостерона составил 1,1 (+/-0,9) нг/мл, средняя масса семенников - 0,55 (+/-0,32) г. Показатели для группы И, соответствующей по возрасту, - средний уровень общего тестостерона составил 2,26 (+/-0,95) нг/мл, средняя масса семенников - 1,74 (+/-0,22) г.
Через 8 месяцев после трансплантации в группе Э (возраст исследуемых животных 11,5 месяцев) средний уровень общего тестостерона составил 0,47 (+/-0,08) нг/мл, средняя масса семенников - 0,67 (+/-0,08) г, тогда как у самцов в группе ГГ соответствующего возраста средний уровень общего тестостерона составил 0,23 (+/-0,08) нг/мл, средняя масса семенников - 0,26 (+/-0,02) г. Показатели для группы И, соответствующей по возрасту, - средний уровень общего тестостерона составил 0,94 (+/-0,57) нг/мл, средняя масса семенников - 1,8 (+/-0,15) г.
Среди существенных признаков, характеризующих способ, отличительными являются:
- наложение лигатуры в одностороннем порядке с одновременным удалением контралатерального тестикула;
- открытая селективная перевязка семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока;
- сила деформирующего воздействия лигатуры составляет 3-4 Н;
- трансплантацию осуществляют путем инъекции под белочную оболочку тестикула;
- трансплантат представляет собой клеточно-гелевый комплекс, состоящий из клеточной массы аллогенного костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум, причем соотношение объема вносимой клеточной массы к объему гидрогеля Сферо®ГЕЛЬ составляет 1:1-1,5:1.
Между совокупностью существенных признаков и заявляемым техническим результатом существует причинно-следственная связь. Так, наложение лигатуры в одностороннем порядке с одновременным удалением контралатерального тестикула позволяет повысить точность исследования за счет воздействия на единственный тестикул. Открытая селективная перевязка семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока и определенный диапазон силы деформирующего воздействия лигатуры позволяет снизить и практически исключить риск некроза тестикула, подвергающегося воздействию, при этом максимально точно смоделировать первичный гипогонадизм у лабораторного животного. Трансплантация путем инъекции под белочную оболочку тестикула клеточно-гелевого комплекса позволяет достигнуть пролонгации регенераторного потенциала аллогенных костно-мозговых стромальных клеток-предшественников, обеспечения адаптивной среды-окружения для них. Оптимальный размер частиц Сферо®ГЕЛЬ медиум позволяет поддержать жизнеспособность аллогенных клеток костного мозга и простимулировать регенеративные процессы в области тестикул в течение необходимого срока для восстановления тканей.
Таким образом, предлагаемый способ прост, доступен, имеет доказанную высокую эффективность лечения гипогонадизма, основанную на точной и контролируемой экспериментальной модели данной патологии, практически лишенной побочных и искажающих чистоту эксперимента эффектов.
Способ лечения первичного мужского гипогонадизма в эксперименте, включающий трансплантацию аллогенной ткани костного мозга лабораторному животному с первичным мужским гипогонадизмом, смоделированным на основании временной ишемии тестикул, отличающийся тем, что для эксперимента используют модель, которой осуществляют ишемическое воздействие с помощью наложения лигатуры в одностороннем порядке путем открытой селективной перевязки семенной вены и артерии в проксимальной части семенного канатика с сохранением коллатерального кровотока сроком на 3 суток, при этом накладывают лигатуру с силой деформирующего воздействия 3-4 Н, одновременно с наложением лигатуры удаляют контралатеральный тестикул, а трансплантацию аллогенной ткани костного мозга осуществляют путем инъекции под белочную оболочку тестикула клеточно-гелевого комплекса, состоящего из клеточной массы аллогенного костного мозга и биодеградируемого гетерогенного гидрогеля Сферо®ГЕЛЬ медиум, причем соотношение объема вносимой клеточной массы к объему гидрогеля Сферо®ГЕЛЬ составляет 1:1-1,5:1.