Способ получения водных растворов наночастиц серебра с природным восстановителем
Иллюстрации
Показать всеИзобретение может быть использовано в медицине, косметологии и пищевой промышленности. Для получения наночастиц серебра сначала готовят водный раствор стабилизатора. В качестве стабилизатора используют β-циклодекстрин или натрия бис(2-этилгексил)сульфосукцинат. Концентрация β-циклодекстрина находится в диапазоне от 0,6⋅10-3 до 1,2⋅10-3 М. Концентрация натрия бис(2-этилгексил)сульфосукцината находится в диапазоне от 1,0⋅10-3 до 3,0⋅10-3 М. Затем в раствор стабилизатора вводят водный щелочной раствор флавоноида кверцетина. В полученный раствор при постоянном перемешивании вводят раствор диамминнитрата серебра до заданной молярной концентрации, составляющей от 0,4⋅10-3 до 4⋅10-3 М. Введение в раствор стабилизатора раствора кверцетина проводят до молярной концентрации кверцетина, равной 0,1 от вышеуказанной молярной концентрации диамминнитрата серебра. Изобретение позволяет получить наночастицы со средним размером 14-16 нм, снизить токсичность растворов наночастиц серебра для живых организмов и повысить концентрацию наночастиц в растворе. 4 з.п. ф-лы, 9 ил., 3 пр.
Реферат
Изобретение относится к способам получения водных растворов наночастиц металлов, предназначенных для применения в медицине, косметологии и пищевой промышленности.
Известно, что в развитии науки и технологий за последние два десятилетия наблюдается значительный рост исследований свойств наноразмерных частиц и различных наноматериалов, что связано с широким спектром возможностей их практического применения. Прикладные разработки в этом направлении за рубежом успешно внедряются в производство предприятиями наноиндустрии; есть основания полагать [1-3], что дальнейший прогресс в этом направлении позволит успешно решать многие проблемы (энергообеспечения, экологии, повышения уровня жизни, борьбы с эпидемиями и снижения смертности от различных заболеваний и др.), встающие на современном этапе развития человеческой цивилизации. В то же время становится все более очевидным, что широкое внедрение нанотехнологий, означающее по существу переход на более высокий уровень научно-технического прогресса, влечет за собой и новые опасности, вследствие малой изученности свойств нанообъектов и содержащих их систем, а также возможности проявлений их еще неизвестных свойств и особенностей поведения в реальных условиях применения.
Наиболее явной из таких опасностей является угроза возникновения различных заболеваний (нанопатологий), связанных с проникновением наночастиц в живой организм, прежде всего в организм человека, или действием на него наноструктурных материалов в виде средств для медицины и косметологии, изделий, применяемых в бытовой технике и другой продукции нанотехнологических производств [4-6]. Таким образом, возникает проблема определения условий использования продукции наноиндустрии, безопасных для человека и окружающей среды. В последнее время этой проблеме уделяется большое внимание как в научной литературе, так и в документах государственных органов, ответственных за здравоохранение в разных странах мира, в том числе и в нашей стране [4, 7, 8]. В связи с этим подчеркивается необходимость систематических исследований биологического действия наночастиц и наноматериалов, прежде всего определение степени их токсичности для человека при различных вариантах их практического применения.
Наибольшее внимание здесь уделяется наночастицам металлов, которые являются одним из наиболее популярных объектов прикладных разработок для применения в химии, технике и медицине, и уже широко используются в производстве как продукции для медицины, так и товаров широкого потребления. Исследования биологической активности наночастиц металлов проводятся путем определения влияния на жизнеспособность и функциональную активность живых организмов (главным образом животных клеток и целостных организмов) либо самих наночастиц, либо содержащих наночастицы материалов. Поскольку жизнедеятельность биологических объектов протекает в водной среде, наночастицы можно использовать только в виде водного раствора, а модифицированные ими материалы должны сохранять свои специфические свойства при контакте с водной средой. По этой причине, среди множества методов получения наночастиц металлов, предложенных за последние 10-15 лет, для исследований их биологических эффектов могут использоваться только наночастицы, получаемые в виде водного раствора. При этом способ получения должен быть приемлем для практического применения, поскольку в противном случае исследования биологического действия наночастиц теряют смысл.
Для получения наночастиц металлов в водных растворах наиболее часто используются методы, основанные на восстановлении ионов металла в растворе в условиях, благоприятствующих формированию наночастиц. Методы различаются, главным образом, по типу восстановителя и стабилизатора (вещества, способствующего сохранению наночастиц в растворе в наноразмерном состоянии). При этом синтез наночастиц может проводиться путем (1) химического восстановления - с применением химических восстановителей и стабилизаторов (чисто химический синтез) или с применением источников тока или излучения, обеспечивающих восстановление гидратированным электроном и другими восстановительными частицами (фотохимический, радиационно-химический и электрохимический синтез), и (2) биологического восстановления - с использованием водных сред, содержащих биологические восстановители и стабилизаторы (биологический или «зеленый» синтез). В последнем случае используют водные экстракты различных биологических объектов (зеленых растений, грибов, бактерий и др.). Обзор названных методов синтеза металлических наночастиц можно найти в недавно опубликованной монографии [9]. В последнее десятилетие стали применяться также плазменные технологии, позволяющие получать мелкодисперсные порошки металлических наночастиц в инертной матрице. При этом водные растворы наночастиц получают путем диспергирования этих порошков в водной среде (например, [10, 11]).
Для безопасного использования продукции для медицины особенно важно учитывать опасности применения наночастиц серебра и содержащих их материалов, поскольку именно эти наночастицы стали в последние годы наиболее популярны в медицине, санитарии и других областях, связанных с действием наночастиц на живые организмы. Это обусловлено, прежде всего, их высокой антимикробной активностью; результатам соответствующих исследований и обсуждению возможностей полезных приложений бактерицидных свойств наночастиц серебра посвящена обширная литература (например, [12-14], а также [9] (гл. 6) и цитированная здесь литература). Для создания безопасных лекарственных препаратов или материалов, содержащих наночастицы серебра, необходимо получать водные растворы таких наночастиц, обладающие высокой антимикробной активностью и одновременно достаточно низкой токсичностью для организма человека. Для решения этой задачи в последние 10-15 лет проводятся исследования действия одного и того же раствора наночастиц на культуры бактерий и нормальные культурированные клетки человека. К сожалению, насколько нам известно, такие параллельные исследования весьма немногочисленны, что не позволяет сделать однозначный вывод о возможности создания соответствующих лекарственных препаратов.
Поиски новых эффективных средств борьбы с онкологическими заболеваниями показали, в частности, что, помимо антимикробной активности, наночастицы серебра обладают также цитотоксичностью в отношении различных видов злокачественных клеток. Такие данные были получены для водных растворов наночастиц в исследованиях их действия на жизнеспособность и функциональную активность различных клеточных культур [15]. Это дает основания полагать, что на основе растворов этих наночастиц возможно создание лекарственных препаратов для онкологии, достаточно эффективных и в то же время не вызывающих столь серьезных побочных эффектов, которые отмечаются для применяемых в настоящее время препаратов в химиотерапии. Но и в этом случае необходимо получать растворы наночастиц, которые проявляют, в одной и той же концентрации, высокую токсичность для злокачественных клеток данного типа и низкую токсичность для нормальных клеток соответствующего органа или ткани.
К настоящему времени установлено, что действие наночастиц серебра на культурированные клетки как бактерий, так и млекопитающих, существенно зависит от способа получения наночастиц. Таким образом, для разработки как антимикробных, так и противоопухолевых препаратов на основе наночастиц серебра, актуальной задачей является создание способа получения водных растворов этих наночастиц, обеспечивающего их высокую эффективность как действующего компонента в лекарственных препаратах и одновременно низкую токсичность для организма человека. На основе анализа используемых в настоящее время методов получения наночастиц, а также имеющегося у нас опыта развития оригинального метода биохимического синтеза наночастиц металлов ([9], гл. 2-4), ранее были определены основные требования, которым должен удовлетворять способ получения водных растворов наночастиц, чтобы их можно было применять в биологии и медицине. Такими требованиями являются:
(1) высокая производительность и экономичность (возможность получения больших количеств раствора с высокой концентрацией наночастиц с использованием низкозатратной технологии),
(2) получение наночастиц малого размера с возможно более узким распределением,
(3) стабильность наночастиц на воздухе в течение длительного времени и
(4) минимальная токсичность и экологическая безопасность наночастиц и модифицированных ими материалов (более подробно см. [9], гл. 1, 4).
Названные выше требования используются ниже при рассмотрении ряда известных способов получения водных растворов наночастиц серебра. Вначале обсуждаются известные способы химического восстановления, затем биологического восстановления ионов серебра в водном растворе.
Способы, использующие химическое восстановление
За последние годы предложен ряд химических способов получения водных растворов наночастиц серебра, описанных в патентной литературе. Из чисто химических методов это в основном изобретения, которые могут применяться в химии и технике. Из уровня техники известен «способ получения водной суспензии коллоида благородного металла» (см. заявку на патент РФ №2010136285, МПК B01J 37/16, 10.03.2012), где ионы металлов (в том числе серебра) в водном растворе восстанавливаются солью четвертичного аммония при высоком рН. Полученные наночастицы могут использоваться в качестве катализатора после нанесения на твердую подложку. Известен также «способ получения наночастиц серебра с модифицированной лигандной оболочкой в высоковязкой матрице» (см. патент РФ №2526967, МПК В82В 3/00, B01J 13/00, В82В 1/00, 27.08.2014), где наночастицы получают в водном растворе восстановлением боргидридом и стабилизируются синтетическим (поливиниловым спиртом) или природным полимером (желатином). Такой способ может применяться в областях техники, где востребованы упорядоченные структуры наночастиц (например, в оптоэлектронных устройствах). Из способов этой группы, предложенных для применения, помимо химии и нанотехнологии, также в медицине, известен «способ получения наночастиц серебра» (см. патент РФ №2526390, МПК C01G 5/00, В82В 3/00, B82Y 40/00, 20.08.2014). Наночастицы здесь получают путем инкубации водного раствора соли серебра с аминокислотой (цистеином), в результате чего происходит полимеризация аминокислоты (предположительно через образование мостиковых связей HS-Ag-SH) и затем ионы серебра восстанавливаются боргидридом. При этом получают наночастицы, стабилизированные полимером, со средним гидродинамическим радиусом (по утверждению авторов) 20 нм. Недостатками этого способа являются: (1) использование химического восстановителя (токсичность для персонала и окружающей среды), (2) техническая сложность и дороговизна (длительное время, необходимое для полимеризации при определенных концентрациях реагентов, а также высокая стоимость аминокислоты). Кроме того, как следует из приведенной в патенте гистограммы, полученной методом динамического светорассеяния, для частиц в растворе регистрируется бимодальное распределение по размерам, причем наибольший вклад вносят частицы с диаметром более 100 нм. Из гистограммы очевидно, что средний размер наночастиц существенно превышает указанные авторами 20 нм. Поскольку для наночастиц серебра отмечалась тенденция к снижению антимикробной активности с увеличением размера частиц, (см. [9], гл. 6), для получаемых таким способом наночастиц вряд ли можно ожидать заметного бактерицидного эффекта.
Известен способ получения композиций наночастиц серебра путем восстановления ионов серебра в водном растворе водорастворимыми полимерами, которые одновременно являются стабилизаторами (см. патент РФ №2485051, МПК C01G 5/00, В82В 3/00, 20.06.2013). Процесс идет на воздухе при комнатной температуре и обычном освещении, что позволяет упростить процедуру и сократить энергозатраты по сравнению с предыдущими двумя способами. Недостатками этого способа являются технически сложная процедура получения полимерных композиций и неэкологичность (невозможность биодеградации) применяемых синтетических полимеров, что затрудняет использование таких наночастиц в качестве лекарственных средств или добавок к медицинским препаратам.
Способы, использующие источники тока или излучения
Из уровня техники известен способ получения водных растворов наночастиц серебра путем электрохимического восстановления ионов металла в водном растворе, содержащем органические и неорганические стабилизаторы (см. заявку на патент РФ №2008127628, МПК A61K 33/38, C01G 5/00, В82В 3/00, 27.05.2010). В известном способе ионы серебра поступают в раствор при электрохимическом растворении серебряного анода; образование наночастиц происходит в растворе в результате восстановления ионов неорганическими восстановителями (цитратами щелочных металлов и аммония), а также на катоде из нержавеющей стали, где восстановителями служат электроны, присутствующие на поверхности катода. Наночастицы солюбилизируются в растворителе (дистиллированной воде) и стабилизируются с помощью названных выше неорганических восстановителей (одновременно играющих роль стабилизаторов) а также органических стабилизаторов. В качестве органических стабилизаторов используются синтетические полимеры (поливинилирролидон, полиакрилат натрия и др.) или природный полимер (желатин). Как утверждают авторы, известный способ обеспечивает высокий выход и высокую стабильность наночастиц серебра. Вместе с тем, этот способ имеет недостатки, общие для электрохимических методов - он требует применения дорогостоящего оборудования и является весьма энергоемким, поэтому полученные здесь наночастицы являются дорогими, что затрудняет их внедрение в широких масштабах.
Известен способ получения водных растворов наночастиц серебра путем фотохимического восстановления ионов металла в водном растворе в присутствии неорганического (додецилсульфат натрия) или органических стабилизаторов (см. патент РФ №2569546, МПК C01G 5/00, B01J 13/00, В82В 3/00, 27.11.2015); в качестве последних используются синтетические полимеры (поливиниловый спирт, поливинилпирролидон) или природный полимер (крахмал). Преимуществом известного способа являются стабильность и бактерицидная активность наночастиц, сохраняющаяся в течение как минимум 6-ти месяцев. Недостатком этого способа является необходимость деаэрирования раствора (синтез проводится в вакууме или атмосфере инертного газа), поскольку выход и стабильность наночастиц существенно меньше при синтезе на воздухе, чем в бескислородной среде. Кроме того, в литературе отмечалась высокая вероятность изменения размеров (в данном случае агрегации) частиц со временем в процессе облучения ([16], раздел II.3.3). Таким образом, известный способ технически сложен и требует определенных энергозатрат при облучении, что повышает себестоимость растворов наночастиц.
Способы, использующие биологическое восстановление
В последнее десятилетие наиболее интенсивно развивается направление, в котором синтез наночастиц серебра и золота производится с использованием природных биологически активных веществ, экстрагируемых из растительных или животных организмов, а также водные экстракты из живых организмов или сами живые организмы, способные синтезировать наночастицы. Как неоднократно отмечалось в литературе (например, [17]), для биомедицинских приложений наночастиц это направление имеет ряд преимуществ по сравнению с химическими методами, главными из которых являются мягкие условия синтеза (процесс идет в растворе на воздухе при комнатной или слегка повышенной температуре, не требуется деаэрирования или других дополнительных процедур), более высокая эффективность природных восстановителей и отсутствие в растворе компонентов, токсичных и(или) чужеродных для организма и окружающей среды (например, избытка традиционных химических восстановителей, продуктов их окисления или небиодеградируемых полимеров). Различные варианты биологического восстановления ионов серебра и золота описаны в литературе (см., например, обзоры [18, 19], а также [9], гл. 1). В то же время, как отмечено, в частности, в [9], синтез наночастиц серебра с использованием водных экстрактов из живых организмов имеет ряд недостатков (во многих случаях длительное время синтеза, неизвестные действующие вещества и их концентрации, слабая воспроизводимость результатов, сложность контроля размеров и формы наночастиц и др.), ограничивающих возможности их практического применения.
Более перспективным является способ, в котором используются эффективные биологические восстановители, но синтез проводится не в природном экстракте, а в обратных мицеллах. Такой вариант был реализован в предложенном ранее методе биохимического синтеза в обратных мицеллах (см. патент РФ №2147487, МПК B22F 9/24, 20.04.2000). В качестве восстановителей здесь использовали природные биологически активные вещества из группы флавоноидов (кверцетин, рутин); в качестве стабилизатора - синтетический ПАВ (аэрозоль-ОТ). Тот же способ использован позднее в некоторых разработках с применением флавоноидов для получения наночастиц в обратных мицеллах (см. патент РФ №2322327, МПК B22F 9/24, В82В 3/00, 20.04.2008, а также патент РФ №2461413, МПК B01D 59/00, B01J 37/30, В82В 1/00, 20.09.2012). Как было показано в последнее десятилетие в ряде сообщений об успешном синтезе наночастиц серебра с использованием экстрактов растений (напр., [9, 15]) восстановителями во многих случаях здесь также служат вещества из группы флавоноидов. Однако синтез в обратных мицеллах позволяет получать наночастицы малого размера с узким распределением, что весьма редко удается при синтезе в водных экстрактах. Кроме того, поскольку в предложенном ранее методе используются не растительные экстракты сложного состава, а их активные компоненты (флавоноиды) известной структуры и концентрации, становится возможным целенаправленное влияние на процесс формирования наночастиц и более высокая воспроизводимость результатов. При этом сохраняются такие преимущества биологического направления как технологическая простота, экономичность, высокая стабильность наночастиц и главное - высокая эффективность восстановителя: для полного восстановления ионов серебра (для 100% выхода наночастиц) требуется существенно более низкая концентрация флавоноида, чем любого из используемых для этих целей традиционных химических восстановителей (гидразина, боргидрида натрия и прочих) [9].
Однако наночастицы в обратных мицеллах получают в органическом растворителе. Поскольку для исследований биологических эффектов наночастиц серебра и разработки вариантов их применения в биологии и медицине можно использовать только водные растворы наночастиц, была разработана технология получения водных растворов наночастиц серебра путем переноса наночастиц из мицеллярного раствора в водную фазу (см. патент РФ №2202400, МПК B01D 39/00, B01J 20/20, 20.04.2003). При этом наночастицы в водном растворе были стабилизированы тем же синтетическим ПАВ. Испытания действия этих водных растворов на различные виды микроорганизмов показали, что наночастицы обладают значительной антимикробной активностью и могут использоваться для создания дезинфицирующих средств или в качестве биоцидных добавок к различным жидкофазным системам (лакокрасочным материалам, косметическим средствам, лекарственным препаратам и др.) [9]. Было найдено также, что такие растворы проявляли заметную токсичность по отношению к злокачественным клеткам в опытах in vitro [23], что указывало на возможность их использования в качестве лекарственных препаратов против онкологических заболеваний. Однако, как показали исследования биологического действия таких растворов на некоторых видах растительных организмов, нормальных животных клетках, а также на млекопитающих [24-26], применение этих растворов наночастиц в медицине может быть небезопасно вследствие токсичности синтетического стабилизатора, присутствующего в этих растворах в концентрациях (порядка нескольких десятков миллимолей на литр), определяемых используемой методикой. Снизить концентрацию стабилизатора до приемлемых значений (1-3 мМ) удавалось путем диализа, однако это приводило к значительному усложнению и удорожанию процедуры, что делало нерентабельным получение растворов наночастиц в промышленно значимых количествах.
Для упрощения технологии получения наночастиц серебра в водном растворе и повышения степени их безопасности при использовании в медицине нами была разработана методика синтеза таких наночастиц путем восстановления флавоноидом (кверцетином) непосредственно в водном растворе с применением природных стабилизаторов - крахмала и крахмалоподобного вещества (β-циклодекстрина). Названные стабилизаторы были выбраны, поскольку из литературы известно, что крахмал и циклодекстрины нетоксичны для живых организмов и могут использоваться для синтеза наночастиц металлов в водном растворе, в том числе наночастиц серебра и золота (например, [27, 28]). Но в способах, описанных в литературе, синтез наночастиц проводится с применением химических восстановителей (боргидрида натрия, цитрата) или глюкозы. Как показано нами ранее ([9], гл. 4) в последнем случае, несмотря на нетоксичность глюкозы, ее эффективность как восстановителя существенно ниже, чем используемого нами флавоноида кверцетина (например, [29, 30]). Разработанная методика позволяла обеспечить 100% выход наночастиц малого среднего размера (7-12 нм) и их стабильность в водном растворе в течение длительного времени ([9], гл. 4). Упомянутая методика является наиболее близкой к настоящему изобретению по совокупности существенных признаков, однако были выявлены и недостатки, а именно:
(1) синтез занимал не менее суток, то есть требовал значительно больше времени, чем в ряде подобных же технологий, описанных в литературе (см. [9], ссылки в гл. 4),
(2) не удавалось получить 100% выход наночастиц при концентрации вводимой соли серебра, превышающей 1 ммоль/л (мМ), что делало экономически невыгодным получение практически значимых количеств раствора с концентрацией наночастиц, превышающей 1 мМ, и
(3) при стабилизации крахмалом вследствие его известного агглютинирующего действия в процессе хранения наблюдалась агрегация наночастиц, что приводило к увеличению их среднего размера и ширины распределения. Учитывая влияние размера наночастиц на их биологическую активность, можно было ожидать соответствующего снижения их эффективности как антимикробного агента.
Эти недостатки желательно было устранить как из экономических соображений, так и для повышения эффективности полученных водных растворов наночастиц серебра.
Далее, исследования наночастиц, стабилизированных β-циклодекстрином, на антимикробную активность и цитотоксичность показали, что они проявляют высокую биоцидную активность по отношению к нескольким видам микроорганизмов, но не оказывают заметного влияния на жизнеспособность злокачественных клеток. Отсюда следовало, что такие наночастицы могут применяться в качестве антимикробного средства, но не имеют перспектив применения для лечения онкологических заболеваний. В то же время, как упоминалось выше, наночастицы, стабилизированные аэрозолем-ОТ (бис-(2-этилгексил)сульфосукцинатом натрия, или АОТ), проявляют выраженный цитотоксический эффект на культурах злокачественных клеток, но их применение в онкологии затруднено вследствие присутствия в растворе наночастиц стабилизатора в концентрациях, при которых он проявляет высокую токсичность по отношению к нормальным клеткам. Таким образом, оставалась актуальной задача получения водных растворов наночастиц серебра, стабилизированных аэрозолем-ОТ, но содержащих этот стабилизатор в концентрациях, не превышающих 3 мМ, то есть малотоксичных или безопасных для нормальных клеток человека при экспериментальных разведениях.
При этом известен способ получения наночастиц серебра в водном растворе при стабилизации аэрозолем-ОТ (см. патент США US8852316, МПК B22F 9/16, 27.01.2011), предложенный для получения растворов с высокими концентрациями наночастиц (при использовании соли серебра в интервале концентраций от 10 мМ до 2М), с последующим их высушиванием для получения порошка, который затем можно ресуспендировать в воде или неводном растворителе. Известный способ предназначен для применения порошков или концентрированных растворов наночастиц в различных областях техники, но не пригоден для получения водных растворов наночастиц серебра для применения в биологии и медицине по следующим причинам. Во-первых, синтез проводится не в водном, а в водно-спиртовом растворе (согласно описанию, содержащем около 14% этанола) в присутствии высоких концентраций стабилизатора (согласно описанию, 25% от веса соли серебра). Это означает, что полученный (первичный) раствор наночастиц является высокотоксичным для биологических объектов. При последующем высушивании на воздухе или под вакуумом стабилизатор остается в порошке на поверхности наночастиц, и затем переходит вместе с ними в водный раствор при ресуспендировании. Поэтому полученный таким образом вторичный водный раствор наночастиц также токсичен для биологических объектов. Во-вторых, в качестве восстановителя используется токсичный химический агент (боргидрид натрия), избыток и продукты окисления которого (например, элементный бор) могут загрязнять наночастицы металлов в процессе их формирования ([16], раздел II.3.1), что также неприемлемо для биологических или медицинских приложений. В-третьих, представленная в патенте ТЕМ-фотография показывает, что размер частиц, получаемых известным способом, не менее 20-25 нм, при этом преобладают частицы размером 50 нм и более; согласно сведениям, содержащимся в тексте патента, частицы могут иметь размеры до 1000 нм, которые лежат далеко за пределами наноразмерного диапазона. Отсюда следует, что для нано- и более крупных частиц, получаемых способом согласно US 8852316, нет оснований ожидать высокой биологической активности и размерных эффектов, которые проявляются при диаметре частиц, не превышающем 20 нм. В целом ясно, что способ согласно US 8852316, в принципе не может использоваться для получения водных растворов наночастиц серебра, стабилизированных аэрозолем-ОТ, пригодных для экспериментальных исследований их взаимодействия с биологическими объектами или для создания лекарственных препаратов.
Задачей настоящего изобретения является совершенствование способа получения водных растворов наночастиц серебра путем восстановления ионов серебра флавоноидом кверцетином непосредственно в водном растворе, в присутствии стабилизатора, позволяющего снизить токсичность таких растворов для живых организмов (для безопасного применения в медицине, например, для создания антимикробных или противоопухолевых медицинских препаратов).
Техническим результатом настоящего изобретения является снижение токсичности водных растворов наночастиц, уменьшение времени синтеза наночастиц в водном растворе, увеличение концентрации наночастиц (при 100% выходе) при сохранении размера частиц в требуемом диапазоне.
Технический результат достигается путем создания способа получения наночастиц серебра, включающего: приготовление водного раствора стабилизатора, введение в раствор стабилизатора водного раствора кверцетина, приготовление водного раствора диамминнитрата серебра [Ag(NH3)2]NO3 путем введения водного раствора аммиака в раствор нитрата серебра, введение в водный раствор стабилизатора в присутствии кверцетина при постоянном перемешивании раствора диамминнитрата серебра до заданной концентрации. При этом стабилизатором является β-циклодекстрин (β-ЦД) или натрия бис(2-этилгексил)сульфосукцинат (аэрозоль-ОТ, или АОТ), а введение в раствор стабилизатора раствора кверцетина проводят до его молярной концентрации, равной 0,1 от заданной молярной концентрации соли серебра.
Согласно предпочтительным вариантам реализации указанный технический результат также достигается тем, что:
- раствор кверцетина представляет собой водный щелочной раствор кверцетина,
- концентрация β-циклодекстрина находится в диапазоне от 0,6⋅10-3 до 1,2⋅10-3 М,
- концентрация натрия бис(2-этилгексил)сульфосукцината находится в диапазоне от 1,0⋅10-3 до 3,0⋅10-3 М,
- концентрация диамминнитрата серебра в упомянутом растворе находится в диапазоне от 0,4⋅10-3 до 4⋅10-3 М,
- водный раствор стабилизатора β-циклодекстрина нагревают до 50-60°С,
- для приготовления упомянутого щелочного раствора кверцетина используют гидроксид натрия, калия или аммония,
- перемешивание на этапе d) после введения соли серебра продолжается в течение 5-7 мин.
В настоящем изобретении предлагаются:
(1) способ получения наночастиц серебра в водном растворе с природным стабилизатором (β-циклодекстрином), позволяющий существенно сократить время синтеза и увеличить концентрацию наночастиц без снижения их выхода, и
(2) способ получения наночастиц серебра путем синтеза в водном растворе с синтетическим стабилизатором (аэрозолем-ОТ), позволяющий существенно упростить технологию (по сравнению с переносом из мицеллярного раствора) и снизить концентрацию стабилизатора, что делает возможным применение таких наночастиц против онкологических заболеваний.
В обоих случаях синтез наночастиц производится путем восстановления кверцетином, то есть, сохраняются преимущества этого природного восстановителя по сравнению с традиционными химическими восстановителями.
Настоящее изобретение обеспечивает безопасное использование растворов наночастиц в качестве антимикробной добавки в составе лекарственных средств или для других целей (например, для создания противоопухолевых препаратов), требующих обеспечения минимальной токсичности для человека и экологической безопасности.
Концентрации кверцетина (CQr) и ионов серебра (CAg) выбираются, исходя из того, что их соотношение, соответствующие 100% выходу наночастиц, составляет CQr:CAg=1:10. При этом вначале определяется концентрация наночастиц, которую желательно получить для их последующего использования в исследованиях их биологической активности и для применения в медицине, косметологии и других областях. Имеющийся опыт исследований биологических эффектов наночастиц серебра показывает, что минимальная приемлемая концентрация наночастиц составляет (в пересчете на эквивалентную концентрацию ионов серебра) 0,4⋅10-3 M или 43 мг/л. Поскольку исследования биологического действия и применение наночастиц предполагают разбавление их исходного раствора, то при меньших концентрациях и разумных степенях разбавления не удается получить надежные данные по их биологической активности. Соответственно, концентрация кверцетина должна быть не менее 0,04-10-3 М.В принципе максимально достижимая концентрация наночастиц определяется максимально достижимой концентрацией кверцетина в исходном растворе в дистиллированной воде с добавлением щелочи. Увеличение концентрации наночастиц целесообразно с экономической точки зрения, поскольку очевидно, что чем больше концентрация, тем большее количество продукции, включающей добавки раствора наночастиц, можно произвести с использованием 1 литра раствора. Однако с увеличением концентрации наночастиц ухудшаются их параметры, существенные для сохранения высокой биологической (например, антимикробной) активности, такие как средний размер и ширина распределения по размерам, что может привести к снижению качества раствора наночастиц и их несоответствию требованиям, о которых говорилось выше. Исходя из результатов настоящих исследований, верхней границей концентрации наночастиц можно считать 4⋅10-3 M (432 мг/л).
Краткое описание чертежей
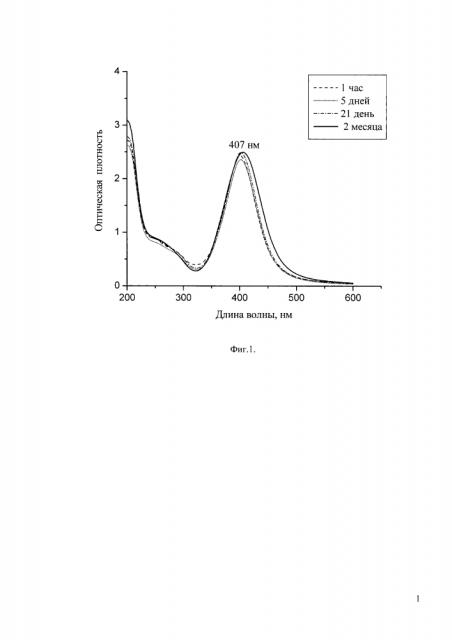
Фиг. 1. Спектры поглощения водных растворов наночастиц серебра через разное время после начала синтеза при стабилизации β-ЦД (Пример 1). Концентрация соли серебра 4 мМ. Спектры сняты после разбавления растворов наночастиц в 2 раза.
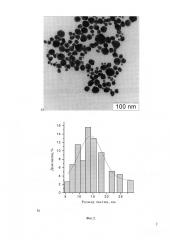
Фиг. 2. Электронная микрофотография (а) и распределение по размерам наночастиц (b), стабилизированных β-ЦД (Пример 1). Размер частиц 14.1±8.5 нм.
Фиг. 3. Электронная дифрактограмма наночастиц, стабилизированных β-ЦД (Пример 1).
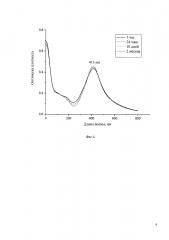
Фиг. 4. Спектры поглощения водных растворов наночастиц серебра через разное время после начала синтеза при стабилизации АОТ (Пример 2). Концентрация соли серебра 0.4 мМ.
Фиг. 5. Электронная микрофотография (а) и распределение по размерам (b) наночастиц, стабилизированных АОТ (Пример 2). Размер частиц 13.4±4.6 нм.
Фиг. 6. Электронная дифрактограмма наночастиц, стабилизированных АОТ (Пример 2).
Фиг. 7. Спектры поглощения водных растворов наночастиц серебра через разное время после начала синтеза при стабилизации β-ЦЦ (Пример 3). Концентрация соли серебра 1 мМ.
Фиг. 8. Электронная микрофотография (а) и распределение по размерам (b) наночастиц, стабилизированных β-ЦД (Пример 3). Размер частиц 15.1±7.5 нм.
Фиг. 9. Электронная дифрактограмма наночастиц, стабилизированных β-ЦЦ (Пример 3).
Далее приводятся примеры осуществления изобретения со ссылками на прилагаемые фигуры.
Примеры осуществления изобретения и реализации назначения
Пример 1
Готовят 1.2 мМ водный раствор β-циклодекстрина (β-ЦД); для этого 0,136 г β-ЦД растворяют в 100 мл дистиллированной воды. Затем готовят 40 мМ щелочной раствор кверцетина путем добавления к 0.082 г кверцетина 5 мл дистиллированной воды и последующего добавления 10% или 27% раствора гидроксида аммония до полного растворения кверцетина. Затем 1 мл приготовленного раствора кверцетина вводят в 100 мл водного раствора β-ЦД при 50°С. Затем готовят 400 мМ раствор диамминнитрата серебра путем введения 10% или 27% раствора гидроксида аммония в раствор нитрата серебра в деионизованной воде до полного растворения образующегося оксида серебра. Затем 1 мл раствора диамминнитрата серебра вводят при указанной температуре и перемешивании в 100 мл раствора, содержащего β-ЦД и кверцетин. При этом наблюдается резкое изменение окраски раствора, свидетельствующее об образовании наночастиц серебра. Через 5-7 мин раствор снимают с магнитной мешалки. Затем контроль формирования наночастиц проводят по изменениям спектров поглощения Изменения со временем спектра поглощения полученного раствора и результаты его анализа методом просвечивающей электронной микроскопии (ТЕМ) показаны на Фиг. 1-3.
Пример 2
Готовят 1 мМ водный раствор АОТ. Для этого 0.044 г АОТ растворяют в 100 мл дистиллированной воды. Затем готовят 4 мМ щелочной раствор кверцетина. Для этого к 0.016 г кверцетина добавляют 10 мл дистиллированной воды с последующим добавлением гидроксида аммония, как описано в примере 1. Затем готовят 40 мМ раствор диамминнитрата серебра, как описано в примере 1. Затем 1 мл раствора диамминнитрата серебра добавляют при перемешивании к 100 мл раствора, содержащего АОТ и кверцетин. При этом наблюдается характерное изменение окраски раствора, свидетельствующее об образовании наночастиц серебра. Как и в примере 1, через 5-7 мин раствор снимается с магнитной мешалки и далее проводят измерения спектров поглощения. Результаты измерений спектров поглощения и данные анализа полученного раствора методом ТЕМ показаны на Фиг. 4-6
Пример 3
Готовят 0.6 мМ водный раствор β-ЦД. Для этого 0.068 г β-ЦД растворяют в 100 мл дистиллированной воды. Затем готовят 10 мМ щелочной раствор кверцетина. Для этого к 0.02 г кверцетина добавляют 5 мл дистиллированной воды с последующим добавлением гидроксида аммония как описано в примере 1. Затем готовят 100 мМ раствор диамминнитрата серебра как описано в примере 1. Затем 1 мл раствора диамминнитрата серебра добавляют при t=50-60°С и перемешивании к 100 мл раствора, содержащего β-ЦД и кверцетин. При этом наблюдается характерное изменение окраски раствора, свидетельствующее об образовании наночастиц серебра. Как и в примерах 1,2, через 5-7 мин раствор снимают с магнитной мешалки. Изменения во времени спектров поглощения и данные анализа полученного раствора методом ТЕМ показаны на Фиг. 7-9.
При стабилизации β-ЦЦ и АОТ максимум полосы поглощен