Усилитель противоопухолевого эффекта, содержащий имидазооксазиновое соединение
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой усилитель противоопухолевого эффекта для усиления противоопухолевого средства, содержащий в качестве активного ингредиента имидазооксазиновое соединение, которое представляет собой транс-3-амино-1-метил-3-(4-(3-фенил-5Н-имидазо[1,2-с]пиридо[3,4-е][1,3]оксазин-2-ил)фенил)циклобутанол или транс-3-амино-1-циклопропил-3-(4-(3-фенил-5Н-имидазо[1,2-c]пиридо[4,3-е][1,3]оксазин-2-ил)фенил)циклобутанол, или его фармацевтически приемлемую соль. Также изобретение относится к фармацевтической композиции, противоопухолевому лекарственному средству, содержащим указанные соединения, их применениям, способам усиления противоопухолевого эффекта и лечения опухолей. Изобретение обеспечивает комбинированную противоопухолевую терапию, позволяющую усилить противоопухолевой эффект противоопухолевых лекарственных средств без значительного увеличения их токсичности. 9 н. и 9 з.п. ф-лы, 77 пр., 22 табл., 18 ил.
Реферат
Область техники, к которой относится изобретение
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет в соответствии с заявкой на выдачу патента Японии №2012-148850, поданной 2 июля 2012 года, и с заявкой на выдачу патента Японии №2012-215902, поданной 28 сентября 2012 года, полное содержание которых включено в настоящий документ посредством ссылки.
Настоящее изобретение относится к усилителю противоопухолевого эффекта и противоопухолевому лекарственному средству, содержащему комбинацию указанного усилителя и одного или нескольких других противоопухолевых средств.
Предпосылки создания изобретения
Широкий спектр лекарственных средств был определен для использования в качестве противоопухолевых средств. Приближенно они делятся на алкилирующие агенты, соединения на основе платины, антиметаболиты, ингибиторы топоизомеразы, ингибиторы микротрубочек, противоопухолевые антибиотики, лекарственные средства, направленные на молекулярные мишени, и т.п. Кроме того, вместо введения одного противоопухолевого средства в последние годы широко распространено комбинированное применение нескольких лекарственных средств.
AKT представляет собой серин/треонин-специфичную киназу, которая служит в качестве нижележащего эффектора в отношении фосфатидилинозитол-3-киназы (PI3-киназы), которая активируется сигналом от рецепторной тирозинкиназы. AKT часто активирована или высоко экспрессирована при многих злокачественных опухолях (почечно-клеточный рак, рак желудка, рак молочной железы, рак легких, колоректальный рак, рак поджелудочной железы, рак яичников, печеночно-клеточный рак, множественная миелома, лимфома, лейкоз, рак головы и шеи, меланома и т.п.), и при некоторых злокачественных опухолях сообщалось о генетической амплификации или активирующей мутации (непатентный документ 1). Что касается функции, то сообщается, что AKT играет важную роль в образовании опухоли, а именно, в пролиферации клеток, устойчивости клеток к апоптозу, ангиогенезе, метастазировании и инвазии, а также в метаболизме глюкозы и метаболизме липидов (непатентный документ 2). Также сообщается, что AKT высоко экспрессирована при опухолях, невосприимчивых или устойчивых к существующим способам лечения с использованием противоопухолевых средств. Таким образом, можно надеяться на эффективность комбинированного применения ингибитора AKT и существующих противоопухолевых средств, включая противоопухолевые средства, направленные на молекулярную мишень (непатентный документ 3).
Например, имеются сообщения о способах лечения с использованием комбинации MK-2206, который представляет собой ингибитор AKT, и доцетаксела (непатентный документ 4 и патентный документ 1).
Перечень ссылок
Патентный документ
Патентный документ 1: публикация заявки на выдачу патента США №2011-0319354
Непатентные документы
Непатентный документ 1: Annals of Oncology, 21, p. 683-691 (2010)
Непатентный документ 2: Cell, 129, p. 1261-1274 (2007)
Непатентный документ 3: Drug Resistance Updates, 11, p. 32-50 (2008)
Непатентный документ 4: Mol. Cancer Ther., 9, p. 1956-1967 (2010)
Краткое описание сущности изобретения
Техническая задача
При этом, совершенно неизвестно и непредсказуемо, какая комбинация противоопухолевых средств может усиливать их противоопухолевые эффекты, или, в случае усиления противоопухолевых эффектов, происходит ли также усиление токсичности средств, как и усиление противоопухолевых эффектов.
Задача настоящего изобретения заключается в обеспечении комбинированного применения двух противоопухолевых средств, которые могут усиливать их противоопухолевые эффекты без значительного усиления их побочных эффектов.
Решение задачи
В свете данной проблемы, авторы настоящего изобретения сосредоточили внимание на специфическом типе ингибитора AKT и провели исследование эффекта комбинированного применения соединения и других противоопухолевых средств. В результате, авторы изобретения обнаружили, что имидазооксазиновое соединение, представленное ниже формулой (I), или его фармацевтически приемлемая соль, действует как высокоэффективный ингибитор AKT, и что комбинированное применение соединения и противоопухолевого(ых) средства(средств) прекрасно усиливает противоопухолевый эффект, увеличивая тем самым эффективную площадь действия и спектр противоопухолевого эффекта. Полученные результаты были положены в основу настоящего изобретения.
Вариант осуществления настоящего изобретения относится к усилителю противоопухолевого эффекта для усиления одного или нескольких других противоопухолевых средств, содержащих в качестве активного ингредиента имидазооксазиновое соединение, представленное формулой (I), или его фармацевтически приемлемую соль
[Хим. 1]
,
где A, B, C и D представляют собой C-R1a, C-R1b, C-R1c и C-R1d соответственно или один или два из A, B, C и D представляют собой атом N;
по меньшей мере два из R1a, R1b, R1c и R1d представляют собой водород, а другой(ие) представляет(ют) собой галоген; циано; C1-6алкил, который может содержать в качестве заместителя(ей) гидроксильную(ые) группу(ы); C1-6алкокси; карбонил, содержащий в качестве заместителя гидроксил, амино, необязательно замещенный моно- или ди-(C1-6алкил)амино или моно- или ди-(C1-6алкокси)амино; или ненасыщенную гетероциклическую группу;
R2 представляет собой фенил, пиридил или тиенил;
R3 представляет собой водород, метил, этил или циклопропил; и
R4 представляет собой водород или гидрокси.
Согласно варианту осуществления настоящего изобретения, A, B, C и D представляют собой C-R1a, C-R1b, C-R1c и C-R1d, соответственно, или один или два из A, B, C и D представляют собой атом N;
по меньшей мере два из R1a, R1b, R1c и R1d представляют собой водород, а другой(ие) по отдельности представляет(ют) собой хлор, фтор, циано, метил, гидроксиметил, метокси, этокси, карбоксил, карбамоил, метиламинокарбонил, этиламинокарбонил, гидроксиэтиламинокарбонил, этоксиаминокарбонил или пиразолил;
R2 представляет собой фенил, пиридил или тиенил;
R3 представляет собой водород, метил, этил или циклопропил; и
R4 представляет собой водород или гидрокси.
Другой вариант осуществления настоящего изобретения относится к усилителю противоопухолевого эффекта для усиления одного или нескольких других противоопухолевых средств, содержащему в качестве активного ингредиента имидазооксазиновое соединение согласно любому из последующих пунктов (a)-(t) или его соль:
(a) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(b) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-(пиридин-4-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(c) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(d) транс-3-амино-1-циклопропил-3-(4-(10-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(e) транс-3-амино-1-циклопропил-3-(4-(9-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(f) транс-3-амино-1-циклопропил-3-(4-(8-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(g) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(h) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(i) транс-3-амино-1-этил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(j) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(k) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(l) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(m) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(n) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,2-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(o) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиразино[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(p) транс-3-амино-3-(4-(9-(гидроксиметил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)-1-метилциклобутанол,
(q) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-9-карбонитрил,
(r) транс-3-амино-1-метил-3-(4-(3-фенил-9-(1H-пиразол-5-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(s) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-метил-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид, и
(t) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-этокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид.
Другой вариант осуществления настоящего изобретения относится к противоопухолевому лекарственному средству, содержащему комбинацию любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли и одного или нескольких других противоопухолевых средств.
Другой вариант осуществления настоящего изобретения относится к применению любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли для усиления одного или нескольких других противоопухолевых средств.
Другой вариант осуществления настоящего изобретения относится к применению любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли для получения усилителя противоопухолевого эффекта для усиления одного или нескольких других противоопухолевых средств.
Другой вариант осуществления настоящего изобретения относится к применению любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли для получения противоопухолевого лекарственного средства, содержащего комбинацию имидазооксазинового соединения или его фармацевтически приемлемой соли и одного или нескольких других противоопухолевых средств.
Согласно другому варианту осуществления настоящего изобретения, одно или несколько других противоопухолевых средств представляют собой паклитаксел, карбоплатин, лапатиниб, иринотекан, доксорубицин, эверолимус, бортезомиб, эрлотиниб, трастузумаб (герцептин), метформин, доцетаксел, и комбинированное лекарственное средство из тегафура, гимерацила и отерацила калия.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции для предупреждения и/или лечения опухолей, содержащей любое из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемую соль и одно или несколько других противоопухолевых средств.
Другой вариант осуществления настоящего изобретения относится к способу усиления противоопухолевого эффекта, включающему введение пациенту любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли в количестве, эффективном для лечения и/или предупреждения.
Другой вариант осуществления настоящего изобретения относится к способу предупреждения и/или лечения опухолей, включающему введение пациенту комбинации любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли и одного или нескольких других противоопухолевых средств в количестве, эффективном для лечения и/или предупреждения.
Другой вариант осуществления настоящего изобретения относится к продукту в виде комбинированного препарата, подлежащего использованию одновременно, последовательно или через некоторый интервал времени для предупреждения и/или лечения опухолей, причем такой продукт содержит комбинацию любого из представленных выше имидазооксазиновых соединений или его фармацевтически приемлемой соли и одного или нескольких других противоопухолевых средств.
Полезные эффекты настоящего изобретения
Будучи использованным с противоопухолевыми средствами, имидазооксазиновое соединение (I) или его фармацевтически приемлемая соль усиливает различные противоопухолевые средства. Более конкретно, при использовании имидазооксазинового соединения (I) с другими противоопухолевыми средствами: 1) оно значимо не усиливает побочные эффекты противоопухолевых средств, позволяя тем самым комбинированное применение нескольких лекарств без снижения их эффективных доз в количествах, эквивалентных количествам конкретных лекарств, дающим максимальный эффект; 2) имидазооксазиновое соединение (I) усиливает противоопухолевые средства независимо от чувствительности к противоопухолевым средствам, подлежащим к комбинированному применению; и 3) такой противоопухолевый эффект наблюдается даже при низких количествах, при которых имидазооксазиновое соединение (I) не может по отдельности проявлять противоопухолевый эффект. Соответственно, настоящее изобретение ведет к обеспечению клинически высоко применимого терапевтического способа увеличения эффективной площади противоракового терапевтического воздействия, улучшения терапевтического эффекта, и т.п.
Краткое описание чертежей
[Фиг. 1] Эффект комбинированного применения соединения I в дозе 8 мг/кг/сутки, 16 мг/кг/сутки и 24 мг/кг/сутки с паклитакселом у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780.
[Фиг. 2] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780 при комбинированном применении соединения I в дозе 8 мг/кг/сутки, 16 мг/кг/сутки и 24 мг/кг/сутки с паклитакселом.
[Фиг. 3] Эффект комбинированного применения соединения I в дозе 8 мг/кг/сутки, 16 мг/кг/сутки и 24 мг/кг/сутки с паклитакселом у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка NCI-N87.
[Фиг. 4] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка NCI-N87 при комбинированном применении соединения I в дозе 8 мг/кг/сутки, 16 мг/кг/сутки и 24 мг/кг/сутки с паклитакселом.
[Фиг. 5] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки с карбоплатином у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780.
[Фиг. 6] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780 при комбинированном применении соединения I в дозе 16 мг/кг/сутки с карбоплатином.
[Фиг. 7] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки с лапатинибом у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка NCI-N87.
[Фиг. 8] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка NCI-N87 при комбинированном применении соединения I в дозе 16 мг/кг/сутки с лапатинибом.
[Фиг. 9] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки с иринотеканом у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780.
[Фиг. 10] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780 при комбинированном применении соединения I в дозе 16 мг/кг/сутки с иринотеканом.
[Фиг. 11] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки с доксорубицином у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780.
[Фиг. 12] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака яичников A2780 при комбинированном применении соединения I в дозе 16 мг/кг/сутки с доксорубицином.
[Фиг. 13] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки с эверолимусом у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка NCI-N87.
[Фиг. 14] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка NCI-N87 при комбинированном применении соединения I в дозе 16 мг/кг/сутки с эверолимусом.
[Фиг. 15] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки (A) и 24 мг/кг/сутки (B) с TS-1 у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка 4-1ST.
[Фиг. 16] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка 4-1ST при комбинированном применении соединения I в дозе 16 мг/кг/сутки (A) и 24 мг/кг/сутки (B) с TS-1.
[Фиг. 17] Эффект комбинированного применения соединения I в дозе 16 мг/кг/сутки (A) и 24 мг/кг/сутки (B) с трастузумабом у бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка 4-1ST.
[Фиг. 18] Изменения массы тела бестимусных мышей с подкожно имплантированной человеческой клеточной линией рака желудка 4-1ST при комбинированном применении соединения I в дозе 16 мг/кг/сутки (A) и 24 мг/кг/сутки (B) с трастузумабом.
Описание вариантов осуществления
Используемый в настоящем описании термин «комбинация» означает применение или введение имидазооксазинового соединения согласно настоящему изобретению или его фармацевтически приемлемой соли и одного или нескольких противоопухолевых средств в количестве, достаточном для предупреждения и/или лечения опухоли у пациента, в виде одной композиции или двух различных композиций, как одновременно, последовательно, так и через некоторый интервал времени. Имидазооксазиновое соединение согласно настоящему изобретению, или его фармацевтически приемлемая соль, может быть введено перед, одновременно или после введения других противоопухолевых средств.
Имидазооксазиновое соединение согласно настоящему изобретению или его фармацевтически приемлемая соль представленной ниже формулы (I) усиливает противоопухолевые эффекты противоопухолевых средств.
[Хим. 2]
В формуле (I) A, B, C и D представляют собой C-R1a, C-R1b, C-R1c и C-R1d, соответственно, или один или два из A, B, C и D представляют собой атом N (любой из A, B, C и D, который не представляет собой атом N, представляет собой C-R1a, C-R1b, C-R1c или C-R1d).
По меньшей мере два из R1a, R1b, R1c и R1d представляют собой водород, а другой(ие) представляет(ют) собой галоген, циано, C1-6алкил, который может содержать в качестве заместителя(ей) гидроксильную(ые) группу(ы), C1-6алкокси, карбонил, содержащий гидроксил, амино, необязательно замещенный моно- или ди-(C1-6алкил)амино или моно- или ди-(C1-6алкокси)амино; или ненасыщенную гетероциклическую группу.
Примеры атома галогена, представленного R1a, R1b, R1c или R1d, включают атом хлора, атом брома, атом фтора и атом иода, предпочтительно атом хлора или атом фтора.
C1-6алкил из «C1-6алкила, который может содержать в качестве заместителя(ей) гидроксильную(ые) группу(ы)» предпочтительно представляет собой неразветвленный или разветвленный C1-6алкил; его примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил и гексил. C1-6алкил предпочтительно представляет собой C1-3алкил, более предпочтительно метил. Число гидроксильных групп (заместителей) составляет от 0 до 2, предпочтительно 0 или 1.
«C1-6алкокси», представленный R1a, R1b, R1c или R1d, представляет собой неразветвленный или разветвленный C1-6алкокси, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси или т.п., предпочтительно C1-3алкокси, более предпочтительно метокси или этокси.
Моно- или ди-(C1-6алкил)аминокарбонил из «необязательно замещенного моно- или ди-(C1-6алкил)аминокарбонила» из «карбонила, содержащего в качестве заместителя гидроксил, амино, необязательно замещенный моно- или ди-(C1-6алкил)амино или моно- или ди-(C1-6алкокси)амино», представленный R1a, R1b, R1c или R1d, представляет собой вышеупомянутый аминокарбонил, содержащий 1 или 2 C1-6алкила, предпочтительно моно- или ди-(C1-3алкил)аминокарбонил, более предпочтительно метиламинокарбонил, диметиламинокарбонил или этиламинокарбонил. Заместитель предпочтительно представляет собой гидроксил. Число заместителей предпочтительно составляет 1.
Моно- или ди-(C1-6алкокси)аминокарбонил представляет собой вышеупомянутый аминокарбонил, содержащий 1 или 2 C1-6алкокси, предпочтительно моно- или ди-(C1-3алкокси)аминокарбонил, более предпочтительно этоксиаминокарбонил.
«Карбонил, содержащий в качестве заместителя гидроксил, амино, необязательно замещенный моно- или ди-(C1-6алкил)амино или моно- или ди-(C1-6алкокси)амино», представленный R1a, R1b, R1c или R1d, в частности, предпочтительно представляет собой карбоксил, карбамоил, метиламинокарбонил, этиламинокарбонил, гидроксиэтиламинокарбонил или этоксиаминокарбонил.
Ненасыщенная гетероциклическая группа, представленная R1a, R1b, R1c или R1d, предпочтительно представляет собой 5-10-членную моноциклическую или бициклическую ненасыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, S и O. Ее примеры включают имидазолил, тиенил, фурил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил, пиридил, пиразил, пиримидинил, пиридазинил, индолил, изоиндолил, индазолил, бензофуранил, бензимидазолил, бензоксазолил, бензотиазолил, пуринил, хинолил, изохинолил, хиназолинил и хиноксалил. Среди них, пиразолил является предпочтительным.
Предпочтительные примеры соединения, представленного формулой (I), включают следующие соединения:
(a) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(b) транс-3-амино-1-циклопропил-3-(4-(10-фтор-3-(пиридин-4-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(c) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(d) транс-3-амино-1-циклопропил-3-(4-(10-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(e) транс-3-амино-1-циклопропил-3-(4-(9-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(f) транс-3-амино-1-циклопропил-3-(4-(8-метокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(g) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(h) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(i) транс-3-амино-1-этил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(j) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(k) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(l) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(m) транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[4,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(n) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,2-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(o) транс-3-амино-1-циклопропил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиразино[2,3-e][1,3]оксазин-2-ил)фенил)циклобутанол,
(p) транс-3-амино-3-(4-(9-(гидроксиметил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)-1-метилциклобутанол,
(q) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-9-карбонитрил,
(r) транс-3-амино-1-метил-3-(4-(3-фенил-9-(1H-пиразол-5-ил)-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-2-ил)фенил)циклобутанол,
(s) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-метил-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид, и
(t) 2-(4-(транс-1-амино-3-гидрокси-3-метилциклобутил)фенил)-N-этокси-3-фенил-5H-бензо[e]имидазо[1,2-c][1,3]оксазин-8-карбоксамид.
Фармацевтически приемлемые соли имидазооксазинового соединения (I) относятся к солям, характеризующимся желаемой фармакологической активностью имидазооксазинового соединения (I), полученным из фармацевтически приемлемого основания или кислоты, включая неорганические/органические основания и неорганические/органические кислоты.
Примеры фармацевтически приемлемых солей имидазооксазинового соединения (I) включают кислотно-аддитивные соли с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота, глутаминовая кислота и т.п.; соли с неорганическими основаниями, такими как натрий, калий, магний, кальций, алюминий и т.п., органическими основаниями, такими как метиламин, этиламин, меглюмин, этаноламин и т.п., или основными аминокислотами, такими как лизин, аргинин, орнитин и т.п.; и соли аммония. Кроме того, имидазооксазиновое соединение (I) включает оптические изомеры и гидраты.
Имидазооксазиновое соединение (I), которое усиливает противоопухолевый эффект согласно настоящему изобретению, может быть получено, например, следующими способами получения или способами, описанными в разделе «Примеры». Однако способ получения соединения согласно настоящему изобретению не ограничивается указанными примерами.
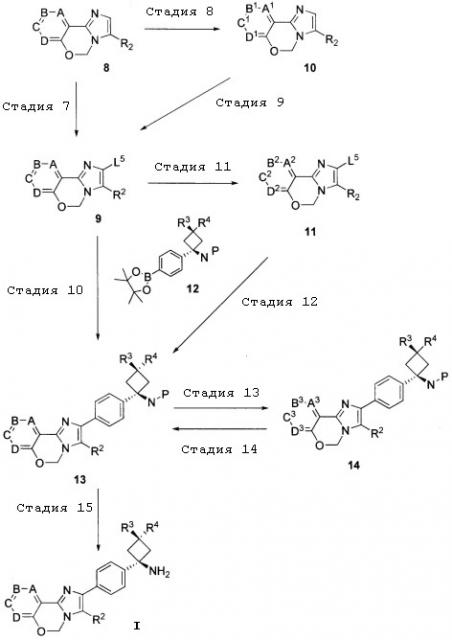
Соединение (I) согласно настоящему изобретению может быть получено с использованием, например, следующего способа получения A и способа получения B.
[Хим. 3]
Способ получения A
(в формуле L1, L2, L3 и L4 являются одинаковыми или отличаются друг от друга, и каждый представляет собой уходящую группу; а другие символы определены выше).
Стадия 1
Указанная стадия представляет собой способ получения соединения 2 из альдегидного соединения 1.
Исходное соединение 1 представляет собой коммерчески доступный продукт, или оно может быть получено в соответствии с известным способом. Первая стадия может быть проведена способом, описанным в документах (например, J. Med. Chem., Vol. 46, p. 5416, 2003; J. Org. Chem., Vol. 68, p. 5415, 2003), способом, основанным на них, или комбинаций указанных способов с обычными способами.
Например, при использовании в реакции водного раствора аммиака и водного раствора глиоксаля количество подлежащего использованию водного раствора аммиака составляет от 1 до 10 эквивалентов относительно соединения 1. Количество подлежащего использованию водного раствора глиоксаля составляет от 1 до 10 эквивалентов относительно соединения 1.
Примеры пригодных для использования растворителей включают метанол, этанол, тетрагидрофуран, этилацетат, N,N-диметилформамид, уксусную кислоту и воду. Растворители могут быть использованы по отдельности или в комбинации. Время реакции составляет от 0,1 до 100 часов и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0 до 100°C.
Полученное таким образом соединение 2 может быть выделено и очищено известными способами разделения и очистки, такими как концентрирование, концентрирование при пониженном давлении, кристаллизация, экстрагирование растворителем, повторное осаждение и хроматография, а затем использовано на следующей стадии; или оно может быть использовано на следующей стадии без выделения и очистки.
Стадия 2
Указанная стадия представляет собой способ получения соединения 4, при котором проводят реакцию алкилирования соединения 2 соединением 3 в присутствии основания.
Соединение 3, в котором в качестве L1 и L2 упомянуты хлор, бром, иод и т.п., представляет собой коммерчески доступный продукт, или оно может быть получено в соответствии с известным способом.
Соединение 3 может быть использовано в количестве от 1 до 100 эквивалентов, и предпочтительно от 1 до 10 эквивалентов, относительно соединения 2.
Примеры основания включают неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и гидроксид цезия, и органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин. Основание может быть использовано в количестве от 1 до 100 эквивалентов, и предпочтительно от 2 до 10 эквивалентов.
Примеры пригодных для использования растворителей включают N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, тетрагидрофуран, 1,4-диоксан, N-метилпирролидин-2-он, ацетонитрил и воду. Растворители могут быть использованы по отдельности или в комбинации. Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0 до 100°C.
Полученное таким образом соединение 4 может быть выделено и очищено известными способами разделения и очистки, а затем использовано на следующей стадии; или оно может быть использовано на следующей стадии без выделения и очистки.
Стадия 3
Указанная стадия представляет собой способ получения соединения 6 из соединения 5.
Соединение 5, в котором в качестве L3 упомянуты хлор, бром, иод и т.п., представляет собой коммерчески доступный продукт, или оно может быть получено в соответствии с известным способом.
Стадия 3 может быть проведена тем же способом, что и стадия 1.
Стадия 4
Указанная стадия представляет собой способ получения соединения 4, при котором взаимодействие соединения 6 с формальдегидом проводят в присутствии основания.
Формальдегид может быть использован в количестве от 1 до 100 эквивалентов, и предпочтительно от 1 до 10 эквивалентов, относительно соединения 6. Формальдегид может быть использован в форме водного раствора или в форме параформальдегида.
Примеры основания включают гидроксид натрия, карбонат натрия, гидроксид калия, карбонат цезия, трет-бутоксид натрия и трет-бутоксид калия. Основание может быть использовано в количестве от 1 до 100 эквивалентов, и предпочтительно от 2 до 10 эквивалентов.
Примеры пригодных для использования растворителей включают N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, тетрагидрофуран, 1,4-диоксан, N-метилпирролидин-2-он, ацетонитрил и воду. Растворители могут быть использованы по отдельности или в комбинации. Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0 до 100°C.
Полученное таким образом соединение 4 может быть выделено и очищено известными способами разделения и очистки, а затем использовано на следующей стадии; или оно может быть использовано на следующей стадии без выделения и очистки.
Стадия 5
Указанная стадия представляет собой способ получения соединения 7 путем проведения галогенирования, например, путем осуществления воздействия галогенирующего агента на соединение 4 (L4 = Cl, Br или I). Галогенирование может быть проведено в соответствии с общеизвестным способом; например, галогенирование может быть проведено в реакционном растворителе, который не оказывает негативное влияние на реакцию.
Полученное таким образом соединение 7 может быть выделено и очищено известными способами разделения и очистки, а затем использовано на следующей стадии; или оно может быть использовано на следующей стадии без выделения и очистки.
Стадия 6
Указанная стадия представляет собой способ получения соединения 8 путем осуществления взаимодействия соединения 7 с арилбороновой кислотой, сложным эфиром арилбороновой кислоты, ненасыщенной гетероциклической бороновой кислотой или сложным эфиром ненасыщенной гетероциклической бороновой кислоты.
Указанная стадия может быть проведена в соответствии с общеизвестным способом (например, Chemical Reviews, Vol. 95, p. 2457, 1995); например, указанная стадия может быть проведена в растворителе, который не оказывает негативное влияние на реакцию, в присутствии катализатора, содержащего металл переменной валентности, и основания.
Арилбороновая кислота, сложный эфир арилбороновой кислоты, ненасыщенная гетероциклическая бороновая кислота или сложный эфир ненасыщенной гетероциклической бороновой кислоты могут быть использованы в количестве от 1 до 10 эквивалентов, и предпочтительно от 1 до 3 эквивалентов, относительно соединения 7.
Примеры пригодных для использования катализаторов, содержащих металл переменной валентности, включают палладиевые катализаторы (например, ацетат палладия, хлорид палладия, тетракис(трифенилфосфин)палладий и т.п.) и никелевые катализаторы (например, хлорид никеля и т.п.). При необходимости, могут быть добавлены лиганды (например, трифенилфосфин, три-трет-бутилфосфин и т.п.), и в качестве сокатализаторов могут быть добавлены оксиды металлов (например, оксид меди, оксид серебра и т.п.), и т.п. Хотя подлежащее использованию количество катализатора, содержащего металл переменной валентности, варьирует в зависимости от типа катализатора, как правило, оно составляет приблизительно от 0,0001 приблизительно до 1 моль, и предпочтительно приблизительно от 0,01 приблизительно до 0,5 моль, относительно соединения 7 (1 моль). Подлежащее использованию количество лиганда, как правило, составляет приблизительно от 0,0001 приблизительно до 4 моль, и предпочтительно приблизительно от 0,01 приблизительно до 2 моль, относительно соединения 7 (1 моль). Подлежащее использованию количество сокатализатора, как правило, составляет приблизительно от 0,0001 приблизительно до 4 моль, и предпочтительно приблизительно от 0,01 приблизительно до 2 моль, относительно соединения 7 (1 моль).
Примеры основания включают органические амины (например, триметиламин, триэтиламин, диизопропилэтиламин, N-метилморфолин, 1,8-диазабицикло[5.4.0]ундец-7-ен, пиридин, N,N-диметиланилин и т.п.), соли щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия, гидроксид калия и т.п.), гидриды металлов (например, гидрид калия, гидрид натрия и т.п.), алкоксиды щелочных металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия и т.п.), дисилазиды щелочных металлов (например, дисилазид лития, дисилазид натрия, дисилазид калия и т.п.). Среди них, предпочтительными являются соли щелочных металлов, такие как карбонат калия, карбонат цезия, фосфат натрия и фосфат калия; алкоксиды щелочных металлов, такие как трет-бутоксид натрия и трет-бутоксид калия; органические амины, такие как триэтиламин и диизопропилэтиламин; и т.п. Подлежащее использованию количество основания, как правило, составляет от 0,1 до 10 моль, и предпочтительно приблизительно от 1 приблизительно до 5 моль, относительно соединения 7 (1 моль).
Любые растворители могут быть использованы при условии, если они не оказывают негативное влияние на реакцию. Их примеры включают углеводороды (например, бензол, толуол, ксилол, и т.п.), галогенированные углеводороды (например, хлороформ, 1,2-дихлорэтан, и т.п.), нитрилы (например, ацетонитрил, и т.п.), эфиры (например, диметоксиэтан, тетрагидрофуран, и т.п.), спирты (например, метанол, этанол, и т.п.), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид, гексаметилфосфорамид, и т.п.), воду и их смеси. Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0 до 150°C.
Полученное таким образом соединение 8 может быть выделено и очищено известными способами разделения и очистки, а затем использовано на следующей стадии; или оно может быть использовано на следующей стадии без выделения и очистки.
[Хим. 4]
Способ получения B
(в формуле L5 являются одинаковыми или отличаются друг от друга, и каждый представляет собой уходящую группу; P представляет соб