Способ определения антиоксидантной активности с использованием радикальных инициаторов
Иллюстрации
Показать всеИзобретение относится к области физико-химических методов анализа, в частности к анализу растворов на предмет определения антиоксидантной активности. Изобретение может быть использовано в научно-исследовательских лабораториях для изучения антиоксидантных свойств различных природных, синтетических и биологических объектов. Сущность заявляемого способа заключается в том, что определение антиоксидантной активности проводят по изменению потенциала, регистрируемого при взаимодействии термически генерируемых радикалов с исследуемым образцом в растворе. Задачей, решаемой данным изобретением, служит повышение точности, достоверности и воспроизводимости результатов, расширение круга исследуемых веществ, а также получение данных в универсальных единицах измерения, что позволяет проводить сравнительный анализ как индивидуальных соединений, так и сложных объектов. 2 з.п. ф-лы, 8 ил., 4 пр.
Реферат
Изобретение относится к области физико-химических методов анализа, в частности к анализу растворов на предмет определения антиоксидантной активности.
Известен способ определения антиоксидантной активности путем изучения кинетики восстановления стабильного радикала 2,2’-дифенил-1-пикригидразила, уменьшение концентрации которого фиксируется спектрофотометрически при длине волны 515 нм (Brand-Williams W., Cuvelier М.Е., Berset С. // LWT - Food Sci. Technol., 1995, V. 28, No.l, P. 25-30). Недостатками данного способа являются неоднозначность данных, получаемых при анализе окрашенных объектов, а также то, что получаемые результаты выражены в относительных единицах, что затрудняет их интерпретацию.
Известен способ определения антиоксидантной активности путем оценки ингибирования свободных радикалов, основанный на реакции восстановления антиоксидантом хромогенного радикала , уменьшение концентрации которого фиксируется спектрофотометрически (Re R., Pellegrini N., Proteggente A., Pannala A., Yang M, Rice-Evans C. // Free Radic. Biol. Med., 1999, V.26, P. 1231-1237). К недостаткам данного способа относятся нестабильность используемых растворов и сложность интерпретации данных при анализе окрашенных объектов.
Наиболее близким решением служит способ определения антиоксидантной активности путем мониторинга изменения люминесценции в ходе реакции инициируемых радикалов с анализируемым образцом [Международная публикация US 5395755]. При добавлении к раствору радикального инициатора анализируемого образца, содержащего антиоксиданты, происходит уменьшение люминесцентного сигнала. Период индукции, т.е. период времени, в течение которого наблюдается уменьшение люминесценции, является характеристикой содержания антиоксидантов в анализируемом образце.
К недостаткам данного способа относится то, что использование люминесценции не позволяет проводить измерения в окрашенных объектах, а также то, что результаты измерений получены путем сравнения с люминесцентными кривыми эталонных антиоксидантов, что делает этот метод относительным. Кроме того, следует отметить сложность процедуры обработки получаемых результатов.
Задачей, решаемой данным изобретением, служит повышение точности, достоверности и воспроизводимости результатов, расширение круга исследуемых веществ, а также получение данных в универсальных единицах измерения, что позволяет проводить сравнительный анализ как индивидуальных соединений, так и сложных объектов.
Указанная задача решается тем, что в способе определения антиоксидантной активности раствора анализируемого вещества, включающего приготовление исходного раствора радикального инициатора, генерирование радикалов в результате термического распада период индукции определяют по изменению окислительно-восстановительного потенциала системы за счет протекания химической реакции исследуемых образцов с генерируемыми радикалами, а антиоксидантную активность рассчитывают по формуле:
AOA=2k⋅C(In)⋅τ,
где AOA - антиоксидантная активность, М-экв;
C(In) - концентрация радикального инициатора, M;
k - константа скорости генерирования. Для 37°C kAAPH=0,98⋅10-6 с-1, kAIPN=3,92⋅10-6 с-1.
τ - период индукции, c.
Период индукции измеряют как время от введения исследуемого раствора в раствор инициатора до точки перегиба зависимости потенциала от времени, которую определяют как максимум второй производной функции зависимости окислительно-восстановительного потенциала от времени. В качестве радикальных инициаторов используют азосоединения, например 2,2’-азобис(2-метилпропионамидин) дигидрохлорида (ААРН), 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорид (AIPN).
Сущность заявляемого способа заключается в том, что определение антиоксидантной активности проводится потенциометрически и включает следующие этапы:
1) инициирование радикальной реакции путем термостатирования раствора инициатора в электрохимической ячейке с погруженными в нее рабочим электродом и электродом сравнения при температуре 37°C; в качестве инициатора используются 2,2’-азобис(2-метилпропионамидин) дигидрохлорида (ААРН) и 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорид (AIPN); уравнение генерирования:
2) добавление анализируемого образца в электрохимическую ячейку, в результате чего наблюдается изменение потенциала реакционной смеси за счет протекания реакции:
,
где AO - антиоксидант, - продукт окисления антиоксиданта, n - стехиометрический коэффициент реакции, зависящий от количества функциональных групп в молекуле антиоксиданта, отвечающих за его антиоксидантные свойства.
3) определение времени полного расходования антиоксиданта в реакционной смеси (периода индукции); Период индукции определяется как время от введения исследуемого раствора в раствор инициатора до точки перегиба зависимости потенциала от времени, которая определяется как максимум второй производной функции зависимости окислительно-восстановительного потенциала от времени.
4) определение антиоксидантной активности анализируемого раствора по формуле:
AOA=2k⋅C(In)⋅τ,
где AOA - антиоксидантная активность, М-экв;
C(In) - концентрация радикального инициатора, M;
k - константа скорости генерирования (для 37°C kAAPH=0,98⋅10-6 с-1, kAIPN=3,92⋅10-6 с-1.
τ - период индукции, c.
В качестве растворителя используют воду.
Рабочим электродом может служить платиновый электрод, в качестве электрода сравнения может быть использован стандартный хлоридсеребряный электрод.
Указанные отличия существенны. За счет использования потенциометрического способа регистрации аналитического сигнала увеличивается точность и чувствительность измерений, а также появляется возможность анализа окрашенных и мутных растворов, в том числе сложных биологических объектов. Кроме того, результаты анализа выражены в универсальных единицах концентрации - моль-эквивалентов в литре, что облегчает интерпретацию данных.
В настоящее время из патентной и научно-технической литературы неизвестен способ определения антиоксидантной активности в заявляемой совокупности признаков. Впервые применен потенциометрический метод для решения данной задачи.
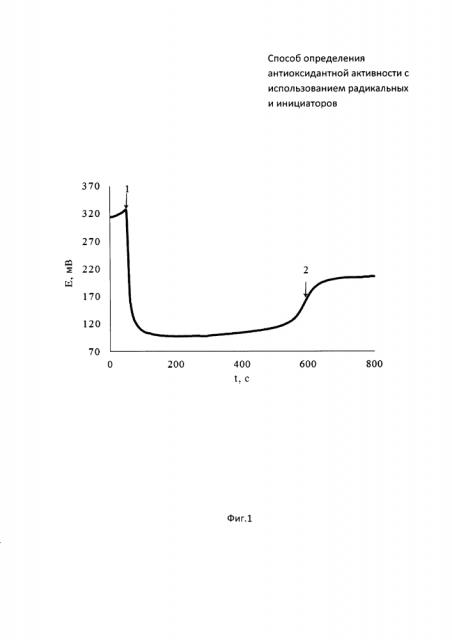
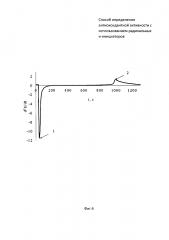
На фиг. 1 представлена зависимость потенциала от времени совместного инкубирования радикального инициатора 2,2’-азобис(2-метилпропионамидин) дигидрохлорида (ААРН) с цистеином. На фиг. 2 зависимость второй производной потенциала от времени.
На фиг. 3 представлена зависимость потенциала от времени совместного инкубирования радикального инициатора 2,2’-азобис(2-метилпропионамидин) дигидрохлорида (ААРН) с аскорбиновой кислотой. На фиг. 4 зависимость второй производной потенциала от времени.
На фиг. 5 представлена зависимость потенциала от времени совместного инкубирования радикального инициатора 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорид (AIPN) с глутатионом. На фиг. 6 зависимость второй производной потенциала от времени.
На фиг. 7 представлена зависимость потенциала от времени совместного инкубирования радикального инициатора 2,2’-азобис(2-метилпропионамидин) дигидрохлорида (ААРН) с образцом крови крыс. На фиг. 8 зависимость второй производной потенциала от времени.
Способ иллюстрируется следующими примерами.
Пример 1
В 5 мл водного раствора, содержащего 0,1М ААРН, инкубируемый в термостатируемой ячейке при 37°C, опускают рабочий электрод и электрод сравнения и вносят 0,05 мл 0,01М цистеина (момент времени (1) на фиг. 1). Далее проводят измерение потенциала до тех пор, пока на зависимости потенциала от времени не появится точка перегиба, определяемая методом двойного дифференцирования (момент времени (2) на фиг. 1). Период индукции, определяемый как время от введения цистеина в раствор инициатора (момент времени (1) на фиг. 2) до максимума на зависимости d2E/dt от времени (момент времени (2) на фиг. 2), равен 525 c.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
где Cyst - цистеин, CystOx - продукт окисления цистеина.
Антиоксидантную активность рассчитывают по формуле:
AOA=2k⋅C(In)⋅τ,
где AOA - антиоксидантная активность, М-экв;
C(In) - концентрация радикального инициатора, 0,1M;
k - константа скорости генерирования. Для 37°C kAAPH=0,98⋅10-6 с-1, kAIPN=3,92⋅10-6 с-1.
τ - период индукции, c.
Расчет показывает, что с учетом разбавления АОА равна 0,01 M-экв, что соответствует наличию одной функциональной группы в молекуле цистеина, определяющей его антиоксидантные свойства, т.е. n равно 1, что соответствует действительности.
Пример 2
В 5 мл водного раствора, содержащего 0,05М ААРН, инкубируемый в термостатируемой ячейке при 37°C, опускают рабочий электрод и электрод сравнения и вносят 0,05 мл 0,005М раствор аскорбиновой кислоты (момент времени (1) на фиг. 3). Далее проводят измерение потенциала до тех пор, пока на зависимости потенциала от времени не появится точка перегиба, определяемая методом двойного дифференцирования (момент времени (2) на фиг. 3). Период индукции, определяемый как время от введения аскорбиновой кислоты в раствор инициатора (момент времени (1) на фиг. 4) до максимума на зависимости d2E/dt от времени (момент времени (2) на фиг. 4), равен 963 c.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
где AK - аскорбиновая кислота, AKOx - продукт окисления аскорбиновой кислоты.
Антиоксидантную активность рассчитывают по формуле:
AOA=2k⋅C(In)⋅τ,
где AOA - антиоксидантная активность, М-экв;
C(In) - концентрация радикального инициатора, 0,05M;
k - константа скорости генерирования. Для 37°C kAAPH=0,98⋅10-6 с-1, kAIPN=3,92⋅10-6 с-1.
τ - период индукции, c.
Расчет показывает, что с учетом разбавления АОА равна 0,01 М-экв, что соответствует наличию двух функциональных групп в молекуле аскорбиновой кислоты, определяющих ее антиоксидантные свойства, т.е. n равно 2, что соответствует действительности.
Пример 3
В 5 мл водного раствора, содержащего ОДМ AIPN, инкубируемый в термостатируемой ячейке при 37°C, опускают рабочий электрод и электрод сравнения и вносят 0,05 мл 0,05М раствор глутатиона (момент времени (1) на фиг. 5). Далее проводят измерение потенциала до тех пор, пока на зависимости потенциала от времени не появится точка перегиба, определяемая методом двойного дифференцирования (момент времени (2) на фиг. 5). Период индукции, определяемый как время от введения глутатиона в раствор инициатора (момент времени (1) на фиг. 6) до максимума на зависимости d2E/dt от времени (момент времени (2) на фиг. 6), равен 630 c.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
где Glu - глутатион, GluOx - продукт окисления глутатиона. Антиоксидантную активность рассчитывают по формуле:
AOA=2k⋅C(In)⋅τ,
где AOA - антиоксидантная активность, М-экв;
C(In) - концентрация радикального инициатора, 0,1M;
k - константа скорости генерирования. Для 37°C kAIPH=0,98⋅10-6 с-1.
τ - период индукции, c.
Расчет показывает, что с учетом разбавления АОА равна 0,05 М-экв, что соответствует наличию одной функциональных группы в молекуле глутатиона, определяющей его антиоксидантные свойства, т.е. n равно 1, что соответствует действительности.
Пример 4
В 5 мл водного раствора, содержащего 0,1М ААРН, инкубируемый в термостатируемой ячейке при 37°C, опускают рабочий электрод и электрод сравнения и вносят 0,1 мл гемолизированной крови крыс (момент времени (1) на фиг. 5). Далее проводят измерение потенциала до тех пор, пока на зависимости потенциала от времени не появится точка перегиба, определяемая методом двойного дифференцирования (момент времени (2) на фиг. 5). Период индукции, определяемый как время от введения крови в раствор инициатора (момент времени (1) на фиг. 6) до максимума на зависимости d2E/dt от времени (момент времени (2) на фиг. 6), равен 714 c.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
где АО - антиоксидантные соединения, находящиеся в образце крови крыс, AOOx - продукты окисления антиоксидантных соединений в образце крови крыс.
Антиоксидантную активность рассчитывают по формуле:
AOA=2k⋅C(In)⋅τ,
где AOA - антиоксидантная активность, М-экв;
C(In) - концентрация радикального инициатора, 0,1M;
k - константа скорости генерирования. Для 37°C kAAPH=0,98⋅10-6 с-1, kAIPN=3,92⋅10-6 с-1.
τ - период индукции, c.
Расчет показывает, что с учетом разбавления, АОА образца гемолизированной крови крыс равна 6,96⋅10-3 М-экв.
Таким образом, технических результат заключается в расширении арсенала уже имеющихся технических средств определения антиоксидантной активности, а именно нового потенциометрического способа определения АОА, который позволяет увеличить точность и чувствительность измерений, анализировать окрашенные и мутные растворы, в том числе сложные биологические объекты, выражать результаты в универсальных единицах.
1. Способ определения антиоксидантной активности раствора анализируемого вещества, включающий приготовление исходного раствора радикального инициатора, генерирование радикалов в результате термического распада и определение антиоксидантной активности по периоду индукции, отличающийся тем, что период индукции определяют по изменению окислительно-восстановительного потенциала системы за счет протекания химической реакции исследуемых образцов с генерируемыми радикалами, а антиоксидантную активность рассчитывают по формуле:
AOA=2k⋅C(In)⋅τ,
где АОА - антиоксидантная активность, М-экв;
С(In) - концентрация радикального инициатора, М;
k - константа скорости генерирования (для 37°C kAAPH=0,98⋅10-6 с-1, kAIPN=3,92⋅10-6c-1);
τ - период индукции, с.
2. Способ по п. 1, отличающийся тем, что период индукции измеряют как время от введения исследуемого раствора в раствор инициатора до точки перегиба зависимости потенциала от времени, которую определяют как максимум второй производной функции зависимости окислительно-восстановительного потенциала от времени.
3. Способ по п. 1, отличающийся тем, что в качестве радикальных инициаторов используют азосоединения, например 2,2'-азобис(2-метилпропионамидин) дигидрохлорида (ААРН), 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорид (AIPN).