Способ микроинкапсулирования стволовых клеток
Иллюстрации
Показать всеИзобретение относится к медицине и биотехнологии, а именно к способу производства микрокапсул, содержащих стволовые клетки (СК) и предназначенных для лечения ишемического повреждения миокарда. Изобретение заключается в том, что суспензию СК в растворе альгината натрия пропускают через форсунку в электростатическом поле и стабилизацию микрокапсул осуществляют в растворе с осмоляльностью 0,23-0,31 осмоль/кг, содержащем 40-60 ммоль/л хлорида кальция и 40-60 ммоль/л хлорида бария. Способ обеспечивает оптимальные сроки биодеградации полученных микрокапсул, а именно 14 дней, и выживаемость инкапсулированных клеток в течение этого периода, превышающую 50%. 3 ил., 1 табл.
Реферат
Изобретение относится к медицине и биотехнологии, а именно к производству микрокапсул, содержащих стволовые клетки (СК) и предназначенных для лечения ишемического повреждения миокарда.
Ишемическая болезнь сердца представляет собой широко распространенное заболевание и является основной причиной летальности и инвалидизации в большинстве промышленно развитых стран мира. Клеточная терапия на основе СК является одним из наиболее перспективных направлений развития подходов к лечению ишемического повреждения миокарда. Однако одной из важнейших проблем в этом терапевтическом подходе является массивная гибель стволовых клеток в ранние сроки после трансплантации под воздействием неблагоприятных факторов микроокружения, таких как гипоксия и воздействие иммунной системы реципиента, поэтому клеточная терапия не может продемонстрировать достаточный уровень эффективности. Для увеличения доли жизнеспособных клеток в зоне трансплантации предложен подход на основе микроинкапсулирования клеток.
Известен способ заключения клеток, в том числе клеток островков Лангерганса или гепатоцитов, в полупроницаемую мембрану (US 4391909 А, опубл. 5.07.1983). Способ предполагает создание микрокапсул с полупроницаемой мембраной, содержащих полисахарид, имеющий кислотные группы с молекулярной массой больше чем 3 кДа, стабилизированный катионами поливалентных металлов или полимерами. Инкапсулированные клетки предназначаются для имплантации в организм с целью продукции биоактивных субстанций, характерных для этих клеток в тканях in vivo, и достижения эффектов последних. Для формирования капсул использовали полисахариды, предпочтительно солей альгиновой кислоты, стабилизированные мультивалентными катионами, предпочтительно ионов кальция, или полимерами, содержащими реактивные группы, такие как аминогруппы или иминогруппы. Формирование капсул производили путем помещения капиллярной трубки в центр водоворота, создаваемого с помощью быстрого перемешивания раствора поливалентного катиона. Капли, выбрасываемые из кончика капилляра, немедленно контактировали со стабилизирующим раствором с формированием сферической капсулы.
К недостаткам указанных микрокапсул и способа их получения следует отнести, во-первых, недостаточную стабильность капсул в физиологическом растворе, фосфатном буфере или плазме крови и, во-вторых, низкую производительность синтеза в связи с отсутствием автоматизации процесса.
Известен способ заключения генетически модифицированных мезенхимных СК (МСК), экспрессирующих глюкагоноподобный пептид-1 (ГЛП-1), в микрокапсулы с целью лечения инфаркта миокарда (ЕР 2163243 А1, опубл. 12.09.2008). Для создания микрокапсул использовали раствор калиевой или натриевой соли альгината в физиологическом растворе (наиболее предпочтительная концентрация альгината 1-2% вес/объем) с суспензированными в нем МСК в наиболее предпочтительной концентрации 105-106 кл/мл, кодирующими и секретирующими ГЛП-1. Формирование капсул производили с помощью пропускания через насадку с внутренним диаметром 50-2000 мкм. Для стабилизации капсул использовали бивалентные катионы, предпочтительно катионы бария или кальция (5-100 ммоль/л). Полученные микрокапсулы предназначены для введения в инфарктную, периинфарктную области, а также в область окружающего миокарда и внутрисосудистым способом.
К недостаткам указанных микрокапсул и способа их получения следует отнести, во-первых, сложность процесса синтеза, заключающуюся в необходимости многоэтапного пропускания суспензии альгината и капсул через шприц-помпу. Во-вторых, отсутствие биодеградации микрокапсул, что приводит к длительному нарушению однородности миокарда, дополнительному фиброзу вокруг инородного тела, и, в свою очередь, способствует аритмогенезу.
Известен способ микроинкапсулирования СК для лечения острого ишемического инфаркта миокарда (Levit R. et al. Cellular encapsulation enhances cardiac repair. J Am Heart Assoc. 2013; 2., опубл. 10.11.13). Клетки заключали в микрокапсулы со средним диаметром 250 мкм. Для инкапсуляции использовали суспензию клеток в 1% растворе альгината натрия, пропускаемую через форсунку диаметром 170 мкм с помощью электростатического инкапсулятора (Nisco; Швейцария) и стабилизируемую в растворе 50 ммоль/л хлорида бария.
Недостатком микрокапсул, полученных указанным способом, является отсутствие биодеградации микрокапсул в физиологических условиях. В то же время, с точки зрения сроков формирования рубцовой ткани после повреждения и имеющихся данных о механизмах действия СК, оптимальный срок присутствия инкапсулированных СК в ткани реципиента составляет 14-21 день. Более короткий срок снижает эффективность клеточной терапии, а более продолжительное нахождение капсул в ткани может приводить к фиброзу и нарушению однородности ткани.
Технический результат заявленного изобретения заключается в создании микрокапсул, содержащих СК, с оптимальным временем биодеградации.
Заявленный технический результат достигается в способе микроинкапсулирования стволовых клеток, включающем пропускание суспензии стволовых клеток в растворе альгината натрия через форсунку в электростатическом поле и стабилизацию микрокапсул в растворе, содержащем хлорид бария, согласно которому стабилизацию осуществляют в растворе с осмоляльностью 0,23-0,31 осмоль/кг, содержащем 40-60 ммоль/л хлорида кальция и 40-60 ммоль/л хлорида бария.
Микрокапсулы, полученные с помощью системы высокопроизводительной микроинкапсуляции по принципу дробления потока инкапсулируемой суспензии и рассеивания полученных микрокапель в электростатическом поле с последующей стабилизацией их в растворе, содержащем катионы кальция и бария в диапазоне концентраций 40-60 ммоль/л хлорида кальция и 40-60 ммоль/л хлорида бария, характеризуются устойчивостью в фосфатном буфере в течение первых трех дней, проявляют признаки биодеградации после пятого дня инкубирования и полностью растворяются к четырнадцатому дню инкубирования. Поддержание осмоляльности стабилизирующего раствора в пределах 0,23-0,31 осмоль/кг обеспечивает оптимальную осмотическую силу раствора, которая не влияет на функциональное состояние СК. Микрокапсулы заключают в себе СК, выживаемость которых в течение 14 суток после инкапсулирования превышает 50%.
На чертежах представлены:
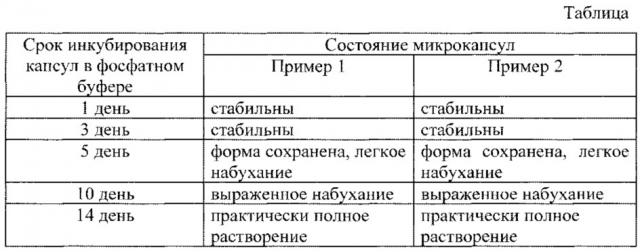
Фиг. 1 - динамика биодеградации микрокапсул, полученных по примеру 1;
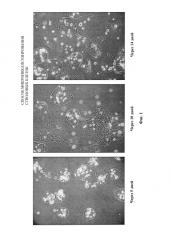
Фиг. 2 - динамика биодеградации микрокапсул, полученных по примеру 2;
Фиг. 3 - выживаемость инкапсулированных СК.
Способ осуществляют, например, следующим образом.
Для получения микрокапсул 1 мл суспензии клеток в фосфатном буфере (PBS), содержащий 1×106 СК, смешивают с 3 мл 1% раствора альгината натрия. Полученную смесь подают на вход установки Encapsulator В-390 (BUCHI, Швейцария) с параметрами работы: диаметр используемой форсунки - 100-150 мкм, частота вибрации 2500-3500 Гц, напряжение электродов 1500-2500В, давление 400-550 мбар. Такие параметры позволяют получить капсулы из альгината со средними размерами от 150 до 400 мкм. В качестве стабилизирующего раствора для формирования поверхностной оболочки микрокапсулы используют раствор, содержащий 40-60 ммоль/л хлорида кальция и 40-60 ммоль/л хлорида бария, с осмолярностью 0,23-0,31 осмоль/кг. Продолжительность инкубирования в стабилизирующем растворе составляет 5 минут. В дальнейшем капсулы отмывают 5 раз 10 мл PBS.
Изобретение иллюстрируется следующими примерами.
1. Для получения микрокапсул 1 мл суспензии клеток в PBS, содержащий 1×106 МСК, смешивали с 3 мл 1% раствора альгината натрия. Полученную смесь подавали на вход установки Encapsulator В-390 с параметрами работы: диаметр используемой форсунки 120 мкм, частота вибрации 2500 Гц, напряжение электродов 2400 В, давление 530 мбар.
В качестве стабилизирующего раствора для формирования поверхностной оболочки микрокапсулы использовали раствор, содержащий 40 ммоль/л хлорида кальция и 60 ммоль/л хлорида бария, при этом осмолярность 0,230 осмоль/кг. Продолжительность инкубирования в стабилизирующем растворе составила 5 минут. В дальнейшем капсулы отмывали 5 раз 10 мл PBS.
В результате были получены капсулы заданного размера 200-250 мкм, среднее количество клеток в одной капсуле 30±3.
2. Для получения микрокапсул 1 мл суспензии клеток в PBS, содержащий 1×106 МСК, смешивали с 3 мл 1% раствора альгината натрия. Полученную смесь подавали на вход установки Encapsulator В-390 с параметрами работы: диаметр используемой форсунки 120 мкм, частота вибрации 3200 Гц, напряжение электродов 1600В, давление 410 мбар.
В качестве стабилизирующего раствора для формирования поверхностной оболочки микрокапсулы использовали раствор, содержащий 60 ммоль/л хлорида кальция и 40 ммоль/л хлорида бария, при этом осмолярность составила 0,245 осмоль/кг. Продолжительность инкубирования в стабилизирующем растворе составила 5 минут. В дальнейшем капсулы отмывали 5 раз 10 мл PBS.
В результате были получены капсулы заданного размера 220-280 мкм, среднее количество клеток в одной капсуле 30±3.
Была проведена оценка стабильности полученных микрокапсул. В обоих примерах стабильность микрокапсул, помещенных в фосфатный буфер, оценивали визуально в динамике в 1 день, 3 день, 5 день, 10 день, 14 день.
Динамика состояния микрокапсул при их инкубировании в фосфатном буфере представлена в таблице и на фигурах 1 и 2.
Для оценки жизнеспособности инкапсулированных клеток был использован витальный краситель LIVE/DEAD Viability/Cytotoxicity Kit (Invitrogen, США), содержащий бромистый этидий для окраски мертвых клеток и кальцеин AM для окраски живых клеток. Результаты окрашивания визуализировали с помощью флуоресцентного микроскопа. Количественную оценку жизнеспособных клеток производили через 30 минут, 5 дней и 14 дней после окрашивания. Процент выживших клеток в обоих примерах не различался и составил 76±6%, 68±9% и 57±8%, соответственно (фиг. 3).
Использование заявленного способа обеспечивает оптимальные сроки биодеградации полученных микрокапсул, а именно 14 дней, и выживаемость инкапсулированных клеток в течение этого периода, превышающую 50%.
Способ микроинкапсулирования стволовых клеток, включающий пропускание суспензии стволовых клеток в растворе альгината натрия через форсунку в электростатическом поле и стабилизацию микрокапсул в растворе, содержащем хлорид бария, отличающийся тем, что стабилизацию осуществляют в растворе с осмоляльностью 0,23-0,31 осмоль/кг, содержащем 40-60 ммоль/л хлорида кальция и 40-60 ммоль/л хлорида бария.