Способ определения генетической предрасположенности к заболеванию инфекционным эндокардитом
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для определения генетической предрасположенности к заболеванию инфекционным эндокардитом (ИЭ) и высокого риска развития ИЭ. У русских пациентов группы риска осуществляют забор образцов венозной крови, выделение геномной ДНК, проведение аллель-специфической полимеразной цепной реакции и определение полиморфных локусов Lys268Arg гена NAT2 и Ile105Val гена GSTP1. У носителей сочетания генотипов NAT2 Arg268Arg × GSTP1 Ile105Val выявляют генетическую предрасположенность и 11,3-кратный риск развития ИЭ. Изобретение обеспечивает установление генетической предрасположенности к ИЭ у пациентов из группы риска, что способствует эффективному определению комплекса профилактических и лечебных мероприятий. 1 з.п. ф-лы, 2 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к медицине, а именно к терапии и хирургии, и может быть использовано для определения генетической предрасположенности и повышенного риска развития инфекционного эндокардита (ИЭ) у пациентов из группы риска.
ИЭ - одно из самых тяжелых заболеваний сердечно-сосудистой системы с летальным исходом в 20-30% случаев. В группу повышенного риска входят лица с ревматическими пороками сердца, дегенеративными изменениями клапанов, ПМК, искусственными клапанами, врожденными и приобретенными пороками сердца, после операций на сердце, а также употребляющие наркотики внутривенно. Однако участились случаи возникновения ИЭ при отсутствии известных факторов риска у детей, ослабленных пожилых пациентов и людей, имеющих хронические очаги инфекции. Рост заболеваемости ИЭ в последние годы, сложность своевременной диагностики и его лечения обусловливает поиск дополнительных факторов, предрасполагающих к его развитию. К таковым можно было бы отнести маркеры, определяющие генетическую предрасположенность к заболеванию и наследственный риск его развития, - однонуклеотидные полиморфизмы (ОНП; single nucleotide polymorphism, SNP) генов. Исследования ОНП, связанных с патогенезом ИЭ, проводимые в последнее десятилетие, немногочисленны и неоднозначны, посвящены, в основном, выявлению ассоциаций ИЭ с вариантами генов системы врожденного иммунитета. Тем не менее, несомненных ассоциаций с ИЭ некоторых вариантов генов толл-подобных рецепторов и интерлейкинов - TLR4, IL10, IL1β, IL6, TNF, не обнаружено [Weinstock М., Grimm I., Dreier J., Knabbe С., Vollmer Т. Genetic Variants in Genes of the Inflammatory Response in Association with Infective Endocarditis. PLoS One. 2014; 9 (10): e110151. Published online Oct 9, 2014].
Наиболее близким к заявляемому способу является способ определения высокого риска развития ИЭ у носителей варианта Q полиморфизма R753Q (rs 5743708) в гене толл-подобного рецептора 2 (TLR2) (Bustamante J., Tamayo Е., Florez S., Telleria J.J., Bustamante E., Lopez J., San Roman J.A., Alvarez F.J. Toll-Like Receptor 2 R753Q Polymorphisms Are Associated With an Increased Risk of Infective Endocarditis. Rev. Esp. Cardiol. 2011; 64 (11): 1056-9). Способ заключается в выделении геномной ДНК из образцов крови, взятой в пробирки с антикоагулянтом - этилендиаминтетрауксусной кислотой (ЭД-ТА), определении полиморфизма R753Q в гене TLR2 с помощью полимеразной цепной реакции и рестрикционного анализа полученных ПЦР-продуктов. Авторами было обследовано 65 больных инфекционным эндокардитом в сравнении с 66 практически здоровыми индивидами. При статистическом анализе результатов генотипирования найдена значительная ассоциация с ИЭ полиморфизма R753Q гена TLR2 и установлен повышенный риск (в 3-13 раз) развития ИЭ у носителей аллеля Q.
Однако заявленная Bustamante J. и соавт. связь полиморфизма R753Q в гене TLR2 с ИЭ не была подтверждена в более поздних исследованиях [Понасенко А.В., Кутихин А.Г., Хуторная М.В., Южалин А.Е., Рутковская Н.В., Головкин А.С., Барбараш Л.С. Связь полиморфизмов генов системы TLR с риском развития инфекционного эндокардита. Медицина в Кузбассе. 2015, XIV(4): 4-10].
Задачей настоящего изобретения явилась разработка нового способа определения генетической предрасположенности и повышенного риска развития инфекционного эндокардита (ИЭ) на основании выявления ассоциации ИЭ с однонуклеотидными полиморфизмами других генов.
Поставленная задача была достигнута забором образцов венозной крови, выделением геномной ДНК, проведением аллель-специфической полимеразной цепной реакции, определением однонуклеотидного полиморфизма Lys268Arg гена ариламин N-ацетилтрансферазы NAT2 (rs1208, нуклеотидная замена 803A>G) и однонуклеотидного полиморфизма Ile105Val гена глутатион-S-трансферазы Пи1 GSTP1 (rs1695, нуклеотидная замена 313A>G) при генотипировании русских пациентов группы риска и у носителей сочетания генотипов NAT2 Arg268Arg × GSTP1 Ile105Val выявлением генетической предрасположенности и 11,3-кратного риска развития инфекционного эндокардита. В группу риска входят пациенты с врожденными и приобретенными пороками сердца, протезированными клапанами сердца, пролапсом митрального клапана сердца (МК) 2-3 степени с систолическим шумом, атеросклеротической деформацией МК и аортального клапана сердца (АК), а также принимающие наркотики внутривенно.
Новизна изобретения
1. Генотипирование по полиморфным локусам Lys268Arg гена NAT2 и Ile105Val гена GSTP1 русских пациентов группы риска позволяет определить генетическую предрасположенность и прогнозировать 11,3-кратный риск развития ИЭ у носителей сочетания генотипов NAT2 Arg268Arg × GSTP1 I105V.
2. В группу риска входят пациенты с врожденными и приобретенными пороками сердца, протезированными клапанами сердца, пролапсом МК 2-3 степени с систолическим шумом, атеросклеротической деформацией МК и АК, а также принимающие наркотики внутривенно.
В патентной и научной литературе отсутствуют сведения об аналогичном способе определения генетической предрасположенности к заболеванию ИЭ.
Совокупность существенных признаков изобретения позволила получить новый технический результат, заключающийся в установлении генетической предрасположенности к ИЭ у пациентов из группы риска, что поможет определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий.
Ген NAT2 кодирует N-ацетилтрансферазу 2, один из ферментов второй фазы системы детоксикации, осуществляющий N-ацетилирование (дезактивацию) ароматических и О-ацетилирование (активацию) гетероциклических аминов, к которым относятся многие канцерогены и лекарственные препараты. Известно более 65 вариантов (гаплотипов) гена NAT2, отличающихся одним или более ОНП в 870-bp кодирующей области NAT2. Большинство гаплотипов NAT2 представляют собой один или сочетание семи наиболее часто встречающихся ОНП в кодирующей области гена. Гаплотипы NAT2 связаны со слабой («медленной») или сильной («быстрой») ацетилирующей способностью (фенотипом), которая модифицирует чувствительность фермента ариламин N-ацетилтрансферазы к субстратам и может повышать риск развития некоторых видов рака (Hein D.W, Doll М.А, Fretland A.J. et al. Molecular genetics and epidemiology of the NAT1 and NAT2 acetylation polymorphisms. Cancer Epidemiol Biomarkers Prev. 2000; 9: 29-42; Agundez J.A. Polymorphisms of human N-acetyltransferases and cancer risk. Curr Drug Metab. 2008; 9:520-31). Гаплотипы делят носителей на фенотипы быстрого и медленного ацетилирования. Показано, что частота и/или степень тяжести лекарственного и ксенобитического токсикоза в человеческих популяциях зависит от статуса ацетилирования (Jiang W., Feng Y., Hein D.W. Higher DNA adduct levels in urinary bladder and prostate of slow acetylator inbred rats administered 3,2'-dimethyl-4-aminobiphenyl. Toxicol Appl Pharmacol 1999; 156: 187-94; Feng Y., Fretland A.J., Rustan T.D., Jiang W., Becker W.K., Hein D.W. Higher frequency of abberant crypt foci in rapid than slow acetylator inbred rats administered the colon carcinogen 3,2'-dimethyl-4-aminobiphenyl. Toxicol Appl Pharmacol. 1997; 147: 56-62).
Носительство двух мутантных («медленных») аллелей гена NAT2 приводит к фенотипу медленного ацетилятора, т.е. продуцируется фермент с пониженной активностью, вследствие чего повышается чувствительность организма к воздействию ароматических аминов, усиливается риск развития онкологических заболеваний, вызываемых воздействием ароматических аминов, особенно рака мочевого пузыря [An Y., Li Н., Wang K.J., Liu Х.Н.„ Qiu М.Х., Liao Y., Huang J.L., Wang X.S. Meta-analysis of the relationship between slow acetylation of N-acetyl transferase 2 and the risk of bladder cancer. Genet Mol Res. 2015 Dec 14; 14(4): 16896-904].
Присутствие в генотипе хотя бы одного аллеля дикого («быстрого») типа приводит к фенотипу быстрого ацетилятора при аутосомно-доминантном типе наследования, т.е. продуцируется фермент с повышенной активностью, из-за чего усиливается чувствительность к воздействию гетероциклических аминов, повышается риск колоректального рака, особенно при употреблении в пищу жареного мяса [Lang N.P., Butler М.А., Massengell J., Lawson М., Stotts R.С., Hauer-Jensen M., Kadlubar F. F. Rapid metabolic phenotypes for acetyltransferase and cytochrome P4501A2 and putative exposure to food-borne heterocyclic amines increases the risk for colorectal cancer or polyps. Cancer Epidemiol. Biomark. Prev. 1994; 3: 675-82,; Roberts-Thomson I. C., Ryan P., Khoo K.K., Hart W.J., McMichael A.J., Butler R.N. Diet, acetylator phenotype, and risk of colorectal neoplasia. Lancet. 1996; 347: 1372-4].
Мутантный вариант первого тестируемого нами полиморфизма rs1208 (общее название Lys268Arg) приводит к несинонимичной замене аминокислот Lysine (AAA)→Arginine (AGA) в кодоне 268. Rs1208 присутствует во множестве гаплотипов NAT2*, формирующих различные фенотипы в зависимости от ассоциации с другими ОНП в гене NAT2. Rs1208 может приводить к формированию фенотипа «медленного» ацетилятора при его сочетании с другими «медленными» функциональными вариантами. NAT2*12 гаплотипы, в составе которых всегда находится rs1208, ассоциируются со статусом быстрого ацетилятора.
Глутатион-S-трансферазы (GST) - семейство мультифункциональных антиоксидантных ферментов фазы II системы детоксикации ксенобиотиков, одной из наиболее известных функций которых является катализ конъюгации глутатиона с различными субстратами, в том числе мутагенами и канцерогенами и их электрофильными метаболитами, генерируемыми в процессах окисления фазы I детоксикации. GST могут играть важную роль в детоксикации электрофильных α- и β-ненасыщенных карбонильных соединений, продуцируемых в реакциях окисления липидов, при воздействии ионизирующей радиации и при метаболизме лекарств [Berhane K., Widersten М., Engstrom А. et al. Detoxication of base propenals and other α,β-unsaturated aldehydeproducts of radical reactions and lipid peroxidation by human glutathione transferases. Proc. Natl. Acad. Sci. U.S.A. 1994; 91: 1480-4]. Фермент GSTP1 экспрессируется во многих нормальных и малигнизированных тканях. Кодирующий его ген GSTP1 выделен и охарактеризован [Lo H.-W. and Ali-Osman F. Genomic Cloning of hGSTP1*C, an Allelic Human Pi Class Glutathione S-Transferase Gene Variant and Functional Characterization of Its Retinoic Acid Response Elements. J. Biol. Chem. 1997; 272(52): 32743-9]. У человека он локализуется в хромосомном локусе 11q13, состоит из 7 экзонов и 6 интронов, содержащих 3116 п.н., и может иметь несколько нуклеотидных транзиций. Несинонимичный полиморфизм 313A>G (Ile105Val в экзоне 5), а именно транзиция нуклеотидов, изменяющая кодон 105 с Ile на Val, приводит к изменениям в связывающем электрофильные соединения сайте фермента и ослаблению его активности, что определяет повышенную чувствительность индивида к множеству заболеваний, в том числе к астме, различным формам рака.
Способ осуществляется следующим образом.
Геномную ДНК выделяют из клеток периферической крови с помощью коммерческих реагентов «ДНК-экспресс-кровь-плюс» или «ДНК-экспресс-кровь» (НПФ «Литех», Москва). Для генотипирования используют коммерческие комплекты реагентов для выявления мутаций (полиморфизмов) в геноме человека - «SNP-экспресс» (НПФ Литех, Москва). Генотипирование проводят по полиморфным локусам Lys268Arg гена NAT2 (Мутация-3 NAT2) [НПФ Литех, Москва] и Ile105Val гена GSTP1 (мутация 1 Пи-глутатион-S-трансферазы) [НПФ Литех, Москва] с помощью метода аллель-специфической полимеразной реакции. Согласно инструкции к комплектам, с образцом выделенной ДНК осуществляют одновременно две реакции амплификации - с двумя парами аллель-специфичных праймеров, на параллельное выявление аллелей мутантного и нормального типа. Реакционная смесь для ПЦР состоит из 5 мкл исследуемого образца ДНК и 20 мкл рабочей амплификационной смеси, содержащей 0,2 мкл рабочего раствора Taq полимеразы. Амплификацию проводят в автоматическом термоциклере Терцик («ДНК-Технология», Москва). Программа амплификации, соответственно инструкции, включает следующий температурный режим - 1 цикл при 93°C в течение 1 мин, 35 циклов с этапами денатурации ДНК в течение 10 с при 93°C, отжига праймеров в течение 10 с при 64°C и синтеза цепей в течение 20 с при 72°C и 1 цикл при 72°C в течение 1 мин. Анализ ПЦР-продуктов проводят после их электрофоретического разделения в 50 мл 3%-агарозного геля на 50×ТАЕ-буфере, в который до застывания вносят 5 мкл 1% раствора бромистого этидия. В каждом геле вырезают два ряда лунок - для детекции аллеля нормального типа и мутантного аллеля. Фрагменты анализируемой ДНК проявляются в виде светящихся полос. Гели анализируют в УФ-трансиллюминаторе ЕСХ-15М (Vilber Lourmat, Франция) с помощью гельдокументирующей видеосистемы GL-2 (Россия) и/или фотографируют при помощи цифрового фотоаппарата Canon PowerShot А590 IS в проходящем ультрафиолетовом свете с длиной волны 310 нм.
Изобретение иллюстрируется фотографиями Фиг. 1 и Фиг. 2.
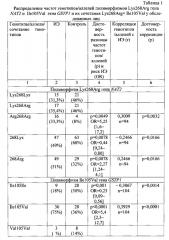
На Фиг. 1 представлены результаты проведения генотипирования 19 человек с диагнозом инфекционного эндокардита по полиморфизму Lys268Arg гена NAT2 в виде электрофореграммы, на которой показаны продукты амплификации исследуемого локуса в виде светящихся полос. K- - отрицательный контроль; дорожки 1,8,9,13 - гомозиготный нормальный генотип Lys268Lys, дорожки 2, 4, 6, 7, 11, 14, 15, 19 - гомозиготный мутантный генотип Arg268Arg, дорожки 3, 5, 10, 12, 16 - гетерозиготный генотип Lys268Arg.
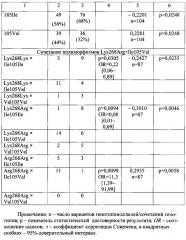
На Фиг. 2 представлены результаты проведения генотипирования 8 пациентов с диагнозом инфекционного эндокардита по полиморфизму Ile105Val гена GSTP1 в виде электрофореграммы, на которой показаны продукты амплификации исследуемого локуса в виде светящихся полос. K- - отрицательный контроль; дорожки 1-4, 6-8 - гетерозиготный генотип Ile105Val, дорожка 5 - гомозиготный генотип Ile105Ile.
Всего обследовано 48 пациентов (16 женщин и 32 мужчины) в возрасте от 19 до 76 лет, находившихся на стационарном лечении в терапевтических клиниках г. Новокузнецка с диагнозом инфекционного эндокардита, выставленным на основании критериев DUKE. Более половины из них принимали наркотики внутривенно (27 человек), 5 человек в этой группе страдали хронической болезнью почек с необходимостью проведения гемодиализа, у большинства из них обнаружено поражение трикуспидального клапана сердца (ТК). У 10 человек обнаружен ревматический порок митрального и аортального клапанов сердца (МК, АК), у пяти из них проведено их протезирование. Врожденные пороки сердца выявлены у 4-х пациентов, пролапс митрального клапана 2-3 степени с систолическим шумом - у 2-х человек, у 3-х пациентов обнаружены атеросклеротические изменения МК и АК, у 2-х больных ИЭ с поражением ТК развился на фоне тяжелой вирусной инфекции. У всех пациентов неоднократно проводилось исследование крови на стерильность. У 18 больных выявлены золотистый стафилококк Staphylococcus aureus и зеленящий стрептококк Streptococcus viridans, у 7 человек - другие возбудители (энтеробактерии, клебсиеллы, кишечная и синегнойная палочки). У остальных пациентов инфекционный агент не был обнаружен.
В группу контроля включены 56 лиц в возрасте от 27 до 74 лет (30 женщин и 26 мужчин), не имеющих признаков очаговой и системной инфекции с умеренно выраженными возрастными изменениями (у лиц старше 60 лет), не страдающих артериальной гипертензией и ишемической болезнью сердца.
Забор крови и молекулярно-генетические исследования осуществляли на основании информированного согласия обследованных лиц. Все обследованные лица проживали на территории Кемеровской области и принадлежали к русскому этносу.
Математическую обработку результатов исследований проводили с помощью пакетов статистических программ InStatII, Microsoft Excel. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05. Соответствие распределения частот генотипов равновесию Харди-Вайнберга определяли стандартно при помощи программы Chi-sq Hardy-Weinberg equilibrium test calculator for biallelic markers. Достоверность различий в распределении частот аллелей и генотипов между группами больных и здоровых индивидов оценивали двусторонним точным критерием Фишера. Частота аллеля/генотипа определялась по соотношению количества его носителей к общему количеству носителей тестируемых аллелей/генотипов в исследуемой выборке. Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов (OR-odds ratio): OR=(а×d)/(b×с), где а и b - количество больных, имеющих и не имеющих мутантный аллель (генотип) соответственно; с и d - количество человек в группе контроля, имеющих и не имеющих мутантный аллель (генотип) соответственно.
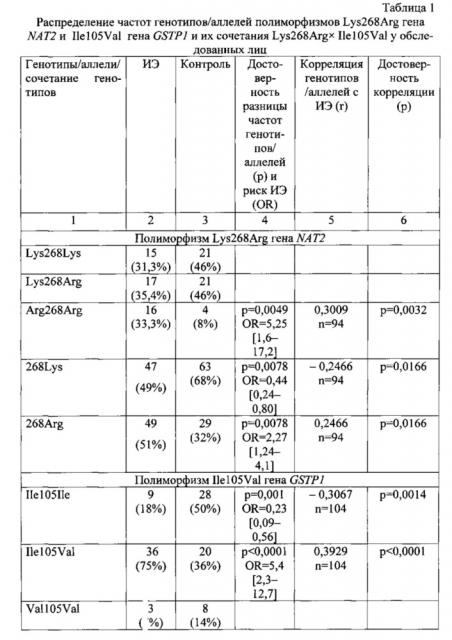
Результаты генотипирования по тестируемым полиморфным локусам генов NAT2 и GSTP1 всех обследуемых лиц представлены в таблице 1. Полиморфизм Lys268Arg гена NAT2 в гомозиготном и гетерозиготном вариантах встречался со сходной частотой как в группе с ИЭ, так и в группе контроля (p>0,05). Однако гомозигот по аллелю 268Arg среди пациентов с ИЭ было в 4 раза больше, чем в контроле (р=0,0081), что, видимо, обусловило небольшое отклонение частот тестируемых генотипов у больных людей от равновесия Харди-Вайнберга (χ2=4,07, р=0,0435), в то время как в группе контроля распределение генотипов не отличалось от равновесия Харди-Вайнберга (χ2=0,15, р=0,6967). Полученные результаты позволили выявить высокий достоверный риск заболевания у носителей генотипа Arg268Arg (OR=5,25, р=0,0049), аллеля 268Arg (OR=2,27, р=0,0078) и положительную корреляционную связь с ИЭ как у носителей данного генотипического варианта (r=0,3009, р=0,0032), так и у носителей аллеля 268Arg (r=0,2466, р=0,0166). Носительство аллеля 268Lys отрицательно связано с заболеванием и поэтому его можно отнести к защитным факторам в отношении ИЭ.
У 75% больных ИЭ обнаружено носительство гетерозиготного варианта полиморфизма Ile105Val гена GSTP1, а в группе контроля данный генотип встретился только у 36% обследованных. Распределение генотипов полиморфизма Ile105Val подчинялось равновесию Харди-Вайнберга в группе контроля (χ2=1,84, р=0,1749), в группе больных ИЭ - значимо отличалось (χ2=13,17, р=0,0003) вследствие существенного превалирования гетерозигот. И расчет показал достоверно высокий риск заболевания (OR=5,4, р<0,0001) и положительную корреляционную связь с ИЭ (r=0,3929, р<0,0001) у гетерозигот по данному полиморфизму. Соответственно, гомозиготный генотип GSTP1 Ile105Ile оказался протективным вариантом (OR=0,23, р=0,001).
Сочетание генотипов NAT2 Arg268Arg × GSTP1 Ile105Val встречалось у 23% больных ИЭ, а в группе контроля только у 3% лиц, и у носителей такого сочетания риск заболевания оказался максимальным (OR=11,3, р=0,0099) в данном исследовании.
Таким образом, выявлена ассоциация однонуклеотидных полиморфизмов Lys268Arg гена NAT2 и Ile105Val гена GSTP1 с ИЭ, проявляющаяся в положительной корреляционной связи с заболеванием и 11,3-кратном риске его развития при носительстве сочетания генотипов NAT2 Arg268Arg × GSTP1 Ile105Val у русских пациентов с врожденными и приобретенными пороками сердца, протезированными клапанами сердца, пролапсом МК 2-3 степени с систолическим шумом, атеросклеротической деформацией МК и АК, а также принимающих наркотики внутривенно.
Клинический пример №1. Пациент Р., 36 лет, русский, поступил 12.12.2014 г. в отделение терапии МБЛПУ ГКБ №2 с жалобами на слабость, потливость, одышку при обычной физической нагрузке, боль в грудной клетке, усиливающуюся при глубоком вдохе, кашле, трудноотделяемую гнойную мокроту, повышение температуры тела до 39-40°C, ознобы, боли в мышцах, в суставах. Болен в течение 2 недель, лечился самостоятельно безрезультатно жаропонижающими препаратами, цефтриаксоном. Доставлен бригадой скорой помощи. В анамнезе: гепатит, туберкулез, ВИЧ - отрицает. Прием наркотиков в/в в течение 15 лет (ханка, соли, героин). Курит в течение 15 лет по 1 пачке в сутки. Простудные заболевания 3-4 раза в год. Постоянной работы нет. При осмотре состояние средней степени тяжести, температура тела 38°C, кожа сухая, бледная, отеков нет, пониженного питания. В легких дыхание везикулярное, рассеянные сухие хрипы над всей легочной поверхностью, ЧД 22 в мин. Тоны сердца глухие ритмичные, ЧСС 110 в мин, систолический шум во всех точках, АД 120/80 мм рт. ст. Живот мягкий, безболезненный. Стул, диурез в норме. При обследовании: AT к ВИЧ, ВГВ, трепонеме - не выявлены. Обнаружены AT к ВГС. Общий анализ крови - Нв 112 г/л, эр. 3,5, лейк. 8,4, п/я 20, лимф. - 13, СОЭ 50 мм/ч. Общий анализ мочи - уд. вес 1012, белок 0,3 г/л, лейк. в большом количестве, эр. - 1-2 в п/зр, цилиндры гиалиновые 1-2 в п/зр. Анализ мочи по Нечипоренко: лейк.-201500, эр. 2500, цилиндры 3000. Б/х ан. крови: сахар 5,7, креатинин 155 (№40-140) мкмоль/л, мочевина 8,0, АЛТ 132, ACT-66 (повышены), фибриноген 5.25, белок 78,1, билирубин 11,7. Кровь на гемокультуру №3 - отрицательно. УЗИ - спленомегалия, печень + 1,5 см из-под края реберной дуги, размеры в норме. Диффузные изменения в паренхиме почек. ЭХО КГ - умеренно расширены правые полости, на ТК гипоэхогенный очаг вегетаций 13×5 мм, регургитация 2-3 ст, незначительный перикардиальный выпот, признаков легочной гипертензии не выявлено, ФВ 67%. ЭКГ - синусовая тахикардия 117 в мин. Рентгенография органов грудной клетки - двусторонняя септическая пневмония с распадом. Результаты генотипирования по полиморфным локусам Lys268Arg гена NAT2 и Ile105Val гена GSTP1: выявлено сочетание генотипов NAT2 Arg268Arg × GSTP1 Ilel05Val, указывающее на 11,3-кратный риск заболевания ИЭ.
Дз: Острый инфекционный эндокардит с поражением трехстворчатого клапана, первичный. Недостаточность ТК. ХСН 1-2а ст. Двусторонняя септическая пневмония, с распадом, тяжелое, затяжное течение. Наркомания. Хр. вирусный гепатит С.
Проведено лечение: цефуроксим, ванкомицин, фраксипарин, гентамицин. Выписан с улучшением на дальнейшее амбулаторное лечение.
Клинический пример №2. Больная М., 26 лет, русская. Госпитализирована в отделение пульмонологии МБЛПУ ГКБ №1 г. Новокузнецка с жалобами на сухой кашель, одышку при незначительной физической нагрузке, озноб, повышение температуры тела до 39°C, потливость по ночам, кашель с небольшим количеством гнойной мокроты. Больна в течение 2-3 недель, накануне перенесла ОРВИ, не обращалась за медицинской помощью, лечение симптоматическое, повышение температуры тела - в дебют заболевания в течение 3-4 дней. На фоне лечения - улучшение состояния, катаральные явления купированы, температура вернулась к норме. Сохранялась выраженная слабость, одышка при умеренной физической нагрузке. В течение последних 2 недель появились ознобы, вновь отмечалось повышение температуры до 39°C без эффекта от жаропонижающих препаратов, нарастала слабость, появился кашель, потливость по ночам. Доставлена бригадой скорой помощи в санпропускник МБЛПУ ГКБ №1. В анамнезе нередкие простудные заболевания до 4-6 раз в год, частое использование антибактериальных препаратов без назначения врача. В 2009 г. выявлен порок сердца, документов с результатами обследования нет, не наблюдалась. Прием наркотиков отрицает. Работа связана с переохлаждением (работала на хладокомбинате фасовщицей). Питание однообразное, мясо, фрукты - редко. Объективно: состояние средней степени тяжести за счет интоксикационного синдрома, температура тела - 38,5°C. Носовое дыхание не затруднено. Кожа бледная, влажная, чистая, отеков нет. В легких дыхание жесткое, ослаблено в подлопаточной области справа, хрипов нет, ЧД 18 в минуту, тоны сердца глухие, ритмичные ЧСС 110 в минуту, аускультативно - грубый систолический шум во всех точках. При обследовании: общий анализ крови - Нв 91 г/л, эр. 3,4, л. 15,0, п/я. 14, лимф. 10,5, юные - 1, тромбоциты - 415, СОЭ 52 мм/ч. Общий анализ мочи - уд. вес 1005, белок 2,5 гр/л, эр. 40-50 в п/зр., л. - 2-6 в п/зр. Б/х ан. крови: АЛТ 2,26, ACT - 3,0, мочевина 10,2, креатинин 106, белок 59,6, сахар 5,0, прокальцитонин 6,1, СРБ 460.3 мг/л. Д-димер 2350, AT к ВГВ, ВГС, ВИЧ не выявлены. ЭКГ - синусовая тахикардия, нарушение процессов реполяризации в задней стенке левого желудочка. Рентгенография органов грудной клетки - полисигментарная пневмония справа с распадом. ЭХО-КГ - признаки ревматического поражения митрального клапана, стеноз створок МК. Smo 1,62 см 2, регургитация 1-2 ст. Аортальный клапан - стеноз не выявлен, кальциноз и фиброз створок, регургитация 2 степени. Уплотнены створки трикуспидального клапана и клапана легочной артерии, регургитация ТК-2 ст. В правом предсердии по в/стенке дополнительное округлое образование, подвижное, средней эхогенности 2,7×1,75 см. Дилятация полостей обоих предсердий, больше левого, ФВ 47,8%. пародоксальное движение МЖП. По УЗИ - гепа-тоспленомегалия. Диффузное изменение паренхимы почек. В динамике - появилась свободная жидкость в брюшной полости. По результатам посева крови на стерильность выявлена Staphylococcus aureus. В последующих посевах появилась Pseudomonas stutseri. Учитывая тяжесть состояния, проводимую инфузионную, антибактериальную терапию, больной был поставлен подключичный катетер. Состояние ухудшилось: присоединился тромбоз подколенной артерии справа, рецидивировали ТЭЛА, нарастала сердечная, дыхательная недостаточность. Проведена ампутация правой нижней конечности до средней трети бедра. Результаты генотипирования по полиморфным локусам Lys268Arg гена NAT2 и Ile105Val гена GSTP1: выявлено сочетание генотипов NAT2 Arg268Arg × GSTP1 Ilel05Val, указывающее на 11,3-кратный риск заболевания ИЭ.
Дз: Вторичный инфекционный эндокардит. Хр. ревматическая болезнь сердца: комбинированный митральный порок с преобладанием стеноза. Недостаточность АК, ТК, ХСН 2Б. ФК III. Состояние после ампутации правой нижней конечности до ср/трети бедра по поводу острого артериального тромбоза. Полисегментарная пневмония справа с распадом. Рецидивирующие ТЭЛА.
1. Способ определения генетической предрасположенности к заболеванию инфекционным эндокардитом и высокого риска развития инфекционного эндокардита, включающий забор образцов венозной крови, выделение геномной ДНК, проведение аллель-специфической полимеразной цепной реакции, определение однонуклеотидного полиморфизма гена, отличающийся тем, что проводят генотипирование по полиморфным локусам Lys268Arg гена ариламин N-ацетилтрансферазы NAT2 и Ile105Val гена глутатион-S-трансферазы Пи1 GSTP1 русских пациентов группы риска и у носителей сочетания генотипов NAT2 Arg268Arg × GSTP1 Ile105Val выявляют генетическую предрасположенность и 11,3-кратный риск развития инфекционного эндокардита.
2. Способ по п.1, отличающийся тем, что в группу риска входят пациенты с врожденными и приобретенными пороками сердца, протезированными клапанами сердца, пролапсом митрального клапана сердца (МК) 2-3 степени с систолическим шумом, атеросклеротической деформацией МК и аортального клапана сердца (АК), а также принимающие наркотики внутривенно.