Плазмидный вектор pet-ppsltp, штамм бактерии escherichia coli bl21(de3)star/ pet-ppsltp - продуцент пищевого аллергена гороха pis s 3 и способ получения указанного аллергена
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к рекомбинантному получению белков в Escherichia coli, и может быть использовано для получения рекомбинантного пищевого аллергена гороха посевного Pisum sativum. Конструируют плазмидный вектор pET-pPsLTP для экспрессии Pis s 3 в клетках Escherichia coli в составе гибридного белка His8-TrxL-Pis s 3. Трансформируют предложенным вектором родительский штамм Escherichia coli BL21(DE3)Star, получая штамм-продуцент гибридного белка His8-TrxL-Pis s 3. Затем проводят культивирование и последующий лизис клеток штамма-продуцента, аффинную очистку гибридного белка His8-TrxL-Pis s 3 на металлохелатном носителе, расщепление гибридного белка His8-TrxL-Pis s 3 бромцианом по остатку метионина, введенному между последовательностями аллергена Pis s 3 и тиоредоксина, повторную металлохелатную хроматографию и очистку целевого пептида с помощью обращенно-фазовой ВЭЖХ. Изобретение позволяет получить особо чистый пищевой аллерген Pis s 3, способный связывать специфические антитела. 3 н.п. ф-лы, 5 ил., 4 пр.
Реферат
Изобретение относится к области биотехнологии, а именно к получению Pis s 3-пищевого аллергена гороха посевного Pisum sativum, относящегося к классу липид-транспортирующих белков (Lipid transfer proteins, LTP), который может найти широкое применение в диагностике аллергических заболеваний для создания современных тест-систем, предназначенных для компонентной аллергодиагностики, а также в медицине с целью создания аллерговакцин для проведения более эффективной и безопасной аллерген-специфической иммунотерапии (АСИТ).
Липид-транспортирующие белки составляют один из наиболее клинически значимых классов растительных аллергенов, участвующих в развитии аллергических реакций различной степени тяжести на пыльцу, растительные продукты и латекс. Компактная пространственная структура этих белков, стабилизированная четырьмя дисульфидными связями, позволяет им достигать кишечника человека в нативной, иммуногенной форме и вызывать сенсибилизацию [Hauser М. et al. Panallergens and their impact on the allergic patient. // Allergy Asthma. Clin. Immunol. 2010. T.6. №1. С. 1]. Наличие у растительных LTP устойчивой к тепловой, химической денатурации и ферментативному расщеплению структуры также объясняется то, что они выступают в роли основных аллергенов в различных прошедших обработку продуктах (соках, джемах, пиве, вине и др.) [Crespo J.F. et al. Frequency of food allergy in a pediatric population from Spain // Pediatr. Allergy Immunol. 1995. T. 6. №1. C. 39-43].
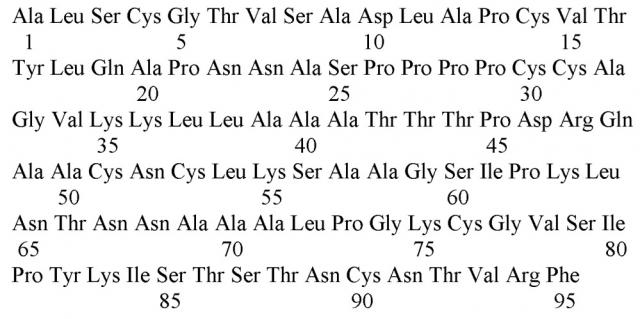
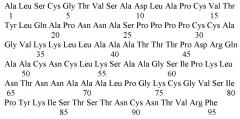
Липид-транспортирующий белок гороха посевного Pisum sativum Pis s 3 (SEQ ID No. 1) является важным пищевым аллергеном семян гороха, который был внесен в международную базу данных по аллергенам (www.allergen.org) Международного союза иммунологических обществ (WHO/IUIS). Данный белок состоит из 95 аминокислотных остатков и включает в себя характерный для аллергенных надсемейств растительных липид-транспортирующих белков и проламинов октацистеиновый мотив. Данный белок с различной эффективностью связывает широкий спектр липидных молекул, включая жирные кислоты, лизолипиды и регулятор роста растений - жасмоновую кислоту. Он обладает также антимикробной активностью в отношении ряда фитопатогенных организмов, главным образом, плесневых грибов - представителей рода Fusarium. Показана высокая стабильность данного аллергена к перевариванию ферментами желудочно-кишечного тракта и термической обработке, благодаря чему данный аллерген сохраняет свою нативную конформацию в прошедших обработку продуктах, содержащих горох. Pis s 3 способен связывать специфические антитела IgE из сывороток пациентов с пищевой аллергией на фрукты, бобовые и орехи, что может приводить к системным аллергическим реакциям при попадании данного аллергена в организм сенсибиллизованных пациентов. В связи с этим данный аллерген может найти широкое применение для диагностики IgE-опосредованной пищевой аллергии на горох, а также для проведения аллерген-специфической иммунотерапии с целью снижения иммунореактивности организма к продуктам, содержащим гороховые бобы и муку, и для лечения аллергических реакций у чувствительных к нему пациентов.
Известен наиболее близкий к заявляемому изобретению способ получения рекомбинантного аналога пищевого аллергена класса LTP - Pha v 3 стручковой фасоли. Данный способ основан на сверхэкспрессии данного аллергена в дрожжах Pichia pastoris, дальнейшей его очистке из культуральной жидкости с помощью последовательных стадий осветления центрифугированием, фильтрации через фильтр с диаметром 0,45 мкм, ультрафильтрации через фильтр с MWCO 3 кДа, ионообменной и эксклюзионной хроматографии [Zoccatelli G. et al. Identification and characterization of the major allergen of green bean (Phaseolus vulgaris) as a non-specific lipid transfer protein (Pha v 3) // Mol. Immunol. - 2010. - Vol. 47(7-8). - PP. 1561-1568]. Предложенный в данном изобретении метод получения рекомбинантного аллергена гороха Pis s 3 основан на его сверхэкспрессии в прокариотической системе кишечной палочки E.coli. Среди преимуществ использования E.coli для гетерологичной экспрессии являются простота условий культивирования, быстрый рост культуры, высокие уровни экспрессии, а также более низкая себестоимость целевых белков.
Изобретение решает задачу расширения ассортимента аллергенных белков, предназначенных, главным образом, для компонентной аллергодиагностики и превентивной иммунотерапии, за счет получения пищевого аллергена гороха Pis s 3.
Поставленная задача решается за счет:
- генно-инженерного конструирования плазмидного вектора pET-pPsLTP, несущего нуклеотидную последовательность SEQ ID No. 2 для экспрессии в клетках Escherichia coli гена пищевого аллергена гороха Pis s 3, кодирующую гибридный полипептид His8-TrxL-Pis s 3, включающий аминокислотные последовательности белков Pis s 3 и тиоредоксина TrxL, а также октагистидиновую аффинную метку;
- создания штамма-продуцента данного гибридного полипептида Escherichia coli BL21(DE3)Star/pET-pPsLTP, сконструированного на основе штамма E.coli BL21(DE3)Star путем трансформации его вектором pET-pPsLTP;
- способа получения целевого белка - пищевого аллергена Pis s 3 - путем экспрессии гена содержащего его гибридного полипептида His8-TrxL-Pis s 3 в клетках указанного штамма, разрушения бактериальных клеток, аффинной очистки гибридного полипептида His8-TrxL-Pis s 3 на металлохелатном носителе, расщепления гибридного белка по сайту, расположенному между последовательностями Pis s 3 и тиоредоксина А, и очистки целевого белка Pis s 3 с помощью обращенно-фазовой ВЭЖХ.
Для получения гетерологичных рекомбинантных белков с клонированной эукариотической кДНК зачастую используются прокариотические системы экспрессии. Однако в некоторых случаях эукариотические белки, синтезированные в бактериях, оказываются неаутентичными и биологически неактивными. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена, в основном, отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций. Однако, несмотря на их значительные недостатки, прокариотические системы находят самое широкое применение, поскольку себестоимость полученных в этих системах рекомбинантных белков ниже, а производительность штаммов-продуцентов выше. Получение рекомбинантных аллергенов класса липид-транспортирующих белков, полностью идентичных природным, в бактериях является вполне осуществимой задачей, поскольку структура большинства из них не требует осуществления посттрансляционных модификаций, кроме замыкания дисульфидных связей.
Предложенная плазмида наряду с геном гибридного белка TrxL содержит маркерный ген устойчивости к ампициллину bla, а также ген-регулятор lad, кодирующий белок-репрессор. Наличие гена lad в структуре плазмиды является одним из факторов, обеспечивающих подавление базальной экспрессии гена гибридного белка, находящегося под контролем промотора бактериофага Т7. Ввиду чрезвычайно высокой активности Т7 РНК-полимеразы даже сравнительно невысокий уровень «протечки» данного промотора может отрицательно сказаться на жизнеспособности клеток штамма-продуцента, поскольку промежуточные и конечные продукты экспрессии часто обладают цитотоксическим действием [Marley J., Lu М., Bracken С. A method for efficient isotopic labeling of recombinant proteins // Journal of Biomolecular NMR. - 2001. - Vol. 20. - PP. 71-75]. В отсутствие индуктора белок-репрессор, синтезирующийся конститутивно, связывается с lac-оператором, тем самым препятствуя взаимодействию РНК-полимеразы с Т7-промотором, что приводит к резкому снижению уровня транскрипции клонированного гена. При добавлении индуктора сайт связывания Т7 РНК-полимеразы освобождается и начинается синтез матричной РНК. Ген Т7 РНК-полимеразы встроен в бактериальную хромосому штамма Е. coli BL21(DE3)Star и контролируется промотором lacUV5. Индукция экспрессии подобного лактозного оперона проводится с помощью β-галактозидов, которые при связывании с одной из субъединиц репрессора блокируют его связывание с оператором. Наиболее часто используемым индуктором экспрессии является изопропилтио-β-D-галактопиранозид (IPTG) - синтетический аналог природного индуктора алло-лактозы. Наличие атома серы в IPTG предотвращает разложение индуктора, таким образом, предлагаемый индуктор характеризуется необратимостью действия.
Конструирование предложенного плазмидного вектора pET-pPsLTP, экспрессирующего ген гибридного белка His8-TrxL-Pis s 3, содержащий аминокислотную последовательность целевого аллергенного белка Pis s 3, может быть осуществлено путем лигирования фрагмента плазмиды, содержащего область инициации репликации и маркерный ген, со вставкой, кодирующей ген гибридного белка. В свою очередь, искусственный ген, который кодирует гибридный белок His8-TrxL-Pis s 3, может быть получен химическим синтезом набора олигонуклеотидных фрагментов с последующей сборкой и амплификацией промежуточных и конечного продуктов при помощи полимеразной цепной реакции (ПЦР). Матрицей для амплификации последовательности тиоредоксина может служить бактериальный геном либо плазмида рЕТ-32а(+). Продуктами лигазной реакции трансформируют компетентные клетки Е. coli штамма с выключенной системой рекомбинации и рестрикции ДНК, например DH10B.
В качестве белка-партнера предлагаемая конструкция содержит тиоредоксин А Escherichia coli, который обеспечивает экспрессию гибридного белка преимущественно в растворимой (нативной) форме. Кроме того, сам тиоредоксин А является природным компонентом цитоплазмы Е. coli и в высоких концентрациях не оказывает токсического действия на бактериальные клетки. Гибридные белки, содержащие тиоредоксин А, очень часто характеризуются теми же свойствами. С целью дальнейшего высвобождения целевого белка Pis s 3 из молекулы гибридного белка His8-TrxL-Pis s 3 между последовательностями Pis s 3 и тиоредоксина вводят, как минимум, один сайт, позволяющий проводить избирательное расщепление гибридного полипептида химическим или ферментативным способом.
Наличие N-концевой октагистидиновой последовательности в составе гибридного белка, кодируемого предложенной плазмидой, обеспечивает возможность проведения аффинной очистки. Данный метод очистки белков основан на способности аминокислот (в основном, остатков гистидина) образовывать мультидентатные комплексы с катионами переходных металлов (Со2+, Ni2+, Cu2+, Zn2+), фиксированными в виде хелатов на нерастворимой матрице, представляющей собой поперечносшитую агарозу, и содержащую такие хелатирующие группы, как иминодиацетат (IDA), нитрилотриацетат (NTA) или карбоксиметиласпартат (СМА, TALON). Сила связывания между белком и ионами металла зависит от некоторых факторов, включая длину и положение аффинной метки в белке, тип используемых ионов металла и рН буфера. Элюцию гибридного белка проводят путем подкисления буфера до рН 4,5-5,5 (при этом остатки гистидина, рКа которых составляет около 6,0, переходят в протонированную форму), пропускания через колонку градиента имидазола, который конкурирует с гистидином за связывание с ионами металлов либо хелатированием ионов металла с помощью ЭДТА.
В случае использования химического метода расщепления гибридного белка His8-TrxL-Pis s 3 бромцианом наиболее целесообразным является использование в качестве белка-партнера для гетерологичной экспрессии модифицированного тиоредоксина А, содержащего замену внутреннего остатка метионина на остаток другой аминокислоты, такой как, например, лейцин (Met37Leu). Известно, что подобное незначительное изменение первичной структуры не оказывает влияния на пространственную структуру и свойства тиоредоксина [Rudresh et al. Structural consequences of replacement of an alpha-helical Pro residue in Escherichia coli thioredoxin // Protein Eng. - 2002. - Vol. 15(8). - PP. 627-633]. Реакцию с бромцианом проводят в стандартных условиях: растворяют белок в 60-90% трифторуксусной кислоте с добавлением 0,1 М соляной кислоты, вносят бромциан в 10-200-кратном стехиометрическом избытке по отношению к числу остатков метионина в образце, инкубируют в темноте в течение 16-20 ч.
После этого проводят очистку продуктов реакции расщепления гибридного белка с помощью повторной металлохелатной хроматографии, разделяя таким образом целевой белок, белок-носитель и нерасщепленный гибридный белок. Целевой полипептид очищают методом высокоэффективной жидкостной хроматографии в системе растворителей ацетонитрил:вода с добавлением 0,1% ТФУ.
Гомогенность полученного аллергена Pis s 3 и его идентичность природному белку устанавливают методами SDS-электрофореза в ПААГ, MALDI-TOF масс-спектрометрии, микросеквенированием N-концевой аминокислотной последовательности по методу Эдмана, КД-спектроскопии, тестированием иммуноглобулин-связывающих свойств.
Изобретение иллюстрируют следующие чертежи:
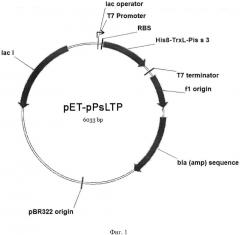
На фиг. 1 отображена физическая карта рекомбинантной плазмиды pET-pPsLTP: pBR322 origin - участок инициации репликации плазмиды; blа - ген устойчивости к β-лактамным антибиотикам; lad - ген lac-репрессора; Т7 promoter - промотор транскрипции; Т7 terminator - терминатор транскрипции; lac operator - сайт связывания lac-репрессора; RBS - сайт связывания рибосомы; His8-TrxL-Pis s 3 - последовательность, кодирующая гибридный белок, включающий участок из восьми остатков гистидина (His8), модифицированный (Met37Leu) тиоредоксин A (TrxL) и модифицированный (Metl lLeu) аллерген Pis s 3.
Фиг. 2 отражает контроль экспрессии (А), очистки (Б) и расщепления (В) гибридного белка His8-TrxL-Pis s 3: смесь белков-стандартов молекулярных масс (М); суммарный клеточный лизат до индукции (1); суммарный клеточный лизат после индукции (2,3) в отсутствие и в присутствии 2-меркаптоэтанола; растворимая (4) и нерастворимая (5) фракции клеточного белка; проскок с металлохелатной колонки (6); элюат (7), диализат (8) и продукты расщепления гибридного белка бромцианом (9) соответственно.
На фиг. 3 изображены: хроматограмма повторной ОФ-ВЭЖХ очистки на колонке Luna С18 (Phenomenex) (A); MALDI-TOF масс-спектрометрия фракции 1, содержащей рекомбинантный Pis s 3 (Б); КД-спектры природного и полученного в соответствии с предложенной схемой рекомбинантного Pis s 3 (В).
На фиг. 4 изображена электрофореграмма (А) и иммунохимический анализ (Б) рекомбинантных аллергенов. Детекцию проводили, используя поликлональные кроличьи антитела к Len с 3: 1,2,3 - рекомбинантные Len с 3, Pru р 3 и Pis s 3 в присутствии 2-меркаптоэтанола, соответственно; 4 - суммарный экстракт гороха в присутствии 2-меркаптоэтанола.
Фиг. 5 отражает результаты твердофазного иммуноферментного анализа с использованием поликлональных кроличьих антител к Len с 3 (А), а также ингибирование рекомбинантным Pis s 3 и аллергеном Pru р 3 связывания аллергена чечевицы с кроличьими антителами к Len с 3 (Б).
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование плазмидного вектора pET-pPsLTP.
Нуклеотидную последовательность (SEQ ID No. 2, нуклеотиды 12-797), содержащую промотор транскрипции Т7 РНК-полимеразы, lac-оператор, участок связывания рибосомы и участок, кодирующий гибридный полипептид, содержащий последовательно расположенные гистидиновый октамер, тиоредоксин с заменой Met37Leu, сайт расщепления бромцианом и Pis s 3, получают химико-ферментативным синтезом с помощью полимеразной цепной реакции (ПНР). Олигонуклеотиды, используемые в ПЦР, синтезируют твердофазным фосфоамидитным методом с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-О-(β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом. Фрагмент, кодирующий белок-носитель тиоредоксин (Met37Leu) получают методом ПЦР-амплификации и направленного мутагенеза с помощью ген-специфических праймеров, используя в качестве исходной матрицы плазмиду рЕТ32а(+), содержащую ген тиоредоксина. Остальные участки последовательности pET-pPsLTP получают путем последовательного отжига и элонгации взаимно перекрывающихся олигонуклеотидов, а также отжига, элонгации и амплификации промежуточных продуктов синтеза.
Фрагмент, кодирующий зрелый Pis s 3, получают методом ПЦР-амплификации, сопряженной с обратной транскрипцией. Для получения данного фрагмента из проращенных семян гороха Pisum sativum выделяют суммарную РНК, проводят реакцию обратной транскрипции с олиго-dT праймером, после чего проводят ПЦР с прямым мутагенизирующим (Met11 Leu)(GCGGGATCCATGGCTTTGTCTTGTGGAACTGTATCCGCTGATTTGGCTCCATGCGTT АС) и обратным (GCGGAATTCTCAAAACCTAACAGTGTTACAGTTGG) праймерами, несущими на 5'-концах сайты узнавания рестриктаз EcoRI и BamHI. С целью предотвращения расщепления целевого аллергена Pis s 3 во время реакции фрагментации полипептидной цепи гибридного белка бромцианом, единственный остаток метионина в составе целевого белка заменяют на лейцин (Met11Leu). На завершающей стадии синтеза последовательность, содержащую данный фрагмент, амплифицируют с помощью праймеров, несущих на 5'-концах сайты узнавания рестриктаз BglII и XhoI. Продукт амплификации гидролизуют указанными рестриктазами, очищают электрофорезом в 1,5% агарозном геле, элюируют набором «Cleanup Mini» (Евроген) и лигируют с фрагментом ДНК размером 5,25 тыс. п. н., полученным в результате обработки плазмиды pET31b(+) рестриктазами BglII и XhoI. В результате лигазной реакции получают кольцевую ковалентно замкнутую ДНК размером 6033 п. н. (фиг. 1).
Продуктами лигазной реакции трансформируют компетентные клетки E.coli DH10B, приготовленные с помощью 0,1 М хлорида кальция. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 100 мкг/мл ампициллина. Отбор клонов, содержащих нужную плазмиду, осуществляют методом «ПЦР с клонов» с использованием праймеров на плазмидный остов и вставку. Отобранные клоны подращивают в жидкой питательной среде и выделяют плазмидную ДНК, которую подтверждают определением нуклеотидной последовательности с помощью секвенирования по Сэнгеру. По данным секвенирования отбирают плазмиду со вставкой, нуклеотидная последовательность которой полностью соответствует SEQ ID No. 2.
Пример 2.
Получение рекомбинантного аллергена гороха Pis s 3.
Трансформацией клеток Е. coli штамма BL21(DE3)Star сконструированной плазмидой получают штамм-продуцент рекомбинантного белка. Клетки штамма-продуцента культивируют в богатой питательной среде LB при температуре 26°С. В качестве индуктора экспрессии используют 0,2 мМ изопропилтио-β-D-галактопиранозид, который добавляют в логарифмической фазе роста клеток. Контроль экспрессии гибридного белка His8-TrxL-Pis s 3 проводят методом SDS-электрофореза в ПААГ (фиг. 2А).
Выделение и очистку гибридного белка, содержащего Pis s 3, проводят с помощью металлохелатной хроматографии на Ni2+-сефарозе, используя растворимую клеточную фракцию (фиг. 2Б). Клеточный осадок, полученный в результате центрифугирования, ресуспендируют в буферном растворе А (50 мМ трис-HCl, 0,5 М NaCl, 20 мМ имидазол, рН 7,8), содержащем ингибитор сериновых протеаз фенилметилсульфонилфторид, и гомогенизируют на льду с помощью ультразвука. Полученный лизат центрифугируют (осветляют) при 25000 g в течение 20 мин. Все работы по получению осветленного лизата проводят при температуре 4°С. Осветленный лизат наносят на колонку и элюируют связавшийся с носителем гибридный белок буфером В (50 мМ трис-HCl, 0,5 М NaCl, 0,5 М имидазол, рН 7,8). Детектирование ведут при длине волны 280 нм. Элюат, содержащий гибридный белок, диализируют относительно подкисленной воды в течение 16 ч через мембрану с размером пор 12 кДа и лиофильно высушивают.
Расщепление гибридного белка проводят бромцианом в кислой среде по пептидной связи, образованной карбоксильной группой остатка метионина (фиг. 2В). Для этого гибридный белок растворяют в 80% (v/v) ТФУ в концентрации 20 мг/мл, добавляют равную массу бромциана и инкубируют в темноте 18 ч при температуре 25°С. Реакцию останавливают добавлением трехкратного объема воды, после чего упаривают образцы на вакуумном концентраторе SpeedVac.
После расщепления продукты реакции разделяют с помощью повторной металлохелатной хроматографии в денатурирующих условиях в системе буферов с 6М гуанидина гидрохлоридом. Дальнейшую очистку рекомбинантного аллергена осуществляют методом ОФ-ВЭЖХ на колонке Reprosil-Pur C18-AQ (Dr. Maisch GmbH). Разделение проводят в линейном градиенте концентрации ацетонитрила от 5 до 80% за 60 мин в присутствии 0,1% ТФУ при скорости потока 2 мл/мин. Финальным этапом очистки является повторная ОФ ВЭЖХ на колонке Luna С18 (Phenomenex) в тех же условиях при скорости потока 0,7 мл/мин (фиг. 3А).
Гомогенность полученного рекомбинантного Pis s 3 и его идентичность природному аллергену подтверждают с помощью методов SDS-электрофореза в ПААГ, MALDI-TOF масс-спектрометрии (фиг. 3Б) и автоматического микросеквенирования по Эдману. Исследование вторичной структуры полученного рекомбинантного белка проводят с помощью метода КД-спектроскопии. Спектр кругового дихроизма рекомбинантного Pis s 3 представляет собой кривую, характерную для белков с высоким содержанием а-спиральной структуры, и идентичен таковой природного аллергена Pis s 3, выделенного из гороха посевного Pisum sativum (фиг. 3В).
Пример 3.
Сравнительный иммунохимический анализ с анти-Len с 3 антителами кролика методом иммуноблоттинга.
Проведение сравнительного исследования иммунологических свойств рекомбинантных аллергенов Pis s 3, Len с 3 и Pru р 3 с кроличьими анти-Len с 3 антителами осуществляют методом иммуноблоттинга. После проведения SDS-электрофореза в 15% ПААГ (фиг. 4А) осуществляют электроперенос рекомбинантных аллергенов и белков суммарного экстракта семян гороха на нитроцеллюлозную мембрану в течение 50 мин в буфере, содержащем 25 мМ NaHCO3, 20% метанола и 0,1% SDS. Свободные сайты связывания предварительно блокируют, инкубируя мембрану при комнатной температуре в течение 1 ч в 1% растворе обезжиренного сухого молока в буфере, содержащем 20 мМ Трис-HCl, 150 мМ NaCl, рН 7,4 (TBS). После трехкратного промывания мембраны тем же буфером, содержащим 0,05% твин 20 (TBS-T), ее инкубируют при комнатной температуре в течение 2 ч в растворе кроличьих анти-Len с 3 антител в 1% молоке/TBS (разведение 1:200). Далее мембрану снова промывают три раза буфером TBS-T, после чего инкубируют ее при комнатной температуре в растворе конъюгированных с пероксидазой хрена козьих антивидовых антител к IgG кролика в 1%-м молоке/TBS. Отмытую буфером TBS-T мембрану обрабатывают раствором 3,3',5,5'-тетраметилбензидина (ТМВ). Ферментативную реакцию останавливают, промывая мембрану водой для удаления остатков субстрата. По результатам иммуноблоттинга поликлональные кроличьи анти-Len с 3 антитела связываются со всеми тремя рекомбинантными аллергенами, а также с природным Pis s 3 из суммарного экстракта гороха (фиг. 4Б).
Пример 4.
Твердофазный иммуноферментный анализ с анти-Len с 3 антителами кролика.
Сорбцию белков-антигенов (0,5 мкг) в ячейках полистеренового 96-луночного планшета производят в буфере TBS в течение 1 ч при температуре 37°С. После трехкратной промывки лунок планшета буфером TBS, содержащим 0,05% твин 20 (TBS-Т), свободные сайты связывания в лунках планшета блокируют путем инкубации в термостатируемом шейкере ST-3 (ELMI) в течение 1 ч при температуре 37°С с 1% раствором BSA в буфере TBS. Далее в лунки планшета вносят раствор кроличьих анти-Len с 3 антител в TBS (разведение 1:8000) и проводят инкубацию в течение 1 ч при температуре 37°С. После пятикратной промывки буфером TBS-T в лунки вносят раствор конъюгированных с пероксидазой хрена козьих антивидовых антител к IgG кролика и инкубируют планшет при температуре 37°С в течение 1 ч. После пятикратной промывки буфером TBS-T в лунки вносят раствор ТМВ для ИФА. Ферментативную реакцию останавливают через 30 мин добавлением 4 н. H2SO4 и проводят анализ полученных данных, измеряя оптическую плотность в лунках при 450 нм при помощи планшетного фотометра Multiscan EX (Thermo). На основании результатов твердофазного иммуноферментного анализа можно сделать вывод, что анти-Len с 3 антитела взаимодействуют со всеми исследуемыми антигенами (фиг. 5А).
Ингибирование связывания анти-Len с 3 антител с Len с 3 проводят по вышеописанной методике с небольшими модификациями. В лунки планшета вносят раствор Len с 3, а анти-Len с 3 антитела в разведении 1:16000 предварительно инкубируют с аллергенами Pis s 3, Pru р 3 и Len с 3 в концентрациях 0,02-200 мкг/мл в течение 3 ч при температуре 37°С. Остальные этапы осуществляют по описанной выше методике (фиг. 5Б).
SEQUENCE LISTING
<110> ИБХ РАН
Богданов, Иван
Баландин, Сергей
Овчинникова, Татьяна
<120> ПЛАЗМИДНЫЙ ВЕКТОР pET-pPsLTP, ШТАММ БАКТЕРИИ Escherichia coli
BL21(DE3)Star/pET-pPsLTP - ПРОДУЦЕНТ ПИЩЕВОГО АЛЛЕРГЕНА ГОРОХА
Pis s 3 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО АЛЛЕРГЕНА
<130> (Reference Number)
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 95
<212> PRT
<213> Pisum sativum
<400> 1
<210> 2
<211> 6033
<212> DNA
<213> Artificial Sequence
<220>
<223> plasmid vector
<400> 2
gtagaggatc gagatctgcg ggatctcgat cccgcgaaat taatacgact cactataggg 60
gaattgtgag cggataacaa ttcccctcta gagtcgacgg atcttacttt aagaaggaga 120
tatacatatg agccatcacc accaccatca ccatcacgga tctagcgata aaattattca 180
cctgactgac gacagttttg acacggatgt actcaaagcg gacggggcga tcctcgtcga 240
tttctgggca gagtggtgcg gtccgtgcaa actgatcgcc ccgattctgg atgaaatcgc 300
tgacgaatat cagggcaaac tgaccgttgc aaaactgaac atcgatcaaa accctggcac 360
tgcgccgaaa tatggcatcc gtggtatccc gactctgctg ctgttcaaaa acggtgaagt 420
ggcggcaacc aaagtgggtg cactgtctaa aggtcagttg aaagagttcc tcgacgctaa 480
cctggccgga tccatggctt tgtcttgtgg aactgtatcc gctgatttgg ctccatgcgt 540
tacttatctt caagctccta ataatgccag tcctccaccg ccatgctgtg caggagtgaa 600
gaagcttctt gctgccgcca ccaccacgcc ggatcgtcag gctgcctgta actgcttgaa 660
atcagctgcc ggttctattc ctaaattgaa tactaacaat gctgctgctc tccctggcaa 720
atgcggtgtt agcatccctt acaagatcag tacctccacc aactgtaaca ctgttaggtt 780
ttgagaattc tctcgagcac caccaccacc accactgaga tccggctgct aacaaagccc 840
gaaaggaagc tgagttggct gctgccaccg ctgagcaata actagcataa ccccttgggg 900
cctctaaacg ggtcttgagg ggttttttgc tgaaaggagg aactatatcc ggattggcga 960
atgggacgcg ccctgtagcg gcgcattaag cgcggcgggt gtggtggtta cgcgcagcgt 1020
gaccgctaca cttgccagcg ccctagcgcc cgctcctttc gctttcttcc cttcctttct 1080
cgccacgttc gccggctttc cccgtcaagc tctaaatcgg gggctccctt tagggttccg 1140
atttagtgct ttacggcacc tcgaccccaa aaaacttgat tagggtgatg gttcacgtag 1200
tgggccatcg ccctgataga cggtttttcg ccctttgacg ttggagtcca cgttctttaa 1260
tagtggactc ttgttccaaa ctggaacaac actcaaccct atctcggtct attcttttga 1320
tttataaggg attttgccga tttcggccta ttggttaaaa aatgagctga tttaacaaaa 1380
atttaacgcg aattttaaca aaatattaac gtttacaatt tcaggtggca cttttcgggg 1440
aaatgtgcgc ggaaccccta tttgtttatt tttctaaata cattcaaata tgtatccgct 1500
catgagacaa taaccctgat aaatgcttca ataatattga aaaaggaaga gtatgagtat 1560
tcaacatttc cgtgtcgccc ttattccctt ttttgcggca ttttgccttc ctgtttttgc 1620
tcacccagaa acgctggtga aagtaaaaga tgctgaagat cagttgggtg cacgagtggg 1680
ttacatcgaa ctggatctca acagcggtaa gatccttgag agttttcgcc ccgaagaacg 1740
ttttccaatg atgagcactt ttaaagttct gctatgtggc gcggtattat cccgtattga 1800
cgccgggcaa gagcaactcg gtcgccgcat acactattct cagaatgact tggttgagta 1860
ctcaccagtc acagaaaagc atcttacgga tggcatgaca gtaagagaat tatgcagtgc 1920
tgccataacc atgagtgata acactgcggc caacttactt ctgacaacga tcggaggacc 1980
gaaggagcta accgcttttt tgcacaacat gggggatcat gtaactcgcc ttgatcgttg 2040
ggaaccggag ctgaatgaag ccataccaaa cgacgagcgt gacaccacga tgcctgcagc 2100
aatggcaaca acgttgcgca aactattaac tggcgaacta cttactctag cttcccggca 2160
acaattaata gactggatgg aggcggataa agttgcagga ccacttctgc gctcggccct 2220
tccggctggc tggtttattg ctgataaatc tggagccggt gagcgtgggt ctcgcggtat 2280
cattgcagca ctggggccag atggtaagcc ctcccgtatc gtagttatct acacgacggg 2340
gagtcaggca actatggatg aacgaaatag acagatcgct gagataggtg cctcactgat 2400
taagcattgg taactgtcag accaagttta ctcatatata ctttagattg atttaaaact 2460
tcatttttaa tttaaaagga tctaggtgaa gatccttttt gataatctca tgaccaaaat 2520
cccttaacgt gagttttcgt tccactgagc gtcagacccc gtagaaaaga tcaaaggatc 2580
ttcttgagat cctttttttc tgcgcgtaat ctgctgcttg caaacaaaaa aaccaccgct 2640
accagcggtg gtttgtttgc cggatcaaga gctaccaact ctttttccga aggtaactgg 2700
cttcagcaga gcgcagatac caaatactgt ccttctagtg tagccgtagt taggccacca 2760
cttcaagaac tctgtagcac cgcctacata cctcgctctg ctaatcctgt taccagctgc 2820
cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc 2880
gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta 2940
caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag 3000
aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct 3060
tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga 3120
gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc 3180
ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt 3240
atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg 3300
cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcctgatgcg 3360
gtattttctc cttacgcatc tgtgcggtat ttcacaccgc atatatggtg cactctcagt 3420
acaatctgct ctgatgccgc atagttaagc cagtatacac tccgctatcg ctacgtgact 3480
gggtcatggc tgcgccccga cacccgccaa cacccgctga cgcgccctga cgggcttgtc 3540
tgctcccggc atccgcttac agacaagctg tgaccgtctc cgggagctgc atgtgtcaga 3600
ggttttcacc gtcatcaccg aaacgcgcga ggcagctgcg gtaaagctca tcagcgtggt 3660
cgtgaagcga ttcacagatg tctgcctgtt catccgcgtc cagctcgttg agtttctcca 3720
gaagcgttaa tgtctggctt ctgataaagc gggccatgtt aagggcggtt ttttcctgtt 3780
tggtcactga tgcctccgtg taagggggat ttctgttcat gggggtaatg ataccgatga 3840
aacgagagag gatgctcacg atacgggtta ctgatgatga acatgcccgg ttactggaac 3900
gttgtgaggg taaacaactg gcggtatgga tgcggcggga ccagagaaaa atcactcagg 3960
gtcaatgcca gcgcttcgtt aatacagatg taggtgttcc acagggtagc cagcagcatc 4020
ctgcgatgca gatccggaac ataatggtgc agggcgctga cttccgcgtt tccagacttt 4080
acgaaacacg gaaaccgaag accattcatg ttgttgctca ggtcgcagac gttttgcagc 4140
agcagtcgct tcacgttcgc tcgcgtatcg gtgattcatt ctgctaacca gtaaggcaac 4200
cccgccagcc tagccgggtc ctcaacgaca ggagcacgat catgcgcacc cgtggggccg 4260
ccatgccggc gataatggcc tgcttctcgc cgaaacgttt ggtggcggga ccagtgacga 4320
aggcttgagc gagggcgtgc aagattccga ataccgcaag cgacaggccg atcatcgtcg 4380
cgctccagcg aaagcggtcc tcgccgaaaa tgacccagag cgctgccggc acctgtccta 4440
cgagttgcat gataaagaag acagtcataa gtgcggcgac gatagtcatg ccccgcgccc 4500
accggaagga gctgactggg ttgaaggctc tcaagggcat cggtcgagat cccggtgcct 4560
aatgagtgag ctaacttaca ttaattgcgt tgcgctcact gcccgctttc cagtcgggaa 4620
acctgtcgtg ccagctgcat taatgaatcg gccaacgcgc ggggagaggc ggtttgcgta 4680
ttgggcgcca gggtggtttt tcttttcacc agtgagacgg gcaacagctg attgcccttc 4740
accgcctggc cctgagagag ttgcagcaag cggtccacgc tggtttgccc cagcaggcga 4800
aaatcctgtt tgatggtggt taacggcggg atataacatg agctgtcttc ggtatcgtcg 4860
tatcccacta ccgagatatc cgcaccaacg cgcagcccgg actcggtaat ggcgcgcatt 4920
gcgcccagcg ccatctgatc gttggcaacc agcatcgcag tgggaacgat gccctcattc 4980
agcatttgca tggtttgttg aaaaccggac atggcactcc agtcgccttc ccgttccgct 5040
atcggctgaa tttgattgcg agtgagatat ttatgccagc cagccagacg cagacgcgcc 5100
gagacagaac ttaatgggcc cgctaacagc gcgatttgct ggtgacccaa tgcgaccaga 5160
tgctccacgc ccagtcgcgt accgtcttca tgggagaaaa taatactgtt gatgggtgtc 5220
tggtcagaga catcaagaaa taacgccgga acattagtgc aggcagcttc cacagcaatg 5280
gcatcctggt catccagcgg atagttaatg atcagcccac tgacgcgttg cgcgagaaga 5340
ttgtgcaccg ccgctttaca ggcttcgacg ccgcttcgtt ctaccatcga caccaccacg 5400
ctggcaccca gttgatcggc gcgagattta atcgccgcga caatttgcga cggcgcgtgc 5460
agggccagac tggaggtggc aacgccaatc agcaacgact gtttgcccgc cagttgttgt 5520
gccacgcggt tgggaatgta attcagctcc gccatcgccg cttccacttt ttcccgcgtt 5580
ttcgcagaaa cgtggctggc ctggttcacc acgcgggaaa cggtctgata agagacaccg 5640
gcatactctg cgacatcgta taacgttact ggtttcacat tcaccaccct gaattgactc 5700
tcttccgggc gctatcatgc cataccgcga aaggttttgc gccattcgat ggtgtccggg 5760
atctcgacgc tctcccttat gcgactcctg cattaggaag cagcccagta gtaggttgag 5820
gccgttgagc accgccgccg caaggaatgg tgcatgcaag gagatggcgc ccaacagtcc 5880
cccggccacg gggcctgcca ccatacccac gccgaaacaa gcgctcatga gcccgaagtg 5940
gcgagcccga tcttccccat cggtgatgtc ggcgatatag gcgccagcaa ccgcacctgt 6000
ggcgccggtg atgccggcca cgatgcgtcc ggc 6033
1. Плазмидный вектор pET-pPsLTP, несущий нуклеотидную последовательность SEQ ID No. 2 для экспрессии в клетках Escherichia coli пищевого аллергена гороха посевного Pis s 3, имеющего аминокислотную последовательность SEQ ID NO: 1, в составе гибридного белка His8-TrxL-Pis s 3, и состоящий из двух фрагментов ДНК:
- BglII/XhoI-фрагмента, содержащего промотор транскрипции Т7 РНК-полимеразы, lac-оператор, участок связывания рибосомы и участок, кодирующий аффинную метку, белок тиоредоксин и аллерген Pis s 3;
- BglII/XhoI-фрагмента плазмиды pET31b(+), содержащего терминатор транскрипции Т7 РНК-полимеразы, сайт инициации репликации, ген β-лактамазы и ген lac-репрессора (lacI).
2. Штамм бактерии Escherichia coli BL21(DE3)Star/pET-pPsLTP - продуцент гибридного белка His8-TrxL-Pis s 3, получаемый путем трансформации клеток родительского штамма BL21(DE3)Star плазмидным вектором pET-pPsLTP по п.1.
3. Способ получения пищевого аллергена Pis s 3, включающий экспрессию гена гибридного белка His8-TrxL-Pis s 3 в штамме-продуценте Escherichia coli BL21(DE3)Star/pET-pPsLTP по п.2, лизис клеток, аффинную очистку гибридного белка His8-TrxL-Pis s 3 на металлохелатном носителе, расщепление гибридного белка His8-TrxL-Pis s 3 бромцианом по остатку метионина, введенному между последовательностями аллергена Pis s 3 и тиоредоксина А, повторную металлохелатную очистку и очистку целевого пептида с помощью обращенно-фазовой ВЭЖХ.