Лентивирусные векторы, псевдотипированные мутантными baev гликопротеинами
Иллюстрации
Показать всеНастоящая группа изобретений относится к биотехнологии. Предложены псевдотипированная вирусная векторная частица для переноса биологического материала в гемопоэтические клетки, способ ее получения и ее применение, медикамент для лечения гемопоэтических нарушений или аутоиммунных заболеваний, содержащий указанную частицу, способ трансдукции гемопоэтический клетки и стабильная пакующая вирус клеточная линия. Предложенная псевдотипированная вирусная векторная частица является лентивирусной и содержит химерный оболочечный гликопротеин или модифицированный оболочечный гликопротеин эндогенного ретровируса бабуинов (BaEV). При этом химерный оболочечный гликопротеин содержит трансмембранный и внеклеточный домен оболочечного гликопротеина BaEV и цитоплазматический хвостовой домен оболочечного гликопротеина вируса лейкемии мышей (MLV). Модифицированный оболочечный гликопротеин BaEV лишен ингибирующего слияние R пептида в цитоплазматическом хвостовом домене. Предложенная векторная частица эффективно трансдуцирует гемопоэтические клетки и может быть использована в генной терапии. 6 н. и 7 з.п. ф-лы, 27 ил., 2 табл., 1 пр.
Реферат
Настоящее изобретение относится к псевдотипированным лентивирусным векторам, обеспечивающим эффективный перенос генов в гемопоэтических клетках.
Генная терапия подает большие надежды в лечении многих наследственных и приобретенных заболеваний, о чем свидетельствует успех лечения Х-сцепленного тяжелого комбинированного иммунодефицита (ТКИД-Х1), дефицита аденозиндезаминазы (АДА) и хронической гранулематозной болезни. Недавно сообщалось об успешном лечении пациентов, страдающих Х-сцепленной адренолейкодистрофией (АЛД), с применением лентивирусных векторов. В этом испытании генная терапия на основе гемопоэтических стволовых клеток (ГСК) позволяла остановить прогрессирование заболевания у двух пациентов, страдающих этим смертельным демиелинизирующим заболеванием центральной нервной системы. Важно, что для коррекции всех этих дефектов гемопоэтической системы терапевтический ген нужно доставить в клетки, способные как к самообновлению, так и к дифференцировке во все гемопоэтические линии. Поскольку ГСК соответствуют этим критериям, они являются привлекательными кандидатами для генной терапии.
Однако основным препятствием трансдукции лентивирусным вектором ГСК является то, что 75% ГСК находятся в Go фазе клеточного цикла, и не позволяют проводить классическую трансдукцию лентивирусным вектором. Это ограничение препятствует применению обычных лентивирусных векторов для генной терапии ГСК, поскольку не позволяет осуществлять эффективный перенос гена в субпопуляцию покоящихся (Go) ГКС (Sutton et al. (1999) J. Virol. 73:3649-3660). Для преодоления этого ограничения во многих исследованиях с применением лентивирусных векторов для трансдукции hCD34+ клеток применяли введение высоких доз вектора и присутствие очень мощных цитокиновых коктейлей (ТПО, ФСК, Flk-3, IL-6, IL-3) для индукции входа ГСК в клеточный цикл. Очень часто используют ретронектин, фрагмент фибронектина, для солокализации векторных частиц и клеток-мишеней, или множественные применения векторов для достижения высокого уровня переноса генов в ГСК. Однако нежелательным эффектом длительной стимуляции цитокинами является снижение полипотенциальности и длительное приживление человеческих ГСК. Кроме того, слишком высокая доза вектора повышает риск многокопийной интеграции, и в частности, инсерционного мутагенеза.
Таким образом, имеется потребность в вирусных векторах, обеспечивающих трансдукцию покоящихся ГСК с уменьшенным риском многокопийной интеграции.
Эффективный перенос гена в покоящиеся Т и В лимфоциты с целью генной терапии или иммунотерапии позволяет обеспечить лечение некоторых генетических дисфункций гемопоэтической системы, таких как иммунодефицита, и разработку новых терапевтических стратегий для рака и приобретенных заболеваний. Лентивирусные векторы (LV) не способны к трансдукции некоторых покоящихся типов клеток, таких как покоящиеся Т- и В-клетки (Bovia et al. (2003) Blood 101: 1727-1733; Verhoeyen et al. (2003) Blood 101: 2167-2174). В Т-клетках завершение обратной транскрипции, импорта в ядро и последующей интеграции в геном лентивирусных векторов, псевдотипированных гликопротеином оболочки из вируса везикулярного стоматита (VSV-G), не осуществляется эффективно, пока они не активируются через Т-клеточный рецептор или при воздействии цитокинов, определяющих выживаемость, индуцирующих их переход в Gib фазу клеточного цикла. Лентивирусная трансдукция В-клеток является другой проблемой, поскольку даже индуцированная стимуляцией В-клеточного рецептора (BCR) пролиферация не является достаточной для обеспечения эффективной трансдукции VSV-G псевдотипированными лентивирусными векторами (VSV-G-LV).
Таким образом, имеется потребность в вирусных векторах, обеспечивающих трансдукцию покоящихся Т- и В-клеток.
Для доставки генов с помощью лентивирусного вектора в гемопоэтические клетки нужно, чтобы на их поверхности был представлен оболочечный белок «входа», обеспечивающий эффективное слияние вектора и клетки. Процесс встраивания гетерологичного оболочечного гликопротеина в оболочку лентивирусного вектора называется «псевдотипированием». В течение долгого времени использовали VSV-G, ассоциированный с вирусными оболочками, полученными из ВИЧ-1. Тем не менее, имеются недостатки при использовании VSV-G-LV. С долговременной экспрессией VSV-G связана токсичность, что затрудняет генерацию стабильных клеточных линий. В дополнение, VSV-G-LV являются чувствительными к человеческому комплементу, что делает их непригодными для использования in vivo. Только высокие дозы VSV-G-LV (множественность заражения = MOI 50-100) обеспечивают эффективную трансдукцию hCD34+ клеток, повышая риск многокопийной интеграции, и таким образом, генотоксичности (Di Nunzio et al. (2007) Hum. Gene Ther. 18: 811-820). У людей может также развиваться сильный иммунный ответ против VSV-G, что может снижать эффективность второго применения VSV-G-LV. Все эти свидетельства ограничивают применение VSV-G-LV ех vivo и in vivo. Химерный оболочечный гликопротеин, содержащий внеклеточные и трансмембранные домены оболочечного гликопротеина вируса лейкемии кошек RD114, гибридизованный с цитоплазматическим хвостом (обозначенным TR) оболочечного гликопротеина вируса лейкемии мышей A (MLV-A), далее обозначенный в настоящей заявке как RD114/TR и описанный в международной заявке WO 03/091442, как кажется, является достаточно хорошей альтернативной оболочкой. Действительно, этот псевдотип не является чувствительным к человеческой системе комплемента, что делает его привлекательным для применения in vivo. RD114/TR-LV обеспечивает эффективную трансдукцию CD34+ клеток человека и макаки. Однако уровни трансдукции остаются ниже уровней для VSV-G-LV, и титры RD114 гораздо ниже, чем для VSV-G-LV. Кроме того, RD114/TR гликопротеин не может эффективно проникать в мышиные клетки. Таким образом, эта рецепторная специфичность ограничивает возможности работы с этим LV, поскольку большая часть моделей доклинических испытаний, пригодных для генной терапии, является мышиными моделями.
Настоящее изобретение основано на неожиданном открытии авторов изобретения, что лентивирусные векторы, псевдотипированные с химерным оболочечным гликопротеином, который включает или состоит из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуинов (BaEV) и оболочечного гликопротеина цитоплазматического хвостового домена вируса лейкемии мышей (MLV); или модифицированным оболочечным гликопротеином BaEV, где цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида;
проявляют свойства трансдукции, особо пригодные для переноса гена в гемопоэтические клетки, включая ГСК и покоящиеся Т- и В-клетки. Действительно, эти новые LV могут трансдуцировать очень эффективно и стабильно hCD34+ клетки вплоть до 70% при низких дозах вектора и при умеренной стимуляции цитокинами. BaEV-LV явно превосходит VSV-G и RD114/TR-LV для трансдукции CD34+ клеток макаки и человека. Кроме того, авторы изобретения показали, что BaEV-LV трансдуцирует очень ранние hCD34+ клетки-предшественники, включая ГСК, когда эти клетки способны к восстановлению на модели иммунодефицита мышей, и высокий уровень трансдуцированных клеток крови был найден в некоторых гемопоэтических тканях, и в этих тканях в других линиях клеток крови. Важно, что BaEV-LV способны к трансдукции предварительно стимулированных IL-7 клеток памяти и интактных Т-клеток в высоких уровнях. Далее, в отличие от VSV-G-LV и RD114/TR-LV, эти BaEV-LV также обеспечивают высокий уровень трансдукции покоящихся и BCR-стимулированных В-клеток без индукции смены фенотипа.
Таким образом, настоящее изобретение относится к псевдотипированной вирусной векторной частице для переноса биологического материала в клетки, где указанная векторная частица содержит по меньшей мере:
- химерный оболочечный протеин, содержащий или состоящий из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуина (BaEV) и цитоплазматического хвостового домена оболочечного гликопротеина вируса лейкемии мышей (MLV); или
- модифицированный оболочечный гликопротеин BaEV, где цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида.
Настоящее изобретение также относится к псевдотипированной вирусной векторной частице в соответствии с настоящим изобретением для применения в лечении гемопоэтических нарушений.
Другим объектом настоящего изобретения является медикамент, содержащий псевдотипированную вирусную векторную частицу в соответствии с настоящим изобретением в качестве активного ингредиента.
Настоящее изобретение также относится к применению псевдотипированной вирусной векторной частицы в соответствии с настоящим изобретением для переноса биологического материала в гемопоэтические клетки ex vivo.
Другим объектом настоящего изобретения является способ трансдукции гемопоэтической клетки, включающий обеспечение контакта гемопоэтической клетки с псевдотипированной вирусной векторной частицей в соответствии с настоящим изобретением в условиях, обеспечивающих трансдукцию гемопоэтической клетки псевдотипированной вирусной векторной частицей.
Настоящее изобретение также относится к пакующей стабильный вирус клеточной линии, продуцирующей псевдотипированную вирусную векторную частицу, как описано выше.
Подробное описание изобретения
Псевдотипированная вирусная векторная частица
Настоящее изобретение относится к псевдотипированной вирусной векторной частице для переноса биологического материала в клетки, где указанная векторная частица содержит по меньшей мере:
- химерный оболочечный гликопротеин, содержащий или состоящий из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуина (BaEV) и цитоплазматического хвостового домена оболочечного гликопротеина вируса лейкемии мышей (MLV); или
- модифицированный оболочечный гликопротеин BaEV, где цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида.
Как подразумевается в настоящей заявке, термин «векторная частица» означает любую частицу, ответственную за презентирование химерного оболочечного гликопротеина или модифицированного BaEV оболочечного гликопротеина на своей поверхности, и за обратимое связывание с биологическим материалом. Такая векторная частица предпочтительно является вирусной векторной частицей, в частности ретровирусной векторной частицей. Предпочтительно, указанная ретровирусная векторная частица выбрана из группы, состоящей из онковирусной вирусной частицы, включая вирусные частицы вируса лейкемии мышей (MLV), вируса лейкоза птиц (ALV), респираторного синцитиального вируса (RSV) или вируса обезьян Мейзена-Пфейзера (MPMV); лентивирусной векторной частицы, такой как векторные частицы вируса иммунодефицита человека (ВИЧ), например, ВИЧ-1 или ВИЧ-2, вируса иммунодефицита обезьян (SIV), вируса иммунодефицита кошек (FIV), вируса инфекционной анемии лошадей (EIAV) и вируса артроэнцефалита коз (CAEV), и спумавирусной векторной частицы, такой как вирусная частица пенящего вируса человека (HFV).
Лентивирусные векторные частицы хорошо известны специалистам в данной области техники и подробно описаны в Naldini et al. (2000) Adv. Virus. Res. 55:599-609 и Negre et al. (2002) Biochimie 84:1161-1171. Обычно лентивирусные векторные частицы в соответствии с настоящим изобретением содержат по меньшей мере следующие компоненты: (i) оболочечный компонент, состоящий из фосфолипидного двойного слоя, связанного с оболочечными белками, где оболочечные белки содержат по меньшей мере вышеуказанные химерные или модифицированные гликопротеины, указанная оболочка окружает (ii) коровый компонент, состоящий из ассоциации gag белка, где указанный капсид сам окружает (iii) геномные компоненты, обычно состоящие из рибонуклеиновых кислот (РНК), и (iv) ферментативного компонента (pol). Биологический материал может присутствовать в оболочке, в капсиде и/или в геномных компонентах.
Лентивирусные векторные частицы могут быть легко приготовлены специалистом в данной области техники, например, в соответствии с указаниями Sandrin et al. (2002) Blood 100:823-832. Вкратце, лентивирусные векторные частицы можно создать путем совместной экспрессии упаковочных элементов (т.е. коровый и ферментативного компонентов), геномного компонента и оболочечного компонента в так называемых клетках-продуцентах, например, клетках эмбриональной почки человека 293Т. Как правило, можно применять от трех до четырех плазмид, но их число может быть выше, в зависимости от степени, до которой лентивирусные компоненты разрушаются на отдельные единицы.
Как применяется в настоящей заявке, термин «псевдотипированный вирусный
вектор» относится к вирусному вектору, содержащему чужеродные вирусные оболочечные гликопротеины. Как правило, вирусные векторы в соответствии с настоящим изобретением являются псевдотипированными с вышеуказанными химерными или модифицированными гликопротеинами.
Эндогенный ретровирус бабуинов или BaEV является ретровирусом С типа, присутствующим во множественных провирусных копиях в ДНК бабуинов. Оболочечный гликопротеин BaEV подробно описан в Benveniste et al. (1974) Nature 248: 17-20 и Todaro et al. (1974) Cell 2: 55-61.
В контексте настоящего изобретения термин «оболочечный гликопротеин BaEV» относится к форме оболочечного гликопротеина BaEV дикого типа или к мутанту указанного оболочечного гликопротеина BaEV дикого типа, который по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 99% идентичен указанному оболочечному гликопротеину BaEV дикого типа, где указанный мутантный гликопротеин сохраняет способность гликопротеина дикого типа к связыванию и слиянию с мембраной гемопоэтической клетки.
Как правило, оболочечный гликопротеин BaEV дикого типа кодирован нуклеиновокислотной последовательностью SEQ ID №:1. Предпочтительно, она состоит из последовательности SEQ ID №:2. Как известно специалисту в данной области техники, оболочечный гликопротеин BaEV построен из цитоплазматического хвостового домена, трансмембранного домена и внеклеточного домена. Области, соответствующие цитоплазматическому хвостовому домену, трансмембранному домену и внеклеточному домену в последовательности оболочечного гликопротеина, могут быть легко определены специалистом в данной области техники. Как правило, цитоплазматический хвостовой домен расположен между аминокислотами 530-564 оболочечного гликопротеина BaEV дикого типа. Предпочтительно, цитоплазматический хвостовой домен дикого типа из оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №:3. Как правило, трансмембранный домен расположен между аминокислотами 507 и 529 оболочечного гликопротеина дикого типа. Предпочтительно, трансмембранный домен дикого типа из оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №4. Как правило, внеклеточный домен расположен между аминокислотами 1-506 оболочечного гликопротеина BaEV дикого типа. Предпочтительно, внеклеточный домен дикого типа из оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №: 5.
В частном варианте осуществления настоящего изобретения цитоплазматический хвостовой домен оболочечного гликопротеина BaEV лишен ингибирующего слияние R пептида.
В контексте настоящего изобретения выражение «ингибирующий слияние R пептид» означает С-концевую часть цитоплазматического хвостового домена оболочечного гликопротеина, которая несет тирозиновый сигнал эндоцитоза YXXL, и которая отщепляется вирусной протеазой во время созревания вириона, таким образом, усиливая слияние с мембраной оболочечного гликопротеина. Ингибирующий слияние R пептид оболочечного гликопротеина BaEV, как правило, расположен между аминокислотами 547 и 564 оболочечного гликопротеина BaEV дикого типа. Предпочтительно, ингибирующий слияние R пептид оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №: 6.
Таким образом, в особо предпочтительном варианте осуществления модифицированный оболочечный гликопротеин BaEV, в котором цитоплазматический хвостовой домен не содержит ингибирующего слияние R пептида, содержит или состоит из аминокислотной последовательности SEQ ID №: 7. Такой модифицированный оболочечный гликопротеин BaEV далее обозначается как «BaEVRLess».
В другом частном варианте осуществления цитоплазматический хвостовой домен оболочечного гликопротеина BaEV заменен цитоплазматическим хвостовым доменом оболочечного гликопротеина вируса лейкемии мышей (MLV).
Оболочечный гликопротеин вируса лейкемии мышей подробно описан в Ott et al. (1990) J. Virol. 64:151-166. Оболочечный гликопротеин вируса лейкемии мышей предпочтительно относится к штамму 4070А.
В контексте настоящего изобретения термин «оболочечный гликопротеин MLV» относится к форме оболочечного гликопротеина MLV дикого типа или к мутанту указанного оболочечного гликопротеина MLV дикого типа, который по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 99% идентичен указанному оболочечному гликопротеину MLV дикого типа, где указанный мутантный гликопротеин сохраняет способность гликопротеина дикого типа к взаимодействию с вирусными коровыми белками, в частности, с лентивирусными коровыми белками.
Область, соответствующая цитоплазматическому хвостовому домену в последовательности оболочечного гликопротеина, может быть легко определена специалистами в данной области техники. Как правило, цитоплазматический хвостовой домен оболочечного гликопротеина MLV расположен между аминокислотами 622 и 654 оболочечного гликопротеина MLV дикого типа. Предпочтительно, цитоплазматический хвостовой домен дикого типа из оболочечного гликопротеина MLV содержит или состоит из аминокислотной последовательности SEQ ID №:8.
Таким образом, в особо предпочтительном варианте осуществления химерный оболочечный гликопротеин, который содержит или состоит из гибрида трансмембранного или внеклеточного домена оболочечного гликопротеина BaEV и цитоплазматического хвостового домена оболочечного гликопротеина MLV, содержит или состоит из аминокислотной последовательности SEQ ID №:9. Такой химерный оболочечный гликопротеин далее обозначается как «BaEV/TR».
Авторы настоящего изобретения продемонстрировали, что BaEV/TR и BaEVRLess гликопротеины были встроены с более высоким уровнем на поверхность лентивируса, чем гликопротеин BaEV дикого типа.
Кроме того, авторы настоящего изобретения продемонстрировали, что совместная презентация специфических цитокинов на вирусных векторных частицах обеспечивает усиление направленной трансдукции интересующих клеток.
Таким образом, в частном варианте осуществления вирусная векторная частица в соответствии с настоящим изобретением может дополнительно презентировать, предпочтительно на своей поверхности, по меньшей мере один цитокин, выбранный из группы, состоящей из фактора стволовых клеток (ФСК), тромбопоэтина (ТПО), IL-2, IL-15 и IL-7.
Предпочтительно, указанный по меньшей мере один цитокин выбран из группы, состоящей из человеческого ФСК, человеческого ТПО, человеческого IL-2, человеческого IL-15 и человеческого IL-7.
В контексте настоящего изобретения цитокин может быть цитокином дикого типа или любым мутантом указанного цитокина дикого типа, который по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 99% идентичен указанному цитокину дикого типа, с тем условием, что указанный мутантный цитокин обладает по существу теми же самыми свойствами, что и цитокин дикого типа, из которого он получен.
Цитокин ФСК дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №:10. ТПО дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №:11. IL-2 дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №: 12. IL-7 дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №: 13. IL-15 дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №: 14.
Процентную идентичность можно рассчитать путем выполнения парного глобального выравнивания на основе алгоритма выравнивания Нидлмана-Вунша для поиска оптимального выравнивания (включая разрывы) двух последовательностей по всей длине, например, с применением Needle, или с помощью BLOSUM62 матрицы со штрафом на внесение разрыва в выравнивание 10 и штрафом на продолжение разрыва 0,5.
В особо предпочтительном варианте осуществления псевдотипированную вирусную векторную частицу в соответствии с настоящим изобретением можно получить или получают посредством способа получения, описанного в разделе «Способ получения псевдотипированной вирусной векторной частицы» ниже.
Биологический материал
Псевдотипированные вирусные векторные частицы из настоящего изобретения представляют особый интерес для переноса биологических материалов в клетки, в частности, в гемопоэтические клетки.
Соответственно, в предпочтительном варианте осуществления псевдотипированные вирусные векторные частицы, как определено выше, дополнительно содержат биологический материал.
Как подразумевается в настоящей заявке, выражение «биологический материал» относится к одному или нескольким соединениям, способным изменять структуру и/или функцию клетки. В контексте настоящего изобретения биологический материал предпочтительно является одной или несколькими нуклеиновыми кислотами, которые в случае лентивирусных векторных частиц могут быть включены в геном векторной частицы. Геном, как правило, содержит одну или несколько нуклеиновых кислот, предпочтительно, связанных с генетическими элементами, необходимыми для их экспрессии в клетке-мишени, такими как промоторы и терминаторы, с расположенными по бокам цис-действующими элементами, необходимыми для включения генома в коровый элемент, его обратной транскрипции в дезоксирибонуклеиновую кислоту (ДНК), импорта ретротранскрибированного генома в ядро клетки-мишени, и интеграции ретротранскрибированного генома в геном клетки-мишени.
Примеры интересующих нуклеиновых кислот включают глобиновые гены, гемопоэтические факторы роста, которые включают эритропоэтин (ЭПО), интерлейкины (особенно интерлейкин-1, интерлейкин-2, интерлейкин-3, интерлейкин-6, интерлейкин-12, и т.д.), и колониестимулирующие факторы (такие, как гранулоцитарный колониестимулирующий фактор, гранулоцитарно/макрофагальный колониестимулирующий фактор, или колониестимулирующий фактор стволовых клеток), тромбоцит-специфический интегрин aIIbβ, гены множественной лекарственной устойчивости; гены gp91 или gp47, дефектные у пациентов с хронической гранулематозной болезнью (ХГБ); антивирусные гены, придающие клетке устойчивость к инфекции патогенами, такими как вирус иммунодефицита человека; гены, кодирующие факторы гемокоагуляции VIII или IX, которые являются мутантными при гемофилии; лиганды, вовлеченные в Т-клеточно-опосредованный иммунный ответ, такие как Т-клеточные рецепторы антигена, В-клеточные рецепторы антигена (иммуноглобулины), общая γ-цепь рецептора интерлейкина, комбинация Т- и В-клеточных рецепторов антигена по отдельности и/или в комбинации с одноцепочечными антителами (ScFv), IL-2, IL-12, ФНО, интерфероном-гамма, CTLA4, В7 и тому подобными; гены, экспрессируемые в опухолевых клетках, таких как MelanA; гены MAGE (такие, как MAGE-1, MAGE-3), P198, Р1А, gp100, и т.д.
Как подразумевается в настоящей заявке, термин «перенос» относится к исходной способности векторной частицы к доставке биологического материала в мембрану или цитоплазму клетки-мишени при связывании с клеткой-мишенью. После доставки биологический материал может быть перемещен в другую часть клетки.
Как применяется в настоящей заявке, клетки-реципиенты, в которые нужно перенести биологический материал, или клетки-мишени, означают любую клетку, которая может связаться с вышеуказанной векторной частицей. Если векторная частица является лентивирусной векторной частицей, клетка-мишень означает любую клетку, способную к трансдукции с помощью векторной частицы. Эти клетки предпочтительно являются гемопоэтическими клетками человека.
Гемопоэтические клетки
Как применяется в настоящей заявке, термин «гемопоэтическая клетка» означает, как правило, клетки крови, как из миелоидной, так и из лимфоидной линии. В частности, термин «гемопоэтическая клетка» включает как недифференцированные и слабо дифференцированные клетки, такие как гемопоэтические стволовые клетки и клетки-предшественники, так и дифференцированные клетки, такие как Т-лимфоциты, В-лимфоциты или дендритные клетки. Предпочтительно, гемопоэтические клетки выбраны из группы, состоящей из гемопоэтических стволовых клеток, CD34+ клеток-предшественников, в частности, клеток периферической крови CD34+, очень ранних клеток-предшественников CD34+, В-клеток-предшественников CD19+, миелоидных клеток-предшественников CD13+ Т-лимфоцитов, В-лимфоцитов, моноцитов, дендритных клеток; опухолевых В-клеток, в частности, клеток В-клеточной хронической лимфоцитарной лейкемии (BCLL) и В-клеточной лимфомы из клеток маргинальной зоны (MZL), и тимоцитов.
Как известно специалистам в данной области техники, каждая гемопоэтическая клетка происходит из гемопоэтической стволовой клетки костного мозга.
Как применяется в настоящей заявке, термин «гемопоэтическая стволовая клетка» или «ГСК» относится к клетке, способной восполнять все типы клеток крови и самообновляться. Гемопоэтические стволовые клетки могут быть, в частности, определены как клетки, поддерживающие уровни миелоидных, Т- и В-клеток на четко выявляемых уровнях (обычно более 1% от периферических клеток крови) в течение 16 недель при введении в циркуляцию мыши-реципиента с истощенной гемопоэтической системой (Schroeder (2010) Cell Stem Cell 6: 203-207).
Как применяется в настоящей заявке, термин «CD34+ клетка-предшественник» относится к гетерогенной популяции, включающей субпопуляцию ГСК, плюрипотентных стволовых клеток и клеток на ранних стадиях детерминации дифференцировки. Клетки-предшественники CD34+ постоянно мигрируют в/из костного мозга здоровых взрослых животных. Они могут дифференцироваться до получения всех линий гемопоэтических клеток, находящихся в циркуляции. Выражение «CD34+ клетки периферической крови» в частности, относится к CD34+ клеткам, присутствующим в крови.
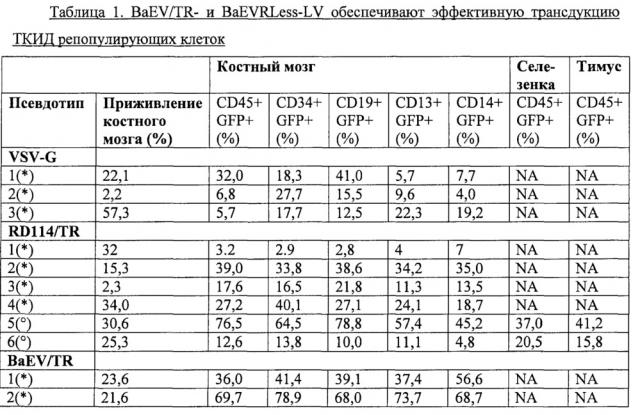
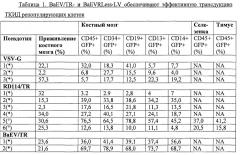
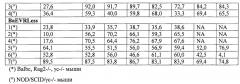
Авторы настоящего изобретения предварительно стимулировали CD34+ ранние человеческие клетки-предшественники сильным цитокиновым коктейлем (ФСК, ТПО и Flt3-L), и трансдуцировали их псевдотипированными лентивирусными векторными частицами BaEV/TR и BaEVRLess. Они показали, что псевдотипированные лентивирусные векторные частицы могут эффективно трансдуцировать человеческие CD34+ ранние клетки-предшественники, в частности, более чем на 70% в присутствии ретронектина.
Далее, авторы настоящего изобретения показали, что высокая трансдукция человеческих CD34+ клеток, полученная с псевдотипированными лентивирусными векторными частицами BaEV/TR и BaEVRLess, была обусловлена стабильной трансдукцией транзиторных предшественников. Действительно, не отмечено существенного различия между пропорцией трансдуцированных BaEV/TR и BaEVRLess лентивирусными векторными частицами CD34+ клеток после предварительной стимуляции ФСК/ТПО и клоногенных предшественников, полученных из них. Напротив, для лентивирусных векторных частиц, псевдотипированных VSV-G, пропорция трансдуцированных клоногенных предшественников была существенно ниже, чем уровень трансдуцированных CD34+ клеток, из которых они были получены.
Как применяется в настоящей заявке, термин «очень ранняя CD34+ клетка-предшественник» означает подгруппу CD34+ клеток-предшественников, обогащенных в ГСК.
Как применяется в настоящей заявке, термин «CD19+ В-клетка-предшественник» означает популяцию В-клеток, экспрессирующих на поверхности CD10, CD34 и CD19.
Как применяется в настоящей заявке, термин «миелоидная CD13+ клетка-предшественник» означает популяцию миелоидных клеток, экспрессирующих на поверхности CD34 и CD13, и факультативно CD33.
Авторы изобретения показали, что BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы способны к трансдукции с высокой эффективностью гемопоэтических предшественников, способных к репопуляции иммунодефицитной мыши. Они оценили способность к долговременному восстановлению трансдуцированных этими псевдотипированными лентивирусными векторными частицами человеческих CD34+ клеток на модели иммунодефицитных мышей Rag2-/- γ-/- Balbc и мышиной модели NOD/SCID/γc-/- (NSG). Они показали, что очень ранние CD34+ клетки-предшественники, а также CD19+ В-клетки-предшественники и миелоидные CD13+ клетки были трансдупированы до той же самой степени посредством псевдотипированных лентивирусных векторных частиц BaEV/TR и BaEVRLess из настоящего изобретения при низких инфицирующих дозах векторной частицы. Далее, BaEV/TR-LV и BaEVRLess-LV трансдуцировали hCD34+ клетки, приводя к высоким уровням восстановления в костном мозге и к наивысшим уровням трансдукции ТКИД репопулирующих клеток (до 90% CD45+GFP+клеток) в костном мозге. Они также показали, что эти высокие уровни трансдукции поддерживались у мыши - первичного реципиента во всех гемопоэтических тканях (костном мозге, тимусе и селезенке). Эквивалентный высокий уровень трансдукции был выявлен для незрелых предшественников (hCD34+ клеток), лимфоидных клеток (CD19+) и миелоидных клеток (CD13+ и CD14+) в костном мозге. Напротив, лентивирусные векторные частицы, псевдотипированные VSV-G, трансдуцируют ранние CD34+ предшественники, CD13+ миелоидные предшественники и моноциты до гораздо более низких уровней. Для лентивирусных векторных частиц, псевдотипированных RD114/TR, также был выявлена низкая трансдукция всех различных костномозговых клеточных линий. Аналогичная картина наблюдалась для Т- и В-клеток и моноцитов в селезенке. RD114/TR-LV продемонстрировали вариабельные уровни трансдукции ТКИД репопулирующих клеток (в диапазоне от 3,2-76% от GFP+CD45+ клеток).
Авторы изобретения также показали, что в селезенке и костном мозге процент GFP+hCD45+ клеток поддерживался или повышался после вторичной трансплантации hCD34+ клеток, выделенных из первичных реципиентов у иммунодефицитной мыши. Далее, и для BaEV/TR-, и для BaEVRLess-LV были обнаружены высокие уровни GFP+hCD34+ ранних предшественников, лимфоидных (CD19+) и миелоидных (CD13+) клеток в костном мозге этих мышей - вторичных реципиентов, и эквивалентный процент GFP+ клеток был выявлен в этих разных линиях. Таким образом, авторы настоящего изобретения показали, что вторичные восстановленные ТКИД репопулирующие клетки способны к смешанной дифференцировке, и что действительное человеческие ГСК были генетически модифицированы до высоких уровней BaEV/TR- и BaEVRLess-LV.
Авторы настоящего изобретения показали, что BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы обеспечивают эффективную трансдукцию человеческих Т-клеток, в частности предварительно стимулированных IL-7 человеческих Т-клеток. Эти псевдотипированные лентивирусные векторные частицы превосходили лентивирусные векторные частицы, псевдотипированные VSV-G в тех же самых дозах вектора в присутствии ретронектина. Важно, что BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы обеспечивают эффективную трансдукцию как интактных, так и предварительно стимулированных IL-7 Т-клеток памяти. Действительно, они обеспечивают трансдукцию IL-стимулированных Т-клеток без нарушения их интактного фенотипа. Особо интересно, что они также обеспечивают близкий к 100% перенос гена Т-клеток при стимуляции Т-клеточного рецептора (TCR) при MOI 10.
Таким образом, в частном варианте осуществления гемопоэтической клеткой-предшественником является Т-клетка, предпочтительно интактная или Т-клетка памяти.
BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы также обеспечивают высоко эффективную трансдукцию 20-30% покоящихся В-клеток, и таким образом, явно превосходят лентивирусные векторные частицы, псевдотипированные с VSV-G или RD114/TR, не обеспечивающие трансдукцию или обеспечивающие очень низкую трансдукцию покоящихся В-клеток человека. Далее, при стимуляции В-клеточного рецептора (BCR), BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы трансдуцируют до 70% В-клеток, в то время как трансдукция лентивирусными векторными частицами, псевдотипированными с VSV-G, действительно не превышает 5%. Важно, что как клетки памяти, так и интактные В-клетки были эффективно трансдуцированы BaEV/TR и BaEVRLess псевдотипированными лентивирусными векторными частицами.
Таким образом, в частном варианте осуществления целевые гемопоэтические клетки являются В-клетками, в частности, покоящимися В-клетками, предпочтительно, интактными клетками или В-клетками памяти. Они могут быть также опухолевой В-клеткой, в частности, В-клеткой хронической лимфоцитарной лейкемии (BCLL) или В-клеточной лимфомы из клеток маргинальной зоны (MZL).
Благодаря потенциальному значению переноса тимоцитарных генов для иммуномодуляции, авторы настоящего изобретения оценили активность BaEVgp-LV по сравнению с другими LV псевдотипами для трансдукции различных субпопуляций тимоцитов. При выделении тимоцитов из тимуса человека, их трансдуцировали в присутствии определяющего выживание цитокина IL-7 с VSV-G-, RD114/TR-, BaEV/TR-, и BaEVRLess-LV, кодирующими GFP репортер при MOI 10. Авторы настоящего изобретения показали, что RD114/TR-LV, BaEV/TR-LV и BaEVRLess-LV обеспечивают предпочтительную трансдукцию тимоцитов на ранних стадиях развития (двойных негативных и незрелых CD4 одинарных позитивных клеток), в то время как они обеспечивают трансдукцию более зрелых до более низких уровней. Как уже было установлено для зрелых человеческих Т-клеток, BaEVgp LV трансдуцируют все различные субпопуляции тимоцитов более эффективно, чем RD114/TR-LV. Далее, трансдукция различными псевдотипами лентивирусных векторов не оказывает влияние на распределение различных субпопуляций тимоцитов. Таким образом, авторы настоящего изобретения продемонстрировали, что BaEVgp-LV являются отличным инструментом для трансдукции тимоцитов, и что они особенно превосходят VSV-G- и RD114/TR-LV для трансдукции субпопуляций незрелых двойных негативных (DN) и незрелых CD4 одинарных позитивных (ISP) тимоцитов.
Таким образом, в частном варианте осуществления гемопоэтическая клетка-мишень является тимоцитом.
Наконец, авторы настоящего изобретения предварительно стимулировали свежевыделенные общие Т-клетки пуповинной крови с цитокином выживания Т-клеток IL-7 для сохранения интактного фенотипа Т-клеток, а затем трансдуцировали их различными векторами: VSV-G-, RD114/TR-, BaEV/TR-, и BaEVRLess-LV, кодирующими GFP репортер, при MOI 10 или 20, или при MOI 50 для VSV-G-LV. Они показали, что BaEV/TR- и BaEVRLess-LV обеспечивают эффективность трансдукции, значительно более высокую (40-50% трансдукции) при MOI=10, по сравнению с VSV-G или RD114/TR-LV. Важно, что BaEV/TR- и BaEVRLess-LV легко достигали 65% трансдукции, когда доза вектора повышалась в два раза (MOI=20). Во всех случаях интактные недавние тимоцитарные эмигранты (CD69L+CD45RA+CD31+) были трансдуцированы до той же степени, что и более зрелые интактные ПК Т-клетки (CD69L+CD45RA+CD31-), Далее, трансдукция не оказывала влияния на распределение этих двух интактных ПК Т-клеточных популяций.
Таким образом, в частном варианте осуществления гемопоэтические клетки-мишени являются интактными клетками. Как применяется в настоящей заявке, термин «интактные клетки» относится к клеткам, которые не подвергаются клеточной активации в ответ на стимул. В частности, «интактная клетка» может быть клеткой, которую не подвергали воздействию антигена.
Поскольку сильная стимуляция цитокиновым коктейлем индуцирует дифференцировку ГСК и потерю их способности к самообновлению, очень важно как можно меньше предварительно стимулировать клетки, чтобы как мо