Метод динамического сканирования при мультипараметрической магнитно-резонансной томографии с использованием парамагнитного контрастного агента для определения параметров кровотока в ткани матки при миоме и аденомиозе
Иллюстрации
Показать всеИзобретение относится к медицине, гинекологии, томографическим исследованиям. Проводят динамическое сканирование при мультипараметрической магнитно-резонансной томографии с использованием парамагнитного контрастного агента в качестве метода определения параметров кровотока в ткани матки при миоме матки и аденомиозе. При этом определяют перфузионный кровоток в миометрии, представляя его графическими зависимостями и цветным картированием, для чего МРТ выполняют на томографе с индукцией магнитного поля 3Т. В качестве контрастного препарата используют гадолиниевый парамагнитный контрастный агент. Введение препарата осуществляют с помощью автоматического инжектора со скоростью 4,5 мл/с в локтевую вену одновременно с началом динамического сканирования. Количество вводимого контрастного препарата рассчитывают из соотношения 1 ммоль на кг массы тела пациентки. После введения контрастного препарата отслеживают и оценивают кинетику контрастного препарата в патологической и нормальной ткани. Построение кривых кинетики контрастного препарата с последующим цветовым картированием полученных данных и построением цветных перфузионных карт выполняют по результатам динамического сканирования с использованием импульсной последовательности TWIST, где время получения одной серии изображений 3 с, количество серий - 100, с использованием программного обеспечения MeanCurve рабочей станции SyngoVia. Способ обеспечивает точную оценку тканевой перфузии миометрия, что в дальнейшем позволит определить тактику ведения пациенток. 4 ил., 5 пр., 1 табл.
Реферат
Развитие визуализирующих технологий в диагностике идет по пути от анатомии к исследованию функции. Современные методы магнитно-резонансной томографии позволяют оценить скорость и ориентацию диффузионного движения молекул воды, визуализировать ткани, отличающиеся химической и молекулярной структуре, определить перфузию и оксигенацию ткани и ее метаболическую активность.
Информация может быть представлена как в виде параметрических цветных карт, так и в виде линейных графиков. Динамическая контраст-усиленная MPT (DCE) и бесконтрастная ASL (маркировка артериальных спинов) МРТ позволяют изучать тканевую перфузию. Функциональная МРТ на основе BOLD-контрастности (blood oxygenation level-dependent contrast - контрастность, зависящая от степени насыщения крови кислородом) и кислород-усиленная (ОЕ) МРТ позволяют оценивать оксигенацию ткани. Диффузионно-взвешенная МРТ (DWI) дает информацию о скорости диффузии молекул воды в ткани, мультинаправленная диффузно-взвешенная МРТ (MDDW) позволяет оценить не только скорость, но и направленность диффузионного движения.
Динамическая контраст-усиленная МРТ является одним из методов изучения перфузии, и основана на внутривенной, болюсной, инъекции парамагнитного контрастного агента, для определения тканевой перфузии, которая позволяет количественно оценить движение крови в ткани.
После того, как болюс контрастного вещества вводят внутривенно, оно проходит по капиллярному руслу, а затем проникает из крови в ткань (в межклеточные пространства) в размере, определяемом проницаемостью капилляров, а так же площадью их поверхности.
Динамическая контраст-усиленная МРТ может быть разделена на несколько подвидов в зависимости от временного разрешения и это определяет импульсную последовательность для ее выполнения. Так использование эхопланарной последовательности обеспечивает временное разрешение в пределах одной секунды для получения тканевой перфузии, методика так и называется MP-перфузия. Данная методика получила широкое распространение при исследованиях головного мозга для оценки гемодинамики опухолей головного мозга, при дифференциальной диагностике его поражений, для оценки эффекта от химио- и лучевой терапии, при черепно-мозговых травмах, ишемических повреждениях центральной нервной системы. Однако эхопланарные импульсные последовательности имеют ряд недостатков. Прежде всего, это крайне низкое пространственное разрешение, во-вторых - это существенные артефакты на границе раздела сред (например, воздух-ткань) и в-третьих - низкий тканевой контраст. Вышеперечисленные недостатки затрудняют использование методики в других анатомических зонах.
Использование сверхбыстрых импульсных последовательностей основанных на получении Т1-взвешенных изображений (например, TWIST) позволяет получить временное разрешение 3-5 секунд, что с одной стороны не позволяет достоверно оценить тканевую перфузию, но с другой стороны, пространственное и тканевое разрешение у этих импульсных последовательностей выше, артефакты выражены гораздо слабее, это позволяет использовать данные импульсные последовательности не только для головного мозга, но и для других органов. Клиническое применение этой методики идентично МР-перфузии.
Использование быстрых импульсных последовательностей (например, VIBE, LAVA) обеспечивает временное разрешение от 10 с до 1 мин, при этом изображения имеют хорошее пространственное разрешение, высокий тканевой контраст, практически не имеют артефактов и обеспечивают высокую анатомическую детализацию. МРТ DCE, основанное на данных импульсных последовательностях используется для оценки кинетики контрастного препарата в опухолевых тканях и выявления гиперваскулярных новообразований (например, исследования печени, почек, гипофиза). При выполнении данной методики возможно оценить не только кинетику препарата, но и четко выявить границы и структуру образования. Оценить перфузию при использовании данной методики невозможно из-за низкого временного разрешения.
Публикации о применении данной методики (динамическая контраст-услиленная МРТ) для оценки кровотока в миометрии отсутствуют.
МРТ с использованием импульсной последовательности ASL показывает абсолютные значения перфузии ткани. Эта методика использует маркировку молекул воды движущейся крови в качестве эндогенного индикатора. Таким образом, ASL МРТ неинвазивный метод, позволяющий изучить перфузию ткани, в том числе ее изменение во временном промежутке. ASL предполагает наличие двух изображений, с маркировкой и без. Однако, на сегодняшний день, в связи с рядом физических ограничений методика может быть использована только для оценки перфузии головного мозга.
Физические принципы динамической контраст-усиленной МРТ
Метод динамической контраст-усиленной МРТ основан на изменении Т1-релаксационных характеристик ткани после введения парамагнитного контрастного вещества.
Среди преимуществ МРТ следует отметить возможность получения изображения в любой плоскости и отсутствие «невидимых» зон, высокая разрешающая способность метода и отличный тканевой контраст, которым к тому же можно управлять в зависимости от диагностической задачи, используя различные импульсные последовательности и их параметры. Данные МРТ весьма наглядны и фактически представляют собой набор томограмм «пироговских срезов» в разных плоскостях, похожих на изображения в анатомических атласах. МРТ позволяет точно определить характер патологического образования, его локализацию, взаимосвязь и взаимоотношение с соседними органами, что особенно важно, например, при аномалиях развития внутренних половых органов и часто связанных с этим нарушениях пороков развития мочевыводящей системы.
В основе МРТ лежит явление ядерного магнитного резонанса ядер водорода или протонов, которые наиболее эффективно взаимодействуют с внешним магнитным полем по сравнению с другими ядрами, обладающими магнитным моментом. При проведении исследования пациент помещается в однородное магнитное поле, которое и взаимодействует с магнитным моментом протонов организма человека. В результате магнитные моменты ядер водорода (или их спины) ориентируются по направлению силовых линий поля и начинают вращаться или прецессировать с частотой, прямо пропорциональной напряженности поля и получившей название частоты Лармора. В целом способ подачи градиентных и радиочастотных импульсов называют "импульсной последовательностью". В результате ядра водорода начинают поглощать подаваемую электромагнитную энергию, что и носит название ядерного магнитного резонанса. Получаемый сигнал (спад свободной индукции) обрабатывают с помощью Фурье-преобразования, что и создает на магнитно-резонансной томограмме подробную анатомическую картину "срезов" тканей и органов. Время, требуемое для того, чтобы эти ядра водорода вновь обрели положение равновесия, может быть измерено, и называется временем релаксации.
Существует два процесса релаксации (два периода времени релаксации): Т1 - продольное время релаксации (или спин-решеточная) и Т2 - поперечное время релаксации (или спин-спиновая). Сопоставление полученных Т1 - взвешенных изображений с Т2-взвешенными изображениями дают возможность получать прекрасное зрительное изображение тканей и патологических изменений.
В человеческом организме протоны встречаются в основном в таких веществах, как жир и вода. Таким образом, MP-томограмма в первую очередь отражает распределение и состояние воды в теле человека. Практически все жизненно важные процессы в клетках протекают в водной среде. Эти процессы в тканях имеют большое значение для MP-томографии, так как лежат в основе формирования относительного контраста тканей на МРТ-изображениях, и определяют возможность ранней диагностики многих заболеваний, в частности, онкологических. Объемные эффекты, выраженные как значительные отклонения от нормальной анатомии, появляются, как правило, на более поздней стадии заболевания, когда уже и клинически можно диагностировать данный процесс. На ранней стадии, когда нет нарушений структуры тканей и, следовательно, нет изменений анатомических взаимоотношений, физико-химические условия в клетках могут уже меняться, и вместе с ними изменяется количество и состояние клеточной воды, что и фиксируется при МР-томографии.
Изображение органов малого таза, выполненное методом МРТ, проводится во фронтальной, сагиттальной и аксиальной (поперечной) плоскостях. Изображения представляют собой Т1- и Т2-взвешенные изображении, где толщина одного анатомического сечения равна не более 5 мм. Сагиттальные сечения имеют преимущество для визуализации тела и шейки матки, влагалища, а также прямой кишки. Фронтальная проекция позволяет успешно выявлять вовлечение в опухолевый процесс мочевого пузыря, а также распространение опухоли на стенки таза.
Преимущества МРТ
1. Магнитный резонанс безопасен для пациентов и может широко использоваться как для диагностики, так и для динамического контроля за течением заболевания, ходом лечения.
2. МРТ не имеет ограничения в плоскостях исследования, позволяет получать многоплоскостные изображения с учетом физиологических и патологических изменений. Фактор многоплоскостного получения изображения решает вопросы топической дифференциальной диагностики с детализацией структурных компонентов органа, учитывая лучшую визуализацию в зависимости от проекции исследования.
3. Метод позволяет получать изображения определенной области организма на большом протяжении, что создает благоприятные условия для более точной топической диагностики.
4. МРТ обладает высоким естественном тканевым контрастом, позволяет детализировать и оценивать все мягкотканные компоненты с точной детализацией структурных особенностей, а также отчетливо определить сосудистые структуры без применения контрастных препаратов
5. Метод имеет большой дифференциально-диагностический спектр получения изображений за счет изменения протоколов исследования: импульсной последовательности, проекций исследований.
6. В большинстве случаев МРТ - неинвазивный метод, а те случаи инвазии (внутривенное введение парамагнитных MP-контрастных средств), не влекут за собой осложнений.
7. Метод практически не имеет противопоказаний, за исключением: искусственных водителей ритма сердца, инсулиновых насосов (и других электронных имплантатов), наличия ферромагнитных клипс на сосудах головного мозга.
Недостатки МРТ:
1. Невозможность проведения количественной оценки плотности тканей.
2. Длительность получения изображения
3. Невозможность оценки состояния костных структур.
4. Возможность появления проблем, связанных с клаустрофобией.
5. Невозможность проведения исследований у пациентов с искусственными водителями ритма сердца и наличием ферромагнитных имплантатов или трансплантатов.
6. Невозможность использования в качестве скринингового метода.
МРТ выполнялись на томографе с индукцией магнитного поля 3Т по следующему протоколу (таблица 1). В качестве контрастного препарата использовался гадопентетат димеглюмина или гадодиамид, введение препарата осуществлялось с помощью автоматического инжектора со скоростью 4,5 мл/с в локтевую вену одновременно с началом динамического сканирования, количество вводимого контрастного препарата рассчитывалось из соотношения 0,2 мл (1 ммоль)/кг массы тела пациентки. Построение кривых кинетики контрастного препарата, карт картирования кинетики препарата (WI, WO, ТТР, PEI, MIP-time) выполнялось по результатам динамического сканирования с использованием импульсной последовательности TWIST (время получения одной серии изображений 3 с, количество серий - 100) с использованием программного обеспечения MeanCurve рабочей станции SyngoVia. Оценка кинетики контрастного препарата проводится с помощью построения графиков (Фиг. 1). Показания кинетики контрастного препарата в миоматозном узле соотносятся с данными кинетики в неизменном миометрии (синяя кривая) с оценкой в зависимости от скорости кровотока, а соответственно накоплении и вымывании контрастного препарата в патологической ткани, характера кровоснабжения. На Фиг. 2 и Фиг. 3 представлены клинические случаи с оценкой кровотока в миоматозных узлах. Также проводится построение цветных карт картировани (Фиг. 4) с визуальной оценкой по отношению к неизменному миометрию скорости накопления контрастного препарата (цветная карта WashIn), скорости вымывания контрастного препарата (WashOut), проекция максимальной интенсивности по времени (цветная карта MIP time map), позитивного интеграла накопления (цветная карта PEI).
Были получены данные.
Клинический пример №1
Ориентация срезов: аксиальная, фронтальная, сагиттальная.
Использование контрастного препарата - да.
Толщина срезов 3-4 мм.
Исследование выполнено при не наполненном мочевом пузыре. Матка в положении anteversio, неправильной формы, размерами: передне-задний 48 мм, билатеральный 46 мм, продольный 52 мм. Толщина функционального слоя до 4 мм, ПСЗ до 5 мм. В толще миометрия и субмукозно (преимущественно в области дна и задней стенке) определяются множественные миоматозные узлы размерами до 29×28×28 мм (наибольший интрамуральный в задней стенке, деформирует полость матки). Кроме того, в области перешейка, по передне-правой стенке, определяется единичный субсерозный узел размерами до 21×20×23 мм. Правый яичник обычно расположен, размерами 20×20×13 мм с единичными жидкостными включениями. Левый яичник обычно расположен, размерами 27×18×27 мм с множественными жидкостными включениями. Мочевой пузырь не расправлен, содержимое однородное. Клетчаточные пространства таза дифференцированы. Крупные сосуды таза не изменены. Увеличенных лимфоузлов, костной деструкции на исследованном уровне не определяется.
После введения контрастного препарата (Гадодиамид 0,2 мл/кг массы тела) побочных реакций на введение не отмечено. Вышеописанные узлы накапливают препарат (узел в задней стенке с кривой кинетики препарата характерной для гиперваскулярных узлов, субсерозный узел - с кривой кинетики препарата характерной для узлов промежуточной васкуляризацией). Других участков патологического накопления препарата в зоне исследования не выявлено.
ЗАКЛЮЧЕНИЕ: MP-картина множественных миом матки расположенных интрамурально, субмукозно и субсерозно.
Клинический пример №2
Ориентация срезов: аксиальная, фронтальная, сагиттальная.
Использование контрастного препарата - да.
Толщина срезов 3-4 мм.
Исследование выполнено при не полностью наполненном мочевом пузыре. Матка в положении anteversio, неправильной формы, размерами: передне-задний 46 мм, билатеральный 62 мм, продольный 55 мм. Толщина функционального слоя до 9 мм, ПСЗ до 11 мм. В толще миометрия, в среднем и нижнем маточном сегментах, в левой боковой стенке матки определяется единичный миоматозный узел размерами до 48×50×44 мм. Узел не деформирует полость матки, интенсивность MP-сигнала от узла однородная. Шейка матки обычного вида. Правый яичник обычно расположен, размерами 34×30×40 мм с множественными жидкостными включениями, наибольшее диаметром 25 мм - вероятно функциональная киста. Левый яичник расположен по нижнелатеральному контуру узла, размерами 36×38×18 мм, неправильной формы, с множественными жидкостными включениями. Мочевой пузырь расправлен не полностью, содержимое его однородное. Определяются две кисты бартолиниевых желез размерами до 8 мм. Клетчаточные пространства таза дифференцированы. Крупные сосуды таза не изменены. Увеличенных лимфоузлов, костной деструкции на исследованном уровне не определяется.
После введения контрастного препарата (Гадодиамид 0,2 мл/кг массы тела) побочных реакций на введение не отмечено. Вышеописанный узел несколько негомогенно накапливает контрастный препарат (с кривой кинетики препарата характерной для гиперваскулярного типа кровоснабжения), по его нижнему контуру определяется петля левой маточной артерии. Других участков патологического накопления препарата в зоне исследования не выявлено.
ЗАКЛЮЧЕНИЕ: MP-картина единичной миомы матки.
Клинический пример №3
Ориентация срезов: аксиальная, фронтальная, сагиттальная.
Использование контрастного препарата - да.
Толщина срезов 3-4 мм.
Исследование выполнено при наполненном мочевом пузыре. Матка в положении anteversio, неправильной формы, размерами: передне-задний 77 мм, билатеральный 81 мм, продольный 67 мм. Толщина функционального слоя до 9 мм, ПСЗ без четких границ. В толще миометрия по задней стенке, ближе к дну, определяется миоматозный узел размерами 29×35×37 мм, В левой боковой стенке - интрамуральный узел размерами 30×34×32 мм деформирующий полость матки, по задней стенке матки, в области нижнего маточного сегмента справа определяется субсерозно расположенный, на широком основании, миоматозный узел размерам 29×30×25 мм. Кроме того, MP-сигнал от миометрия негомогенный, в нижнем маточном сегменте определяется рубец. В шейке матки визуализируются немногочисленные Наботовы кисты диаметрами до 10 мм. Правый яичник расположен по задне-правой стенке матки, размерами 25×13×14 мм с единичным жидкостным включением. Левый яичник расположен по задне-левой стенке матки, размерами 36×20×25 мм с единичным жидкостным включением. Мочевой пузырь расправлен, стенки его не изменены, содержимое однородное. Клетчаточные пространства таза дифференцированы. Крупные сосуды таза не изменены. Определяются увеличены лимфоузлы (подвздошные до 20×10×11 мм, костной деструкции на исследованном уровне не определяется. После введения контрастного препарата (Гадодиамид 0,2 мл/кг массы тела) побочных реакций на введение не отмечено. Вышеописанный узлы №1 и №2 имеют гиперваскулярную кинетику контрастного препарата, узел №3 - гиповаскулярную. Других участков патологического накопления препарата в зоне исследования не выявлено. ЗАКЛЮЧЕНИЕ: MP-картина трех миом матки расположенных интрамурально и субсерозно, рубца в нижнем маточном сегменте. MP-признаки аденомиоза, спаечного процесса. Лимфаденопатия.
Клинический пример №4
Ориентация срезов: аксиальная, фронтальная, сагиттальная.
Использование контрастного препарата - да.
Толщина срезов 3-4 мм.
Исследование выполнено при наполненном мочевом пузыре. Матка в положении anteversio, неправильной формы, размерами: передне-задний 70 мм, билатеральный 85 мм, продольный 75 мм. Толщина функционального слоя до 12 мм, ПСЗ до 8 мм. В толще миометрия определяются три миоматозных узла размерами до 50×53×48 мм (наибольший с неоднородной структурой, в левой боковой стенке, деформирует полость матки). Шейка обычного вида с единичными Наботовыми кистами размерами до 11 мм. Правый яичник обычно расположен, размерами 35×22×26 мм с множественными жидкостными включениями. Левый яичник обычно расположен, размерами 25×30×23 мм с множественными жидкостными включениями. Мочевой пузырь расправлен, стенки его не изменены, содержимое однородное. Клетчаточные пространства таза дифференцированы. Крупные сосуды таза не изменены. Увеличенных лимфоузлов, костной деструкции на исследованном уровне не определяется. После введения контрастного препарата (Гадодиамид 0,2 мл/кг массы тела) побочных реакций на введение не отмечено. Вышеописанные миоматозные узлы (наибольший - несколько негомогенно, остальные - гомогенно) накапливают контрастный препарат с кинетикой, характерной для гиперваскулярных узлов. Других участков патологического накопления препарата в зоне исследования не выявлено. ЗАКЛЮЧЕНИЕ: MP-картина трех миом матки с гиперваскулярным типом кинетики контрастного препарата расположенных интрамурально. МР-признаки аденомиоза.
Клинический пример №5
Ориентация срезов: аксиальная, фронтальная, сагиттальная.
Использование контрастного препарата - да.
Толщина срезов 3-4 мм.
Исследование выполнено на 23-24 день цикла, при не полностью наполненном мочевом пузыре. Матка в положении anteversio, отклонена влево, неправильной формы, размерами: передне-задний 49 мм, билатеральный 84 мм, вертикальный 59 мм. Толщина функционального слоя до 8 мм, ПСЗ до 9 мм. В толще миометрия определяются три миоматозных узла, наибольший из которых размерами 43×52×71 мм, расположен в нижнем сегменте передней стенки матки парасаггитально справа. Шейка обычного вида. Правый яичник обычно расположен, размерами 22×16×20 мм без жидкостных включений. Левый яичник обычно расположен, размерами 20×20×23 мм с единичными жидкостными включениями. По наружному контуру матки, в области правого угла расположена жидкостная структура неясного генеза, размерами 13×14 мм. Мочевой пузырь расправлен не полностью, стенки его не изменены, содержимое однородное. Клетчаточные пространства таза дифференцированы. Крупные сосуды таза не изменены. Увеличенных лимфоузлов, костной деструкции на исследованном уровне не определяется.
После введения контрастного препарата (Гадодиамид 0,2 мл/кг массы тела) побочных реакций на введение не отмечено. Вышеописанные миоматозные узлы гомогенно накапливают контрастный препарат, с кривой кинетики препарата характерной для гиперваскулярных узлов. Других участков патологического накопления препарата в зоне исследования не выявлено. ЗАКЛЮЧЕНИЕ: МР-картина единичных миом матки расположенных интрамурально.
Метод функциональной МРТ позволяет оценить кровоток в миометрии при различных патологиях, в том числе таких как миома матки и аденомиоз. Метод позволяет разработать рекомендации по тактике и планированию лечения в зависимости от определяемой тканевой перфузии.
На чертежах изображено:
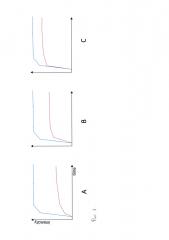
Фиг. 1. Кинетика контрастного препарата в миоматозных узлах. Синим показана кривая кинетики неизмененного миометрия, красным – миоматозного узла. А – I тип кривой характерен для гиповаскулярных узлов. В – II тип кривой характерен для узлов со средней васкуляризацией. С – III тип кривой характерен для гиперваскулярных узлов.
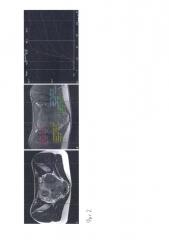
Фиг. 2. МРТ пациентки с гиповаскулярным миоматозным узлом и двумя миоматозными узлами со средней васкуляризацией. А – Т2WI в аксиальной плоскости, на изображении определяются множественные миоматозные узлы. В – МРТ с динамическим контрастным усилением, на изображении показаны зоны для построения кривых кинетики контрастного препарата: 1 (красный) – неизмененный миометрий, 2, 3 и 4 (желтый, зеленый и голубой) – миоматозные узлы. С – кривые кинетики препарата: 1 (красный) неизмененный миометрий, 2 и 3 (желтый и зеленый) – миоматозные узлы со средней васкуляризацией (II тип кривой), 4 (голубой) – гиповаскулярный миоматозный узел (I тип кривой).
Фиг. 3. МРТ пациентки с гиперваскулярным миоматозным узлом. А - Т2WI в аксиальной плоскости, на изображении определяется больших размеров миоматозный узел. В – МРТ с динамическим контрастным усилением, на изображении показаны зоны для построения кривых кинетики контрастного препарата: 1 (красный) – неизмененный миометрий, 2 (желтый) – миоматозный узел. С – кривые кинетики препарата: 1 (красный) – неизмененный миометрий, 2 (желтый) – гиперваскулярный миоматозный узел.
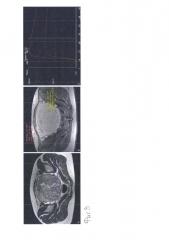
Фиг. 4. МРТ пациентки с двумя миоматозными узлами с промежуточной васкуляризацией. А – Т2ВИ в саггитальной плоскости, на изображении определяются два миоматозных узла. В – МРТ с динамическим контрастным усилением, на изображении показаны зоны интереса для построения кривых кинетики контрастного препарата: 1 (красный) – миоматозный узел, 2 (желтый) – миоматозный узел, 3 (зеленый) – неизмененный миометрий. С – кривые кинетики контрастного препарата: 1 (красный) – миоматозный узел, 2 (желтый) – миоматозный узел, 3 (зеленый) – неизменный миометрий. D-G – цветные карты кинетики контрастного препарата, оцениваемый параметр закодирован в цвете (красный – максимальное значение, синий – минимальное значение). D – цветная карта WashIn (WI – скорость накопления). Е – цветная карта WashOut (WO – скорость вымывания). F – цветная карта MIP time map (проекция максимальной интенсивности по времени). G – цветная карта PEI (позитивный интеграл накопления).
Список литературы
1. Aimot-Macron S., Salomon L.J., Deloison B. et al. In vivo MRI assessment of placental and fetal oxygenation changes in a rat model of growth restriction using blood oxygen leveldependent (BOLD) magnetic resonance imaging. Eur Radiol 2013; 23:1335-42.
2. Alario F.X., Chainay H, Lehericy S, et al: The role of the sup-plementary motor area (SMA) in word production. Brain Res. 2006; 1076(1):129-143.
3. Alison M, Chalouhi GE, Autret G, et al. Use of intravoxel incoherent motion MR imaging to assess placental perfusion in a murine model of placental insufficiency. Invest Radiol 2013; 48: 17-23.
4. Alsop DC. Arterial spin labeling: its time is now. MAGMA 2012; 25:75-77.
5. An Wang, Terry M. Peters, Sandrine de Ribaupierre, and Seyed M. Mirsattari. Hindawi Publishing Corporation Epilepsy Research and Treatment Volume 2012, Article ID 198183, 8 pages doi:10.1155/2012/198183 Functional Magnetic Reso-nance Imaging for Language Mapping in Temporal Lobe Epilepsy.
6. Asllani I, Borogovac A, Brown TR. Regression algorithm correcting for partial volume effects in arterial spin labeling MRI. Magn Reson Med 2008; 60:1362-1371.
7. Baschat AA, Hecher K. Fetal growth restriction due to placental disease. Semin Perinatol 2004; 28:67-80.
8. Bjornerud A., Sorensen AG, Mouridsen K, Emblem KE. T1- and T2*-dominant extravasation correction in DSC-MRI: part I--theoretical considerations and implications for assessment of tumor hemodynamic properties. J Cereb Blood Flow Metab 2011; 31:2041-2053
9. Bleeker EJ, van Buchem MA, van Osch MJ. Optimal location for arterial input function measurements near the middle cerebral artery in first-pass perfusion MRI. J Cereb Blood Flow Metab 2009; 29:840-852.
10. Bleeker EJ, van Osch MJ, Connelly A, van Buchem MA, Webb AG, Calamante F. New criterion to aid manual and automatic selection of the arterial input function in dynamic susceptibility contrast MRI. Magn Reson Med 2011; 65:448-456.
11. Bogomolny DL, Petrovich NM, Hou BL, et al. Functional MRI in the brain tumor patient. Top Magn. Reson. Imaging 2004; 15(5):325-335.
12. Bonekamp D, Degaonkar M, Barker PB. Quantitative cerebral blood flow in dynamic susceptibility contrast MRI using total cerebral flow from phase contrast magnetic resonance angiography. Magn Reson Med 2011; 66:57-66.
13. Brennan CW, Petrovich Brennan NM: Functional image-guided neurosurgery. In: Functional neuroimaging: a clinical approach. Holodny AI (Ed.), Informa Healthcare Inc, New York, USA; 2008. p. 91-106.
14. Brennan NP: Preparing the patient for the fMRI Study and optimization of paradigm selection and delivery. In: Functional neuroimaging: a clinical approach. Holodny AI (Ed.), Informa Healthcare Inc, New York, USA, 2008. P. 13-21.
15. Brennan NP: Preparing the patient for the fMRI Study and optimization of paradigm selection and delivery. In: Functional neuroimaging: a clinical approach. Holodny AI (Ed.), Informa Healthcare Inc, New York, USA; 2008. p. 13-21.
16. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The "great obstetrical syndromes" are associated with disorders of deep placentation. Am J Obstet Gynecol 2011; 204:193-201.
17. Buckley DL. Uncertainty in the analysis of tracer kinetics using dynamic contrast-enhanced T1-weighted MRI. Magn Reson Med 2002; 47:601-606.
18. Buxton RB, Uludag K, Dubowitz DJ, et al: Modeling the he-modynamic response to brain activation. Neuroimage. 2004; 23(1):220-233.
19. Calamante F, Christensen S, Desmond PM, Ostergaard L, Davis SM, Connelly A. The physiological significance of the time-to-maximum (Tmax) parameter in perfusion MRI. Stroke 2010; 41:1169-1174.
20. Calamante F, Connelly A, van Osch MJ. Nonlinear DeltaR*2 effects in perfusion quantification using bolus-tracking MRI. Magn Reson Med 2009; 61:486-492.
21. Calamante F, M, Hansen LK. Defining a local arterial input function for perfusion MRI using independent component analysis. Magn Reson Med 2004; 52:789-797.
22. Calamante F, Willats L, Gadian DG, Connelly A. Bolus delay and dispersion in perfusion MRI: implications for tissue predictor models in stroke. Magn Reson Med 2006; 55:1180-1185.
23. Calamante F, Yim PJ, Cebral JR. Estimation of bolus dispersion effects in perfusion MRI using image-based computational fluid dynamics. Neuroimage 2003; 19(2 Pt 1):341-353.
24. Chalouhi GE, Alison M, Deloison B, et al. Fetoplacental oxygenation in an intrauterine growth restriction rat model by using blood oxygen level-dependent MR imaging at 4.7 T. Radiology 2013; 269:122-9.
25. Chalouhi GE, Deloison B, Siauve N, et al. Dynamic contrast-enhanced magnetic resonance imaging: definitive imaging of placental function? Semin Fetal Neonatal Med 2011; 16: 22-8.
26. Chalouhi GE, Salomon LJ. BOLD-MRI to explore the oxygenation of fetal organs and of the placenta. BJOG 2014; 121:1595.
27. Chen Y, Wang DJ, Detre JA. Comparison of arterial transit times estimated using arterial spin labeling. MAGMA 2012; 25:135-144.
28. Clement O, Faye N, Fournier L, Siauve N, Frija G. [Kidney and iodinated and gadoliniumbased contrast agents]. J Radiol 2011; 92: 291-8.
29. De Bazelaire C, Rofsky NM, Duhamel G, Michaelson MD, George D, Alsop DC. Arterial spin labeling blood flow magnetic resonance imaging for the characterization of metastatic renal cell carcinoma(1). Acad Radiol 2005; 12: 347-57.
30. Delmaire C, Krainik A, Lethuc V, et al. [Functional magnetic resonance imaging: physiopathology, techniques and applications]. J Radiol 2007; 88:497-509.
31. Deloison B, Siauve N, Aimot S, et al. SPIOenhanced magnetic resonance imaging study of placental perfusion in a rat model of intrauterine growth restriction. BJOG Int J Obstet Gynaecol 2012; 119:626-33.
32. Deray G, Rouviere O, Bacigalupo L, et al. Safety of meglumine gadoterate (Gd-DOTA)-enhanced MRI compared to unenhanced MRI in patients with chronic kidney disease (RESCUE study). Eur Radiol 2013; 23:1250-9.
33. Dwyer BK, Belogolovkin V, Tran L, et al. Prenatal diagnosis of placenta accreta sonography or magnetic resonance imaging? J Ultrasound Med 2008; 27:1275-81.
34. Expert Panel on MR Safety, Kanal E, Barkovich AJ, et al. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging 2013; 37:501-30.
35. Ferre JC, Bannier E, Raoult H, Mineur G, Carsin-Nicol B, Gauvrit JY. Arterial spin labeling (ASL) perfusion: techniques and clinical use. Diagn Interv Imaging 2013; 94:1211-23.
36. Forster MT, Senft C, Hattingen E, et al. Motor cortex evaluation by nTMS after surgery of central region tumors: a feasibility study. Acta Neurochir (Wien). 2012 Jun 7.
37. Frias AE, Schabel MC, Roberts VHJ, et al. Using dynamic contrast-enhanced MRI to quantitatively characterize maternal vascular organization in the primate placenta. Magn Reson Med 2015; 73:1570-8.
38. Functional MR Imaging (fMRI) - Brain, American College of Radiology & Radiological Society of North America, May 24, 2011, retrieved December 30, 2011.
39. Gartus A, Foki T, Geissler A, Beisteiner R. Improvement of clinical language localization with an overt semantic and syntactic language functional MR imaging paradigm. AJNR Am J Neuroradiol. 2009 Nov; 30(10): 1977-85. Epub 2009 Jul 30.
40. Gordon Y, Partovi S, M, et al. Dynamic contrast-enhanced magnetic resonance imaging: fundamentals and application to the evaluation of the peripheral perfusion. Cardiovasc Diagn Ther 2014; 4:147.
41. Hoeller M, Krings T, Reinges MH, et al: Movement artifacts and MR BOLD signal increase during different paradigms for mapping the sensorimotor cortex. Acta. Neurochir (Wien). 2002; 144(3):279-284.
42. Holodny A, Hou B. Physical principles of BOLD fMRI-what is important for the clinician. In: Functional neuroimaging: a clinical approach. Holodny AI (Ed.), Informa Healthcare Inc, New York, USA; 2008. p. 1-12.
43. Holodny AI, Schulder M, Ybasco A, Liu WC. Translocation of Broca's area to the contralateral hemisphere as the result of the growth of a left inferior frontal glioma. J Comput Assist Tomogr. 2002 Nov-Dec; 26(6):941-3.
44. Hou BL, Bradbury M, Peck KK, et al. Effect of brain tumor neovasculature defined by rCBV on BOLD fMRI activation vol-ume in the primary motor cortex. Neuroimage 2006; 32(2):489-97.
45. Ius T, Angelini E, Thiebaut de Schotten M, et al. Evidence for potentials and limitations of brain plasticity using an atlas of functional resectability of WHO grade II gliomas: towards a "minimal common brain". Neuroimage. 2011 Jun 1; 56(3):992-1000.
46. Jack CR Jr. Alzheimer disease: new concepts on its neuro-biology and the clinical role imaging will play. Radiology. 2012 May; 263(2):344-61.
47. Jackson A, Li KL, Zhu X. Semi-quantitative parameter analysis of DCE-MRI revisited: monte-carlo simulation, clinical comparisons, and clinical validation of measurement errors in patients with type 2 neurofibromatosis. PLoS One 2014; 9:e90300.
48. Jahng GH, Stables L, Ebel A, Matson GB, Meyerhoff DJ, Weiner MW, et al. Sensitive and fast T1 mapping based on two inversion recovery images and a reference image. Med Phys 2005; 32:1524-1528.
49. Kao YH, Guo WY, Wu YT, Liu KC, Chai WY, Lin CY, et al. Hemodynamic segmentation of MR brain perfusion images using independent component analysis, thresholding, and Bayesian estimation. Magn Reson Med 2003; 49:885-894.
50. Kesavadas C, Thomas B: Clinical applications of functional MRI in epilepsy. Indian J. Radiol. Imaging. 2008; 18(3):210-217.
51. Krings T, Reinges MH, Erberich S, et al: Functional MRI for presurgical planning: problems, artifacts, and solution strategies. J. Neurol. Neurosurg. Psychiatry. 2001; 70(6):749-760.
52. Lam G, Kuller J, McMahon M. Use of magnetic resonance imaging and ultrasound in the antenatal diagnosis of placenta accreta. J Soc Gynecol Investig 2002; 9:37-40.
53. Larsson HB, Courivaud F, Rostrup E, Hansen AE. Measurement of brain perfusion, blood volume, and blood-brain barrier permeability, using dynamic contrast-enhanced T(1)-weighted MRI at 3 tesla. Magn Reson Med 2009; 62:1270-1281.
54. Liang X, Connelly A, Calamante F. Improved partial volume correction for single inversion time arterial spin labeling data. Magn Reson Med 2013; 69:531-537.
55. Logothetis NK, Wandell BA: Interpreting the BOLD signal. Annu. Rev. Physiol. 2004; 66:735-769.
56. Lorenz C, Benner T, Chen PJ, Lopez CJ, Ay H, Zhu MW, et al. Automated perfusion-weighted MRI using localized arterial input functions. J Magn Reson Imaging 2006; 24:1133-1139.
57. Matthews PM, Honey GD, Bullmore ET. Applications of fMRI in translational medicine and clinical practice. Nat Rev Neurosci 2006; 7(9):732-44.
58. Millischer A, Sonigo P, Ville Y, Brunelle F, Boddaert N, Salomon L. Standardized anatomical examination of the fetus at MRI: a feasibility study. Ultrasound Obstet Gynecol 2013; 42: 553-9.
59. Moran M, McAuliffe FM. Imaging and assessment of placental function. J Clin Ultrasound 2011; 39:390-8.
60. Mouridsen K, Friston K, Hjort N, Gyldensted L, L, Kiebel S. Bayesian estimation of cerebral perfusion using a physiological model of microvasculature. Neuroimage 2006; 33:570-579.
61. Nader Sanai, M.D., Zaman Mirzadeh, Ph.D., and Mitchel S. Berger, M.D. Functional Outcome after Language Mapping for Glioma Resection N Engl J Med 2008; 358:18-27 January 3, 2008.
62. Park SH, Wang DJ, Duong TQ. Balanced steady state free precession for arterial spin labeling MRI: initial experience for blood flow mapping in human brain, retina, and kidney. Magn Reson Imaging 2013; 31:1044-50.
63. Patenaude Y, Pugash D, Lim K, et al. The use of magnetic resonance imaging in the obstetric patient. J Obstet Gynaecol Can 2014; 36: 349-63.
64. Peck K, Jessica Galgano, Ryan Branski, Margaret Ho, Andrei Holodny, Dennis Kraus. Event Related Functional MRI Investigation of Vocal Pitch Variation. Neuroimage, 2009; 14(1):175 181.
65. Peck K, Michelle B, Pasty Estee, Brennan N, Holodny A. Joint Activation of the SMA and pre-SMA during Simultaneous Motor and Language fMRI, NeuroReport, 2009; 20(5):487-491.
66. Peck KK, Bradbury M, Petrovich N, et al. Presurgical evaluation of language using functional magnetic resonance imaging in brain tumor patients with previous surgery. Neurosurgery. 2009 Apr; 64(4):644-52; discussion 652-3.
67. Peck KK, Bradbury M, Psaty EL, et al: Joint activation of the supplementary motor area and presupplementary motor area during simultaneous motor and language functional MRI. Neu-roreport. 2009; 20(5):487-491.
68. Peck KK, Bradbury M, Psaty EL, et al. Joint activation of the supplementary motor area and presupplementary motor area during simultaneous motor and language functional MRI. Neu-roreport 2009; 20(5):487-91.
69. Peck KK, Bradbury MS, Hou BL, et al: The role of the sup-plementary motor area (SMA) in the execution of primary motor activities in brain tumor patients: functional MRI detection of time-resolved differences in the hemodynamic response. Med. Sci. Monit. 15(4), 55-62 (2009).
70. Peck KK, Bradbury MS, Hou BL, et al. The role of the sup-plementary motor area (SMA) in the execution of primary motor activities in brain tumor patients: functional MRI detection of time-resolved differences in the hemodynamic response. Med Sci Monit 2009; 15(4):MT55-62.
71. Peck KK, Holodny Al: fMRI clinical applications. In: Magnetic resonance tomography. Reiser MF, Semmler W, Hricak H (Ed.), Springer Verlag, Berlin, Germany; 2007. p. 1308-1331.
72. Petrovich NM, Holodny Al, Brennan CW, et al. Isolated translocation of Wernicke's area to the right hemisphere in a 62-year-man with a temporo-parietal glioma. AJNR Am J Neuroradiol. 2004 Jan; 25(1):130-3.
73. Pollock JM, Deibler AR, Burdette JH, et al. Migraine associated cerebral hyperperfusion with arterial spin-labeled MR imaging. AJNR Am J Neuroradiol 2008; 29:1494-7.
74. Pollock JM, Tan H, Kraft RA, Whitlow CT, Burdette JH, Maldjian JA. Arterial spin-labeled MR perfusion imaging: clinical applications. Magn Reson Imaging Clin N Am 2009; 17: 315-38.
75. Regnault TR, Galan HL, Parker ТА, Anthony RV. Placental development in normal and compromised pregnancies: a review. Placenta 2002; 23 (suppl A): S119-29.
76. Robles SG, Gatignol P, S, et al. Long-term brain plasticity allowing a multistage surgical approach to World Health Organization Grade II gliomas in eloquent areas. J Neurosurg. 2008 Oct; 109(4):615-24.
77. Rombouts, S.A.R.В.; Barkhof, F.; Sheltens, P. (2007), Clini-cal applications of functional brain MRI, UK: Oxford University Press, ISBN 978-0-19-856629-8.
78. Romero R, Kusanovic JP, Kim CJ. Placental bed disorders in the genesis of the great obstetrical syndromes. In: Pijnenborg R, Brosens I, Romero R, eds. Placental bed disorders. Basic science and its translation to obstetrics. Cambridge, UK: Cambridge University Press; 2010:271-89.
79. Salomon LJ, Bernard J-P, Millischer A-E, et al. MRI and ultrasound fusion imaging for prenatal diagnosis. Am J Obstet Gynecol 2013; 209:148.e1-9.
80. Salomon LJ, Siauve N, Balvay D, et al. Placental perfusion MR imaging with contrast agents in a mouse model. Radiology 2005; 235: 73-80.
81. Salomon LJ, Siauve N, Taillieu F, et al. In vivo dynamic MRI measurement of the noradrenaline-induced reduction in placental blood flow in mice. Placenta 2006; 27:1007-13.
82. Sasan Partovi, Florian Konrad. "Effects of Covert and Overt Paradigms in Clinical Language fMRI" Academic Radiology. May 2012; 19(5):518-525.
83. Shin W, Horowitz S, Ragin A, Chen Y, Walker M, Carroll TJ. Quantitative cerebral perfusion using dynamic susceptibility contrast MRI: evaluation of reproducibility and age- and gender-dependence with fully automatic image postprocessing algorithm. Magn Reson Med 2007; 58:1232-1241.
84. Solomon E, Avni R, Hadas R, et al. Major mouse placental compartments revealed by diffusion-weighted MRI, contrast-enhanced MRI, and fluorescence imaging. Proc Natl Acad Sci USA 2014; 111:10353-8.
85. Sorensen A, Pedersen M, Tietze A, Ottosen L, Duus L, Uldbjerg N. BOLD MRI in sheep fetuses: a non-invasive method for measuring changes in tissue oxygenation. Ultrasound Obstet Gynecol 2009; 34:687-92.
86. Sorensen A, Peters D, E, Lingman G, Christiansen O, Uldbjerg N. Changes in human placental oxygenation during maternal hyperoxia as estimated by bold oxygen levele dependent magnetic resonance imaging (BOLD MRI). Ultrasound Obstet Gynecol 2013; 42: 310-4.
87. A, Peters D, Simonsen C, et al. Changes in human fetal oxygenation during maternal hyperoxia as estimated by BOLD MRI. Prenat Diagn 2013; 33:141-5.
88. Sourbron S. Technical aspects of MR perfusion. Eur J Radiol 2010; 76:304-13.
89. Taillieu F, Salomon LJ, Siauve N, et al. Placental perfusion and permeability: simultaneous assessment with dual-echo contrastenhanced MR imaging in mice. Radiology 2006; 241:737-45.
90. Tocchio S, Kline-Fath B, Kanal E, Schmithorst VJ, Panigrahy A. MRI evaluation and safety in the developing brain. Semin Perinatol 2015; 39:73-104.
91. Unterscheider J, Daly S, Geary MP, et al. Predictable progressive Doppler deterioration in IUGR: does it really exist? Am J Obstet Gynecol 2013; 209:539.e1-7.
92. Vincent K, Moore J, Kennedy S, Tracey I. Blood oxygenation level dependent functional magnetic resonance imaging: current and potential uses in obstetrics and gynaecology. BJOG 2009; 116:240-6.
93. Warnking JM, Pike GB. Bandwidth-modulated adiabatic RF pulses for uniform selective saturation and inversion. Magn Reson Med 2004; 52:1190-1199.
94. Willats L, Calamante F. The 39 steps: evading error and deciphering the secrets for accurate dynamic susceptibility contrast MRI. NMR Biomed 2013; 26:913-931 Korean J Radiol 15(5), Sep/Oct 2014 kjronline.org 575 Perfusion MRI.
95. Willats L, Christensen S, Ma HK, Donnan GA, Connelly A, Calamante F. Validating a local Arterial Input Function method for improved perfusion quantification in stroke. J Cereb Blood Flow Metab 2011; 31:2189-2198.
96. Wong EC. An introduction to ASL labeling techniques. J Magn Reson Imaging 2014; 40: 1-10.
97. Wu WC, Su MY, Chang CC, Tseng WY, Liu KL. Renal perfusion 3-T MR imaging: a comparative study of arterial spin labeling and dynamic contrast-enhanced techniques. Radiology 2011; 261:845-53.
98. Zaharchuk G, Straka M, Marks MP, Albers GW, Moseley ME, Bammer R. Combined arterial spin label and dynamic susceptibility contrast measurement of cerebral blood flow. Magn Reson Med 2010; 63:1548-1556.
Способ динамического сканирования при мультипараметрической магнитно-резонансной томографии (МРТ) с использованием парамагнитного контрастного агента при миоме матки и аденомиозе, отличающийся тем, что определяют перфузионный кровоток в миометрии, представляя его графическими зависимостями и цветным картированием, для чего МРТ выполняют на томографе с индукцией магнитного поля 3Т, в качестве контрастного препарата используют гадолиниевый парамагнитный контрастный агент, введение препарата осуществляют с помощью автоматического инжектора со скоростью 4,5 мл/с в локтевую вену одновременно с началом динамического сканирования, количество вводимого контрастного препарата рассчитывают из соотношения 1 ммоль на кг массы тела пациентки, после введения контрастного препарата отслеживают и оценивают кинетику контрастного препарата в патологической и нормальной ткани, построение кривых кинетики контрастного препарата с последующим цветовым картированием полученных данных и построением цветных перфузионных карт выполняют по результатам динамического сканирования с использованием импульсной последовательности TWIST, где время получения одной серии изображений 3 с, количество серий - 100, с использованием программного обеспечения MeanCurve рабочей станции SyngoVia.