Фторирование эфиров акриловой кислоты и их производных
Иллюстрации
Показать всеНастоящее изобретение относится к способам превращения эфиров акриловой кислоты или их производных в дифторпропионовую кислоту или ее производные. Этот способ обычно проводят с использованием фтористого газа в фторуглеводородном растворителе. Способ получения производных 2,3-дифторпропионовой кислоты включает образование реакционной смеси, содержащей растворитель, фтористый газ и соединение формулы 1, где R1 представляет собой гидрокси, алкокси, хлор или-ОС(О)СН=СН2, с образованием соединения формулы 2 с выходом по меньшей мере 50%, и взаимодействие соединения формулы 2 со спиртом и катализатором; где R2 представляет собой гидрокси, алкокси, хлор, -OC(O)CHFCH2F и где растворитель представляет собой 2Н,3Н-декафторпентан, эйкозафторнонан, тетрадекафторгексан, тетрадекафтор-2-метилпентан, гексафторбензол, октадекафтордекагидронафталин, октадекафтороктан, октафторциклопентен, октафтортолуол, перфтор(1,3-диметилциклогексан), перфторгептан, перфтор(2-бутилтетрагидрофуран), перфтортриэтиламин, гептакозафтортрибутиламин, тетрадекафторметилциклогексан, 1,1,1,3,3-пентафторбутан или их комбинацию. 18 з.п. ф-лы, 8 табл., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение, в общем, относится к способам превращения эфиров акриловой кислоты или их производных в соответствующие дифторпропионаты или их производные. Способ, в общем, осуществляется с использованием фтористого газа в фторуглеводородном растворителе.
УРОВЕНЬ ТЕХНИКИ
[0002] Калий (K+) является одним из самых широко распространенных внутриклеточных катионов. Гомеостаз калия поддерживается преимущественно с помощью регулирования выведения с мочой. Различные медицинские состояния, такие как пониженная почечная функция, заболевание мочеиспускательного тракта, рак, тяжелый сахарный диабет, хроническая сердечная недостаточность и/или лечение этих состояний, могут привести или предрасположить пациента к гиперкалиемии. Гиперкалиемию можно лечить различными полимерами катионного обмена, в том числе полифторакриловой кислотой (polyFAA), которая описана в WO 2005/097081, WO 2010/022381, WO 2010/022382 и WO 2010/022383, содержание которых полностью включено в настоящую заявку посредством ссылки.
[0003] Полифторакриловая кислота может быть получена путем полимеризации альфа-фторакрилатных эфиров и их производных. Несмотря на то что существует несколько известных способов производства альфа-фторакриловой кислоты или альфа-фторакрилатного мономера, многие из этих возможных способов синтеза коммерчески не обоснованы из-за чрезмерного фторирования или стоимости исходных материалов. Сейчас известно, что определенные условия способа прямого фторирования эфиров акриловой кислоты или их производных с использованием фтористого газа и дальнейшим удалением фторида водорода дают необходимую альфа-фторакриловую кислоту или альфа-фторакрилатный мономер коммерчески и экономически выгодным образом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] Настоящее изобретение предоставляет способ фторирования эфиров акриловой кислоты или их производных с образованием дифторпропионовой кислоты или ее производных.
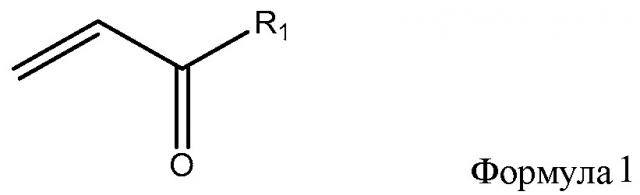
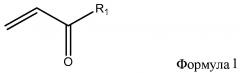
[0005] Одним из многих аспектов изобретения является способ фторирования двойной связи, который включает образование реакционной смеси, содержащей фторуглеводородный растворитель, фтористый газ и соединение формулы 1
,
с образованием соединения формулы 2 с выходом по меньшей мере 50%
,
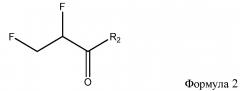
где R1 представляет собой гидрокси, алкокси, хлор или -OC(O)CH=CH2 и R2 представляет собой гидрокси, алкокси, хлор или -OC(O)CHFCH2F.
[0006] Другим аспектом является способ фторирования двойной связи, который включает образование реакционной смеси, содержащей фторуглеводородный растворитель, фтористый газ и соединение формулы 5
,
с образованием соединения формулы 6
.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0007] Фторирование может быть сложным для контроля, и оно может легко привести к чрезмерному фторированию продуктов. Таким образом, для максимального выхода требуемого продукта и минимизации побочных реакций растворитель, температуру реакции и добавки считают особенно важными. Было установлено, что фторирование двойной связи (например, в таких соединениях, как эфиры акриловой кислоты или их производные) с последующим удалением фторида водорода является коммерчески возможным способом производства альфа-фторакрилатного сложного эфира.
[0008] Способ фторирования двойной связи включает образование реакционной смеси, содержащей фторуглеводородный растворитель, фтористый газ и соединение, содержащее двойную связь. Соединение, содержащее двойную связь, может представлять собой соединение формулы 1
,
где R1 представляет собой гидрокси, алкокси, хлор или -OC(O)CH=CH2. Способ фторирования включает соединение продукта формулы 2
,
где R2 представляет собой гидрокси, алкокси, хлор или -OC(O)CHFCH2F.
[0009] R1 и R2 содержат, но не ограничиваясь ими, гидрокси, алкокси, например, метокси, этокси, пропокси, 2-пропокси, н-бутокси, изо-бутокси, втор-бутокси, трет-бутокси, н-пентокси, изо-пентокси, втор-пентокси или трет-пентокси или хлор. Предпочтительно, R1 и R2 представляют собой метокси, R1 и R2 представляют собой гидрокси или R1 и R2 представляют собой хлор.
[0010] Соединение, содержащее двойную связь, может также быть соединением формулы 5
Способ фторирования включает соединение продукта формулы 6
[0011] Реакционная смесь также содержит фтористый газ. Фтористый газ обычно используется в смеси с инертным газом. Примерами таких инертных газов являются азот и гелий. Смесь фтористого/инертного газа может содержать от 1 до 50 мольных процентов фтора; от приблизительно 20 мольных процентов до приблизительно 30 мольных процентов фтора является предпочтительным.
[0012] Реакционная смесь также содержит фторуглеводородный растворитель. Фторуглеводородный растворитель представляет собой 2H,3H-декафторпентан, эйкозафторнонан, тетрадекафторгексан, тетрадекафтор-2-метилпентан, гексафторбензол, октадекафтордекагидронафталин, октадекафтороктан, октафторциклопентен, октафтортолуол, перфтор(1,3-диметилциклогексан), перфторгептан, перфтор(2-бутилтетрагидрофуран), перфтортриэтиламин, гептакозафтортрибутиламин, тетрадекафторметилциклогексан, 1,1,1,3,3-пентафторбутан или их комбинацию. Предпочтительно, растворитель представляет собой 2H,3H-декафторпентан.
[0013] Температура плавления реакционной смеси составляет менее чем приблизительно -20°C, предпочтительно менее чем приблизительно -40°C.
[0014] Температура кипения реакционной смеси может составлять более чем приблизительно 30°C. Если температура кипения фторуглеводородного растворителя больше требуемой температуры (например, -40°C или -20°C), тогда другой агент может быть добавлен для снижения температуры плавления реакционной смеси до требуемой температуры. Например, дихлорметан или спирт, такой как метанол или этанол, и подобные им вещества могут быть добавлены к реакционной смеси для снижения температуры плавления реакционной смеси.
[0015] Также реакционная смесь может дополнительно содержать фторирующую добавку. Такая фторирующая добавка может содержать спирт, кислоту или их комбинацию. Если фторирующая добавка содержит спирт, тогда спирт включает этанол, метанол, трифторэтанол или их комбинацию. Если фторирующая добавка содержит кислоту, тогда кислота включает трифлатную кислоту, трифторуксусную кислоту, серную кислоту, муравьиную кислоту, уксусную кислоту или их комбинацию.
[0016] Дополнительно, реакционная смесь может содержать акцептор фторида водорода (HF). Акцептор HF содержит фторид натрия, фторид калия, фторид цезия, фторид кальция, оксид кальция, оксид магния, оксид алюминия или их комбинацию. Предпочтительно, акцептор HF содержит фторид натрия.
[0017] Расход элементарного фтора может находиться в диапазоне от 0,2 ммоль/мин до 8,3 ммоль/мин в зависимости от масштаба реакции. Расход и время реакции выбирают для максимального превращения (i) соединения формулы 1 в соединение формулы 2 или (ii) соединения формулы 5 в соединение формулы 6 при минимальных побочных реакциях, в частности побочных реакциях, вызывающих чрезмерное насыщение соединений фтором.
[0018] Реакционная смесь может содержать по меньшей мере приблизительно 1 кг, по меньшей мере приблизительно 5 кг, по меньшей мере приблизительно 10 кг или более соединения формулы 1 или 5.
[0019] Температура реакции способа находится в диапазоне от приблизительно -80°C до приблизительно -20°C. Предпочтительная температура реакции находится в диапазоне от приблизительно -80°C до приблизительно -60°C.
[0020] Способ фторирования может также осуществляться с использованием реактора непрерывного фторирования. В общем случае, соответствующий реактор содержит место введения фтористого газа, а также устройство регулирования температуры. Реактор может иметь соответствующий размер для масштаба проводимой реакции непрерывного фторирования. Соответствующий микрореактор был описан в статье Chambers, R.C. et al в "Microreactors for elemental fluorine," Chem. Commun., 1999, 883-884, и аппаратное исполнение такого реактора понятно специалисту в данной области техники. Реактор может быть изготовлен из материала, не реагирующего с кислотами, фтористым газом и другими корродирующими веществами. Например, таким материалом может быть нержавеющая сталь, монель, Хастеллой и подобные им материалы.
[0021] При осуществлении описанного здесь способа с использованием реактора непрерывного фторирования соединение формулы 1 или 5 (например, метилакрилат) растворяется в растворителе (например, 2H,3H-декафторпентан) в концентрации от приблизительно 2 масс.% до приблизительно 20 масс.%. Этот раствор подается через реактор со скоростью введения от приблизительно 0,2 мл/мин до приблизительно 2 мл/мин. Во время реакции реактор находится на поверхности, температура которой может быть уменьшена, чтобы температура реактора находилась в диапазоне от приблизительно 25°C до приблизительно -80°C. Процесс может охлаждаться приблизительно до приблизительно -15°C. При этом фтористый газ проходит через реактор со скоростью потока от приблизительно 0,2 ммоль/минуту до приблизительно 2 ммоль/минуту. Соединение формулы 1 или 5 и фтористый газ смешиваются внутри реактора, и продукт, содержащий соединение формулы 2 или 6, собирается в приемной колбе, температура которой находится в диапазоне от приблизительно 25°C до приблизительно -80°C, предпочтительно приблизительно -78°C.
[0022] Фтористый газ может быть разбавлен перед добавлением в реактор фторирования от приблизительно 1% фтористого газа в составе гелия до приблизительно 20% фтористого газа в составе гелия.
[0023] Время пребывания реагентов в реакторе непрерывного фторирования может составлять от приблизительно 1 миллисекунды до приблизительно 30 минут. Среднее время пребывания предпочтительно составляет от приблизительно 0,5 секунды до приблизительно 1 минуты или более предпочтительно от приблизительно 1 секунды до приблизительно 10 секунд.
[0024] Если не углубляться в теорию, можно считать, что реактор непрерывного фторирования дает меньшее время взаимодействия соединения формулы 1 или 5 и фтористого газа, что уменьшает чрезмерное насыщение фтором соединений формулы 2 или 6 (например, продукты фторирования).
[0025] После реакции смеси в степени, необходимой для максимального содержания дифторпропионовой кислоты или ее производных, может осуществляться реакция этерификации или переэтерификации. Когда производные формулы 2 содержат R1 в виде гидрокси или хлор, происходит реакция этерификации. Когда производные формулы 2 содержат R1 в виде алкокси, происходит реакция переэтерификации. Каждая реакция может производить требуемый алкилдифторпропаноат путем взаимодействия соединения формулы 2 со спиртом и катализатором. Например, когда требуемым веществом является метилдифторпропаноат, в качестве спирта используется метанол.
[0026] Катализатором переэтерификации может служить кислота или основание. Если катализатором переэтерификации является кислота, то это может быть кислота Бренстеда или кислота Льюиса. Соответствующие кислоты Бренстеда включают, но не ограничиваются ими, толуолсульфоновую кислоту (TsOH), серную кислоту, соляную кислоту, ортофосфорную кислоту, уксусную кислоту, муравьиную кислоту, трифлатную кислоту, трифторуксусную кислоту или их комбинации. Соответствующие кислоты Льюиса включают, но не ограничиваются ими, трехбромистый бор, оксид алюминия, тетраэтоксититан или их комбинации.
[0027] Если катализатором переэтерификации является основание, то этим основанием может быть, например, диметиламинопиридин (DMAP), диэтилгидроксиамин, триэтиламин, N,N-диизопропилэтиламин (основание Хунига), пиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) или их комбинация. Предпочтительным основанием является диметиламинопиридин.
[0028] Для соединения формулы 6 нитрильная группа может быть превращена в сложноэфирную группу путем взаимодействия спирта с кислотным катализатором (т.е. этерификация). Предпочтительным спиртом является метанол. Кислотный катализатор может быть кислотой Бренстеда или кислотой Льюиса. Соответствующие кислоты Бренстеда включают, но не ограничиваются ими, толуолсульфоновую кислоту (TsOH), серную кислоту, соляную кислоту, фосфорную кислоту, уксусную кислоту, муравьиную кислоту, трифлатную кислоту, трифторуксусную кислоту или их комбинации. Соответствующие кислоты Льюиса содержат, но не ограничиваются ими, трехбромистый бор, оксид алюминия, тетраэтоксититан или их комбинации.
[0029] После реакции этерификации или переэтерификации реакционная смесь может содержать 50%, 55%, 60% или более соединения формулы 2 (где R2 является метокси) на основе числа молей соединения формулы 1, добавленных в реакционную смесь.
[0030] Когда используется реактор непрерывного фторирования, после реакции этерификации или переэтерификации реакционная смесь может содержать 50%, 55%, 60% или более соединения формулы 2 (где R2 является метокси) на основе числа молей соединения формулы 1, добавленных в реакционную смесь.
[0031] Превращение 2,3-дифторпропионовой кислоты или ее производных в α-фторакрилатный эфир или его производное может быть осуществлено с помощью удаления HF благодаря добавлению основания. Примеры оснований включают органические амины, такие как третичные амины (например, диметиланилин, триметиламин, 1,5-диазабицикло[4,3,0]нон-5-ен (DBN) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU)), алкоксиды, щелочные или щелочноземельные гидроксиды или их комбинации.
[0032] Для удаления HF используется стехиометрически эквивалентное основание на моль соединения формул 2 или 6. Обычно от 0,8 до 1,2 эквивалента основания используется для удаления HF.
[0033] Удаление HF может осуществляться, например, при температуре реакции от приблизительно -78°C до приблизительно 180°C; предпочтительная температура находится в диапазоне от приблизительно -20°C до приблизительно 55°C. Простые эфиры, галогензамещенные углеводороды и ароматические растворители могут использоваться в качестве растворителей для устранения реакции HF.
[0034] Если не указано иное, термин «алкокси», используемый отдельно или как часть другой группы, обозначает -OX радикал, где X определяется термином «алкил». Примерами алкокси-групп являются метокси, этокси, пропокси или 2-пропокси, н-, изо- или трет-бутокси и подобные им соединения.
[0035] Описанная здесь алкильная группа представляет собой необязательно замещенный линейный одновалентный углеводородный радикал, содержащий от одного до двадцати атомов углерода и предпочтительно от одного до двенадцати атомов углерода, или необязательно замещенный разветвленный насыщенный одновалентный углеводородный радикал, содержащий от трех до двадцати атомов углерода и предпочтительно от трех до восьми атомов углерода. Примеры незамещенных алкильных групп включают метил, этил, н-пропал, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил, изо-пентил, втор-пентил, трет-пентил и т.п.
[0036] Термин «замещенный», например, в выражении «замещенный алкил» и т.п., означает, что в рассматриваемой группе (т.е. алкильная или другая группа, следующая после термина) по меньшей мере один атом водорода, связанный с атомом углерода, замещается одной или несколькими замещающими группами, такими как гидрокси (-OH), алкилтио, фосфино, амидо (-CON(RA)(RB), где RA и RB независимо представляют собой водород, алкил или арил), амино (-N(RA)(RB), где RA и RB независимо представляют собой водород, алкил или арил), галоген (фтор, хлор, бром или йод), силил, нитро (-NO2), простой эфир (-ORA, где RA представляет собой алкил или арил), сложный эфир (-OC(O)RA, где RA представляет собой алкил или арил), кето (-C(O)RA, где RA представляет собой алкил или арил), гетероцикло и т.п. Когда термин «замещенный» вводит список возможных замещаемых групп, предполагается, что этот термин относится ко всем членам этой группы.
[0037] После подробного описания изобретения становится понятно, что модификации и варианты возможны без отклонения от сущности изобретения, определенной в данной патентной заявке.
ПРИМЕРЫ
[0038] Следующие неограничивающие примеры представлены для дополнительного иллюстрирования настоящего изобретения.
[0039] Общая процедура фторирования метилакрилата. Установка линии подачи фтора была описана в Organic Synthesis, Coll. Vol. 8, p. 286-295 (1993) Teruo Umemoto, Kyoichi Tomita and Kosuke Kawada. Вся работа была проведена с эффективным отсосом с помощью детектора фтористого газа в дымоуловителе. Цилиндр с предварительно смешанным 20% содержанием фтора в гелии был получен от компании Matheson Trigas, Inc. Реакция регулировалась с помощью ГХ/МС на колонке DB-5.
Пример 1: Общая процедура синтеза метил 2,3-дифторпропаноата (B)
[0040] 100 мл реакционную колбу с круглым дном наполняли метилакрилатом и растворителем. Систему продували гелием. Реакционную смесь охлаждали до -78°C на бане сухой лед/ацетон. Медленный поток 20% фтора в гелии вводили на дно колбы при интенсивном перемешивании. Расход настраивали на уровне 47,2 мл/мин (0,39 ммоль/мин) и поддерживали на этом уровне при температуре реакции -78°C в течение 2 часов. Затем реакционную смесь продували гелием и нагревали до комнатной температуры. Растворитель удаляли. ГХ/МС использовали для анализа реакции. Предполагая одинаковый коэффициент отклика для каждого соединения, смесь продукта содержала 46,8 масс.% требуемого продукта метил 2,3-дифторпропаноата (B), вместе с 4,5 масс.% исходного материала (A), 13,8 масс.% метил 2,3,3-трифторпропаноата (D), 11,7 масс.% фторметил 2,3,3-трифторпропаноата (E) и 23,2 масс.% фторметил 2,3-дифторпропаноата (C).
| Таблица 1Экспериментальные условия применения различных растворителей, температур и концентраций фтора | |||||||
| Эксперимент | Исходный материал | Количество (моль) | Растворитель | Темп. (°С) | F2 конц. | F2 эквив. | |
| 1 | А | 0,033 | ацетонитрил | 60 мл | -15 | 20% | 1,8 |
| 2 | А | 0,022 | ацетонитрил | 60 мл | -40 | 20% | 2,3 |
| 3 | А | 0,022 | дихлор-метан | 60 мл | -78 | 20% | 2,1 |
| 4 | А | 0,022 | пентафтор-бутан | 60 мл | -15 | 20% | 2,1 |
| 5 | А | 0,022 | 2H,3H-декафтор-пентан | 60 мл | -78 | 20% | 2,1 |
| 6 | А | 0,022 | 2H,3H-декафтор-пентан | 60 мл | -40 | 20% | 2,1 |
| 7 | А | 0,022 | 2H,3H-декафтор-пентан | 60 мл | -78 | 10% | 2,1 |
| Таблица 2Результаты применения различных растворителей, температур и концентраций фтора | |||||
| Эксперимент | Распределение продукта (% поверхности) | ||||
| A | B | C | D | E | |
| 1 | 45,8 | 13,4 | |||
| 2 | 63,1 | 11,8 | |||
| 3 | 61,8 | 18,4 | |||
| 4 | 12,9 | 27,1 | 4,2 | ||
| 5 | 14,9 | 35,5 | 18,4 | 14,5 | 11,5 |
| 6 | 3,1 | 33,6 | 20 | 18,5 | 14,6 |
| 7 | 28,4 | 37,9 | 15 | 11,1 | 7,6 |
| Таблица 3Экспериментальные условия использования различных добавок и комбинаций растворителяВсе реакции проводились при -78°С при 20% концентрации фтора в гелии | |||||
| Эксперимент | Исходный материал | Количество (моль) | Растворитель | F2 эквивалент | |
| 8 | А | 0,022 | 2H,3H-декафторпентан: этанол | 50 мл: 0,1мл | 2,5 |
| 9 | А | 0,022 | 2H,3H-декафторпентан: этанол | 60 мл: 1 мл | 2,5 |
| 10 | А | 0,022 | 2H,3H-декафторпентан: CF3SO3H | 50 мл: 0,5мл | 2,5 |
| 11 | А | 0,022 | 2H,3H-декафторпентан: метанол | 50 мл: 5мл | 2,5 |
| 12 | А | 0,022 | 2H,3H-декафторпентан: дихлорметан | 30 мл: 30мл | 2,5 |
| 13 | А | 0,022 | 2H,3H-декафторпентан: 2,2,2-трифторэтанол | 50 мл: 1мл | 2,5 |
| Таблица 4Результаты применения различных добавок и комбинаций растворителя | |||||
| Эксперимент | Распределение продукта (% поверхности) | ||||
| A | B | C | D | E | |
| 8 | 17,7 | 44,1 | 15,8 | 9,73 | 6,1 |
| 9 | 11,4 | 48,5 | 14 | 14,2 | 6,1 |
| 10 | 16,2 | 30,8 | 15,4 | 15,1 | 11,7 |
| 11 | 32,8 | 39,9 | 5,5 | 7,8 | |
| 12 | 27,2 | 13,5 | 1,6 | ||
| 13 | 33 | 37,7 | 11,3 | 9,8 | 6 |
Пример 2: Синтез 2,3-дифторпропионовой кислоты (G)
[0041] К раствору акриловой кислоты в 2H,3H-декафторпентане добавляли фторид натрия в качестве акцептора HF. Суспензию охлаждали до -78°C при интенсивном перемешивании. Фтор вводили в смесь при тех же условиях, что и в примере 1. После реакции смесь фильтровали и анализировали с помощью ГХ/МС.
Пример 3: Синтез метил 2,3-дифторпропаноата (B) с помощью акрилоилхлорида
[0042] К раствору акрилоилхлорида в 2H,3H-декафторпентане добавляли фторид натрия в качестве акцептора HF. Суспензию охлаждали до -78°C при интенсивном перемешивании. Фтор вводили в смесь при тех же условиях, которые были описаны в примере 1. После реакции смесь отфильтровывали. К фильтрату добавляли карбонат натрия (Na2CO3) с последующим добавлением метанола при температуре 0-4°С. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Смесь отфильтровывали и анализировали с помощью ГХ/МС.
Пример 4: Синтез 2,3-дифторпропаннитрила (L)
[0043] Раствор акрилонитрила в 2H,3H-декафторпентане охлаждали до -78°C. Фтор вводили в смесь при тех же условиях, которые были описаны в примере 1. После удаления растворителя смесь анализировали с помощью ГХ/МС.
| Таблица 5Условия экспериментов из примеров 2-4Все реакции проводились при -78°С при 20% концентрации фтора в гелии. | |||||
| Эксперимент | Исходный материал | Количество (моль) | Растворитель | F2 эквивалент | |
| 14 | F | 0,029 | 2H, 3H-декафторпентан | 50 мл | 1,6 |
| NaF (2,44 г, 0,058 моль) | |||||
| 15 | J | 0,025 | 2H, 3H-декафторпентан | 60 мл | 2,8 |
| NaF (2,1 г, 0,05 моль) | |||||
| 16 | K | 0,0304 | 2H, 3H-декафторпентан | 60 мл | 2,3 |
| Таблица 6Результаты использования различных исходных материалов | ||||
| Эксперимент | Распределение продукта (% поверхности) | |||
| 14 | F | G | H | I |
| 40,5 | 40 | 10,8 | 5,8 | |
| 15 | A | B | D | |
| 15,2 | 43,5 | 12,5 | ||
| 16 | K | L | M | |
| 38,2 | 24,3 | 10,7 |
Пример 5: Переэтерификация
[0044] К 2 мл раствора фторированной реакционной смеси добавляли метанол и катализатор. Реакционную смесь перемешивали при комнатной температуре в течение 48 часов и анализировали с помощью ГХ/МС.
| Таблица 7Результаты переэтерификации | |||||||
| Эксперимент | Катализатор | Количество | Распределение продукта (% поверхности) | ||||
| A | E | D | C | B | |||
| 17 | 18,35 | 7,06 | 10,42 | 14,17 | 35,37 | ||
| 18 | TsOH | 5 мг | 19,75 | 0,00 | 18,42 | 0,37 | 48,23 |
| 19 | DMAP | 10 мг | 19,54 | 0,00 | 18,46 | 1,72 | 46,75 |
| 20 | H2SO4 (98%) | 50 мкл | 19,23 | 0,00 | 17,74 | 0,51 | 47,63 |
[0045] К 2 мл раствора реакционной смеси от прямого фторирования добавляли ROH или метанол и катализатор. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов и анализировали с помощью ГХ/МС.
| Эксперимент | R | ROH | Распределение продукта (% поверхности) | ||
| N | O | B | |||
| 21 | Et | EtOH | 41,4 | 39 | |
| MeOH | 36,3 | 9 | 43,9 | ||
| 22 | n-Bu | n-BuOH | 47,1 | 43,7 | |
| MeOH | 38,3 | 7,6 | 28,2 |
Пример 6: Синтез метил 2,3-дифторпропаноата
[0046] Этилакрилат (2 мл) смешивали с 50 мл 2H,3H-декафторпентана и охлаждали на бане изопропанол/сухой лед (-78°C). Раствор обрабатывали фтором (20% в гелии) при расходе фтора 0,1 стандартных кубических фунтов в час (SCFH) в течение 120 минут. Продукт в виде сложного эфира с чрезмерным содержанием фтора переэтерифицировали путем добавления метанола или этанола и DMAP. Превращение составило приблизительно 60%. Наблюдение за дифторэтиловым эфиром и дифторметиловым эфиром проводили с помощью газовой хроматографии-масс-спектрометрии (ГХ/МС).
Пример 7: Синтез н-бутил 2,3-дифторпропаноата
[0047] н-Бутилакрилат (2 мл) смешивали с 50 мл 2H,3H-декафторпентана и охлаждали на бане изопропанол/сухой лед (-78°C). Раствор обрабатывали фтором (20% в гелии) при расходе фтора 0,1 SCFH в течение 120 минут. Продукт с чрезмерным содержанием фтора переэтерифицировали путем добавления метанола и DMAP. Превращение составило около 40%. н-Бутил 2,3-дифторпропаноат