Способ оценки защитной концентрации летучих ингибиторов коррозии в фазовой пленке влаги, формирующейся на поверхности металла
Иллюстрации
Показать всеИзобретение относится к электрохимическому способу оценки защитной концентрации летучих ингибиторов коррозии (ЛИК), которые абсорбируются в фазовой пленке влаги, формирующейся на поверхности металла. Способ включает в себя следующие этапы: определение весовым методом момента времени, к которому скорость коррозии на металлических образцах достигает постоянного значения, а концентрация летучего ингибитора становится достаточной для их противокоррозионной защиты (защитной); получение на дистиллированной воде, абсорбировавшей за этот момент времени летучий ингибитор в замкнутом объеме, раствора электролита; сопоставление поляризационных кривых этого электролита с поляризационными кривыми того же электролита с введенными в него заданными концентрациями летучего ингибитора. Техническим результатом является экспресс-оценка защитной концентрации ЛИК любой природы в фазовой пленке влаги на металле. 3 ил.
Реферат
Изобретение относится к электрохимическому способу для оценки защитной концентрации летучих ингибиторов коррозии в фазовой пленке влаги, формирующейся на поверхности металла.
В условиях атмосферной коррозии на поверхности корродирующего металла формируется фазовая пленка влаги, в которой абсорбируются присутствующие в воздухе агрессивные микропримеси (H2S, SO2, НСl и др.) (Михайловский Ю.Н., Агафонов В.В., Санько В.А. Физико-математическое моделирование коррозии стали в атмосферных условиях // Защита металлов. 1977. Т. 13. №5. С. 515-522; Панченко Ю.М., Ковтанюк В.В., Николаева Л.А. Долгосрочное прогнозирование коррозионных массопотерь пластин и проволочных спиралей технически важных металлов в различных регионах мира. Ч.1. Связь параметра, характеризующего защитные свойства продуктов с агрессивностью атмосферы. // Коррозия: материалы, защита. 2013. №7. С. 1-7). Именно эта фазовая пленка определяет коррозионные потери и разрушение металла в атмосферных условиях (Михайлов Α.Α., Стрекалов П.В. Моделирование атмосферной коррозии металлов в виде функции «доза-ответ» // Коррозия: материалы, защита. 2006. №3. С. 2-13) Летучие ингибиторы коррозии металлов, абсорбируясь в такой поверхностной фазовой пленке влаги, предотвращают этот процесс.
Однако до сих пор отсутствуют методы оценки защитной концентрации летучих ингибиторов коррозии (ЛИК), адсорбирующихся в таких пленках. Подобные публикации отсутствуют как в отечественной, так и в зарубежной литературе (Landolfo R., Cascini L, Portion F. Modeling of Metal Structure Corrosion Damage. A. State of the Art Report // Sustain ability. 2010. №2. P. 2163-2175). Нет и подобных нормативных документов (EN/ISO / 9223. Corrosion of metal sand alloys: corrosivity of atmospheres: Classification; European Committee for Standardication (CEN); Brussels. Belgium. 1992; EN ISO /9226/ corrosion of atmospheres: Determination of corrosion rate of standart specimen for the evolution of corrosivity; European committee for standardization (CEN): Brussels. Belgium. 1992).
Подобная ситуация приводит к тому, что пользователи ЛИК просто вводят их больше массы в закрытые атмосферы, предполагая, что заведомо избыток ингибиторов позволит достичь их максимально защитной концентрации в атмосфере и фазовой поверхностной пленке влаги. Кроме того, отсутствует прямой метод определения промежутка времени от начала ввода ЛИК, за который достигается эта защитная концентрация. С этой целью используются косвенные весовые оценки скорости коррозии, длительные и весьма затратные.
Цель изобретения - экспресс-оценка защитной концентрации ЛИК любой природы в фазовой пленке влаги на металле.
Нами предлагается прямой электрохимический способ подобной оценки защитной концентрации ЛИК в фазовой пленке влаги на поверхности корродирующего металла и времени ее достижения после введения ингибиторов в замкнутую атмосферу. Способ можно использовать независимо от природы ЛИК и корродирующего металла. С некоторыми ограничениями его можно применять и при отличной от 100%-ной влажности воздуха, о чем подробнее указано в описании способа.
В герметичные емкости, в качестве которых можно использовать эксикаторы, на подставках из не набухающего материала с использованием капроновых нитей, подвешивают испытуемые образцы из исследуемого металла (сталь, медь, латунь и т.д.) в количестве 6 штук или более. Одновременно на дно эксикаторов ставят две емкости. В одну из них наливают дистиллированную воду, позволяющую создать в объеме паровой фазы 100%-ную относительную влажность. Эта емкость должна легко вмещать 200-300 см3 жидкости. Если проводят испытания при любой другой заданной относительной влажности (Н), то вместо дистиллированной воды в емкость наливают раствор, создающий заданную величину Η (Краткий справочник химика (составитель В.И. Перельман, под общей редакцией Б.В. Некрасова, М.: ГНТИ химической литературы. 1956. 56 с.). Например, насыщенный раствор NaCl позволяет получить относительную влажность, равную 75% в интервале температур 10-30°С; насыщенный раствор NH4Cl - (79±1)% в интервале температур 20-30°С, насыщенный раствор Na2CO3⋅10Н2О - (89±2)% в том же температурном интервале. Во вторую емкость помещают 25-50 г летучего ингибитора. Целесообразно использовать несколько эксикаторов, например четыре. Их необходимое количество станет ясно из последующего изложения.
Помимо этого проводят холостой опыт. С этой целью в пятый эксикатор подвешивают 24 образца из того же металла (либо используют 2 эксикатора по 12 образцов) и помещают емкость с дистиллированной водой или солевой раствор, если изучение эффективности ЛИК проводят при величине Η<100%. Емкость с ингибитором в этот эксикатор не помещают, то есть в нем образцы металла выступают в роли образцов-свидетелей.
В первом эксикаторе коррозионное воздействие среды продолжают 7 суток, во втором - 14 суток, в третьем 21 сутки и в четвертом - 28 суток. После этого из первого эксикатора извлекают образцы металла (желательно не менее 6 штук) для проведения статистической обработки посредством метода малых выборок (Физико-химические методы анализа (практическое руководство). Под редакцией В.Б. Алексовского и К.Б. Яцимирского. Л.: Химия. 1971. 424 с.) и определяют его скорость коррозии по известной формуле: (Цыганкова Л.Е., Вигдорович В.И., Поздняков А.П. Введение в теорию коррозии металлов. Тамбов: Издательство ТГУ им. Г.Р. Державина. 2002. 311 с.):
Ki=(m0, i-mi)/S⋅τ,
где m0, i - и mi - исходная и после коррозии и снятия продуктов окисления масса i-гo образца, S - его площадь и τ - продолжительность коррозионных испытаний. Величины К обычно приводят в г/(м2⋅ч). Затем находят среднюю с учетом всех образцов(i в формуле в нижнем индексе - номер образца).
Из этого же эксикатора извлекают емкость с водным раствором, который образуется в результате абсорбции ингибитора в исходной дистиллированной воде.
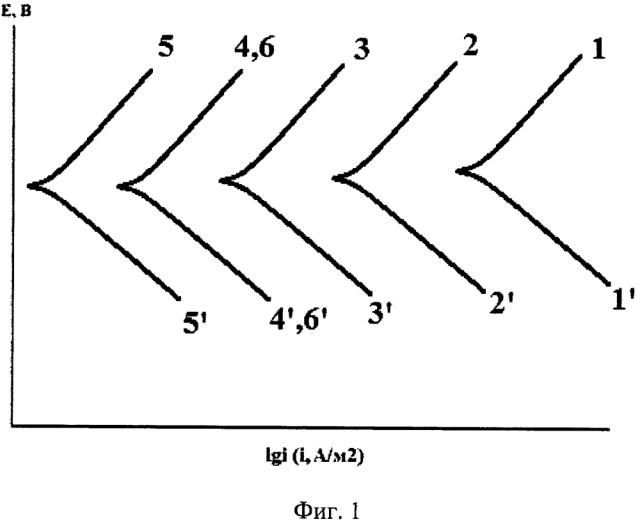
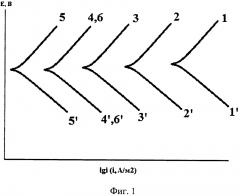
В этот раствор добавляют твердый хлорид натрия (квалификация не ниже ч.д.а.) в количестве, необходимом для получения 0,1 Μ концентрации, и в нем снимают поляризационные кривые потенциодинамическим методом со скоростью развертки потенциала порядка 0,66-1,00 мВ/с. Дополнительно готовят серию стандартных 0,1 Μ растворов NaCl, содержащих 5, 20, 50, 150, 500 мг/л исследуемого ингибитора, и также снимают поляризационные кривые при той же скорости развертки потенциала. Их наносят на единый график в полулогарифмических координатах Е, lgi, где Е и i - соответственно, потенциал электрода и плотность поляризующего тока, А/м2.
При этом возможны следующие варианты:
1. Ингибитор замедляет катодную и анодную реакции. Тогда катодные ветки поляризационных кривых в его присутствии смещаются в область отрицательных, а анодные - положительных потенциалов. Соответственно, снижается и скорость коррозии. Подобный случай показан на фиг. 1. Совпадение кривых 4 и 6 (4' и 6'), фиг. 1 указывает, что концентрация ЛИК в растворе, полученном адсорбцией ингибитора, равна или близка к 50 мг/л.
2. Ингибитор ускоряет катодную реакцию на корродирующем металле и замедляет анодную. В этом случае с ростом концентрации ингибитора катодная и анодная ветви поляризационной кривой сдвигаются в область положительных потенциалов. Но протекание коррозии лимитируется кинетикой анодной реакции, так как снижается скорость коррозии металла. Этот случай показан на фиг. 2. Из фиг. 2 следует совпадение поляризационных кривых под номерами 4' и 6', следовательно, концентрация ингибитора в растворе, образованном в результате его абсорбции, вновь равна или близка к 50 мг/л.
Возможен и третий случай, наблюдающийся правда сравнительно редко, когда ингибитор замедляет катодную реакцию и ускоряет анодную. Тогда катодная и анодная ветви поляризационных кривых смещаются в область более отрицательных потенциалов. Подход к оценке концентрации адсорбированного ингибитора в этом случае не меняется. Поэтому этот вариант специально не интерпретирован, как не несущий дополнительной информации.
Конечно, определить концентрацию абсорбированного ингибитора можно и посредством химического анализа раствора. Но это, как правило, возможно, если ингибитор представляет собой индивидуальное соединение, что бывает достаточно редко. В подавляющем большинстве случаев ЛИК представляют собой синергетические смеси. Предлагаемый нами способ является универсальным. На него не накладываются, как ранее отмечалось, ограничения, обуславливаемые природой и составом изучаемых ЛИК и природой металлической фазы.
Если же химический анализ может быть использован при оценке концентрации ЛИК, то это целесообразно делать в том случае, когда для создания необходимой относительной влажности используются солевые растворы.
Процедуры, связанные с использованием образцов металла и раствора, взятые из первого эксикатора, не позволяют решить, является ли найденная концентрация ЛИК текущей или равновесной, и тем более понять, являются создаваемые ею условия защиты максимально достижимыми. Для этого и используются результаты, которые можно оценить с использованием данных, получаемых после обработки образцов и растворов, находящихся в трех оставшихся эксикаторах.
С этой целью через указанные выше промежутки времени извлекаются образцы из остальных эксикаторов и рассчитывают скорости коррозии за соответствующие промежутки времени (14, 21 и 28 суток). Выясняют, к какому моменту времени скорость коррозии достигает постоянного значения либо ее снижение становится незначительным (величина ΔΖ составляет 1% и менее).
Из этих эксикаторов извлекают также растворы, полученные абсорбцией летучего ингибитора дистиллированной водой, и вводят в них твердый хлористый натрий для получения 0,1 Μ растворов.
В растворах, абсорбирующих ингибитор, соответствующий каждому эксикатору (продолжительности коррозии), определяют его концентрацию. С этой целью вновь строят графики типа показанных на фиг. 1 или 2 и определяют Синг, обусловливающего максимальную величину Ζ. Если концентрация ЛИК в стандартных (модельных) растворах оказывается недостаточной, то готовят дополнительные среды с большей Синг вплоть до равновесной величины. Последняя достигается, в частности, в том случае, когда после введения ингибитора и его растворения образуется осадок, либо для этого используются иные широко известные методы.
Концентрация ингибитора, позволяющая получить максимальную величину защитного действия, остается той же и в фазовой поверхностной пленке (ФПП) влаги, так как свойства воды в объеме жидкой фазе и в ФФП одинаковы (Стрекалов В.П. Атмосферная коррозия металлов под полимолекулярными адсорбционными слоями влаги. Обзор. // Защита металлов. 1998. Т. 34. №6. С. 565-584). Наличие хлорид-ионов может только несколько повысить эту предельную величину (Синг, пред), позволяющую достичь максимального значения Ζ, создавая, тем самым, определенный коэффициент запаса для коррозии в реальных условиях.
Таким образом, предлагаемый способ позволяет оценить и расходные коэффициенты ЛИК с учетом давления их насыщенного пара, защищаемой поверхности металла и толщин фазовых пленок влаги.
Оценим защитную концентрацию ингибитора ИФХАН-118, созданного на основе соли ароматического амина, при коррозии углеродистой стали Ст3 в условиях 100%-ной относительной влажности.
Согласно данным весовых испытаний в закрытой атмосфере (эксикатор) при 100%-ной влажности наблюдается следующая зависимость защитного действия от времени.
Таким образом, за 4 недели в растворе достигается защитная концентрация ингибитора ИФХАН-118.
Данные потенциодинамических поляризационных измерений в растворе после 4 недель адсорбции ингибитора в модельных средах (0,1 Μ NaCl) со скоростью развертки 0,66 мВ/с приведены на фиг. 3.
Анализ относительного расположения катодных и анодных ветвей потенциодинамических поляризационных кривых показывает, что ингибитор ИФХАН-118 замедляет анодную реакцию и ускоряет катодную (фиг. 3). Следовательно, кинетика анодного процесса лимитирует скорость коррозии. В присутствии 50 мг/л ИФХАН-118 анодная реакция тормозится слабее, чем в растворе, адсорбировавшем ингибитор (фиг. 3, кривые 2 и 4). В присутствии 150 мг/л ИФХАН-118 поляризационные ветви кривых 2 и 5 фиг. 3 полностью совпадают. В присутствии 500 мг/л ингибитора наблюдается снижение торможения анодной реакции (кривые 2 и 6 фиг. 3). Таким образом, в фазовой поверхностной пленке влаги максимальным защитным действием обладает летучий ингибитор ИФХАН-118 в концентрации 150 мг/л.
Но это не значит, что данная концентрация этого летучего ингибитора позволяет достичь максимального защитного эффекта и на других металлических конструкционных материалах. Предложенный способ показал, что, например, при коррозии латуни Л62 (сплав с α+β фазами сплавов, содержащий, масс. %: Zn-22,5; Mn-2,9; Fe-2,8, Αl - 4,1 и Cu-67,7) в тех же условиях максимальная защита (85±0,5%) достигается в присутствии 5 мг/л ИФХАН-118. Повышение этой концентрации в пленке не увеличивает значение защитной эффективности.
Способ оценки защитной концентрации летучих ингибиторов коррозии в фазовой пленке влаги, формирующейся на поверхности металла, заключающийся в сопоставлении поляризационных кривых, полученных на металле в электролите на основе дистиллированной воды, абсорбировавшей летучий ингибитор коррозии (ЛИК) в момент времени, когда скорость коррозии металла, находящегося с ней в едином замкнутом объеме, стала постоянной, с поляризационными кривыми того же электролита с введенными в него заданными концентрациями ЛИК.