Элементы рекомбинантной днк для экспрессии рекомбинантных белков в клетке-хозяине
Иллюстрации
Показать всеНастоящая группа изобретений относится к биотехнологии. Предложены рекомбинантный бакуловирус для экспрессии рекомбинантного белка, вектор переноса, клонирующий вектор и последовательность нуклеиновой кислоты, подходящие для получения указанного бакуловируса, и их применение, а также клетка-хозяин и способ продукции рекомбинантного белка. Предложенный рекомбинантный бакуловирус содержит последовательность нуклеиновой кислоты, обеспечивающую экспрессию белков IE-1 или IE-0 на уровне, превышающем эндогенный уровень, рекомбинантную гомологичную область в качестве энхансерной области, функционально связанную с промотором, и последовательность нуклеиновой кислоты, кодирующую рекомбинантный белок. Строение предложенного бакуловируса обеспечивает повышенный уровень экспрессии целевого рекомбинантного белка. Предложенная группа изобретений может быть использована для получения рекомбинантных белков с использованием бакуловирусных векторных систем экспрессии в клетках насекомых. 9 н. и 8 з.п. ф-лы, 10 ил., 1 табл., 16 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение может быть отнесено к области биотехнологии и охватывает нуклеотидные последовательности, содержащие, например, промоторы, гомологичные области (hr) в качестве энхансеров, а также последовательности, кодирующие регуляторы транскрипции, например, кДНК бакуловируса Ас-ie-01, или любые их комбинации, которые способны повысить качество и эффективность продукции рекомбинантных белков. Кроме того, настоящее изобретение также относится к самим векторам, содержащим вышеупомянутые нуклеотидные последовательности в соответствии с изобретением, клетки, инфицированные, трансформированные или трансфицированные указанными последовательностями или векторами, и способы продукции белковое применением вышеуказанных последовательностей, векторов или клеток.
УРОВЕНЬ ТЕХНИКИ
Бакуловирусная векторная система экспрессии (BEVS) является общепринятым способом продукции рекомбинантных белков для применения в качестве вакцин, терапевтических молекул или диагностических реагентов. Благодаря своему потенциалу сверхэкспрессии и быстрой разработки BEVS является одним из самых привлекательных вариантов для продукции рекомбинантных белков для любых целей. Бакуловирусы, наиболее часто применяемые в промышленности для экспрессии рекомбинантных белков, основаны на вирусе многоядерного полиэдроза Autographa californica (AcMNPV) и клетках насекомых Spodoptera frugiperda 9 (Sf9) или 21 (Sf21) в качестве подходящего хозяина для экспрессии (1), а также личинках насекомых Trichoplusia ni (m.ni) в качестве живых биофабрик (2). Со времени разработки BEVS в 80-х годах (3) в клетках насекомых, инфицированных бакуловирусами, успешно продуцированы сотни рекомбинантных белков, начиная от цитозольных ферментов до мембрано-связанных белков.
Предпринимались усилия для увеличения производительности BEVS (4). Доступен ряд векторов переноса для конструирования рекомбинантных бакуловирусов, кодирующих постоянные гибридные белки, которые, по сообщениям, улучшают экспрессию белков, в том числе мальтоза-связывающий белок, глутатион S-трансферазу, SUMO и последовательность удерживания KDEL. Другие попытки исследований, связанных с улучшением стабильности экспрессированных белков, были направлены на два гена в геноме бакуловируса, которые не являются необходимыми для роста вируса в культуре клеток, а именно chiA (хитиназа) и cath (катепсин). Делеция ChiA, по-видимому, улучшает продукцию секретируемых белков за счет накопления белка в эндоплазматическом ретикулуме и процессинга белков посредством секреторных путей клеток. Кроме того, в улучшение стабильности продуктов chiA--вирусов может вносить вклад предотвращение образования катепсиновых протеаз. С целью повышения продуктивности бакуловирусов недавно были разработаны новые линии клеток насекомых, например, линии клеток Т. ni High-Five™ (Hi-5) или BTI-TnAo38, обеспечивающие значительное повышение итогового количества выделяемых гетерологичных белков (5, 6).
Ускорение экспрессии рекомбинантных белков, при котором экспрессия белка происходила бы до серьезного нарушения механизмов клеток насекомых бакуловирусной инфекцией, могло бы представлять собой важное усовершенствование BEVS. Поздняя экспрессия, управляемая обычными сильными вирусными промоторами генов polyhedrin (polh) или p10, обладает серьезными недостатками в виде посттрансляционных модификаций чужеродных белков. Описаны характеристики бакуловирусных промоторов, обеспечивающих более раннюю экспрессию, чем традиционно используемые промоторы polh или p10; указанные промоторы применяются для продукции гетерологичных белков, однако демонстрируют более низкую производительность (7).
Еще одной возможностью усовершенствования BEVS могло бы быть повышение сохранения целостности клеток на поздних стадиях после инфицирования путем снижения гибели клеток, вызванной вирусом. Ослабление тяжелых повреждений механизмов клеток насекомых на поздних стадиях после инфицирования, вызванных BEVS, должно не только увеличить время продукции и накопления рекомбинантных белков (секретируемых или нет), но и предоставить больше времени на фолдинг сложных белков или посттрансляционные модификации продуцируемых белков.
Установлено, что некоторые элементы ДНК бакуловирусов участвуют в активации поздней экспрессии генов факторов, необходимых для размножения вируса. Одним из них является немедленный ранний (ie) белок IE-1 и его сплайс-вариант IE-0 из AcMNPV (вируса многоядерного полиэдроза Autographa californica). Трансляция мРНК AcMNPV, кодируемой геном Ас-ie-01, приводит к получению IE-0 и IE-1 вследствие внутренней инициации трансляции. Оба указанных соединения считаются критическими медиаторами экспрессии бакуловирусных генов из-за их способности выступать в качестве регуляторов транскрипции (8). AcMNPV IE-1 является 67-кДа димерным ДНК-связывающим белком, синтезирующимся на самых ранних стадиях инфекции и стимулирующим транскрипцию в анализах трансфекции плазмид за счет активности его N-концевого кислого домена (9, 10). IE-1 накапливается в ядре, где его концентрация поддерживается на поздних стадиях (11). Трансактивация за счет IE-1 усиливается посредством его связывания в виде гомодимера с последовательностями гомологичной области (hr) бакуловируса, действующими в качестве энхансеров транскрипции и сайтов начала репликации вирусной ДНК. AcMNPV IE-0 - 72,6-кДа белок из 636 аминокислот, причем 38 аминокислот в его составе кодируются orf141 (экзон 0), 16 аминокислот - вышележащим нетранслируемым лидером ie1 и 582 аминокислоты представляют собой полный белок IE-1. Поэтому конечный продукт идентичен IE-1, за исключением дополнительных 54 аминокислот, присоединенных с N-конца. Предположительно из-за их общей последовательности, IE-0 и IE-1 обладают одинаковой биохимической активностью, включая связывание hr-энхансера и регуляцию транскрипции.
Существует потребность в новых альтернативных BEVS, обеспечивающих а) усиленную экспрессию по сравнению с коммерческими BEVS, которые используют промоторы polh или р10 и b) долгосрочную экспрессию в бакуловирусной системе путем снижения вирус-индуцированного повреждения клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены продукты и способы улучшения экспрессиии рекомбинантных белков с помощью BEVS.
Следующие элементы являются предпочтительными вариантами реализации, поскольку обеспечивают указанную улучшенную экспрессию:
1. Рекомбинантный бакуловирус, содержащий последовательность нуклеиновой кислоты, обеспечивающую экспрессию белков IE-1, IE-0 и/или их фрагментов, функционирующих в качестве регуляторов транскрипции, на уровне, превышающем эндогенный уровень, причем нуклеиновая кислота выбрана из группы, состоящей из:
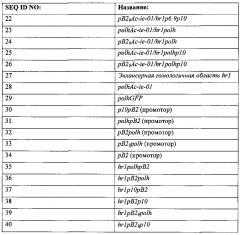
(а) нуклеиновой кислоты, содержащей нуклеотидную последовательность, указанную в любой из SEQ ID NO: 1-5;
(b) последовательности нуклеиновой кислоты, обладающей по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательность, указанной в любой из SEQ ID NO: 1-5 и кодирующей белок, который может функционировать как регулятор транскрипции в рекомбинантном бакуловирусе;
(c) последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, содержащую аминокислотную последовательность, указанную в любой из SEQ ID NO: 6-9; и
(d) последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, обладающую по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% сходством с аминокислотной последовательностью, указанной в любой из SEQ ID NO: 6-9 и способной функционировать как регулятор транскрипции в рекомбинантном бакуловирусе.
2. Рекомбинантный бакуловирус по пункту 1, дополнительно содержащий по меньшей мере одну рекомбинантную гомологичную область (hr) в качестве энхансерной области, функционально связанную с любым промотором, подходящим для управления экспрессией рекомбинантных белков.
3. Рекомбинантный бакуловирус по пункту 2, отличающийся тем, что рекомбинантная гомологичная область (hr) является последовательностью, указанной в SEQ ID NO: 27 (hr1).
4. Рекомбинантный бакуловирус по пункту 2 или 3, отличающийся тем, что промотор, функционально связанный с гомологичной областью (hr), выбран из группы нуклеиновых кислот, включающей:
(а) нуклеиновую кислоту, содержащую нуклеотидную последовательность, указанную в любой из SEQ ID NO: 10-16; и
(b) последовательность нуклеиновой кислоты, способную функционировать в качестве промотора в рекомбинантном бакуловирусе и обладающую по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательностью, указанной в любой из SEQ ID NO: 10-16.
5. Рекомбинантный бакуловирус по любому из пунктов 1-4, содержащий последовательность нуклеиновой кислоты, содержащую комбинации рекомбинантных промоторов, последовательностей, кодирующих регуляторы транскрипции, и энхансерных областей, выбранных из группы, включающей SEQ ID NO: 17-26.
6. Рекомбинантный бакуловирус по любому из пунктов 1-5, дополнительно содержащий последовательность нуклеиновой кислоты, кодирующую рекомбинантный белок, причем указанная нуклеотидная последовательность функционально связана с нуклеотидной последовательностью, выбранной из, группы, состоящей из нуклеотидных последовательностей по пунктам 1-5.
7. Вектор переноса, подходящий для получения рекомбинантного бакуловируса по любому из пунктов 1-6, содержащий указанную последовательность для экспрессии белков IE-0, IE-1 и/или их фрагментов, функционирующих в качестве регуляторов транскрипции, на уровне, превышающем эндогенный уровень, дополнительно содержащую нуклеотидную последовательность, подходящую для интеграции или транспозиции в бакуловирус.
8. Вектор переноса по пункту 7, дополнительно содержащий по меньшей мере одну рекомбинантную гомологичную область (hr) в качестве энхансерной области, функционально связанную с любым промотором, подходящим для управления экспрессией рекомбинантных белков.
9. Вектор переноса по пункту 8, отличающийся тем, что рекомбинантная гомологичная область (hr) является последовательностью, указанной в SEQ ID NO: 27 (hr1).
10. Вектор переноса по пункту 8 или 9, отличающийся тем, что промотор, функционально связанный с гомологичной областью (hr), выбран из группы нуклеиновых кислот, включающей:
(a) нуклеиновую кислоту, содержащую нуклеотидную последовательность, указанную в любой из SEQ ID NO: 10-16; и
(b) нуклеотидной последовательности, способной функционировать в качестве промотора в рекомбинантном бакуловирусе и обладающей по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательностью, указанной в любой из SEQ ID NO: 10-16.
11. Вектор переноса по любому из пунктов 7-10, содержащий последовательность нуклеиновой кислоты, содержащую комбинации рекомбинантных промоторов, последовательностей, кодирующих регуляторы транскрипции, и энхансерных областей, выбранных из группы, включающей SEQ ID NO: 17-26.
12. Вектор переноса по любому из пунктов 7-11, дополнительно содержащий последовательность нуклеиновой кислоты, кодирующую рекомбинантный белок, причем указанная нуклеотидная последовательность функционально связана с нуклеотидной последовательностью, выбранной из группы, состоящей из нуклеотидных последовательностей по пунктам 7-11.
13. Вектор переноса по любому из пунктов 7-11, не содержащий последовательности нуклеиновой кислоты, кодирующей рекомбинантный белок.
14. Вектор переноса по любому из пунктов 7-13, характеризующийся тем, что указанный вектор переноса является бакмидой.
15. Вектор переноса по любому из пунктов 7-14, характеризующийся тем, что указанный вектор переноса является производным любой из бакуловирусных систем экспрессии «Bac-to-Bac®» (invitrogen™), «BacPAK™» (Clontech™), «FlashBAC™» (Oxford Expression Technologies™), «BacuVance™» (GenScript™), «Вас-N-Blue DNA™» (invitrogen™), «BaculoDirect™» (invitrogen™), «BacVector®» 1000, 2000, 3000 (Novagen®), «DiamondBac™» (Sigma-Aldrich®) или» BaculoGold™» (BD biosciences™).
16. Клонирующий вектор, подходящий для получения рекомбинантного бакуловируса или вектора переноса по любому из пунктов 1-15, содержащий указанную последовательность для экспрессии белков IE-0, IE-1 и/или их фрагментов, функционирующих в качестве регуляторов транскрипции, на уровне, превышающем эндогенный уровень, который также подходит для репликации у бактерий.
17. Клонирующий вектор по пункту 16, дополнительно содержащий по меньшей мере одну рекомбинантную гомологичную область (hr) в качестве энхансерной области, функционально связанную с любым промотором, подходящим для управления экспрессией рекомбинантных белков.
18. Клонирующий вектор по пункту 17, отличающийся тем, что рекомбинантная гомологичная область (hr) является последовательностью, указанной в SEQ ID NO: 27 (hr1).
19. Клонирующий вектор по пункту 17 или 18, отличающийся тем, что промотор, функционально связанный с гомологичной областью (hr), выбран из группы нуклеиновых кислот, включающей:
(a) нуклеиновую кислоту, содержащую нуклеотидную последовательность, указанную в любой из SEQ ID NO: 10-16; и
(b) нуклеотидной последовательности, способной функционировать в качестве промотора в рекомбинантном бакуловирусе и обладающей по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательностью, указанной в любой из SEQ ID NO: 10-16.
20. Клонирующий вектор по любому из пунктов 16-19, содержащий последовательность нуклеиновой кислоты, содержащую комбинации рекомбинантных промоторов, последовательностей, кодирующих регуляторы транскрипции, и энхансерных областей, выбранных из группы, включающей SEQ ID NO: 17-26.
21. Клонирующий вектор по любому из пунктов 16-20, дополнительно содержащий последовательность нуклеиновой кислоты, кодирующую рекомбинантный белок, причем указанная нуклеотидная последовательность функционально связана с нуклеотидной последовательностью, выбранной из группы, состоящей из нуклеотидных последовательностей по пунктам 16-20.
22. Клонирующий вектор по любому из пунктов 16-20, не содержащий последовательности нуклеиновой кислоты, кодирующей рекомбинантный белок.
23. Нуклеотидная последовательность, подходящая для получения рекомбинантного бакуловируса, вектора переноса или клонирующего вектора по любому из пунктов 1-22, содержащая указанную последовательность для экспрессии белков IE-0, IE-1 и/или их фрагментов, функционирующих в качестве регуляторов транскрипции, на уровне, превышающем эндогенный уровень.
24. Нуклеотидная последовательность по пункту 23, дополнительно содержащая по меньшей мере одну рекомбинантную гомологичную область (hr) в качестве энхансерной области, функционально связанную с любым промотором, подходящим для управления экспрессией рекомбинантных белков.
25. Нуклеотидная последовательность по пункту 24, отличающаяся тем, что рекомбинантная гомологичная область (hr) является последовательностью, указанной в SEQ ID NO: 27 (hr1).
26. Нуклеотидная последовательность по пункту 24 или 25, отличающаяся тем, что промотор, функционально связанный с гомологичной областью (hr), выбран из группы нуклеиновых кислот, включающей:
(a) нуклеиновую кислоту, содержащую нуклеотидную последовательность, указанную в любой из SEQ ID NO: 10-16; и
(b) нуклеотидной последовательности, способной функционировать в качестве промотора в рекомбинантном бакуловирусе и обладающей по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательностью, указанной в любой из SEQ ID NO: 10-16.
27. Нуклеотидная последовательность по любому из пунктов 23-26, содержащая нуклеотидную последовательность, содержащую комбинации рекомбинантных промоторов, последовательностей, кодирующих регуляторы транскрипции, и энхансерных областей, выбранных из группы, включающей SEQ ID NO: 17-26.
28. Нуклеотидная последовательность по любому из пунктов 23-27, дополнительно содержащая нуклеотидную последовательность, кодирующую рекомбинантный белок, причем указанная нуклеотидная последовательность функционально связана с нуклеотидной последовательностью, выбранной из группы, состоящей из нуклеотидных последовательностей по пунктам 23-27.
29. Нуклеотидная последовательность по любому из пунктов 23-27, не содержащая последовательности нуклеиновой кислоты, кодирующей рекомбинантный белок.
30. Клетка-хозяин, инфицированная, трансфицированная, трансдуцированная иди трансформированная рекомбинантным бакуловирусом, вектор переноса, клонирующим вектором или нуклеотидной последовательностью по любому из пунктов 1-29.
31. Инфицированная, трансфицированная, трансдуцированная или трансформированная клетка-хозяин по пункту 30, характеризующаяся тем, что является линией клеток насекомого.
32. Инфицированная, трансфицированная, трансдуцированная или трансформированная клетка-хозяин по пунктам 30 или 31, характеризующаяся тем, что происходит от насекомого, принадлежащего к роду Lepidoptera или Diptera.
33. Инфицированная, трансфицированная, трансдуцированная или трансформированная клетка-хозяин по любому из пунктов 30-32, характеризующаяся тем, что происходит от Trichoplusia ni, Spodoptera frugiperda, Ascalapha odorata, Bombyx mori, Drosophila melanogaster или Aedes aegypti..
34. Инфицированная, трансфицированная, трансдуцированная или трансформированная клетка-хозяин по любому из пунктов 30-33, характеризующаяся тем, что является линией клеток, выбранной из группы, состоящей из Hi-5™, Sf9, Sf21, BTI-Tn5B-1, Tn368, ExpresSf+®, BTI-TnAo38, АТС-10 и линии Шнайдера 2 Drosophila.
35. Культуральная среда, содержащая рекомбинантный бакуловирус, вектор переноса, клонирующий вектор или нуклеотидную последовательность по любому из пунктов 1-29.
36. Способ продукции рекомбинантного белка, включающий инфицированную, трансфицированную, трансдуцированную или трансформированную клетку-хозяина по пунктам 30-34 и выделение, и очистку рекомбинантного белка общепринятыми средствами.
37. Способ продукции рекомбинантного белка по пункту 36, отличающийся тем, что рекомбинантный белок выбран из группы, включающей субъединичную мономерную вакцину, субъединичную мультимерную вакцину, вирусоподобную частицу, терапевтический белок, антитело, фермент, цитокин, фактор свертывания крови, антикоагулянт, рецептор, гормон и диагностический белковый реагент.
38. Применение вектора переноса по любому из пунктов 7-15 для получения рекомбинантного бакуловируса по любому из пунктов 1-6.
39. Применение клонирующего вектора по любому из пунктов 16-22 для получения рекомбинантного бакуловируса или вектора переноса по любому из пунктов 1-15.
40. Применение нуклеотидной последовательности по любому из пунктов 23-29 для получения рекомбинантного бакуловируса, вектора переноса или клонирующего вектора по любому из пунктов 1-22.
41. Трансгенная линия клеток, содержащая трансген, который является нуклеиновой кислотой, выбранной из группы, состоящей из:
(a) нуклеиновой кислоты, содержащей нуклеотидную последовательность, указанную в любой из SEQ ID NO: 1-5;
(b) последовательности нуклеиновой кислоты, обладающей по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательностью, указанной в любой из SEQ ID NO: 1-5 и кодирующей белок, который может функционировать как регулятор транскрипции в рекомбинантном бакуловирусе;
(c) последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, содержащую аминокислотную последовательность, указанную в любой из SEQ ID NO: 6-9; и
(d) последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, обладающую по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% сходством с аминокислотной последовательностью, указанной в любой из SEQ ID NO: 6-9 и способной функционировать как регулятор транскрипции в рекомбинантном бакуловирусе.
42. Трансгенная линия клеток по пункту 41, происходящая из насекомого, птицы или млекопитающего.
43. Способ продукции рекомбинантного белка, включающий выращивание трансгенной линии клеток по пункту 41 или 42 и выделение и очистку рекомбинантного белка общепринятыми средствами.
44. Последовательность нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, функционирующую в качестве промотора в рекомбинантном бакуловирусе, причем указанная нуклеотидная последовательность выбрана из группы, состоящей из:
(a) нуклеиновой кислоты, содержащей нуклеотидную последовательность, указанную в SEQ ID NO: 12, 14 или 15; и
(b) последовательности нуклеиновой кислоты, обладающей по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с нуклеотидной последовательностью, указанной в SEQ ID NO: 12, 14 или 15;
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Схематическое представление элементов рекомбинантной ДНК бакуловируса в соответствии с изобретением, содержащей четыре основных элемента: последовательность, кодирующую регуляторы транскрипции (А; например, IE0 и IE1), экспрессия которых управляется промотором (В; например, polh или рВ29); последовательность энхансерной гомологичной области (hr) (С; например, hr1), расположенную выше промоторов (D; например, p10, polh, рВ29р10 или р6.9р10), управляющих экспрессией чужеродного гена, кодирующего рекомбинантный белок. На схеме показан теоретический механизм взаимодействия между элементами рекомбинантной ДНК в соответствии с настоящим изобретением, приводящий к беспрецедентной сверхэкспрессии рекомбинантного белка.
Фигура 2: Различные стратегии, которые приводят к получению рекомбинатных бакуловирусов с помощью системы клонирования «Bac-to-Bac®» (invitrogen™).
Фигура 3: Общая схема получения клонирующих, донорных векторов и векторов переноса, совместимых с другими коммерческими технологиями, используемыми для создания рекомбинантных бакуловирусов.
Фигура 4: А) Флуориметрические анализы для измерения наработки белка GFP, накапливаемого в инфицированных клетках Sf21 в разное время после инфицирования при экспрессии в бакуловирусных экспрессионных кассетах в соответствии с изобретением, содержащих кДНК hr1p10, hr1pB29p10 или hr1p6.9p10 и Ac-ie-01, экспрессируемую под контролем промоторов рВ29 или polh. Все уровни экспрессии GFP сравнивали с уровнем, получаемым с помощью промотора в обычном бакуловирусном векторе. На графике представлены средние значения трех независимых экспериментов по экспрессии для каждого бакуловируса; в каждом случае стандартное отклонение было менее 5%. На данной фигуре также продемонстрированы типичные микрофотографии флуоресценции, на которых показаны клетки Sf21 в разное время после инфицирования бакуловирусом дикого типа (контроль), обычным бакуловирусом, экспрессирующим GFP под контролем промотора polh или бакуловирусом, экспрессирующим GFP посредством экспрессионной кассеты в соответствии с изобретением polhAc m-01/hr1pB29p10GFP. Клетки инфицированы в случаях А) и В) при множественности заражения (MOI) 5 или в случае С) при MOI 0,1.
Фигура 5: А) Сравнение количества рекомбинантного белка GFP в клетках насекомых Sf21, выращенных в монослое в разное время после инфицирования при экспрессии с помощью обычного бакуловирусного вектора под контролем промотора polh (светло-серый) или бакуловирусного вектора со встроенной экспрессионной кассетой в соответствии с изобретением, состоящей из элементов polhAc-ie-01/hr1pB29p10GFP (темно-серый), измеренного посредством микрофлюидного анализа белка (Experion™; BioRad™, США). Клетки инфицировали обоими вирусами при MOI 5; В) Сравнение рекомбинантного белка GFP, накопленного в клетках насекомых Sf9, выращенных в суспензии в разное время после инфицирования, при экспрессии с помощью обычного бакуловирусного вектора под контролем промотора polh (светло-серый) или бакуловирусного вектора со встроенной экспрессионной кассетой в соответствии с изобретением, состоящей из элементов polhAc-ie-01/hr1p6.p10GFP (темно-серый), измеренного посредством микрофлюидного анализа белка (Experion™; BioRad™, США). Клетки инфицировали обоими вирусами при MOI 0,1; перрывистыми линиями показан процент прироста количества рекомбинантного GFP, продуцируемого бакуловирусами, содержащими экспрессионную кассету в соответствии с изобретением по сравнению с количеством, полученным с помощью обычных бакуловирусов, экспрессирующих GFP под контролем промотора polh; С) Гели ДСН-ПААГ для электрофореза, окрашенные" Кумасси синим, разделяющие экстракты инфицированных клеток после эксперимента, описанного на графике A; D) Гели ДСН-ПААГ для электрофореза, окрашенные Кумасси синим, разделяющие экстракты инфицированных клеток после эксперимента, описанного на графике В.
Фигура 6. Клетки насекомых SF9 культивировали в суспензии и инфицировали бакуловирусом, сверхэкспрессирующим кДНК Ас-ie-01 под контролем polh, или бакуловирусом, экспрессирующим репортерный белок GFP в составе бакуловирусной экспрессионной кассеты polhAc-ie-01/hr1p6.9p10GFP в соответствии с настоящим изобретением, с целью оценки плотности клеток (А) и жизнеспособности (В) данных клеток. В качестве контроля использовали обычный бакуловирус, экспрессирующий белок GFP под контролем polh. Клетки инфицировали в суспензии при MOI 0,1. (А) Клетки подсчитывали в разное время после инфицирования (0, 24 и 48 часов) для вычисления плотности клеток. Более подробный анализ точного момента, в который сверхэкспрессия кДНК Ас-ie-01 приводит к пролиферации клеток, показан на графике-вставке для клеток, инфицированных polhGFP или polhAc-ie-01/hr1p6.9p10GFP. (В) Жизнеспособность клеток оценивали путем окрашивания трипановым синим (1:1 суспензия клеток и краситель в концентрации 0,4% в PBS-буфере). Это окрашивание позволяет различать живые и мертвые клетки. Жизнеспособность клеток рассчитывали, вычисляя процентное содержание живых клеток по отношению к общему количеству клеток в разное время после инфицирования (от 0 до 120 часов). Микрофотографии монослоев клеток насекомых Hi-5™, инфицированных при MOI 5 контрольным обычным бакуловирусом, экспрессирующим репортерный белок GFP под контролем промотора polh (С) или бакуловирусом, экспрессирующим кДНК Ас-ie-01 под контролем промотора polh (D). Микрофотографии получены через 96 часов после инфицирования при 20-кратном увеличении с помощью инвертационного микроскопа Leica™ DMIL™.
Фигура 7: А) Клетки насекомых Sf9 иинфицировали обычным бакуловирусом, экспрессирующим белок GFP под контролем промотора polh (1) или бакуловирусным вектором со встроенной экспрессионной кассетой в соответствии с изобретением, содержащей элементы polhAc-ie-01/hr1p6.9p10GFP, сверхэкспрессирующим регуляторы транскрипции, кодируемые кДНК Ac-ie-01 (2). Клетки отбирали в различные моменты времени после инфицирования (от 0 до 120 часов) и анализировали клеточные экстракты с помощью электрофореза в ДСН-ПААГ и вестерн-блоттинга с антисывороткой против GFP или против актина клеток. В) Функциональность белка GFP, экспрессированного в клетках насекомых Sf9 согласно анализу, показанному на графике А, измеряли с помощью флуориметрии. Значения флуоресценции белка GFP, продуцированного с помощью обычного рекомбинантного бакуловируса, полученные в разное время после инфицирования (серые столбцы), сравнивали с флуоресценцией белка, продуцированного рекомбинантным бакуловирусом с бакуловирусной кассетой в соответствии с настоящим изобретением (черные столбцы).
Фигура 8: Схематическое представление предпочтительных элементов, содержащихся в бакуловирусных экспрессионных кассетах в соответствии с изобретением, содержащих кодирующие последовательности регуляторов транскрипции, гомологичные области (hr), являющиеся энхансерами транскрипции с промотора(ов) чужеродного гена, кодирующего рекомбинантный белок.
Фигура 9: Анализ последовательности промотора рВ2, выделенного из Т. ni, и определение последовательности регуляторного элемента транскрипции рВ29. А) Нуклеотидная последовательность области промотора рВ2 BJHSP2 (номер доступа в GenBank U41640), выделенной из Т. ni. Ранее описанный сайт начала транскрипции обозначен треугольником, в то время как ТАТА-бокс подчеркнут, а потенциальные цис-действующие элементы последовательности рВ2 заключены в прямоугольники. Нуклеотидные остатки с тенью - последовательность, внедренная в промотор рВ29. Прогнозируемые гипотетические сайты связывания Br-С и EcR также обозначены на фигуре прозрачными прямоугольниками В) Схематическое изображение фрагмента ДНК рВ2 и производного от него промотора рВ29. Активность промоторов анализировали С помощью флуоресцентного анализа с использованием белка GFP в качестве репортерного гена. Экспрессию GFP во всех экспериментах количественно определяли через 72 часа после инфицирования; она показана в виде среднеарифметического со стандартным отклонением по трем независимым экспериментам.
Фигура 10: Уровни экспрессии GFP, опосредованной применением различных промоторов или комбинации промоторов. А) Флуориметрический анализ через 24 часа после инфицирования клеток Sf21 различными рекомбинантными бакуловирусами, экспрессирующими GFP под контролем различных отдельных или химерных промоторов. В) Исследование зависимости экспрессии GFP от времени в клетках Sf21, инфицированных теми же рекомбинантными бакуловирусами, что и на графике А, измеряемой с помощью флуоресцентного анализа. Все эксперименты проводили при MOI 5; на фигуре показано среднеарифметическое по трем независимым экспериментам с соответствующими стандартными отклонениями.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение улучшает экспрессию рекомбинантных белков в BEVS за счет внедрения элементов рекомбинантной ДНК в бакуловирусы.
Элементы рекомбинантной ДНК в соответствии с настоящим изобретением представляют собой последовательности, которые вызывают экспрессию бакуловирусных регуляторов транскрипции на уровне, превышающем эндогенный уровень, и, необязательно, энхансерные гомологичные области (hr) и промоторы, функционально связанные с вышеупомянутыми элементами.
Кроме того, элементы рекомбинантной ДНК могут образовывать часть экспрессионной кассеты.
«Экспрессионная кассета» относится к нуклеотидной последовательности, содержащей элементы рекомбинантной ДНК, которые контролируют (например, промотор) и/или требуются (например, сам ген) для экспрессии гена. Экспрессионную кассету можно внедрить в рекомбинантный вектор или бакуловирус.
Элементы рекомбинантной ДНК можно внедрить в одиночную нуклеотидную последовательность, клонирующий вектор, вектор переноса, рекомбинантный бакуловирус или клетку. Тем не менее, они также могут присутствовать в различных нуклеотидных последовательностях, клонирующих векторах, векторах переноса или рекомбинантных бакуловирусах и могут быть внедрены в одну и ту же клетку.
Настоящее изобретение, как ни странно, показывает, что внедрение последовательностей, вызывающих экспрессию бакуловирусных регуляторов транскрипции на уровне, превышающем эндогенный уровень, и, необязательно, внедрение последовательности энхансерной гомологичной области (hr), промотора или комбинации промоторов может увеличить продукцию рекомбинантного белка до беспрецедентного уровня с ранних (от 6 до 8 часов после инфицирования) до поздних (от 48 до 96-120 часов после инфицирования) стадий.
Кроме того, внедрение указанных элементов рекомбинантной ДНК также усиливает пролиферацию клеток, инфицированных бакуловирусом (в частности, на ранних стадиях после инфицирования), жизнеспособность на поздних стадиях после инфицирования и целостность молекулярных механизмов и морфологии указанных клеток, инфицированных бакуловирусом. Улучшение целостности функций клеток во время бакуловирусной инфекции также способствует правильному посттрансляционному процессингу рекомбинантного белка.
Внедрение указанных элементов рекомбинантной ДНК также увеличивает продукцию рекомбинантного белка в клетке-хозяине по сравнению с обычными промоторами polh или p10.
Таким образом, один из аспектов настоящего изобретения относится к рекомбинантному бакуловирусу, содержащему нуклеотидную последовательность, обеспечивающую экспрессию регуляторов транскрипции на уровне, превышающем эндогенный. В предпочтительном варианте реализации регуляторы транскрипции представляют собой IE-1, IE-0 и/или их фрагменты.
«Бакуловирус» относится к семейству инфекционных вирусов беспозвоночных, главным образом заражающих насекомых и членистоногих. «Рекомбинантный бакуловирус» дополнительно содержит рекомбинантную ДНК, внедренную, например, путем гомологичной рекомбинации или транспозиции. Рекомбинантный бакуловирус предпочтительно происходит от AcMNPV.
«Рекомбинантная ДНК» относится к форме искусственной ДНК, созданной путем комбинации или вставки одной или нескольких цепей ДНК, тем самым объединяя ДНК; которые обычно не встречаются совместно.
«Элемент рекомбинантной ДНК» относится к функциональному элементу в составе рекомбинантной ДНК, например, промотору, энхансеру или гену. Как упоминалось выше, элементы рекомбинантной ДНК-в соответствии с настоящим изобретением представляют собой последовательности, которые вызывают экспрессию бакуловирусных регуляторов транскрипции на уровне, превышающем эндогенный уровень, энхансерные гомологичные области (hr) и промоторы, функционально связанные с вышеупомянутыми элементами.
«Регулятор транскрипции» относится к регуляторному белку, который обладает способностью регулировать транскрипцию специфических генов посредством, например, связывания с энхансерной или репрессорной областями и/или рекрутинга дополнительных белков, участвующих в транскрипции.
IE-1 и его сплайс-вариант IE-0 являются регуляторами транскрипции, эндогенно экспрессирующимися во время бакуловирусной инфекции. Согласно настоящему изобретению, IE-1, IE-0 и/или их фрагменты рекомбинантно экспрессируются, повышая общий уровень этих белков выше эндогенного уровня. Этого можно добиться, например, внедряя дополнительные копии эндогенного гена или манипулируя экспрессией промотора эндогенного гена. Кроме того, копии эндогенных генов можно внедрить в виде трансгенов под контролем подходящего промотора, например, polh или рВ29.
Уровень экспрессии белков IE-1, IE-0 и/или их фрагментов можно определять как на уровне мРНК, так и белка с помощью способов, общеизвестных для специалистов в данной области техники, например, количественной ПЦР и вестерн-блоттинга.
В соответствии с настоящим изобретением, IE-1, IE-0 и их фрагменты кодируются нуклеиновыми кислотами SEQ ID NO: 1 (также называемой Ac-ie-01) - SEQ ID NO: 5. SEQ ID NO: 1 является кДНК Ac-ie-01, кодирующей IE-1 и IE-0, SEQ ID NO: 2 является кодирующей последовательностью (CDS) IE-1, a SEQ ID NO: 3 является CDS IE-0. SEQ ID NO: 4 и 5 являются CDS N-концевых доменов IE-1 и IE-0 соответственно, которые сохраняют каталитическую активность регулятора транскрипции. Белки, кодируемые SEQ ID NO: 2-5, представлены SEQ ID NO: 6-9 соответственно.
Кроме того, в настоящем изобретении описаны варианты SEQ ID NO: 1-9, которые являются или кодируют амин