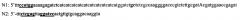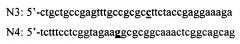Температурочувствительный мутантный интеин для нерастворимой экспрессии предшественника целевого белка
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен температурочувствительный мутантный PRP8 мини-интеин из Penicillium chrysogenum для нерастворимой экспрессии в клетках Escherichia coli предшественника целевого белка. Мутантный PRP8 мини-интеин содержит замену аминокислотного остатка лейцина в положении 93 на остаток пролина, замену остатка цистеина в положении 1 на остаток аланина и необязательно содержит замену остатка цистеина в положении 11 на остаток тирозина в исходной последовательности PRP8 мини-интеина из Penicillium chrysogenum, состоящей из 157 аминокислотных остатков. При использовании мутантного интеина совмещаются нерастворимая экспрессия и самовыщепление очищенного белка из фьюжна в процессе ренатурации, не требующей использования протеаз. Степень процессинга для модельного целевого белка SUMO составляет более 50%, а для нейротоксина CVIE - около 60%. 9 ил., 8 пр.
Реферат
Будем называть нерастворимой экспрессией такой вариант экспрессии целевого белка, при котором целевой экспрессируемый продукт выделяется из клеток во фракции нерастворимых клеточных белков, осаждаемых путем центрифугирования.
Настоящее изобретение относится к области биотехнологии и касается направленной нерастворимой экспрессии целевого белка, получаемого в составе гибридного предшественника (фьюжна), включающего мутантный вариант интеина PRP8 из организма Penicillium chrysogenum, с последующим последовательным осуществлением процессов денатурации и ренатурации, в ходе которых происходит отщепление мутантного интеина и высвобождение целевого белка.
Гетерологичная экспрессия белка в клетках Escherichia coli зачастую приводит к накоплению целевого белка в нерастворимом виде (в виде "телец включения"). В большинстве случаев это является нежелательным фактом, так как требует дополнительных этапов по рефолдингу интересующего исследователя белка. Однако, в ряде случаев при экспрессии пептидов малых размеров, быстро деградирующих в клетке, или токсичных белков, нерастворимая экспрессия может служить простым и эффективным способом для их получения [1].
Наряду с белками, используемыми в качестве модулей для конструирования фьюжнов с целью повысить растворимость целевого белка (тиоредоксин, глутатион трансфераза (GST), SUMO [1]), распространено использование белковых модулей, экспрессия в фьюжне с которыми приводит к агрегированию и накоплению белка в нерастворимом виде. Данные модули находят свое применение при производстве небольших пептидов и представлены в ряде коммерческих предложений. Наиболее популярными являются - кетостероид изомераза (13,5 кДа), домен TAF12 и др. [2].
Преимущество «нерастворимых» модулей состоит в упрощении процесса очистки целевого белка: легко отделяемый нерастворимый компонент лизированных клеток в большинстве своем представлен белками-компонентами телец включения.
Часто используемым подходом к высвобождению целевого белка из состава фьюжна является помещение сайта узнавания протеазы на границе целевого белка и белка-модуля (например, сайт энтерокиназы, сайт эндопептидазы KEX2 и другие). Протеаза специфически разрезает фьюжн, высвобождая целевой белок. Такой процесс требует дополнительных затрат протеазы и времени, что может стать критическим для экономической обоснованности производства при промышленном получении целевого белка [3].
Лишенным этих недостатков является подход, основанный на использовании самоотщепляющихся белков. Открыты в 1990-м году интеины - белковые элементы, способные аутокаталитически самовыщепляться и/или отщепляться по границе своих концевых аминокислот. Это их свойство успешно реализовано в коммерческих векторах IMPACT® System и IMPACT-CN® System (New England Biolabs) [4]. Выщепление белка сопровождается образованием полноценной пептидной связи между аминокислотами, фланкирующими интеин. Мутирование консервативных N'- и С'-концевых аминокислот приводит к невозможности прохождения полноценного белкового сплайсинга, при этом сохраняется активность отщепления по N- или С-концевым аминокислотам. Так, замена первого цистеина на аланин накладывает запрет на обрыв связи у N-конца интеина [5]. Такой интеин приобретает свойства самоотщепляющейся метки.
Первоначально все интеины содержали эндонуклеазный домен, отвечающий за интеграцию интеинового гена (размер таких интеинов ~ 400-500 п.о.), не обязательный для прохождения сплайсинга [5]. Интеины, не имеющие эндонуклеазного домена, так называемые мини-интеины, предпочтительнее для биотехнологии благодаря меньшему размеру.
К числу известных особенностей интеинов, ограничивающих их использование для получения целевых белковых продуктов, обычно относят зависимость эффективности С-концевого процессинга от природы аминокислотных остатков, следующих за сайтом процессинга [20]. Кроме того, из уровня техники известно, что вообще на сплайсинг белка, даже если он полностью катализируется интеином, могут заметно влиять последовательности экстеинов (фланкирующие области белка), и некоторые белки хозяева могут быть несовместимы с активностью интеинов, т.е. не могут быть получены в биологически активном состоянии ([21], описание с. 5 строка 5 - с. 6 строка 5 со ссылкой на [22]; в частности с. 460 абз. 2, а также [23], в частности с. 855 средняя и правая колонки).
Первое ограничение носит общий характер и относится ко всем используемым интеинам, включая заявляемый. Второе ограничение не относится к заявляемому изобретению, в котором экспрессия целевого белка в составе предшественника в биологически активном состоянии не является обязательным условием, так как перевод процессированного целевого белка в активное состояние осуществляют на последующих стадиях в процессе ренатурации очищеного белка и достигают средствами, известными из уровня техники.
Упомянутые выше коммерчески доступные векторы IMPACT® System и IMPACT-CN® System (NEB) разработаны для растворимой экспрессии фьюжнов. В вариантах этих систем, при которых интеин расположен на N-конце фьюжна, скорость процессинга регулируется рН и температурой: с повышением температуры и/или увеличением времени культивирования происходит увеличение доли неконтролируемо процессированного белка, что снижает выход конечного продукта [6].
Этого недостатка лишена система экспрессии, основанная на нерастворимой экспрессии фьюжнов. В частности, известна система на основе аутокаталитической протеазы Npro (168 а.к.) из вируса рода Pestivirus [7, 8]. Эту протеазу будем рассматривать в качестве ближайшего аналога заявляемого мутантного интеина.
Протеаза Npro аутокаталитически отщепляется из фьюжна по границе своей С-концевой аминокислоты [9]. При использовании Npro совмещаются два явления: нерастворимая экспрессия (данный фьюжн преимущественно находится в нерастворимой фракции клетки) и самовыщепление Npro из фьюжна в процессе ренатурации очищеного белка, не требующее использования протеаз.
Задачей настоящего изобретения является расширение арсенала самовыщепляющихся средств для осуществления нерастворимой экспрессии предшественника целевого белка.
Задача решена путем получения температурочувствительного мутантного интеина для нерастворимой экспрессии предшественника целевого белка в клетках Escherichia coli, соответствующего аминокислотной последовательности интеина, относящегося к семейству PRP8, содержащего замену аминокислотного остатка лейцина в положении 93 на остаток пролина, замену остатка цистеина в положении 1 на остаток аланина и не обязательно содержащий замену цистеина в положении 11 на остаток тирозина.
Такой мутантный интеин неспособен к правильному фолдингу при повышенной (непермессивной) температуре, что приводит к нерастворимой экспрессии [10]. Для получения температурочувствительного интеина выбран интеин из Penicillium chrysogenum [11, 12].
Широко известный способ получения температурочувствительных мутантов белка основан на скрининге библиотеки мутационных вариантов, полученных при проведении случайного мутагенеза с помощью ПЦР [10]. Данный подход был применен нами в настоящей работе, вследствие чего был отобран вариант интеина с мутацией Leu93Pro, который способен к преимущественно нерастворимой экспрессии в E. coli при температуре 37°С.
Настоящее изобретение основано на использовании мутантного интеина из организма P.chrysogenum (157 аминокислотных остатков) [11] и представляет собой независимо разработанный подход, аналогичный системе Npro. При использовании заявляемого мутантного интеина, равно как и при использовании протеазы Npro, совмещается два явления: нерастворимая экспрессия и самовыщепление из фьюжна в процессе ренатурации очищеного белка, не требующей использования протеаз.
Заявляемый интеин содержит следующие мутации:
1) Cys1Ala блокирующую отщепление по N-концу интеина. При этом сохраняется способность интеина к аутокаталитическому отщеплению по границе между собственной последней аминокислотой (Asnl57) и следующей за ней аминокислотой слитого с интеином белка;
2) Leu93Pro (впервые полученную нами), изменяющую характер внутриклеточной экспрессии образуемых им фьюжнов в клетках E. coli в сравнении с интеином, не содержащим этой мутации: при экспрессии при температуре 37°С фьюжны с интеином, содержащие эту мутацию, преимущественно накапливаются во фракции нерастворимых клеточных белков в непроцессированном виде. При последующей ренатурации при пониженной температуре (4°С) мутантный интеин эффективно отщепляется.
3) Дополнительно, заявляемый интеин содержит мутацию Cys11Tyr, которая не является обязательной.
Изобретение проиллюстрировано следующими чертежами.
Фиг. 1. Схема плазмиды pET28b_(His)×10_IntMUT.
Фиг. 2. Электрофореграмма экспрессии фьюжнов SUMO с мутантным интеином (Cys1Ala, Leu93Pro, Cys11Tyr) и контрольным вариантом интеина (Cys1Ala, Cys11Tyr): Дорожки: 1 - маркер, 2-4: [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих
(His)×10_IntMUT_SUMO, 5-7 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)× 10_IntWT_SUMO.
Фиг. 3. Электрофореграмма процессированного белка (His)×10_IntMUT_SUMO. Дорожки: 1 - маркер, 2 - общий белок, 3 - осадок, растворенный в 8М мочевине, 4 - ренатурированный белок в 1М мочевине после процессинга.
Фиг. 4. Электрофореграмма экспрессии фьюжнов GFP с мутантным интеином (Cys1Ala, Leu93Pro, Cys11Tyr) и контрольным вариантом интеина (Cys1Ala, Cys11Tyr). Дорожки: 1 - маркер, 2-4: [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntMUT_GFP, 5-7 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His) × 10_IntWT_GFP.
Фиг. 5. Электрофореграмма процессированного белка (His)×10_IntMUT_GFP. Дорожки: 1 - маркер, 2 - общий белок, 3 - осадок, растворенный в 8М мочевине, 4 - белок, ренатурированный в 1М мочевине после процессинга.
Фиг. 6. Электрофореграмма экспрессии белков (His)×10_IntMUT и (His)×10_IntWT. Дорожки: 1 - маркер, 2-4 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntMUT, 5-7 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntWT.
Фиг. 7. Электрофореграмма экспрессии фьюжнов IFN с мутантным интеином (Cys1Ala, Leu93Pro, Cys11Tyr) и контрольным вариантом интеина (Cys1Ala, Cys11Tyr). Дорожки: М - маркер (кДа), 1-3 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntMUT_IFN, 4-6 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntWT_IFN.
Фиг. 8. Электрофореграмма экспрессии фьюжнов Ssm6A с мутантным интеином (Cys1Ala, Leu93Pro, Cys11Tyr). Дорожки: М - маркер (кДа), 1-3 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntMUT_Ssm6A, 4 - осадок белка (His)×10_IntMUT_Ssm6A, растворенный в 8М мочевине, 5 - ренатурированный в 1М мочевине белок после процессинга.
Фиг. 9. Электрофореграмма экспрессии фьюжнов CVIE с мутантным интеином (Cys1Ala, Leu93Pro, Cys11Tyr). Дорожки: М - маркер (кДа), 1-3 : [общий белок ⎜ супернатант ⎜ осадок] клеток, экспрессирующих (His)×10_IntMUT_CVIE, 4 - осадок белка (His)×10_IntMUT_CVIE, растворенный в 8М мочевине, 5 - ренатурированный в 1М мочевине белок после процессинга.
Пример 1. Получение плазмиды pET28b_(His)×10_IntWT, содержащей ген интеина, модифицированного по N-концу (Cys1Ala, Cys11Tyr) из генома Penicillium chrysogenum (контрольный вариант)
Ген интеина, несущего две мутации Cys1Ala и Cys11Tyr и не несущий ключевой мутации (Leu93Pro), амплифицируют в ПЦР с тотальной геномной ДНК P. chrysogenum с использованием праймеров N1 + N2
Праймеры конструируют на основе представленной последовательности интеина в базе данных GeneBank (АМ042015.1) с расчетом внесения заявленных мутаций и фланкирующих ген сайтов рестрикции для клонирования. В качестве матрицы используют тотальную геномную ДНК P. chrysogenum, выделенную по стандартной методике [13] из штамма P. chrysogenum ВКПМ F-3.
Полученный ПЦР фрагмент (размером ~500 пар нуклеотидов) клонируют в плазмиду pET28b (Novagen) по сайтам рестрикции NcoI и XhoI, и получают плазмиду pET28b_(His)×10_IntWT. Экспрессия гена в полученном векторе на которой регулируется промотором Т7 [14].
Для клонирования и последующей экспрессии в соответствии со стандартными методами [15] используют штаммы E. coli XL1blue и BL21(DE3).
Пример 2. Получение плазмиды pET28b_(His)×10_IntMUT, содержащей ген мутантного интеина (Cys1Ala, Cys11Tyr, Leu93Pro)
Ген интеина, несущего три мутации Cys1Ala, Cys11Tyr и Leu93Pro, получают с помощью ПЦР в 2 раунда с использованием праймеров N1 и N2 и дополнительных праймеров N3 и N4 имеющих следующую структуру:
Вносимая нуклеотидная замена (праймеры N3, N4), приводящая к мутации Leu93Pro, выделена жирным цветом (ctt→cct).
В первом раунде проводят две реакции ПЦР, используя пары праймеров N1 + N4 и N3 + N2. В качестве матрицы используют плазмиду pET28b_(His)×10_IntWT, получение которой описано в Примере 1. Во втором раунде используют праймеры N1 и N2, а в качестве матрицы используют полученные в первом раунде два продукта ПЦР реакции.
Полученный ПЦР фрагмент (SEQ ID NO 1) клонируют в плазмиду pET28b по сайтам рестрикции NcoI и XhoI, получая плазмиду pET28b_(His)×10_IntMUT (Фиг. 1).
Таким образом, получают плазмиду pET28b_(His)×10_IntMUT, содержащую ген мутантного интеина (Cys1Ala, Cys11Tyr, Leu93Pro) с добавленным на 3'-конец (перед стоп-кодоном) трехаминокислотным линкером Ser-Gly-Ser, кодирующая последовательность которого содержит сайт узнавания эндонуклеазы рестрикции BamHI для удобства последующего клонирования.
Пример 3. Сравнение экспрессии белков (His)×10_IntMUT и (His)×10_IntWT
Для демонстрации отличия свойств интеина, несущего мутацию Leu93Pro от интеина этой мутации не несущего сравнивают их внутриклеточную экспрессию. Экспрессию осуществляют в клетках штамма BL21(DE3), трансформированных соответствующими плазмидами. Анализ экспрессируемых белков осуществляют аналогично описанному в Примере 4.
Экспрессируемый белок (His)×10_IntMUT накапливается преимущественно во фракции нерастворимых белков, а белок (His)×10_IntWT накапливается преимущественно в виде растворимого белка (Фиг. 6).
Пример 4. Экспрессия и процессинг in vitro белка (His)×10_IntMUT_SUMO с использованием мутантного интеина
4-1. Экспрессия
Для демонстрации способности заявляемого мутантного интеина направлять экспрессию в тельца включения в качестве целевого белка выбирают белок SUMO (Small Ubiquitin-like Modifier), который в биотехнологии используют для создания фьюжнов с плохо растворимыми белками для увеличения их растворимости [1].
Сравнивают экспрессию SUMO в составе фьюжнов с интеином, несущем мутацию Leu93Pro и интеином, этой мутации не несущим (контроль).
Плазмиды, содержащие генетические конструкции, кодирующие гибридные белки (His)×10_IntMUT_SUMO и (His)×10_IntWT_SUMO (контроль), получают посредством клонирования в вышеописанные плазмиды (пример 1 и 2) гена SMT3, кодирующего белок SUMO из дрожжей Saccharomyces cerevisiae по сайтам рестрикции BamHI и XhoI, амплифицированного в ПЦР с помощью соответствующих праймеров, несущих необходимые для клонирования сайты рестрикции [16].
Экспрессию фьюжнов (His)×10_IntMUT_SUMO и (His)×10_IntWT_SUMO анализируют в клетках штамма E. coli BL21(DE3).
Компетентные клетки [17] штамма BL21(DE3), трансформируют плазмидами pET28b_(His)×10_IntMUT_SUMO или pET28b_(His)×10_IntWT_SUMO и высевают на чашку со средой LB следующего состава в мас. %: бакто-триптон - 1, дрожжевой экстракт - 0,5, хлористый натрий - 1, агар 1,5, вода - остальное, содержащую селективный антибиотик канамицин в количестве 30 мг/л, и инкубируют в течение 12 часов при температуре 37°С. Колонии выросших трансформантов засевают в жидкую среду LB (50 мл среды в конической колбе объемом 1 л) с канамицином и лактозой (0,2% объем/объем), добавляемой в среду с целью индукции экспрессии генетических конструкций. Засеянные колбы инкубируют в течение 14 часов при температуре 37°С при встряхивании (250 об/мин). Выросшие клетки осаждают центрифугированием (5000 об/мин, 5 минут) и разрушают на френч-прессе [18].
Полученные клеточные лизаты разделяют на растворимую и нерастворимую фракции центрифугированием (4°С, 13000 об/мин, 15 минут). Эффективное накопление гибридного белка-предшественника (His)×10_IntMUT_SUMO в нерастворимом и непроцессированном виде подтверждено методом белкового гель-электрофореза. На Фиг. 2 видно накопление в нерастворимой фракции непроцессированного белка (His)×10_IntMUT_SUMO (что соответствует молекулярному весу 32 кДа). В то же время белок (His)×10_IntWT_SUMO в непроцессированном состоянии не обнаруживается, в лизате наблюдаются его части, представляющие собой продукты его процессинга SUMO и (His)×10_IntWT.
4-2. Процессинг гибридного белка-предшественника (His)×10_IntMUT_SUMO in vitro
Последующие операции проводят во льду.
После отделения центрифугированием (13000 об/мин, 10 минут, 4°С) нерастворимых компонентов разрушенных клеток, проводят денатурацию и ренатурацию белка из этих нерастворимых компонентов, в процессе которой происходит аутокаталитическое отщепление интеина. Для этого полученный осадок из клеточных лизатов растворяют посредством добавления к нему раствора 8М мочевины (~100 мг осадка в 2 мл 8М мочевины) в течение 1 часа. Нерастворенные компоненты отделяют центрифугированием (13000 об/мин, 10 мин, 4°С). Содержание экспрессируемого гибридного белка в надосадочной жидкости определяют электрофоретическим методом. Для аутокаталитического отщепления интеиновой части полученный раствор разбавляют водой до концентрации мочевины 1М, после чего полученные пробы инкубируют при
температуре 4°С в течение 3 дней. Степень процессинга белка, определенная методом белкового электрофореза (Фиг. 3) составляет более 50%.
Пример 5. Экспрессия и процессинг in vitro белка (His)×10_IntMUT_GFP
Для подтверждения эффективности заявляемого интеина осуществлять нерастворимую экспрессию белка-предшественника в качестве модельного белка используют белок GFP [19]. Ген GFP амплифицируют в ПЦР с плазмиды pEGFP (Clontech) и клонируют в плазмиды pET28b_(His)×10_IntMUT и pET28b_(His)×10_IntWT, в результате чего получают генетические конструкции, кодирующие белки (His)×10IntMUT_GFP и (His)×10_IntMUT_GFP, в составе которых аналогично конструкциям фьюжнов с белком SUMO (Пример 4), между последней кодируемой аминокислотой интеина (Asn) и первой GFP (Met) помещается трехаминокислотный линкер Ser-Gly-Ser.
Получение и культивирование штаммов, содержащих данные конструкции, и анализ экпрессируемых белков осуществляют согласно методике, описанной в Примере 4.
На Фиг. 4 видно накопление в нерастворимой фракции непроцессированного белка His×10_IntMUT_GFP (что соответствует молекулярному весу 43 кДа), чего не наблюдается для белка His×10_IntWT _GFP.
Дальнейшие операции по очистке телец включения, содержащих фьюжн (His)×10_intMUT_GFP, а также его процессинг проводят по методике, описанной в Примере 4 для белка (His)×10_IntMUT_SUMO.
Из результатов, приведенных на Фиг. 5, видно, что определенная методом белкового электрофореза доля процессированного. белка (His)×10_IntMUT_GFP меньше, чем доля процессированного белка (His)×10_IntMUT_SUMO (Фиг. 3), что иллюстрирует зависимость эффективности процессинга белка-предшественника от свойств целевого белка.
Пример 6. Экспрессия и процессинг in vitro белка (His)×10_IntMUT_IFN
Эффективность применения заявляемого интеина для осуществления нерастворимой экспрессии белка-предшественника подтверждают путем синтеза модельного целевого белка интерферона альфа 2b человека (IFN) [24].
Ген IFN получают в виде BamHI/XhoI фрагмента ДНК из плазмиды pUC18×-(Ser)IFN [24] и клонируют в плазмиды pET28b_(His)×10_IntMUT или pET28b_(His)×10_IntWT, в результате чего получают генетические конструкции, кодирующие белки (His)×10_IntMUT_IFN или (His)×10IntWT_IFN. В их составе также как в конструкциях фьюжнов с белком SUMO (Пример 4) между последним аминокислотным остатком интеина (Asn) и первым остатком зрелого IFN (Cys) находится трехаминокислотный линкер Ser-Gly-Ser.
Культивирование штаммов, содержащих данные конструкции, и анализ экпрессируемых белков осуществляют согласно методике, описанной в Примере 4.
На Фиг. 7 видно накопление в нерастворимой фракции исключительно непроцессированного белка His×10_IntMUT_IFN с молекулярным весом около 43 кД, в то время как при экспрессии конструкции His×10_IntWT_IFN главным накапливаемым продуктом оказывается белок IFN с молекулярным весом около 18 кД.
Дальнейшие операции по очистке телец включения, содержащих фьюжн (His)×10_intMUT_IFN, а также его процессингу требуют использования особых специфических условий для их осуществления, отличающихся от условий, описанных в Примере 4 для белка (His)×10_IntMUT_SUMO. Это иллюстрирует зависимость свойств получаемого фьюжна и эффективности его процессинга от свойств целевого белка.
Пример 7. Экспрессия и процессинг in vitro белка (His)×10_IntMUT_Ssm6A
Эффективность применения заявляемого интеина для осуществления нерастворимой экспрессии белка-предшественника подтверждают путем синтеза еще одного модельного целевого белка - рекомбинантного нейротоксина Ssm6A из яда китайской красноголовой сороконожки (Chinese red-headed centipede) Scolopendra subspinipes mutilans, аминокислотная последовательность и структура которого раскрыта в работе [25].
С этой целью конструируют рекомбинантную плазмиду pET28b_(His)×10_IntMUT_Ssm6A, содержащую комплексный фрагмент ДНК, кодирующий фьюжн (His)×10_IntMUT_Ssm6A.
Комплексный фрагмент ДНК получают в две стадии.
На первой стадии конструируют два перекрывающихся фрагмента ДНК:
• Фрагмент 1, заключающий последовательность ДНК, содержащую в 5'-концевой части уникальный сайт NcoI и кодирующую белок (His)×10_IntMUT, получают в процессе ПЦР-амплификации с использованием в качестве матрицы ДНК плазмиды pET28b_(His)×10_IntMUT. Для амплификации используют следующую пару праймеров:
• Фрагмент 2, заключающий последовательность ДНК, содержащую в 3'-концевой части уникальный сайт XhoI и кодирующую белок Ssm6A, синтезируют в виде двуцепочечной последовательности ДНК в процессе ПЦР с использованием следующего набора перекрывающихся олигонуклеотидов:
Амплифицированные фрагменты ДНК очищают в агарозном геле с использованием кита Qiagen (Qiagen, cat. №28706) и используют на второй стадии для получения комплексного фрагмента ДНК.
На этой стадии в реакционную смесь для ПЦР вносят смесь очищенных перекрывающихся фрагментов 1 и 2. В качестве праймеров для амплификации используют N(his) и N(terl). В результате ПЦР осуществляют лигирование фрагментов 1 и 2 и получают комплексный амплифицированный фрагмент ДНК размером около 680 п.о., кодирующий фьюжн (His)×10_IntMUT_Ssm6A.
Полученный фрагмент ДНК очищают в агарозном геле, обрабатывают рестриктазами NcoI и XhoI и клонируют в векторе экспрессии pET28b (Novagen) по сайтам рестрикции NcoI и XhoI.
В результате клонирования получают плазмиду pET28b_(His)×10_IntMUT_Ssm6A, которая содержит ген фьюжна (His)×10_IntMUT_Ssm6A под контролем сильного промотора, узнаваемого РНК полимеразой фага Т7.
В составе фьюжна (His)×10_IntMUT_Ssm6A между последним аминокислотным остатком интеина (Asn) и первым остатком зрелого Ssm6A (Ala) линкер отсутствует.
Культивирование штамма, содержащего данную конструкцию и анализ экпрессируемого фьюжна осуществляют согласно методике, описанной в Примере 4.
На Фиг. 8 видно накопление в нерастворимой фракции исключительно непроцессированного белка His×10_IntMUT_Ssm6A с молекулярным весом около 25 кД.
Дальнейшие операции по очистке телец включения, содержащих фьюжн (His)×10_intMUT_Ssm6A, а также его процессинг проводят по методике, описанной в Примере 4 для белка (His)×10_IntMUT_SUMO.
Из результатов, приведенных на Фиг. 8, видно, что полученный белок (His)×10_IntMUT_Ssm6A способен эффективно процессироваться in vitro. При этом определенная методом белкового электрофореза доля процессированного белка (His)×10_IntMUT_Ssm6A составляет около 35%, что ниже доли процессированного белка (His)×10_IntMUT_SUMO (Фиг. 3), и иллюстрирует зависимость эффективности процессинга белка-предшественника от свойств целевого белка.
Пример 8. Экспрессия и процессинг in vitro белка (His)×10_IntMUT_CVIE
Эффективность применения заявляемого интеина для осуществления нерастворимой экспрессии белка-предшественника подтверждают путем синтеза еще одного модельного целевого белка - рекомбинантного нейротоксина CVIE из яда улитки Conus catus, аминокислотная последовательность и структура которого раскрыты в работе [26].
С этой целью конструируют рекомбинантную плазмиду pET28b_(His)×10_IntMUT_CVIE, содержащую комплексный фрагмент ДНК, кодирующий слитый белок (His)×10_IntMUT_CVIE.
Комплексный фрагмент ДНК получают в две стадии.
На первой стадии конструируют два перекрывающихся фрагмента ДНК:
• Фрагмент 1 получают, как описано в примере 7;
• Фрагмент 2, заключающий последовательность ДНК, содержащую в 3-концевой части уникальный сайт XhoI и кодирующую белок CVIE, синтезируют в виде двуцепочечной последовательности ДНК в процессе ПЦР с использованием следующего набора перекрывающихся олигонуклеотидов:
Амплифицированные фрагменты ДНК очищают в агарозном геле с использованием кита Qiagen (Qiagen, cat. №28706) и используют на второй стадии для получения комплексного фрагмента ДНК.
На этой стадии в реакционную смесь для ПЦР вносят смесь очищенных перекрывающихся фрагментов 1 и 2. В качестве праймеров для амплификации используют N(his) и N(ter2). В результате ПЦР осуществляют лигирование фрагментов 1 и 2 и получают комплексный амплифицированный фрагмент ДНК размером 620 п. о., кодирующий фьюжн (His)×10_IntMUT_CVIE.
Полученный фрагмент ДНК очищают в агарозном геле, обрабатывают рестриктазами NcoI и XhoI и клонируют в векторе экспрессии pET28b (Novagen) по сайтам рестрикции NcoI и XhoI.
В результате клонирования получают плазмиду pET28b_(His)×10_IntMUT_CVIE, которая содержит ген фьюжна (His)×10_IntMUT_CVIE под контролем сильного промотора, узнаваемого РНК полимеразой фага Т7.
В составе фьюжна (His)×10_IntMUT_Ssm6A между последним аминокислотным остатком интеина (Asn) и первым остатком зрелого CVIE (Cys) линкер отсутствует.
Культивирование штамма, содержащего данную конструкцию и анализ экпрессируемого белка, осуществляют согласно методике, описанной в Примере 4.
На Фиг. 9 видно накопление в нерастворимой фракции исключительно непроцессированного белка His×10_IntMUT_Ssm6A с молекулярным весом около 24 кД.
Дальнейшие операции по очистке телец включения, содержащих фьюжн (His)×10_intMUT_CVIE, а также его процессинг, проводят по методике, описанной в Примере 4 для белка (His)×10_IntMUT_SUMO.
Из результатов, приведенных на Фиг. 9, видно, что полученный белок (His)×10_IntMUT_CVIE способен эффективно процессироваться in vitro. При этом определенная методом белкового электрофореза доля процессированного белка (His)×10_IntMUT_CVIE составляет около 60%, что превышает долю процессированного белка (His)×10_IntMUT_SUMO (Фиг. 3) и иллюстрирует зависимость эффективности процессинга белка-предшественника от свойств целевого белка.
Таким образом, для осуществления нерастворимой экспрессии предшественника целевого белка, представляющего собой фьюжн самовыщепляющегося белкового модуля с целевым белком, в качестве самовыщепляющегося белкового модуля предложен заявляемый температурочувствительный мутантный интеин (SEQ ID NO 1).
Показано, что степень процессинга фьюжна заявляемого мутантного интеина с целевым белком варьирует в зависимости от выбранного целевого белка. Для модельного целевого белка SUMO эта величина составляет более 50%, а для нейротоксина CVIE - около 60%.
ИСТОЧНИКИ ИСПОЛЬЗОВАННОЙ ИНФОРМАЦИИ
[1] Peter М. Hwang et al. (2014) Targeted expression, purification, and cleavage of fusion proteins from inclusion bodies in Escherichia coli. FEBS Letters 588 (2014) 247-252.
[2] Kuliopulos, A. and Walsh, C.T. (1994) Production, purification, and cleavage of tandem repeats of recombinant peptides. J. Am. Chem Soc 116, 4599-4607.
[3] US 20060141570.
[4] Xu MQ, Evans TC Jr. (2003) Purification of Recombinant Proteins from E. coli by Engineered Inteins. Methods Mol Biol 205:43-68.
[5] Scander Elleuche & Stefanie (2010) Inteins, valuable genetic elements in molecular biology and biotechnology. Appl Microbiol Biotechnol 87: 479-189.
[6] Zhao Z. et al. (2008) Purification of green fluorescent protein using a two-intein system. Appl Microbiol Biotechnol 77: 1175-1180.
[7] WO 2006113957.
[8] US 6936455.
[9] Yifeng Li. (2011) Recombinant production of antimicrobial peptides in Escherichia coli: a review. Protein Expression and Purification 80: 260-267.
[10] Martin P Zeidler et al. (2004) Temperature-sensitive control of protein activity by conditionally splicing inteins. Nat Biotechnol Jul; 22(7):871-6.
[11] Skander Elleuche et al. (2006) Protein splicing of PRP8 mini-inteins from species of the genus Penicillium. Appl Microbiol Biotechnol 72(5): 959-67.
[12] Skander Elleuche, Stefanie (2007) Trans-splicing of an artificially split fungal mini-intein. Biochem Biophys Res Commun 355: 830-834.
[13] Kaiser et.al. (1994) Methods in Yeast Genetics. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
[14] Studier FW et al. (1990) Use of T7 RNA polymerase to direct expression of cloned genes. Methods Enzymol 185: 60-89.
[15] Sambrook and Russell (2001) Molecularr Cloning: a laboratory manual, 3rd cd. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.
[16] RU 2451076.
[17] Hanahan D et al. (1991) Plasmid transformation of Escherichia coli and other bacteria. Methods Enzymol 204: 63-113.
[18] -Benov L, Al-Ibraheem J. (2002) Disrupting Escherichia coli: A Comparison of Methods. J Biochem Mol Biol; 35(4): 428-31.
[19] Niedz RP et al. (1995) Green fluorescent protein: an in vivo reporter of plant gene expression. Plant Cell Rep. 14(7): 403-406.
[20] Sibylle Mathys, Thomas C. Evans Jr., Ian C. Chute, Hong Wu, Shaorong Chong, Jack Benner, Xiang-Qin Liu, Ming-Qun Xu (1999). Characterization of a self-splicing mini-intein and its conversion into autocatalytic N- and C-terminal cleavage elements: facile production of protein building blocks for protein ligation. Gene 231: 1-13.
[21] RU 2478709 C2, 10.04.2013.
[22] PAULUS H. (2000). Protein splicing and related forms of protein autoprocessing, Annual review of biochemistry, 69(1): 447-496.
[23] AMITAI G. et al. (1999). Fine-tuning an engineered intein, Nature biotechnology, 17(9): 854-855.
[24] RU 2515913.
[25] Shilong Yang, Yao Xiao, Di Kanga, Jie Liu, Yuan Li, Eivind A.B. Undheim, Julie K. Klint, Mingqiang Rong, Ren Lai, and Glenn F. King (2013). Discovery of a selective Navl. 7 inhibitor from centipede venom with analgesic efficacy exceeding morphine in rodent pain models. Proc. Natl. Acad. Sci. USA; 110(43): 17534-17539. doi: 10.1073/pnas. 1306285110.
[26] Berecki G, Motin L, Haythornthwaite A, Vink S, Bansal P, Drinkwater R et al. (2010). Analgesic ω-conotoxins CVIE and CVIF selectively and voltage-dependently block recombinant and native N-type calcium channels. Mol Pharmacol, 77: 139-148.
Температурочувствительный мутантный PRP8 мини-интеин из Penicillium chrysogenum, для нерастворимой экспрессии в клетках Escherichia coli предшественника целевого белка, содержащий замену аминокислотного остатка лейцина в положении 93 на остаток пролина, замену остатка цистеина в положении 1 на остаток аланина и необязательно содержащий замену остатка цистеина в положении 11 на остаток тирозина в исходной последовательности PRP8 мини-интеина из Penicillium chrysogenum, состоящей из 157 аминокислотных остатков.