Анализ содержания фибриногена
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии и медицины и касается иммунологических способов детекции интактного фибриногена, включающих стадии: a) получения образца, содержащего по меньшей мере некоторое количество фибриногена, необязательно превращенного по меньшей мере частично в фибрин, и необязательно содержащего тромбин; b) растворения образца в растворе растворителя, который ингибирует активность тромбина; c) переноса/нанесения части указанного образца на мембрану, связывающую белок, после необязательного ДСН-ПААГ-электрофореза; d) взаимодействия фибриногена с первичным моноклональным антителом, способным связываться с фрагментом фибринопептида A или фрагментом фибринопептида В; и e) детекции количества интактного фибриногена в образце посредством определения количества связанного первичного моноклонального антитела. Группа изобретений включает также способы оценки эффективности или стабильности гемостатического устройства, включающие использование заявленных способов детекции интактного фибриногена. Группа изобретений обеспечивает использование заявленных способов в качестве диагностических или прогностических критериев с высокой точностью. 5 н. и 22 з.п. ф-лы, 8 ил., 2 табл., 2 пр.
Реферат
Область применения изобретения
Настоящее изобретение по существу относится к иммунологическому анализу для детекции фибриногена в присутствии тромбина.
Предпосылки создания изобретения
Кровь представляет собой жидкую ткань, включающую эритроциты, лейкоциты, форменные элементы крови и тромбоциты, растворенные в жидкой фазе. Жидкой фазой является плазма, которая включает кислоты, липиды, растворенные электролиты и белки. Особым белком, присутствующим в жидкой фазе, является фибриноген. При кровотечении фибриноген взаимодействует с тромбином (ферментом) для образования нерастворимого фибринового сгустка.
В самых различных ситуациях животные, включая людей, могут страдать кровотечениями, связанными с ранами или хирургическими процедурами. В некоторых ситуациях кровотечение является сравнительно слабым, и нормальных функций свертывания крови вместе с применением простых приемов первой помощи оказывается достаточно. В других ситуациях может наблюдаться существенное кровотечение. В данных ситуациях обычно требуется специализированное оборудование и материалы, а также обученный персонал для оказания необходимой помощи.
Для решения описанных выше проблем были разработаны материалы для контроля чрезмерного кровотечения. Топические абсорбируемые гемостатические средства (TAH) широко используются в хирургической практике. TAH включают продукты на основе различных тканых или нетканых полотен или губок, как правило, полученных из по меньшей мере частично рассасывающихся материалов, варьирующихся от натуральных до синтетических полимеров и их комбинаций, включая сополимеры на основе лактида-гликолида, такие как полиглаклин 910, окисленная целлюлоза (ОЦ), окисленная регенерированная целлюлоза (ОРЦ), желатин, коллаген, хитин, хитозан и т.п. Для улучшения гемостатических характеристик каркасы на основе указанных выше материалов можно комбинировать с факторами свертывания крови биологического происхождения, такими как тромбин и/или фибриноген.
В ряде гемостатических составов, которые в настоящее время доступны в продаже или находятся в процессе разработки, используют лиофилизированный фибриноген, часто в комбинации с лиофилизированным тромбином, причем гемостатические составы применяют в виде сухого порошка, полужидкой пасты, жидкого состава или необязательно помещают на опорный каркас, такой как абсорбируемый тканевой каркас.
Ряд ссылок на уже известный уровень техники относится к анализу плазмы крови для определения содержания фибрина и фибриногена и смежным анализам, а также к разработке моноклональных антител (mAB) и моноклональных антител, направленных против продуктов разложения фибриногена. В таких ссылках на уже известный уровень техники описаны анализы, где в образце отсутствует тромбин (или присутствует только его неактивный предшественник протромбин); они не применимы к сухим лиофилизированным белкам, представляющим интерес; в них отсутствуют стадии растворения и/или стадии инактивации тромбина.
В статье «Useful laboratory tests for studying thrombogenesis in acute cardiac syndromes», Fareed et al., Clinical Chemistry, 44 (8, Ч. 2):1845-53, 1998 г., описано использование антител к фибринопептиду A (FpA) при ИФА и радиоиммунологических анализах в клинической практике, что является обычным вариантом применения антител к FpA как маркера тромбоза (внутрисосудистых сгустков крови).
В статье «Fibrin detected in plasma of patients with disseminated intravascular coagulation by fibrin-specific antibodies consists primarily of high molecular weight factor XIIIa-crosslinked and plasmin-modified complexes partially containing fibrinopeptide A», Pfitzner et al., Thrombosis & Haemostasis, 78(3):1069-78, 1997 г., утверждается, что образцы плазмы, полученные от пациентов с активным тромбообразованием, оценивали с помощью различных антител (включая антитело к фибринопептиду A) для определения характеристик фибриногена и фибрина в комплексах сгустков. Исходным материалом образцов была плазма.
В статье «The conversion of fibrinogen to fibrin: recombinant fibrinogen typifies plasma fibrinogen», Gorkun et al., Blood, 89(12):4407-14, 1997 г., описано использование ВЭЖХ для количественного определения FpA, выделяемого из двух форм фибриногена. Исходным материалом образцов была жидкость (плазма).
В статье «Isolation and characterization of the fibrin intermediate arising from cleavage of one fibrinopeptide A from fibrinogen», Shainoff et al., Journal of Biological Chemistry, 271(39):24129-37, 1996 г., описано исследование «альфа-профибрина» (мономера фибрина с одним выделяемым фибринопептидом A в отличие от обычно выделяемых двух фибринопептидов FpA) и его способность к полимеризации. Для определения возможного расщепления FpA использовали моноклональное антитело, направленное против FpA. Исходным материалом был раствор, содержащий фибриноген, фибрин или промежуточные соединения.
В статье «A monoclonal antibody, specific for human fibrinogen, fibrinopeptide A-containing fragments and not reacting with free fibrinopeptide», Koppert et al., Blood, 66(3):503-7, 1985 г., описано производство моноклонального антитела к FpA.
В статье «Monoclonal antibodies to different neo-epitopes on fibrinogen and fibrin degradation products», Amiral et al., Blood Coagul Fibrinolysis, октябрь 1990 г.; 1(4-5):447-52, описана попытка разработки различных моноклональных антител, специфичных в отношении неоэпитопов, образующихся во время разложения фибрина или фибриногена, которые классифицируются по трем классам реакционной способности: D и D-димер, D-димер и ранний фибриноген и продукты разложения фибрина. Данные моноклональные антитела использовали для разработки латексного анализа на предметном стекле и методик ИФА. Были получены два типа анализов цитратной плазмы: анализы, специфичные в отношении продуктов, связанных с фибрином, и анализы, предназначенные для оценки совокупности продуктов разложения фибрина или фибриногена.
В статье «A monoclonal antibody-based quantitative enzyme immunoassay for the determination of plasma fibrinogen concentrations», Hoegee-de Nobel et al., Thromb Haemost, 22 декабря 1988 г.; 60(3):415-8, описан количественный иммуноферментный анализ на основе моноклональных антител, предназначенный для определения концентрации фибриногена в плазме, и приводится описание таких иммунологических анализов для определения фибринопептида А фибриногена, с помощью которых невозможно обнаружить продукты разложения фибриногена.
В статье «Comparison of several mouse and rat monoclonal antibodies against human fibrinogen», Marecek et al., Hybridoma, декабрь 1996 г.; 15(6):423-7, представлено описание шести моноклональных антител к человеческому фибриногену. Предметом изучения служили моноклональные антитела мыши против последовательных эпитопов на иммунодоминантном D-домене фибриногена. Они вступали в перекрестную реакцию со всеми молекулами, содержащими D-домен [продукты разложения фибрина, фибрин(огена)].
В патенте США № 7790410 B2 описан способ проверки потенциального материала на гемосовместимость, включающий: (1) приведение потенциального материала в контакт с фибриногеном; (2) приведение потенциального материала, описанного на стадии (1), в контакт с тромбином; определение присутствия или количественного содержания продукта расщепления фибриногена, описанного на стадии (2); и определение гемосовместимости потенциального материала на основании присутствия или количественного содержания продукта расщепления фибриногена.
В патенте США № 6074837 описан конкурентный иммунологический анализ, предназначенный для определения содержания фибрина и продуктов разложения фибрина в образце; причем указанный иммунологический анализ включает отдельное приведение указанного образца и положительного контроля с известной концентрацией фибрина и продуктов разложения фибрина в контакт с меченым антителом, которое специфически связывается с указанными фибрином и продуктами разложения фибрина; отделение связанного меченого антитела от несвязанного меченого антитела после подходящего периода инкубации; измерение количества связанной метки и сравнение измеренного количества связанной метки в прореагировавшем образце с измеренным количеством связанной метки в прореагировавшем положительном контроле для определения присутствия или количества указанного фибрина и продуктов разложения фибрина в указанном образце, причем усовершенствование включает применение модифицированного фибриногена в качестве указанного фибрина и продуктов разложения фибрина в указанном положительном контроле. Дополнительно в ссылке описан иммунологический сэндвич-анализ для определения содержания фибрина и продуктов разложения фибрина в образце; причем указанный иммунологический анализ включает покрытие лунок титрационного микропланшета первым антителом, которое специфически связывается с указанным фибрином, указанными продуктами разложения фибрина и мономером фибрина; приведение указанного образца и положительного контроля с известной концентрацией фибрина или мономера фибрина в контакт с разными лунками указанного титрационного микропланшета; удаление любого несвязанного образца или положительного контроля из соответствующей лунки; приведение каждой лунки в контакт c меченым антителом к первому антителу; измерение количества любой связанной метки в каждой лунке и сравнение измеренного количества связанной метки в лунках, содержащих образец, с измеренным количеством связанной метки в лунках, содержащих положительный контроль, для определения присутствия или количества указанных фибрина и продуктов разложения фибрина в образце, причем усовершенствование включает применение модифицированного фибриногена в качестве указанного фибрина или мономера фибрина в указанном положительном контроле, причем модифицированный фибриноген получают способом, включающим следующие стадии: (1) частичное восстановление фибриногена с концентрацией от 3 до 25 микромолей с помощью восстановителя из расчета 0,25 миллимоля на один наномоль указанного фибриногена при температуре 30-40°C в условиях, исключающих денатурацию, и в отсутствие двухвалентных катионов в течение 0,5-1,5 часов; затем (2) блокирование тиольных групп любого свободного цистеина, образованного на стадии (1), посредством взаимодействия продукта, полученного на стадии (1), с блокатором, который не вызывает осаждения продукта, полученного на стадии (2); затем (3) взаимодействие продукта, полученного на стадии (2), с коагулирующим ферментом в физиологическом буферном растворе в отсутствие двухвалентных катионов для высвобождения фибринопептидов A и B; и (4) прерывание активности указанного коагулирующего фермента.
В патенте США № 5876947 описана стабильная клеточная линия, идентифицированная как P10 и зарегистрированная в ATCC Accession за № HB-12398, которая продуцирует моноклональное антитело, которое специфически связывается с эпитопом, определяемым специфической последовательностью аминокислот. Кроме того, дополнительно описано моноспецифическое антитело или его фрагмент, который специфически связывается с эпитопом, присутствующим в фибриногене, а именно фибринопептидом B, или des-Arg-фибринопептидом B.
В патенте США № 4438209 описан конкурентный способ радиоиммунологического анализа для определения концентрации фибринопептида A в плазме, где, во-первых, выполняют забор образца крови, тромбин в указанном образце подавляют ингибирующим количеством ингибитора тромбина и отделяют плазму от указанного образца, и, во-вторых, в условиях радиоиммунологического конкурентного связывания образец указанной плазмы приводят в контакт с достаточным количеством антитела к фибринопептиду A и радиоактивно меченым фибринопептидом A, после чего антитело, связавшееся с фибринопептидом A, отделяют от несвязанного фибринопептида A и измеряют радиоактивность; усовершенствование включает применение в качестве ингибитора тромбина, ингибитора, выбранного из группы, состоящей из D-фенилаланил-L-пропил-L-N-[2(1-хлор-7-гуанидогептан-2-она)], его кислотно-аддитивной соли соляной кислоты; его кислотно-аддитивной соли фтороводородной кислоты, его кислотно-аддитивной соли уксусной кислоты и его кислотно-аддитивной соли лимонной кислоты.
В Европейской патентной публикации № EP 345811 A2 описана гибридома, секретирующая моноклональное антитело, специфическое в отношении человеческого фибринопептида A, но не взаимодействующее ни с интактным фибриногеном, ни с фрагментами человеческого фибриногена, содержащего фибринопептид A. Дополнительно в ссылке описан способ определения свободного FpA, включающий (a) иммобилизацию моноклонального антитела, причем указанное моноклональное антитело соответствует п. 1, (b) приведение иммобилизированного моноклонального антитела, полученного на стадии (a), в контакт с меченым пептидом hFPA или его меченым фрагментом, или его Tyr-производным и образцом плазмы, и (c) выполнение анализа для определения метки.
В патенте США № 5817768 описано моноспецифическое антитело, которое связывается с эпитопом субэлемента αE фибриногена, причем указанное моноспецифическое антитело продуцируется клеточной линией гибридомы, выбранной из группы, состоящей из клеточной линии гибридомы, идентифицированной как № 3-10, клеточной линии гибридомы, идентифицированной как № 29-1, и клеточной линии гибридомы № 148-B.
В патенте PCT № WO2007/030571 A2 описана идентификация целевых молекул, характерных для заболевания, а также разработка реагентов, применяемых для визуализации и диагностических анализов, специфических в отношении данных молекул. В нем описаны способы и реагенты, предназначенные для идентификации молекулярных мишеней, специфических для заболевания или болезненного состояния, способы визуализации, которые могут применяться, разработка специфических молекулярных реагентов для визуализации, клиническая валидация реагентов для визуализации и клинические показания для молекулярной визуализации. В ссылке заявлен реагент для визуализации, специфичный в отношении мишени, который включает аффинный агент, соединенный с визуализирующим агентом, причем указанный аффинный агент специфически связывается с биологической молекулой, причем экспрессия указанной биологической молекулы является прогностическим признаком заболевания или болезненного состояния.
В патенте PCT № WO 2007/030531 описана идентификация целевых молекул, характерных для заболевания, а также разработка визуализирующих реагентов и диагностических анализов, специфических в отношении данных молекул. В нем описаны способы и реагенты, предназначенные для идентификации молекулярных мишеней, специфических для заболевания или болезненного состояния, способы визуализации, которые могут применяться, разработка специфических молекулярных реагентов для визуализации, клиническая валидация реагентов для визуализации и клинические показания для молекулярной визуализации. В ссылке заявлен реагент для визуализации, специфический в отношении мишени, который включает антитело, соединенное с визуализирующим агентом, поддающимся детекции с помощью магнитного резонанса, причем указанное антитело специфически связывается с глипиканом-3, причем экспрессия глипикана-3 является прогностическим признаком рака печени.
В опубликованной заявке на патент США № 20110053193 описан способ определения активности или функциональности либо первого реакционного компонента, либо второго реакционного компонента в непрореагировавшей примеси первого реакционного компонента и второго реакционного компонента; причем способ включает стадии (a) обратимого ингибирования первого реакционного компонента для получения смеси, имеющей инактивированный первый реакционный компонент и второй реакционный компонент; (b) добавления к смеси известного количества второго реакционного компонента при оценке активности первого реакционного компонента или известного количества первого реакционного компонента при оценке активности второго реакционного компонента; (c) обратимой активации первого реакционного компонента; (d) взаимодействия первого реакционного компонента со вторым реакционным компонентом, который изначально присутствует в примеси, а также с известным количеством второго реакционного компонента, либо взаимодействия первого реакционного компонента со вторым реакционным компонентом, который изначально присутствует в примеси, а также с известным количеством первого реакционного компонента; и (e) определения активности или функциональности первого или второго реакционного компонента, изначально присутствующего в примеси.
Гемостатические пластыри или прокладки, содержащие лиофилизированные тромбин и фибриноген, необязательно расположенные на абсорбируемых каркасах, нуждаются в анализе, предполагающем количественную оценку состояния активации биологических компонентов (т.е. определение того, превратился ли фибриноген в фибрин). Поскольку фибриноген и тромбин спонтанно взаимодействуют при гидратации, воздействие влаги на гемостатическую прокладку может вызвать преждевременную активацию биологических компонентов (до наложения на место кровотечения) и потенциально повлиять на общую стабильность и эффективность прокладки. В настоящее время устройства доставки фибринового герметика, которые позволяют нанести смесь растворов фибриногена и тромбина на рану для гемостаза или закрытия ткани, нуждаются в испытаниях для непосредственной оценки степени превращения фибриногена в фибрин. Одна цель работы заявителей заключалась в разработке надежного анализа, предназначенного для измерения скорости реакции и степени превращения фибриногена в фибрин, а также измерения количества интактного фибриногена в присутствии тромбина.
Изложение сущности изобретения
Вкратце, настоящее изобретение относится к способу детекции интактного фибриногена, включающему стадии: получения образца, содержащего по меньшей мере некоторое количество фибриногена, необязательно превращенного по меньшей мере частично в фибрин, и необязательно содержащего тромбин; растворения образца в растворе растворителя и ингибирования активности тромбина; переноса части указанного образца на мембрану, связывающую белок, после необязательного ДСН-ПААГ-электрофореза; взаимодействия фибриногена с первичным моноклональным антителом, способным связываться с фрагментом фибринопептида A; и детекции количества интактного фибриногена в образце посредством определения количества связанного первичного моноклонального антитела.
В одном варианте осуществления настоящее изобретение относится к способу детекции интактного фибриногена, включающему стадии: получения образца, содержащего по меньшей мере некоторое количество фибриногена, необязательно превращенного по меньшей мере частично в фибрин, и необязательно содержащего тромбин; растворения образца в растворе растворителя, который ингибирует активность тромбина; переноса части указанного образца в гель и выполнения электрофореза указанной части; переноса фракции указанной части образца из указанного геля на мембрану, связывающую белок, и иммобилизации фибриногена на указанной мембране; выполнения по меньшей мере одной стадии блокирования указанной мембраны; взаимодействия фибриногена, иммобилизированного на указанной мембране, с первичным моноклональным антителом, способным связываться с фрагментом фибринопептида A, для образования комплекса фибриноген-антитело; выполнения по меньшей мере одной стадии промывки указанной мембраны для удаления любого несвязанного первичного моноклонального антитела; взаимодействия указанного моноклонального антитела, образовавшего комплекс фибриноген-антитело, с вторичным антителом, имеющим маркер; выполнения по меньшей мере одной стадии промывки указанной мембраны для удаления любого несвязанного вторичного антитела, имеющего маркер; и детекции количества интактного фибриногена в образце посредством определения количества маркера.
В альтернативном варианте осуществления фибриноген, иммобилизированный на указанной мембране, взаимодействует с первичным моноклональным антителом, способным связываться с фрагментом фибринопептида B, для образования комплекса фибриноген-антитело.
Образец может содержать неизвестное количество интактного фибриногена. Образец может быть твердым, жидким или полужидким веществом. Образец может содержать лиофилизированные фибриноген и тромбин.
В данном способе можно использовать ДСН-ПААГ-электрофорез и/или вестерн-блоттинг, либо дот-блоттинг. Первичное моноклональное антитело, способное связываться с фрагментом фибринопептида A, может представлять собой клон 1F7. В альтернативном варианте осуществления первичное моноклональное антитело способно связываться с фрагментом фибринопептида B. Фибринопептиды A и B расщепляются в результате ферментативного действия тромбина на N-концах цепей Aα и Bβ фибриногена соответственно. Данные пептиды состоят из 16 и 14 аминокислот, которые имеют молекулярную массу 1536,6 дальтон и 1570,6 дальтон соответственно. Вторичное антитело, имеющее маркер, представляет собой козье антитело к IgG мыши, конъюгированное с щелочной фосфатазой.
Стадия детекции количества интактного фибриногена в образце посредством определения количества маркера можно выполнить путем инкубации мембраны, связывающей белок, с субстратом для щелочной фосфатазы.
Маркер может представлять собой электрохимически определяемый маркер, колориметрически определяемый маркер, рентгенологически определяемый маркер, маркер, определяемый магнитным способом, или флуоресцентный маркер.
В другом варианте осуществления настоящее изобретение относится к способу оценки эффективности или стабильности гемостатического устройства, содержащего по меньшей мере один биологический компонент, который представляет собой фибриноген; причем способ включает сравнение количества интактного фибриногена в образце, который получен в соответствии с описанным выше способом, и порогового значения интактного фибриногена.
В другом варианте осуществления настоящее изобретение относится к способу детекции интактного фибриногена, включающему стадии: получения образца, содержащего по меньшей мере некоторое количество фибриногена, необязательно превращенного по меньшей мере частично в фибрин, и необязательно содержащего тромбин; растворения образца в растворе растворителя, который ингибирует активность тромбина; нанесения части указанного образца на мембрану, связывающую белок, и иммобилизации фибриногена на указанной мембране; выполнения по меньшей мере одной стадии блокирования указанной мембраны и удаления фибринопептида А, отщепленного от фибриногена, входящего в состав мембраны для дот-блоттинга; взаимодействия фибриногена, иммобилизированного на указанной мембране, с первичным моноклональным антителом, способным связываться с фрагментом фибринопептида A, для образования комплекса фибриноген-антитело; выполнения по меньшей мере одной стадии промывки указанной мембраны для удаления любого несвязанного первичного моноклонального антитела; взаимодействия указанного моноклонального антитела, образовавшего комплекс фибриноген-антитело, с вторичным антителом, имеющим маркер; выполнения по меньшей мере одной стадии промывки указанной мембраны для удаления любого несвязанного вторичного антитела, имеющего маркер; и детекции количества интактного фибриногена в образце посредством определения количества маркера.
В другом варианте осуществления настоящее изобретение относится к способу детекции интактного фибриногена, включающему стадии: получения образца, содержащего по меньшей мере некоторое количество фибриногена, необязательно превращенного по меньшей мере частично в фибрин, и необязательно содержащего тромбин; растворения образца в растворе растворителя, который ингибирует активность тромбина; переноса части указанного образца на мембрану, связывающую белок, и иммобилизации фибриногена на указанной мембране; выполнения по меньшей мере одной стадии промывки и одной стадии блокирования указанной мембраны и удаления фибринопептида А, отщепленного от фибриногена, входящего в состав мембраны для дот-блоттинга; взаимодействия фибриногена, иммобилизированного на указанной мембране, с первичным моноклональным антителом, способным связываться с фрагментом фибринопептида A, для образования комплекса фибриноген-антитело; и детекции количества интактного фибриногена в образце посредством определения количества первичного моноклонального антитела, образующего связанный комплекс фибриноген-антитело.
Краткое описание чертежей
На фиг. 1 схематически представлена структура фибриногена.
На фиг. 2 схематически представлено превращение фибриногена в фибрин.
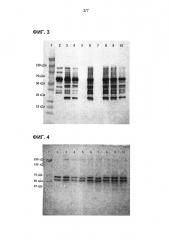
На фиг. 3 представлено изображение нитроцеллюлозной мембраны после проведения вестерн-блоттинга.
На фиг. 4 представлено изображение геля, окрашенного кумасси синим сразу после переноса белка из геля на нитроцеллюлозную мембрану.
На фиг. 5 представлено изображение нитроцеллюлозной мембраны после выполнения дот-блоттинга.
На фиг. 6 представлен график, отражающий линейную зависимость между концентрациями фибриногена и интенсивностью окрашивания.
На фиг. 7 представлена блок-схема обладающего признаками изобретения способа вестерн-блоттинга.
На фиг. 8 представлена блок-схема обладающего признаками изобретения способа дот-блоттинга.
Подробное описание изобретения
Фибриноген является белком-предшественником матрицы сгустка крови. Он имеет молекулярную массу 340000 дальтон и состоит из 3 пар неидентичных полипептидных цепей (Aα, Bβ и γ), соединенных вместе дисульфидными связями. Фибриноген имеет трехузловую структуру: два идентичных концевых глобулярных D-домена и центральный глобулярный E-домен. Все данные домены соединены суперскрученными α-спиралями, как схематически показано на фиг. 1, где FpA и FpB обозначают фибринопептиды A и B соответственно.
В обычных условиях кровь содержится в непрерывной сети сосудов, выстланных клетками эндотелия. Поверхность клеток эндотелия, обращенная в просвет сосуда, образует «гемосовместимый» барьер, который ингибирует спонтанную коагуляцию крови и адгезию тромбоцитов. Однако при нарушении целостности эндотелиальной выстилки запускается ряд биохимических реакций, направленных на прекращение кровотечения. Сразу после повреждения поврежденный сосуд сокращается таким образом, что кровь отводится от места повреждения. Процесс коагуляции запускается путем связывания специфических плазменных белков и тромбоцитов с субэндотелиальными структурами, образовавшимися в результате нарушения целостности эндотелиальной выстилки. Поврежденные клетки эндотелия также запускают процесс коагуляции путем высвобождения тканевого фактора, представляющего собой комплекс белка и фосфолипида. Сразу после начала коагуляции происходит «каскадная» активация ферментов, в результате которой в месте повреждения образуется сгусток крови, насыщенный тромбоцитами, или гемостатическая «пробка».
Представлена ссылка на следующую публикацию, полностью включенную в настоящий документ путем ссылки: AP DeAnglis и GS Retzinger, «Fibrin(ogen) and Inflammation: Current Understanding and New Perspectives», Clinical Immunology Newsletter (1999 г.) 18, 111-118.
Критически важной стадией образования сгустка крови является катализируемое тромбином превращение фибриногена в фибрин. Чтобы произошло такое превращение, собственно тромбин должен образоваться из своего неактивного предшественника - протромбина - с помощью ферментативного комплекса, вырабатывающегося в процессе коагуляции. Тромбин, являющийся серин-протеазой, гидролизует специфические аргинин-глициновые связи, размещенные на N-концах полипептидных цепей Aα и Bβ фибриногена, что способствует высвобождению из белка двух пар отрицательно заряженных белковых фрагментов, которые называются фибринопептидами A и B. Данные пептиды составляют только 2% от общей массы фибриногена. Высвобождение фибринопептидов изменяет заряд E-домена с отрицательного на положительный, способствуя взаимодействиям данного домена с отрицательно заряженными D-доменами других молекул фибрина. Взаимодействия мономеров фибрина друг с другом приводят к спонтанной сборке мономеров фибрина в полушахматном порядке, как схематически показано на фиг. 2. Специфическое соединение мономеров фибрина, которое происходит при полимеризации фибрина, является результатом нековалентных взаимодействий между комплементарными участками полимеризации, называемыми выступами и впадинами, в E- и D-доменах мономеров фибрина. Первоначально при сборке полимера фибрина образуется протофибрилла - длинный олигомер фибрина, имеющий толщину двух молекул. Со временем протофибриллы соединяются латерально, образуя группы протофибрилл, которые в дальнейшем объединяются в более крупные фибриновые волокна. Процесс сборки протофибрилл приводит к образованию взаимосвязанной сети фибриновых волокон, расположенных в характерном полушахматном порядке.
Превращение фибриногена в фибрин является критически важной стадией гемостаза, включающим катализируемое тромбином отщепление от фибриногена фибринопептидов A и B, что приводит к образованию мономера фибрина, который в дальнейшем превращается в полимер фибрина. Измерение степени превращения фибриногена в фибрин в присутствии тромбина представляет собой сложную задачу, так как в обычных условиях фермент спонтанно гидролизует фибриноген в фибрин. Количество фибриногена можно измерить только в том случае, если белок находится в растворенном состоянии. Если белки будут растворены в достаточной степени, тромбин будет спонтанно превращать фибриноген в фибрин, препятствуя измерению первоначального фибриногена.
Цели
Цель настоящего изобретения заключается в получении способа, который позволяет измерить степень превращения фибриногена в фибрин в исходном материале, состоящем из обезвоженного фибриногена и/или фибрина, далее упоминаемых как порошки фибриногена/фибрина и тромбина.
Дополнительная цель настоящего изобретения состоит в обеспечении способа, который позволяет измерить степень потенциального преждевременного превращения фибриногена в фибрин в исходном материале, состоящем из обезвоженных порошков фибриногена/фибрина и тромбина. Спонтанное образование фибрина предотвращают путем ингибирования тромбина во время растворения.
Дополнительная цель настоящего изобретения заключается в получении способа, который можно использовать для оценки скорости и степени реакции между фибриногеном и тромбином в жидких составах, содержащих два белка.
Другая цель настоящего изобретения заключается в получении способа, который можно использовать для оценки биохимической реакции между фибриногеном и тромбином для оптимизации жидких составов или эффективности смешивания (применительно к жидким составам фибринового герметика и специализированным наконечникам для смешивания).
Другая дополнительная цель настоящего изобретения заключается в получении способа, при котором для измерения количества фибриногена и фибрина используют растворение белков. Для предотвращения спонтанного образования фибрина во время приготовления образца растворение белков осуществляется в оптимизированных условиях, в которых при гидратации происходит немедленная инактивация тромбина. Процедура приготовления образца должна предотвращать/минимизировать любое образование фибрина таким образом, чтобы можно было определить количество фибриногена в исходном образце.
Дополнительная цель настоящего изобретения заключается в получении способа, который может иметь диагностическое и клиническое применение для идентификации присутствия фибриногена и дифференцирования фибриногена и фибрина в случае присутствия одновременно двух белков. Депонирование фибриногена и фибрина является важным признаком многих болезненных состояний, например, воспаления, атеросклероза, опухолей, тромбоэмболии и т.п. Присутствие и/или относительные количества фибриногена и фибрина можно использовать в качестве диагностических или прогностических критериев.
Обзор способа
В соответствии с вариантом осуществления настоящего изобретения лиофилизированные фибриноген и тромбин растворяют перед выполнением или в ходе проведения обладающего признаками изобретения анализа содержания интактного фибриногена. Чтобы избежать превращения фибриногена в фибрин при растворении, необходимо инактивировать тромбин сразу же после гидратации. Чтобы измерить количество фибриногена, смесь белков можно разделить с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ-электрофорез) и перенести в виде пятен на мембрану, связывающую белок (например, нитроцеллюлозную, поливинилиденфторидную мембрану). В альтернативном варианте осуществления смесь белков можно нанести непосредственно на мембрану. Используя антитело к FpA или FpB, на мембране можно обнаружить интактный фибриноген, однако при превращении исходного интактного фибриногена в фибрин (путем отщепления фибринопептида от фибриногена) белок не будет обнаружен на мембране. Данный обладающий признаками изобретения способ позволяет оценить степень превращения фибриногена в фибрин и применим к любой смеси фибриногена/фибрина и тромбина.
Кроме того, стадия растворения белка, необходимая для изменения количества фибриногена, может привести к спонтанной реакции между фибриногеном и тромбином и, следовательно, препятствовать точному измерению любой реакции до растворения образца. Авторы изобретения обнаружили, что специфические условия растворения подавляют активность тромбина, в то же время не препятствуя растворению белков. Обладающие признаками изобретения реагенты/условия, способствующие растворению, включают ингибитор тромбина, высокую концентрацию моющего средства и восстановителя в комбинации с высокой температурой.
Аналитический способ измерения степени превращения фибриногена в фибрин, описанный в настоящем изобретении, является методом иммуноблоттинга, в котором используют антитело, специфическое в отношении части молекулы фибриногена, подвергающейся гидролизу и расщеплению ферментом тромбином. С помощью данного антитела обнаруживают образец, содержащий фибриноген, в то время как полностью прореагировавший образец, содержащий только фибрин, невозможно обнаружить с помощью данного антитела. В частично прореагировавшем образце будет получен промежуточный ответ, который можно оценить количественно с помощью метода иммуноблоттинга.
В соответствии с одним вариантом осуществления настоящего изобретения способ детекции (интактного) фибриногена включает стадию растворения и стадию иммуноблоттинга.
Стадия растворения предусматривает растворение образца при одновременном подавлении активности тромбина.
Стадия иммуноблоттинга предусматривает: перенос или нанесение образцов на мембрану; необязательный ДСН-ПААГ-электрофорез; стадию блокирования; взаимодействие фибриногена, иммобилизированного на мембране, с первичным моноклональным антителом; стадию промывки для удаления непрореагировавшего первичного антитела; взаимодействие моноклонального антитела с вторичным антителом, имеющим маркер; стадию промывки для удаления непрореагировавшего вторичного антитела; и детекцию количества интактного фибриногена посредством определения количества маркера.
Гемостатическая прокладка, содержащая лиофилизированные фибриноген и тромбин.
Гемостатическая прокладка, содержащая лиофилизированные фибриноген и тромбин на абсорбируемом каркасе, которую использовали при экспериментальном испытании, составляющем предмет настоящего изобретения, далее упоминается как фибриногенсодержащая прокладка. Фибриногенсодержащая прокладка состоит из композитной структуры, включая слои Vicryl® (полиглактин 910) и ОРЦ (окисленной регенерированной целлюлозы). Слой Vicryl® покрыт порошками человеческого фибриногена и тромбина в обезвоженном, непрореагировавшем состоянии. Когда продукт накладывают на место кровотечения, белки гидратируются, что приводит к превращению фибриногена в фибрин и образованию сгустка фибрина. Образование фибрина на поверхности ткани способствует гемостазу и адгезии к ткани. Очень важно, чтобы до наложения на ткань белки оставались в непрореагировавшем состоянии. Преждевременное превращение фибриногена в фибрин (активация до применения продукта) из-за воздействия воды при производстве или хранении может оказывать негативное влияние на эфф