Способ получения состава с гербицидной активностью
Иллюстрации
Показать всеИзобретение относится к биотехнологии, химическому производству биологически активных веществ, сельскому хозяйству. Для получения состава с гербицидной активностью производят растворение феосферида А или экстракта из культуры его продуцента, содержащего не менее 60% феосферида А, в органическом растворителе и добавление водного раствора адъюванта в соотношении 1:50:950 и 5:50:950 соответственно. Изобретение позволяет реализовать указанное назначение. 3 з.п. ф-лы, 4 ил., 4 пр.
Реферат
Изобретение относится к биотехнологии, химическому производству биологически активных веществ, сельскому хозяйству, в частности к технологии получения состава, содержащего феосферид A, с гербицидной активностью, в т.ч. на основе экстракта гриба Phoma sp. штамм №19, проявляющего фитотоксические свойства и обладающего гербицидными свойствами.
Известно, что феосферид A и грубый экстракт из мицелия гриба Phoma sp. штамм №19 обладают высокими фитотоксическими свойствами на пораненных листовых высечках бодяка полевого и пырея ползучего в низкой концентрации. Так, минимальная концентрация феосферида A, вызывающая некрозы на листовых дисках бодяка, составляет 250 мкг/мл (1,4×10-6 моль/мл или 2.5 мкг/диск), на отрезках листьев пырея - 125 мкг/мл (0,7×10-6 моль/мл). При этом соединение не проявляет антимикробных свойств и не проявляет токсичности в отношении культуры инфузории-туфельки, т.е. является экологически достаточно безвредным (Poluektova, Berestetskiy, 2014, [1]).
Не обнаружены аналоги известных составов, содержащих феосферид A и его соединений, проявляющих гербицидную активность. Известные составы гербицидов токсичны для окружающей среды (Tsui, Chu, 2003, [2]; Ma et al., 2006, [3]; Zhenjiang et al., 2014, [4]), а составы на основе конидий или мицелия фитопатогенных штаммов обладают неустойчивой эффективностью (Gressel et al., 1997, [5]).
Отдельные компоненты состава известны.
Известен феосферид A, полученный из штаммов FA 39 эндофитного гриба, имеющий 97% гомологии с видом Phaeosphaeria avenaria (Maloney et al., 2006, [6]), Phoma sp. №19 (Poluektova, Berestetskiy, 2014, [1]), Paraphaeosphaeria neglecta FT462 (Li et al., 2015, [7]). Известен феосферид A, полученный с помощью химического синтеза (Kobayashi et al., 2011, [8]; Chatzimpaloglou et al., 2012, [9]).
Известно, что адъюванты позволяют повысить смачиваемость листа, площадь нанесенной капли и проникновение активного вещества в ткань листа (Sharma et al., 2004, [10]). Совместно с химическими гербицидами наиболее часто используют неионные и анионные поверхностно-активные вещества и различные масла (Radivojevic et al., 2011, [11]; Yilmaz, Dane, 2012, [12]). Некоторые растворители, например диметилсульфоксид (ДМСО), также способны повышать проницаемость липофильных молекул через мембраны (Gurtovenko, Anwar, 2007, [13]). На данный момент в литературе нет составов с адъювантами с природными фитотоксинами для повышения их активности на интактных листьях сорных растений.
Известно, что адъювант Hasten представляет собой концентрат этерифицированных растительных масел, на основе рапсового и кукурузного масел, и применяется для усиления проникновения некоторых пестицидов, в том числе гербицидов в ткань листа (Somervaille et al., 2012, [14]).
Задача изобретения состоит в получении состава на основе феосферида A с гербицидной активностью.
Задача решена путем создания состава с гербицидной активностью на основе феосферида A - экологически безопасного вещества или экстракта мицелия гриба Phoma sp. штамм №19.
Сущность изобретения заключается в получении состава, содержащего компоненты: феосферид A или экстракт из культуры его продуцента Phoma sp. №19, в концентрации 0.1 и 0.5% соответственно, органический растворитель - 5%, водный раствор, содержащий 0.1% адъюванта Hasten - 95%.
Состав получают путем растворения феосферида A или экстракта из культуры его продуцента, содержащего не менее 60% феосферида A, в органическом растворителе и добавления водного раствора адъюванта в соотношении 1:50:950 или 5:50:950, соответственно.
Феосферид A получали известным способом и из культуры его продуцента - известного штамма Phoma sp. №19 (Poluektova, Berestetskiy, 2014, [1]). В качестве субстрата для твердофазного культивирования гриба использовали перловую крупу.
Примеры конкретного выполнения
Пример 1. Получение грубого экстракта из мицелия гриба Phoma sp. штамм №19
В качестве субстрата для твердофазного культивирования гриба использовали перловую крупу. В колбы вносили по 150 г крупы и 100 мл воды. Стерилизацию зернового субстрата проводили автоклавированием в течение 30 минут при 121°C. Субстрат экстрагировали гексаном, отбрасывая органический слой. Затем водную фазу экстрагировали этилацетатом. Объединенный экстракт обезвоживали фильтрованием через безводный сернокислый натрий. Выход экстракта составил 2.84 г/кг субстрата. Полученный экстракт содержал 60% феосферида A.
Пример 2. Получение феосферида с чистотой более 96%. Сухой остаток, растворенный в ацетонитриле, вносили партиями по 1 г в патрон, предварительно кондиционированный 20 мл ацетонитрила и 30 мл 0.1%-ной муравьиной кислоты. Фракционирование экстракта проводили системой растворителей ацетонитрил - 0.1%-ная муравьиная кислота в соотношении 0:100; 25:75; 50:50; 100:0, объемом 70 мл. Фракция, содержащая феосферид A, была получена в системе ацетонитрил - 0.1%-ная муравьиная кислота в соотношении 50:50. Дальнейшее разделение фракции проводили при помощи полупрепаративной ВЭЖХ на хроматографе BUCHI, на патроне PuriFlash-25 SiHC (Interchim, Франция) с массой сорбента 40 г с использованием предпатрона с предварительно сорбированным на силикагеле экстрактом. Разделение экстракта производили в системе гексан-этилацетат (в градиенте от 0 до 80% этилацетата) со скоростью потока 50 мл/мин, детектирование фитотоксина проводили на длине волны 260. Выход феосферида A составил 130 мг/кг субстрата.
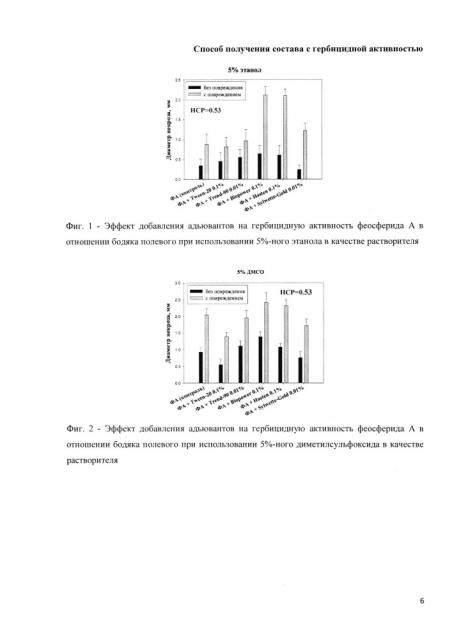
Пример 3. Влияние адъювантов на гербицидную активность феосферида A
Навеску 0.2 мг феосферида A, растворяли в 10 мкл 96%-ного этанола или диметилсульфоксида (ДМСО) и добавляли 190 мкл раствора ПАВ в дистиллированной воде. В качестве адъювантов были использованы следующие добавки: Тренд-90 0.01% (DuPont, этоксилат изодецилового спирта), Hasten 0.1% (BASF, концентрат рапсового и кукурузного масел), Biopower 0.1% (Bayer, 3,6-диоксаоктадецил-сульфат натрия), Tween-20 0.1% (Croda Crop, полиоксиэтилен (20) сорбитан монолаурат), Sylwette-Gold 0.01% (Chemtura, трисилоксан акоксилат). Гербицидная активность феосферида A с добавлением адъювантов была оценена при концентрации 1 мг/мл (0.1%). Раствор фитотоксина в 5%-ном этаноле и ДМСО без ПАВ использовали в качестве контроля. Объем тест-образца составлял 10 мкл. Оценку фитотоксической активности проводили методом листовых дисков (Berestetskiy et al., 2007, [15]), используя поврежденные и интактные листовые высечки бодяка полевого и пырея ползучего.
Было установлено, что добавление некоторых адъювантов к 0.1% раствору феосферида A повышает способность проникновения феосферида A в ткань листа.
Так, добавление Biopower 0.1% и Hasten 0.1% к раствору фитотоксина повышало его эффективность в отношении интактных и пораненных листовых дисков бодяка полевого (фиг. 1, 2).
Также было показано, что при растворении феосферида A в ДМСО гербицидная активность на 20% выше, чем при использовании в качестве растворителя этанола.
Таким образом, было показано, что добавление адъювантов Hasten 0.1% и Biopower 0.1% и использование в качестве растворителя ДМСО повышает гербицидные свойства 0.1%-ного раствора феосферида A.
Пример 4. Оценка гербицидной активности состава на основе феосферида A с добавлением 2-х адъювантов
Для опыта были использованы растения бодяка полевого в фазе розетки. По итогам предварительного исследования были выбраны адъюванты Biopower или Hasten в концентрации 0.1%. Дополнительно исследовали фитотоксичность экстракта без добавления адъювантов. 30 мг экстракта на основе феосферида A из мицелия гриба Phoma sp. штамм №19 растворяли в 300 мкл диметилсульфоксида и добавляли 5700 мкл раствора Hasten (0.1%) и Biopower (0.1%). Для оценки гербицидной активности грубого экстракта мицелия Phoma sp. №19, содержащего 60% феосферида A, растения бодяка полевого в фазе розетки опрыскивали суспензией, содержащей экстракт, растворенный в ДМСО и доведенный водой до концентрации 5 мг/мл (0.5%-й раствор) с добавлением Hasten (0.1%) или Biopower (0.1%). Для сравнения растения бодяка полевого обрабатывали раствором экстракта без добавления адъювантов.
Обработка растений бодяка полевого раствором, содержащим экстракт мицелия гриба с добавлением Hasten (0.1%), вызывала некрозы листьев на уровне 70-80%. При этом масса наземной части растений бодяка достоверно уменьшилась до 30% от массы растений в контрольном варианте (фиг. 3, 4).
Площадь некрозов листьев бодяка после опрыскивания растений раствором экстракта из мицелия Phoma sp. №19 с добавлением адъюванта Biopower (0.1%) составила около 20%, при этом достоверного снижения массы наземной части растений отмечено не было (фиг. 3, 4).
Таким образом, состав с адъювантом Hasten (0.1%) и раствором экстракта мицелия Phoma sp. №19 способствует повышению его гербицидной активности на 50% по сравнению с раствором экстракта без адъювантов. Состав с раствором экстракта и добавлением Hasten (0.1%) приводило к 80%-ному повреждению листьев бодяка полевого, которое сопровождалось значительной потерей массы наземной части и полной гибелью растений спустя 48 часов. Следовательно, состав с адъювантом Hasten (0.1%) может быть рекомендован для применения совместно с экстрактом гриба Phoma sp. штамм №19.
Как видно из примеров, полученный состав обладает гербицидной активностью. Состав может быть применен в биотехнологии для получения экологически безопасных гербицидов на основе феосферида A.
Краткое описание рисунков
На Фиг. 1 приведен график, показывающий эффект добавления адъювантов на гербицидную активность феосферида A в отношении бодяка полевого при использовании в качестве растворителя 5%-ного этанола.
На Фиг.2 приведен график, показывающий эффект добавления адъювантов на гербицидную активность феосферида A в отношении бодяка полевого при использовании в качестве растворителя 5%-ного диметилсульфоксида.
На Фиг. 3 приведен график, показывающий оценку гербицидной активности экстракта гриба Phoma sp. №19.
На Фиг. 4 приведен график, показывающий поражение листьев бодяка полевого после обработки растворами экстракта Phoma sp. №19.
Список использованной литературы
1. Poluektova E.V., Berestetskiy А.О. Isolation and characterization of phytotoxins produced by phoma sp. 19. book of proceedings 7th world congress on allelopathy. Complex interactions in a changing climate. Congress held in Vigo, Spain. July, 28 - August, 1, 2014. P. 114.
2. Tsui M.T.K., Chu L.M. Aquatic toxicity of glyphosate-based formulations: comparison between different organisms and the effects of environmental factors. Chemosphere. 2003. V. 52. P. 1189-1197.
3. Ma J., Wang S., Wang P., Ma L., Chen X., Xu R. Toxicity assessment of 40 herbicides to the green alga Raphidocelis subcapitata. Ecotoxicology and Environmental Safety. 2006. V. 63. P. 456-462.
4. Zhenjiang W., Manhong L., Lixin G., Yukun M. Acute Toxicity of Clethodim, Cypermethrin and 2,4-D-butylate to the Larva of Chironomus sinicus. Agricultural Science and Technology. 2014.V. 15.9. P. 1583-1585.
5. Gressel J. Herbicides as Synergists for Mycoherbicides, and Vice Versa. J. Gressel. Weed Sci. 2010. V. 58.3. P. 324-328.
6. Maloney K.N., Hao W., Xu J., Gibbons J., Hucul J., Roll D., Brady S.F., Schroeder F.C., Clardy J. Phaeosphaeride A, an inhibitor of STAT3-dependent signaling isolated from an endophytic fungus. Org Lett. 2006. P. 4067-4070.
7. Li C.S., Ding Y., Yang B.J., Miklossy G., Yin H.Q., Walker L.A., Turkson J., Cao S. A new metabolite with a unique 4-pyranone-γ-lactam-1,4-thiazine moiety from a hawaiian-plant associated fungus. Org Lett. 2015.
8. Kobayashi K., Okamoto I., Morita N., Kiyotani T., Tamura O. Synthesis of the proposed structure of phaeosphaeride A. Org. Biomol. Chem. 2011. V. 9. P. 5825-5832.
9. Chatzimpaloglou A., Yavropoulou M.P., Rooij К.E., Biedermann R., Mueller U., Kaskel S., Sarli V. Total synthesis and biological activity of the proposed structure of phaeosphaeride a. J. Org. Chem. 2012. V. 77. 9659-9667.
10. Sharma S.D., Chandrasena N., Singh M. Glyphosate-Adjuvant Interactions: A Review Of Recent Experiences. Proc. 20th Asia-Pacific Weed Science Soc. Conf., Ho-Chi-Minh City, Vietnam, P. 434-442.
11. , , , , Impact of Different Adjuvants and Modes of Application on Efficacy of Rimsulfuron in Maize. Pestic. Phytomed. (Belgrade). 2011. V. 26 (3), P. 255-263.
12. Yilmaz G., Dane F. Phytotoxicity Induced by Herbicide and Surfactant on stomata and epicuticular wax of Wheat. Romanian Biotechnological Letters. 2012. V. 17 (6) P. 7757-7765.
13. Gurtovenko A., Anwar J. Modulating the structure and properties of cell membranes: the molecular mechanism of action of dimethyl sulfoxide. J Phys Chem B. 2007. V. 111 (35). P. 10453-10460.
14. Somervaille A., Betts G., Gordon В., Green V., Burgis M., Henderson R. Adjuvants - Oils, surfactants and other additives for farm chemicals - revised 2012 edition. 48 p.
15. Berestetskiy A.O., Fyodorova A.F., Kustova S.A laboratory technique for the evalution of pathogenicity of Septoria cirsii for Cirsium arvense, XV Congress of European mycologists, 2007, p. 242.
1. Способ получения состава с гербицидной активностью путем соединения 5 процентов диметилсульфоксида, содержащего феосферид А с концентрацией 0.1%, или экстракта из культуры его продуцента, содержащего не менее 60% феосферида А, с концентрацией 0.5% и 95 процентов водного раствора, содержащего 0.1% адъюванта Hasten.
2. Способ по п. 1 отличается тем, что в качестве культуры продуцента феосферида А используется штамм гриба Phoma sp. №19.