Способ профилактики нодулярного дерматита крс
Иллюстрации
Показать всеИзобретение относится к области ветеринарии. Предложен способ профилактики нодулярного дерматита крупного рогатого скота (КРС), включающий выявление животных с инфекционным заболеванием на начальной стадии развития, убой больных и дальнейшее обследование остальных животных. Остальных животных в очаге инфекционного заболевания нодулярного дерматита обследуют в течение суток методом полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени. Животных-носителей вируса и здоровых животных переводят в отдельные помещения и в их присутствии осуществляют санацию помещений озоно-воздушной смесью: в помещении с животными-носителями вируса - в течение месяца не менее 3-4 раз в неделю с концентрацией озона 4-6 г/м3 в течение 20-30 минут, в помещении со здоровыми животными - в течение не более двух недель 2-3 раза в неделю с концентрацией озона 3-4 г/м3 в течение 15-20 минут. Изобретение обеспечивает расширение функциональных возможностей способа профилактики нодулярного дерматита КРС. 4 табл., 1 пр.
Реферат
Изобретение относится к области ветеринарии, в частности к способу профилактики нодулярного дерматита крупного рогатого скота.
Известен способ санации животноводческих помещений в присутствии животных, в котором осуществляют обработку животноводческих помещений озоновоздушной смесью, отличающийся тем, что обработку осуществляют озоновоздушной смесью с концентрацией озона 1-3 мг/м3 с периодичностью 24 часа в течение 1,5-2 часа, которую готовят с помощью озонатора, установленного непосредственно в животноводческом помещении (RU №2542504).
Недостатком данного способа является невозможность его использования для проведения дезинфекции помещений в присутствии животных в случае их заражения вирусом африканской чумы свиней, т.к. для уничтожения данной инфекции необходима обработка озоно-воздушной смесью с более высокой концентрацией озона.
Известен способ оздоровления хозяйств от лейкоза крупного рогатого скота (ВЛКРС), включающий оздоровительные мероприятия, которые проводят по вариантам в зависимости от первоначальной инфицированности стада, определенной по результатам серологического исследования, изоляцию инфицированных ВЛКРС животных и немедленную сдачу на убой больных животных, отличающийся тем, что при первоначальной инфицированности стада до 2,5% инфицированных животных немедленно сдают на убой, а остальных животных исследуют каждые 3 месяца с обязательным удалением инфицированных животных; в хозяйствах, где выявлено 2,6-10,0% животных, инфицированных ВЛКРС, инфицированных животных собирают на отдельной ферме, откуда молодняк после откорма коров после отела и по мере прекращения лактации сдают на убой, оставшихся животных исследуют серологическим методом на ВЛКРС и вновь выявленных инфицированных животных немедленно переводят на указанную ферму; при первоначальной инфицированности стада 10,1-40,0% всех животных в хозяйстве делят на две группы: серопозитивные и серонегативные и содержат их изолированно друг от друга, инфицированных животных каждые 6 месяцев исследуют гематологическим методом и признанных больными сдают на убой, а коров и нетелей, не инфицированных ВЛКРС, исследуют серологическим методом с интервалом три месяца, при этом вновь выявленных серопозитивных животных переводят в группу инфицированных коров; при первоначальной инфицированности стада более 40,0% всех взрослых животных исследуют только гематологическим методом через каждые 6 месяцев и выявленных больных сдают на убой (RU №2268589).
Недостатком данного способа является продолжительность диагностирования лейкоза крупного рогатого скота серологическим методом, что в свою очередь способствует прогрессивному развитию заболевания, ведущему к массовой гибели животных.
Техническим результатом является расширение функциональных возможностей способа профилактики нодулярного дерматита крупного рогатого скота.
Технический результат достигается тем, что в способе профилактики нодулярного дерматита крупного рогатого скота, включающем выявление 2,5-3% от общего количества животных с инфекционным заболеванием на начальной стадии развития в очаге и 1-й угрожаемой зоне, убой больных и дальнейшее обследование остальных животных, согласно изобретению остальных животных в очаге инфекционного заболевания нодулярного дерматита крупного рогатого скота обследуют в течение суток методом экспресс-диагностики, включающим отбор проб крови животных, выделение из нее ДНК генома вирусного заболевания, проведение полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени, по результатам которой выявляют животных-носителей вируса и здоровых животных, которых переводят в отдельные помещения и в их присутствии осуществляют санацию помещений озоно-воздушной смесью: в помещении с животными-носителями вируса - в течение месяца не менее 3-4 раз в неделю с концентрацией озона 4-6 г/м3 в течение 20-30 минут, в помещении со здоровыми животными - в течение не более двух недель 2-3 раза в неделю с концентрацией озона 3-4 г/м3 в течение 15-20 минут.
Новизна заявляемого способа профилактики нодулярного дерматита крупного рогатого скота состоит в идентификации вируса в пробах патологического материала с помощью полимеразной цепной реакции (ГТЦР) с флуоресцентной детекцией в режиме реального времени в течение суток, что в свою очередь позволяет выявить животных-носителей вируса нодулярного дерматита крупного рогатого скота на начальной стадии их инфицирования, а также осуществлении санации помещений, в которых отдельно друг от друга присутствуют животные-носители вируса и здоровые животные.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Эти отличия позволяют сделать вывод о соответствии заявляемых технических решений критерию «новизна».
Заявляемый способ профилактики нодулярного дерматита крупного рогатого скота рекомендовано использовать в специализированных ветеринарных, животноводческих, сельскохозяйственных предприятиях.
Способ профилактики нодулярного дерматита крупного рогатого скота осуществляют следующим образом.
В стаде крупного рогатого скота ведут забор проб крови от каждого животного. Цельная кровь (во время виримия) забирается в пробирку с 6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают. Для получения сыворотки забирают кровь в пробирку без антикоагулянта. Помимо крови, в качестве исследуемого материала также используют фрагменты тканей и органов (нодулы, селезенка, лимфатические узлы). Для подготовки пробы к проведению полимеразной цепной реакции используют различные методики, с помощью которых осуществляют экстракцию ДНК из полученных образцов сыворотки крови животных и удаление или нейтрализацию посторонних примесей для получения препарата ДНК с чистотой, пригодной для проведения полимеразной цепной реакции.
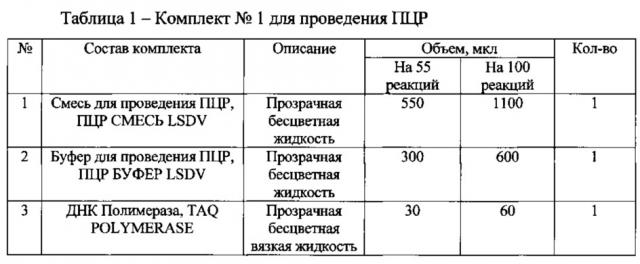
Для подготовки образцов и проведения полимеразной цепной реакции используют специальный набор реагентов для выявления возбудителя нодулярного дерматита крупного рогатого скота «ПЦР-НОДУЛЯРНЫЙ ДЕРМАТИТ КРС-ФАКТОР», состоящий из двух комплектов (таблица 1 и 2):
При подготовке образцов в отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию: 10 мкл ПЦР СМЕСЬ LSDV, 5 мкл смеси ПЦР БУФЕР LSDV, 0,5 мкл TAQ POLYMERASE, данную смесь перемешивают и сбрасывают капли кратковременным центрифугированием. Затем отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб, вносят по 15 мкл приготовленной реакционной смеси. Используя наконечники с фильтром, в подготовленные пробирки добавляют:
1) отрицательный контроль ПЦР (К-) - вносят в пробирку по 10 мкл отрицательного контрольного образца;
2) по 10 мкл ДНК из исследуемых образцов (включая ОКО) в соответствующие пробирки;
3) положительный контроль ПЦР (К+) - вносят в пробирку 10 мкл положительного контрольного образца LSDV.
Далее осуществляют полимеразную цепную реакцию с флуоресцентным детектором в режиме реального времени на амплификаторе Rotor-Gene 3000/6000. Прибор программируют, устанавливают параметры температурно-временного режима амплификации, детекцию флуоресцентного сигнала назначают после стации отжига праймеров, после чего начинают процесс амплификации с флуоресцентной детекцией в режиме реального времени. В его основе лежит принцип флуоресцентной детекции продуктов полимеразной цепной реакции непосредственно в ходе амплификации. Детекция продуктов амплификации проводится прямо в реакционной среде через стенки или крышку закрытой пробирки.
ПЦР с флуоресцентной детекцией в режиме реального времени имеет ряд значительных преимуществ:
- объединение этапов амплификации и детекции результатов. Появляется возможность оценить кинетику процесса, которая зависит от начального количества исследуемого материала;
-существенное снижение риска контаминации и ошибок при анализе результатов;
- высокая специфичность реакции за счет использования высокоспецифичных флуоресцентных зондов;
- высокая производительность;
- упрощение требований к организации ПЦР-лаборатории;
- возможность количественной оценки исходной ДНК матрицы;
- регистрация и учет данных в электронном формате.
ПЦР в реальном времени характеризуется возможностью проведения качественного и количественного анализа. Регистрируемое в процессе амплификации нарастание сигнала от отделенного флуорофора прямо пропорционально увеличению концентрации синтезированных специфических продуктов и отражает концентрацию ДНК в исходной матрице.
Учет результатов полимеразной цепной реакции, согласно указанной выше инструкции, проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией. Образец считают положительным (вирус нодулярного дерматита крупного рогатого скота присутствует), если наблюдают рост специфического сигнала, при этом значения контрольных образцов находятся в пределах нормы. Образец считают отрицательным (вирус нодулярного дерматита крупного рогатого скота отсутствует), если не наблюдают рост специфического сигнала, при этом значения контрольных образцов находятся в пределах нормы.
В результате проведения полимеразной цепной реакции с флуоресцентным детектором в режиме реального времени при выявлении первоначального инфицирования вирусом нодулярного дерматита крупного рогатого скота 2,5-3% голов животных от общего количества в стаде, инфицированных особей сдают на убой, после чего животных-носителей инфекции и здоровых особей переводят в отдельные помещения. Затем осуществляют санацию помещений в присутствии животных с помощью озоно-воздушной смеси, при этом в помещении с животными-носителями вируса ее проводят в течение месяца 3 раза в неделю с концентрацией озона 5 мг/м3 в течение 25 минут. В помещении со здоровыми животными санацию проводят в течение двух недель 2 раза в неделю с концентрацией озона 4 мг/м3 в течение 18 минут.
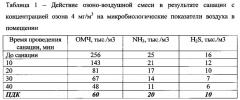
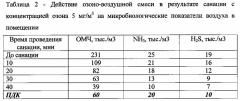
Результаты проведения опытов по санации помещений показывают, что санация помещения озоно-воздушной смесью с концентрацией озона 1-3 мг/м3 является малоэффективной при содержании общего микробного числа по результатам анализа санитарно-микробиологического контроля воздуха в животноводческом помещении более 200 тыс./м3, уровнем аммиака более 20 мг/м3 и сероводорода более 15 мг/м3, т.к. незначительно повлияла на снижение указанных показателей.
После санации помещений озоно-воздушной смесью с концентрацией озона 7-10 мг/м3 наблюдалось значительное снижение параметров ОМЧ, аммиака и сероводорода в воздухе, однако последствием такой дезинфекции являлось ухудшение общего самочувствия животных, снижение их активности и аппетита. Поэтому по итогам проведенных испытаний наиболее оптимальной признана санация с концентрациями озона 4 и 5 мг/м3, т.к. санация озоно-воздушной смесью с данными концентрациями озона не оказывала токсикологического побочного эффекта, а также снижала уровень содержания вредных веществ в животноводческих помещениях до регламентированных норм. Данные по содержанию вредных соединений в воздухе животноводческих помещений до и после санации в зависимости от концентрации озона в озоно-воздушной смеси представлены в таблицах 1 и 2.
По итогам санации видно, что обработка помещений озоно-воздушной смесью с концентрацией озона 4-5 мг/м3 в течение 15-25 минут снижает уровень загрязнения воздуха вредными соединениями до предельно допустимых значений, при этом не оказывая вредного токсикологического воздействия на состояние здоровья животных.
Результаты проведенных мероприятий в животноводческих помещениях в присутствии животных позволяют сделать вывод о том, что данный способ нодулярного дерматита крупного рогатого скота эффективен в качестве улучшения и сохранения санитарного состояния на животноводческих предприятиях.
Способ профилактики нодулярного дерматита КРС, включающий выявление 2,5-3% от общего количества животных с инфекционным заболеванием на начальной стадии развития в очаге и 1-й угрожаемой зоне, убой больных и дальнейшее обследование остальных животных, отличающийся тем, что остальных животных в очаге инфекционного заболевания нодулярного дерматита крупного рогатого скота обследуют в течение суток методом экспресс-диагностики, включающим отбор проб крови животных, выделение из нее ДНК генома вирусного заболевания, проведение полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени, по результатам которой выявляют животных-носителей вируса и здоровых животных, которых переводят в отдельные помещения и в их присутствии осуществляют санацию помещений озоно-воздушной смесью: в помещении с животными-носителями вируса - в течение месяца не менее 3-4 раз в неделю с концентрацией озона 4-6 г/м3 в течение 20-30 минут, в помещении со здоровыми животными - в течение не более двух недель 2-3 раза в неделю с концентрацией озона 3-4 г/м3 в течение 15-20 минут.